06第六章 不稳定碳负离子
- 格式:ppt
- 大小:1.50 MB
- 文档页数:21

有机化学基本理论主讲人:史达清4. 碳正离子与碳负离子碳正离子、碳负离子是有机化学中非常重要的两类活性中间体,我们有必要掌握这两类活性中间体的结构、生成方法及影响稳定性的因素。
(1)碳正离子碳正离子是指碳原子带有正电荷的三价化合物,对碳正离子的研究是最早且最深入的,被称为物理有机化学的基础,许多有机反应历程的研究概念和方法都起始于碳正离子的研究工作。
(a)碳正离子的结构碳正离子的中心碳原子是sp2 杂化的平面型结构,正电荷在p 轨道中:例外:下面的几个实例是例外,这是由于它们都不能形成空的p 轨道形式,如乙烯正离子,乙炔正离子是线型结构,有一个空的sp 杂化轨道,苯基正离子C6H5+则有一个空的sp2杂化轨道,但它们都很难生成,因为空轨道与π 体系相互垂直,正电荷得不到分散。
(b)碳正离子的生成方法离解是形成碳正离子的一个主要方法,离解时,与碳原子相连的基团带着一对对子离去。
苯磺酸根离子和卤离子是常用的较好的离去基团。
卤代物中的卤离子还可以在Ag+ 或Lewis 酸存在下脱去而生成碳正离子。
例如:醇一般是在酸作用下,将不容易离去的羟基转变成易离去的水离去,可以形成碳正离子:伯胺一般先用亚硝酸重氮化得到重氮盐,再脱氮得到碳正离子:如果生成的碳正离子具有芳香性,那么这些碳正离子就比较容易生成。
例如:另一类产生碳正离子的方法是质子或其它带正电荷的原子团或Lewis 酸对不饱和体系的加成。
例如:(c)碳正离子的稳定性凡是能够使碳正离子的正电荷得到分散的,则碳正离子比较稳定;相反,如果使碳正离子的正电荷集中,则碳正离子更不稳定。
其影响因素主要有:(i) 诱导效应给电子的诱导效应(+I)使碳正离子稳定;而吸引电子的诱导效应(-I),使碳正离子不稳定。
例如:(ii) 共轭效应给电子的共轭效应(+C)使碳正离子稳定;而吸电子的共轭效应(-C)使碳正离子不稳定。
例如:(iii) 空间效应由于碳正离子是平面型结构,如果正电荷在桥头碳原子上,由于桥的刚性结构,难以形成平面型,所以该碳正离子的稳定性比较差,例如:1-氯双环[2.2.1]庚烷的乙醇解速度比叔丁基氯慢1013倍。

![[化学]06 碳氢键](https://uimg.taocdn.com/3d974e0a5727a5e9846a6115.webp)



第六章芳烃在有机化学发展初期,曾把从天然树脂、香精油中得到的一类性质上和脂肪族化合物明显不同,具有高度的不饱和性(C/H高),且具有特殊的稳定性和芳香气味的有机化合物称为芳香族化合物,仅由碳氢两种元素组成的芳香族化合物称为芳香烃,简称芳烃。
因当时发现的这些芳香族化合物经递降后最终得到苯,故人们把苯及其衍生物称为芳香族化合物。
随着有机化学的不断发展,又发现了一些非苯构造的环状烃,它们与苯及其衍生物的性质相似,成环原子间的键长也趋于平均化,性质上表现为易发生取代反应,不易发生加成反应,不易被氧化,它们的质子与苯的质子相似,在核磁共振谱中显示相似的化学位移。
这些特性统称为芳香性。
后经研究发现,具有芳香性的化合物在结构上都符合休克尔规则。
所以近代有机化学把结构上符合休克尔规则,性质上具有芳香性的化合物称为芳香族化合物。
芳烃不一定具有“香”味。
根据是否含有以及所含苯环的数目和联结方式不同,芳烃又可分为如下三类:(1)单环芳烃:分子中只含有一个苯环结构,如苯、甲苯、苯乙烯等。
CH3CH CH2(2)多环芳烃:分子中含有两个或两个以上的苯环结构,如联苯、萘、蒽等。
(3)非苯芳烃:分子中不含苯环结构,但含有结构和性质与苯环相似的芳环,并具有芳香族化合物的共同特性。
如环戊二烯负离子,环庚三烯正离子等。
+(一) 单环芳烃最简单的单环芳烃是苯,其分子式为C6H6。
现代物理方法测得苯的结构为:苯分子的六个碳原子和六个氢原子都在同一平面上,六个碳原子构成正六边形,C-C键长0.140nm,C-H 键长为0.108nm,键角∠CCH及∠CCC均为120º。
(缺图)图6-1 苯分子环状结构及π电子云分布图(1)价键理论对苯结构的处理杂化轨道理论认为苯环中碳原子为sp2杂化状态,三个sp2杂化轨道分别与另外两个碳原子的sp2杂化轨道形成C-Cσ键以及与一个氢原子的s轨道形成C-Hσ键,而没有杂化的p轨道互相平行且垂直于σ键所在平面,它们侧面互相重叠形成闭合大π键(图6-1)共扼体系。



碳负离子稳定性影响因素及几个重要反应
碳负离子稳定性受多种因素的影响,其中包括:
1. 离子强度:离子强度越高,碳负离子的稳定性越低。
2. 溶解度:溶解度越高,碳负离子的稳定性越低。
3. 温度:温度越高,碳负离子的稳定性越低。
4. pH值:pH值越高,碳负离子的稳定性越低。
5. 离子类型:离子类型越大,碳负离子的稳定性越低。
几个重要反应:
1. 羧基碳负离子的形成反应:碳负离子通过与酸性分子结合形成羧基碳负离子。
2. 碳负离子的溶解反应:碳负离子可以通过溶解在水中形成稳定的溶液。
3. 碳负离子的吸附反应:碳负离子可以与其他物质形成化学键,从而被吸附在表面上。
4. 碳负离子的氧化反应:碳负离子可以与氧气反应形成碳酸盐类物质。
剑与碳负离子作者:武汉大学化学与分子科学学院,武汉,30072摘要:本文在高教版有机化学基础上,从碳负离子的形成、稳定性出发,讨论了碳负离子的一些典型反应,并同时对反应的相关机理进行了对比和讨论,最后,对借助剑与剑鞘的模型对碳负离子的性质进行了进一步的具体化讨论。
关键词:碳负离子稳定性结构反应剑前言碳负离子在有机化学下中一直扮演着不可替代的角色,从醛酮开始,就已经基本上呈现出接管有机化学下的态势,可见其在大学化学常规教学过程中的重要性之大。
同时,在整个有机化学的架构中,碳负离子也一直是有机反应过程中重要的中间体.对有关化学反应机理的研究起着至关重要的作用。
本文将主要通过碳正离子的形成、碳正离子的稳定性以及有关涉及碳负离子的反应来对碳负离子的相关性质进行系统的讨论。
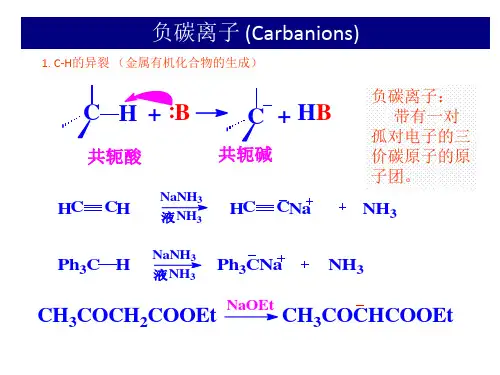
一、碳负离子的形成碳负离子是有机化合物中碳断开一个共价键得到相连原子的共用电子而形成的离子,它与氨或胺是等电子的。
这些分子在两个等同的锥形结构之间进行非常迅速的翻转。
碳是SP3杂化的,因此碳负离子具有发生构型反转的可能性:1.1 含碳酸的脱质子作用有机化合物中C-H 键的电离也应当看作是酸性电离:为了同含氧酸,氢卤酸等相区别,把这种酸称为含碳酸(carbonic acids ),含碳酸的共轭碱即为碳负离子(carbanions )。
比如炔烃失去一个质子所得的碳负离子为sp 杂化,s 成分很大,吸引电子的能力越强,相对的碱性越弱,而共轭酸的酸性越强,容易电离出质子而成为碳负离子。
1.2 醛酮α氢的电离:醛酮在羰基的影响下(诱导效应与共轭作用),α氢有一定的酸性,可以电离出稳定的碳负离子。
例如丙酮电解生成共轭碱。
酮和烯醇在碱的催化下形成动态平衡,中间体是碳负离子的共振体。
1. 3 α-β酮酸酯分子中羰基和酯基之间的活性亚甲基β酮酸酯分子中羰基和酯基之间的活性甲基,受两个吸电子集团的影响而有很高的活性,称为活性亚甲基。
活性亚甲基在碱性条件下容易失去氢原子,形成碳负离子。
碳负离子稳定性顺序1、看分子结构携带的基团。
具有能稳定负电荷的基团的碳负离子具有较高的稳定性。
2、看分子结构的芳香性,具有芳香性的物质、参加共轭的原子、参与共轭的P电子、具备上述三条件稳定性强。
3、3、看分子结构的共轭效应。
碳负离子上连接的双键(或苯环)越多,碳负离子越稳定。
扩展资料:一般碳负离子:碳负离子带有负电荷,中心碳原子为三价,价电子层充满八个电子,具有一对未共用电子。
中心碳原子的可能构型有两种:一种为杂化的平面构型,另一种杂化的棱锥构型。
不同的碳负离子由于中心碳原子连接的基团不一样,其构型不尽相同,但一般简单的烃基负离子是杂化的棱锥构型,未共用电子对处于杂化轨道。
这主要因为杂化轨道与P轨道比较,轨道中包含更多的S轨道成分,而轨道中成分的增加意味着轨道更靠近原子核,轨道的能量降低。
当碳负离子的未共用电子对处于杂化轨道时,与处于P轨道比较,未共用电子对更靠近碳原子核,因此,体系能量较低,比较稳定。
同时,在碳负离子体系中,未共用电子对与其他三对成键电子之间也存在斥力,当未共用电子对处于杂化轨道时,与其他三对成键电子所处的轨道之间近似,而处于P轨道时,则与三个杂化轨道之间为垂直。
因此,处于杂化状态的棱锥构型,电子对的排斥作用较小,比较有利。
所以与碳正离子不同,一般简单的烃基碳负离子是处于杂化状态的棱锥构型,未共用电子对处于四个杂化轨道中的一个,这是碳负离子通常的合理结构。
特殊的碳负离子:虽然环丙基正离子由于环张力不利于平面构型而很不稳定,但环丙基负离子确是存在的,因为棱锥构型对碳负离子是相对有利的。
在桥环化合物中,桥头碳正离子是很不稳定的,因为环的几何形状的限制,不利于平面构型的存在,所以很少有桥头碳正离子生成。
但对桥头碳负离子说,棱锥构型则是相对有利的,所以桥头碳负离子是稳定的,可以存在的。
正因如此,桥头有机锂化合物容易生成,例如下面通过桥头碳负离子进行的反应是很顺利的。
这也为碳负离子的棱锥构型提供了进一步的证据。
不稳定碳磷-回复不稳定碳磷是指碳磷键的化合物,这种化合物具有较低的稳定性,容易发生自发分解的反应。
在本文中,我们将逐步回答有关不稳定碳磷化合物的问题,包括其定义、性质、反应机制以及潜在的应用。
第一部分:不稳定碳磷化合物的定义和性质不稳定碳磷化合物是指含有碳磷键的化合物,其碳原子和磷原子通过共价键连接。
这种键的特点是磷原子提供共价键中心的自由电子,从而形成了碳磷键。
这种键的形成需要某些特殊条件,如高能反应,例如高温或高压。
不稳定碳磷化合物具有一些特殊的性质。
首先,它们的化学性质非常活泼,容易引发自发分解反应。
其次,由于碳磷键的不稳定性,这些化合物通常具有较短的半衰期。
此外,不稳定碳磷化合物在空气中容易燃烧,因此必须采取特殊的防护措施处理。
第二部分:不稳定碳磷化合物的合成方法和反应机制由于不稳定碳磷化合物的特殊性质,其合成方法相对较少。
其中较常用的方法之一是通过热解或高温反应来制备。
例如,可以通过在高温条件下将磷石与含有碳源的反应物反应来合成不稳定碳磷化合物。
不稳定碳磷化合物的反应机制是一个复杂而精细的过程。
在反应开始时,高能反应条件会打破碳磷键,从而形成高能态的中间体。
这些中间体很快发生进一步的反应,可能包括断裂、重组或其他反应,从而形成不同的产物。
第三部分:潜在的应用和研究方向尽管不稳定碳磷化合物具有高度的活性和不稳定性,但这些特性也为其在一些应用领域中提供了潜在的价值。
例如,在药物领域,一些不稳定碳磷化合物具有较强的生物活性,并被用于治疗某些疾病,如肿瘤和感染。
此外,不稳定碳磷化合物在催化领域也显示出潜力。
由于其高度的反应性,不稳定碳磷化合物可以在一些特定反应中作为催化剂中间体,促进反应的进行并提高反应效率。
最后,不稳定碳磷化合物的研究仍然是一个活跃的领域。
通过进一步研究其合成方法、性质和反应机制,我们可以更好地理解不稳定碳磷化合物的特性,并寻找更多潜在的应用领域。
总结:不稳定碳磷化合物是具有碳磷键的化合物,具有较低的稳定性和较短的半衰期。
碳负离子及其稳定性—有机反应机理系列52
碳负离子指的是含有一个连有三个基团,并且带有一对孤对电子的碳,其有两种杂化形式:sp2杂化和sp3杂化,但多数场合取sp3杂化。
1 碳负离子稳定性
影响碳负离子稳定因素主要包括诱导效应、共振效应、杂化效应、位阻效应。
(1)诱导效应
碳负离子与吸电子基团相连,如NO2、COOEt等,稳定性增加,因为吸电基的诱导效应使负电荷得到分散,碳负离子就越稳定。
与之相反,与碳负离子相连的供电基团越多,则稳定性降低。
比如稳定性CH3- > CH3CH2- >(CH3)2CH- > (CH3)3C-。
(2)共振效应
碳负离子与不饱合体系,如CH=CH2,Ar等相连时,稳定性增加,因为碳负离子可以与不饱和体系形成p-π共轭,进而将负电荷分散到整个共轭体系中(共振效应)。
如下图所示,负电荷与CH=CH2以及苯环的共振。
(3)杂化效应
当碳负离子从sp3到sp2到sp,碳负离子稳定性逐渐增加。
这是因为轨道的s特征越大,导致负电荷更紧密的保持在原子核(正电)周围,所以碳负离子更稳定。
(4)位阻效应
多数碳负离子取sp3杂化,取代基之间较为拥挤,与碳正离子的稳定性相反,随着碳负离子的取代基体积变大,分子内张力增加,稳定性降低。
当然也有例外,如与碳负离子相连的苯环增加时,虽然分子内张力增加了,但苯环与碳负离子之间的共振效应对于碳负离子稳定性的贡献要大于位阻效应,所以苯环接的越多稳定性越高。