共价键与分子间作用力
- 格式:ppt
- 大小:819.50 KB
- 文档页数:31

化学键分子间作用力汇总分子间作用力是指分子之间的相互作用力,包括化学键和非化学键。
化学键是指原子之间通过共用或转移电子而形成的强力相互作用力,而非化学键是指分子间的弱力相互作用力。
本文将对各种化学键和分子间作用力进行详细介绍。
一、共价键共价键是指两个原子通过共享电子而形成的键。
共价键的形成是靠原子之间的电子重新排布来完成的,形成的键通常是比较强的。
共价键通常有以下几种类型:1.单共价键:两个原子共享一个电子对,形成一对电子。
单共价键通常是较强的键,常见于碳、氢、氧、氮等元素之间的化学键。
2.双共价键和三共价键:当两个原子之间的电子不能通过单共价键满足,还可以通过双共价键或三共价键来共享更多的电子对。
双共价键和三共价键常见于含碳的有机化合物中。
3.金属键:金属键是指金属元素之间的共价键。
金属键通常是非常强大的键,具有很高的熔点和电导率。
二、离子键离子键是指通过正负离子之间的吸引力而形成的键。
离子键的形成通常发生在金属与非金属元素之间,非金属元素通常会通过转移电子成为带电离子,金属元素通常会失去电子成为带正电离子。
离子键通常是很强的键,因此离子化合物具有高熔点和良好的导电性。
三、金属键金属键是指金属元素之间的共价键。
金属键的形成是由于金属元素的特殊电子结构导致的,金属元素没有固定的价电子,而是形成了电子云。
这种电子云的形成使得金属元素之间的共价键成为了金属键。
金属键通常是非常强大的键,有很高的熔点和电导率。
四、氢键氢键是一种特殊的化学键,是指一个带有氢原子的分子与另一个带有强电负性原子(如氮、氧、氟等)的分子之间的相互作用力。
氢键比较弱,通常只有3-10%的共价键强度,但由于氢原子的小尺寸和高电荷密度,使得氢键对分子间的相互作用有很大的贡献。
氢键是生物和化学体系中很重要的分子间作用力,它对于分子的几何构型、物理性质和化学反应具有重要影响。
除了上述的化学键外,还有一些非化学键的分子间作用力:1.范德华力:范德华力是非极性分子之间的相互作用力,是由于分子中存在的临时性偶极引起的。


第十章共价键和分子间作用力本章教学要求掌握现代价键理论、杂化轨道理论熟悉共价键的本质、特征和类型,分子间作用力了解价层电子对互斥理论、分子轨道理论(chemical bond)。
化学键分为离子键(ionic bond)、共价键(covalent bond)和金属键(metallic bond)。
本章依据量子力学阐述共价键的现代理论,同时要介绍物质分子与分子之间比较弱的相互作用力,即分子间作用力(intermolecular force),它包括范德华力(van der Waals force)和氢键(hydrogen bond)。
第一节现代价键理论1916年美国化学家路易斯(G.N. Lewis)*提出经典的共价键电子理论。
该理论认为两个或多个原子可以相互“共用”一对或多对电子,以便达到稀有气体原子最外层2或8电子层结构(路易斯结构),而生成稳定的分子。
例如:H·+ ·H →H∶H 或H-H分子中通过共用电子对连接的化学键称为共价键,也可用短横线表示。
该理论初步揭示了共价键与离子键的区别,能解释共价键的饱和性。
但不能解释一些分子的中心原子最外层电子数虽然少于或多于8仍能稳定存在的事实,如:也无法说明为什么共用互相排斥的两个带负电荷的电子能使原子成为稳定分子的本质原因。
直到量子力学建立以后,共价键的理论才开始发展。
一、氢分子的形成和共价键的本质* G.N. Lewis加州大学伯克利分校教授,Lewis提出共价键的电子理论对发展化学价理论奠定了基础;他还创造性地提出了酸碱电子理论。
他的研究生中先后有5人获得诺贝尔奖。
图氢分子是最简单的典型共价键分子。
1927年德国化学家海特勒(W. Heitler )和伦敦(F. London )把氢分子看成是两个核和两个电子组成的系统,用量子力学近似求解其薛定谔方程。
结果得到H 2分子形成的势能曲线,见图10-1。
当两个H 原子彼此远离时没有相互作用,它们的势能为零。


共价键与分子间作用力共价键和分子间作用力是化学中两个重要的概念,它们对物质的性质和行为起着决定性的作用。
本文将重点介绍共价键和分子间作用力的概念、类型、特点以及它们在化学反应和物质性质中的应用。
共价键是两个非金属原子间由电子对共享而形成的一种化学键。
在共价键中,原子不会失去或得到电子,而是共享电子,以满足各自的外层电子壳。
共价键的形成能力取决于原子的电负性差异。
电负性是一个原子吸引其共享电子的能力,与原子核的吸引力有关。
共价键分为偶极共价键和非极共价键两种类型。
偶极共价键是指共价键中的电子对更多地靠近一个原子,使其带有相对正电荷,另一个原子则带有相对负电荷。
非极共价键是指共价键两端的原子相对电荷均相等,电子对靠近两个原子中间。
具体来说,如果两个原子电负性相等,那么形成的是非极共价键;如果两个原子电负性差异较大,那么形成的是偶极共价键。
除了共价键,分子间作用力也是分子间相互作用的重要力量。
分子间作用力指的是靠近的两个分子之间的相互作用力。
它是由于分子间的静电相互作用、分子之间的取向相互作用和分子之间的诱导相互作用所导致的。
静电相互作用是一种非共价相互作用力,其中相互作用的分子带有正电荷或负电荷。
根据库仑定律,两个带电荷的物体之间的引力或斥力与它们之间的距离和电荷量成正比。
因此,静电相互作用力对于离子之间的相互作用是非常重要的。
取向相互作用是由于两个极性分子之间的分子极性导致的相互吸引。
极性分子的极性取决于分子中的原子电负性差异。
在这种情况下,正极和负极之间的相互作用力具有较大的分子之间作用力。
诱导相互作用是由于无极性分子中的电子云的瞬间分布的改变而引起的。
当一个原子或分子靠近另一个无极性原子或分子时,它的电子云会更集中地分布在远离相互作用区域的一侧。
这将导致另一个原子或分子的电子云在与之相对的另一侧更加分散。
因此,在周围电子云的引导下,两个无极性分子之间会发生诱导相互作用,由此产生相互作用力。
除了静电相互作用、取向相互作用和诱导相互作用外,范德华力也是一种分子间作用力。
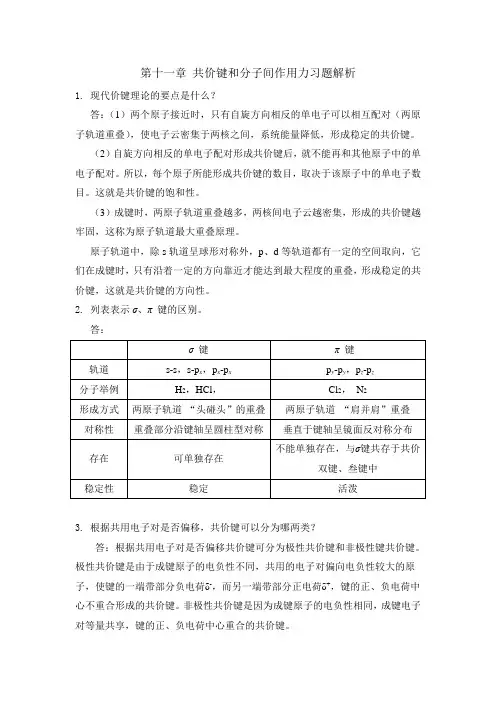
第十一章共价键和分子间作用力习题解析1.现代价键理论的要点是什么?答:(1)两个原子接近时,只有自旋方向相反的单电子可以相互配对(两原子轨道重叠),使电子云密集于两核之间,系统能量降低,形成稳定的共价键。
(2)自旋方向相反的单电子配对形成共价键后,就不能再和其他原子中的单电子配对。
所以,每个原子所能形成共价键的数目,取决于该原子中的单电子数目。
这就是共价键的饱和性。
(3)成键时,两原子轨道重叠越多,两核间电子云越密集,形成的共价键越牢固,这称为原子轨道最大重叠原理。
原子轨道中,除s轨道呈球形对称外,p、d等轨道都有一定的空间取向,它们在成键时,只有沿着一定的方向靠近才能达到最大程度的重叠,形成稳定的共价键,这就是共价键的方向性。
2. 列表表示σ、π 键的区别。
答:3. 根据共用电子对是否偏移,共价键可以分为哪两类?答:根据共用电子对是否偏移共价键可分为极性共价键和非极性键共价键。
极性共价键是由于成键原子的电负性不同,共用的电子对偏向电负性较大的原子,使键的一端带部分负电荷δ-,而另一端带部分正电荷δ+,键的正、负电荷中心不重合形成的共价键。
非极性共价键是因为成键原子的电负性相同,成键电子对等量共享,键的正、负电荷中心重合的共价键。
4.共价键的极性及极性大小用什么来判断?共价分子的极性及极性大小用什么来量度?答:共价键的极性大小根据成键原子的电负性来判断,因为共用的电子对偏向电负性较大的原子,使键的一端带部分负电荷δ-,而另一端带部分正电荷δ+,故成键原子的电负性差别越大,共价键的极性越强。
双原子分子的极性与键的极性一致。
多原子分子的极性不仅与键的极性有关,也与分子构型有关,虽然是极性键,只要键型相同,分子构型对称,其分子中各个键的极性就能相互抵消,正、负电荷重心重合。
分子的极性可用电偶极矩(electric dipole moment)μ来衡量。
它是分子中正、负电荷中心的距离d 与正或负电荷中心上的电量q 的乘积,即μ= q·d ,单位为10-30 C·m 。


分子间作用力的四种形成方式分子间作用力是分子之间相互作用的力量,它是物质存在和物质性质产生的基础。
分子间作用力的形成方式有四种,分别是范德华力、氢键、离子键和共价键。
一、范德华力范德华力是分子间最常见的一种作用力,它是由于分子内部电子的运动导致的。
分子中的电子在空间中的运动会引起电荷分布的不均匀,从而形成一种瞬时的偶极矩。
这种偶极矩会与附近的分子偶极矩相互作用,产生吸引力,即范德华力。
范德华力的大小与分子的极性有关,极性越大,范德华力越强。
二、氢键氢键是指分子中氢原子与氧、氮、氟等高电负性原子之间的相互作用。
氢键的形成需要具备三个条件:①氢原子与较电负的原子之间的键能较强,如氢原子与氮原子之间的键能;②氢原子与较电负的原子之间的距离适当,一般在1.5-2.5埃之间;③氢键的形成需要在分子中存在较为稳定的空间构型。
氢键的强度介于共价键和离子键之间,它对物质的性质起到重要的影响。
三、离子键离子键是指由正离子和负离子之间的静电作用力形成的化学键。
在离子键中,正离子和负离子之间相互吸引,形成离子晶体的结构。
离子键的强度较大,使离子晶体具有高熔点、高硬度和良好的导电性等性质。
离子键的形成需要具备两个条件:①正离子和负离子之间的电荷差异较大;②正离子和负离子之间的距离较近。
四、共价键共价键是指由两个非金属原子共享电子而形成的化学键。
在共价键中,原子之间通过电子的共享而相互吸引。
共价键的强度较大,使得共价化合物具有较高的熔点和沸点。
共价键的形成需要满足两个条件:①原子之间的电负性差异较小;②原子之间的距离适当。
共价键的形成可以是单一共价键、双键或者三键,共价键的类型决定了化合物的性质。
分子间作用力的四种形成方式分别是范德华力、氢键、离子键和共价键。
这些作用力对物质的结构和性质具有重要的影响,深入了解分子间作用力的形成方式有助于我们更好地理解物质的性质和相互作用。

第2课时共价键分子间作用力一、共价键与共价化合物1.共价键的形成过程(1)氯分子的形成过程两个氯原子各提供一个电子→两个氯原子间形成共用电子对→两个氯原子均达到8e-稳定结构→形成稳定的氯气分子请你根据上述图示,用电子式表示其形成过程:。
(2)下图形象地表示了氯化氢分子的形成过程请你用电子式表示HCl的形成过程:。
2.共价键(1)概念:原子间通过共用电子对所形成的强烈的相互作用。
(2)成键三要素:①成键微粒:原子。
②成键元素:一般是同种的或不同种的非金属元素。
③成键条件:成键前原子最外层电子未达到饱和状态。
(3)分类3.共价化合物(1)概念:以共用电子对形成分子的化合物。
(2)四种常见的共价化合物①非金属氢化物:如NH3、H2S、H2O等。
②非金属氧化物:如CO、CO2、SO2等。
③酸:如H2SO4、HNO3等。
④大多数有机化合物:如CH4、CH3CH2OH等。
4.共价分子的电子式与结构式(1)常见分子的电子式和结构式(2)用电子式表示共价分子的形成过程①H2:H·+·H―→H∶H。
②NH3:。
③CO2:。
(1)含有共价键的分子不一定是共价化合物。
例如H2、O2等单质。
(2)含有共价键的化合物不一定是共价化合物。
例如NaOH、Na2O2。
(3)离子化合物中可能含有共价键,共价化合物中一定不含离子键,只有共价键。
例1下列叙述中,不正确的是()A.含有共价键的物质一定是共价化合物B.H2O2中既含有极性键又含有非极性键C.CaO和NaCl晶体熔化时均要破坏离子键D.H2SO4熔融态不导电考点共价键与共价化合物题点共价键与共价化合物的关系与应用答案 A解析部分非金属单质如O2、N2中含有共价键,但不属于化合物;某些离子化合物如NaOH 中既含有离子键又含有共价键。
例2下列分子的电子式书写正确的是()A.氨气B.四氯化碳C.氮气D.二氧化碳考点共价键与共价化合物题点典型物质的电子式的书写与判断答案 C二、化学键与分子间作用力1.化学键(1)化学键概念:使离子相结合或原子相结合的作用力。

化学键和分子间作用力一、化学键化学键是分子中原子之间的相互作用,是维持分子结构稳定性的关键。
它通过共用电子对来实现原子间的连接。
化学键可以分为共价键、离子键和金属键。
1.共价键:在共价键中,原子通过共享电子对来实现互相连接。
共价键是最常见的化学键。
共价键可以分为单共价键、双共价键和三共价键。
单共价键由两个原子共享一个电子对形成,双共价键由两个原子共享两个电子对形成,三共价键由两个原子共享三个电子对形成。
共价键的强度通常较高,使得共价化合物具有很高的熔点和沸点,同时也确保了共价化合物的稳定性。
2.离子键:离子键是由电离的正负离子之间的静电作用力形成的。
在离子键中,正离子和负离子之间的电荷吸引力导致它们组成离子晶体的结构。
离子键通常在金属与非金属元素之间形成,例如氯化钠和氧化铝等。
离子键的强度通常较大,使得离子晶体具有高熔点和硬度。
3.金属键:金属键是金属原子之间的相互作用力。
金属原子之间的电子可以自由流动,形成电子云,因此金属键不像共价键和离子键一样具有明确的共享和转移电子的特性。
金属键的形成使金属具有良好的热和电导性能,同时也是金属具有延展性和可塑性的原因之一除了化学键外,分子之间还存在着分子间作用力,这些作用力决定了液体和固体的性质,如沸点、熔点和溶解度等。
分子间作用力包括范德华力、氢键和离子-偶极作用力等。
1.范德华力:范德华力是暂时性的极化作用力,由于电子在运动中不断产生的电荷不均衡而形成。
分子间的范德华力通常很弱,但是当大量分子之间的范德华力相互叠加时,可以产生明显的效应。
范德华力是液体和固体的性质的主要决定因素之一2.氢键:氢键是一种特殊的分子间作用力,可以在带有部分正电荷的氢原子和带有部分负电荷的氧、氮和氟原子之间形成。
氢键的强度比范德华力强,但仍比化学键要弱。
氢键在生物化学中具有重要作用,如DNA双螺旋结构的稳定性和蛋白质的折叠等。
3.离子-偶极作用力:当带电离子与带极性分子之间相互作用时,形成离子-偶极作用力。
共价键离子键和分子间作用力是共价键、离子键和分子间作用力是化学中常见的键和相互作用力。
它们在物质的性质和化学反应中起着重要的作用。
共价键是由共享电子对形成的键。
在共价键中,两个原子通过共享外层电子来实现稳定。
共价键可以分为极性共价键和非极性共价键。
极性共价键是指共享电子对在空间中不均匀分布,使得分子具有极性。
非极性共价键是指共享电子对在空间中均匀分布,使得分子不具有极性。
共价键的形成需要原子之间具有相互吸引的作用力,如共价键的强度和稳定性与原子核的电荷量、电子云的形状和大小等因素有关。
离子键是由正离子和负离子之间的静电吸引力形成的键。
在离子键中,正离子失去一个或多个电子,形成正电荷,而负离子获得一个或多个电子,形成负电荷。
离子键的形成需要原子之间电荷的相互吸引,形成离子晶体。
离子键通常具有高熔点和良好的导电性。
分子间作用力是分子之间的相互作用力。
分子间作用力的种类很多,常见的有范德华力、氢键和离子-离子相互作用。
范德华力是非极性分子间的相互作用力,它是由于电子在分子中的运动而引起的瞬时偶极矩形成的吸引力。
氢键是极性分子间的相互作用力,它是由于氢原子与带有电负性的原子之间的相互作用而形成的。
离子-离子相互作用是带电离子之间的相互作用力,它是由于正离子和负离子之间的静电吸引力形成的。
共价键、离子键和分子间作用力在物质的性质和化学反应中起着重要的作用。
共价键决定了分子的结构、形状和化学性质。
不同的共价键类型会影响分子的极性和化学反应的进行。
离子键决定了离子晶体的结构和性质。
离子晶体通常具有高熔点和良好的导电性。
分子间作用力影响了物质的相态和物理性质。
范德华力决定了物质的挥发性和溶解性。
氢键影响了液体的沸点和溶解性。
离子-离子相互作用决定了离子晶体的稳定性和溶解性。
共价键、离子键和分子间作用力是化学中常见的键和相互作用力。
它们在物质的性质和化学反应中起着重要的作用。
了解和理解这些键和相互作用力的性质和特点,对于深入理解化学现象和探索新的物质具有重要意义。
分子间作用力大小排序
分子间作用力是指分子与分子之间的相互作用。
这些相互作用可以影
响物质的物理性质,包括熔点、沸点、溶解度和粘度等。
按照作用力
的大小排序,可以将分子间作用力分为以下几种类型:
1.离子键:在离子化合物中,正负离子之间的电荷相互吸引形成离子键。
离子键是所有分子间作用力中最强的一种。
2.共价键:具有共价键的分子中,分子中原子之间通过共享电子形成化学键。
共价键的作用力比离子键大一些。
3.氢键:氢键是分子间的非共价键,它是分子间电性不均引起的一种相互吸引作用力。
氢键的作用力比共价键小一些。
4.范德华力:范德华力是分子间的非共价键,是通过电子云的变化引起的瞬时偶极子相互吸引力。
范德华力是所有分子间作用力中最弱的一种。
总之,分子间作用力的大小与分子的化学结构密切相关。
理解分子间
作用力的本质有助于我们更好地理解物质的性质和行为。
共价键与分子间作用力共价键是指两个或多个原子之间通过电子的共享形成的化学键。
在共价键中,原子之间的电子云被共享,从而使得原子相互连接成分子。
共价键是化学中最常见的键类型,几乎所有有机化合物和许多无机化合物都是通过共价键连接的。
共价键的形成涉及到原子之间电子的重新分布。
每个原子都希望填满其最外层的电子壳,以达到稳定的电子构型。
当两个原子之间有相似的电子云互相重叠时,它们可以形成一个共享电子对,从而形成共价键。
共享的电子对在空间上固定在两个原子之间,维持着原子之间的吸引力,将它们保持在一起价键的强度取决于多种因素,包子云的重叠程度、原子核的电荷、原子间的距离等。
电子云的重叠程度越大价键越强。
原子核的电荷越大,它对电子的吸引力越强,也会增强共价键的强度。
原子间的距离越近,共价键也越强。
共价键的强度可以通过键长和键能来描述。
其中最常见的分子间作用力是范德华力。
范德华力是由于电子运动引起的瞬态偶极子之间的吸引力。
即使是非极性分子也会通过范德华力相互作用。
范德华力是一种短程力,随着分子之间的距离的增大而快速减弱。
另一种分子间作用力是氢键。
氢键的形成涉及到含有氢原子的一个分子与另一个带有电负性原子的分子之间的相互作用。
氢键通常涉及氢原子与氧、氮或氟原子之间的作用。
氢键较强,比范德华力更强,可以在确定分子的性质和结构中起重要的作用。
还有其他一些分子间作用力,如离子-离子相互作用、离子-极性分子相互作用、静电力等。
这些作用力也可以在确定分子的性质和行为方面发挥重要的作用。
总之,共价键是通过电子的共享连接原子的化学键。
它是化学中最常见的键类型,并决定了分子的结构和性质。
然而,分子间作用力也是分子行为中至关重要的因素,可以通过范德华力、氢键、离子-离子相互作用等力来描述。
共价键与分子间作用力共同影响着分子的性质和行为。