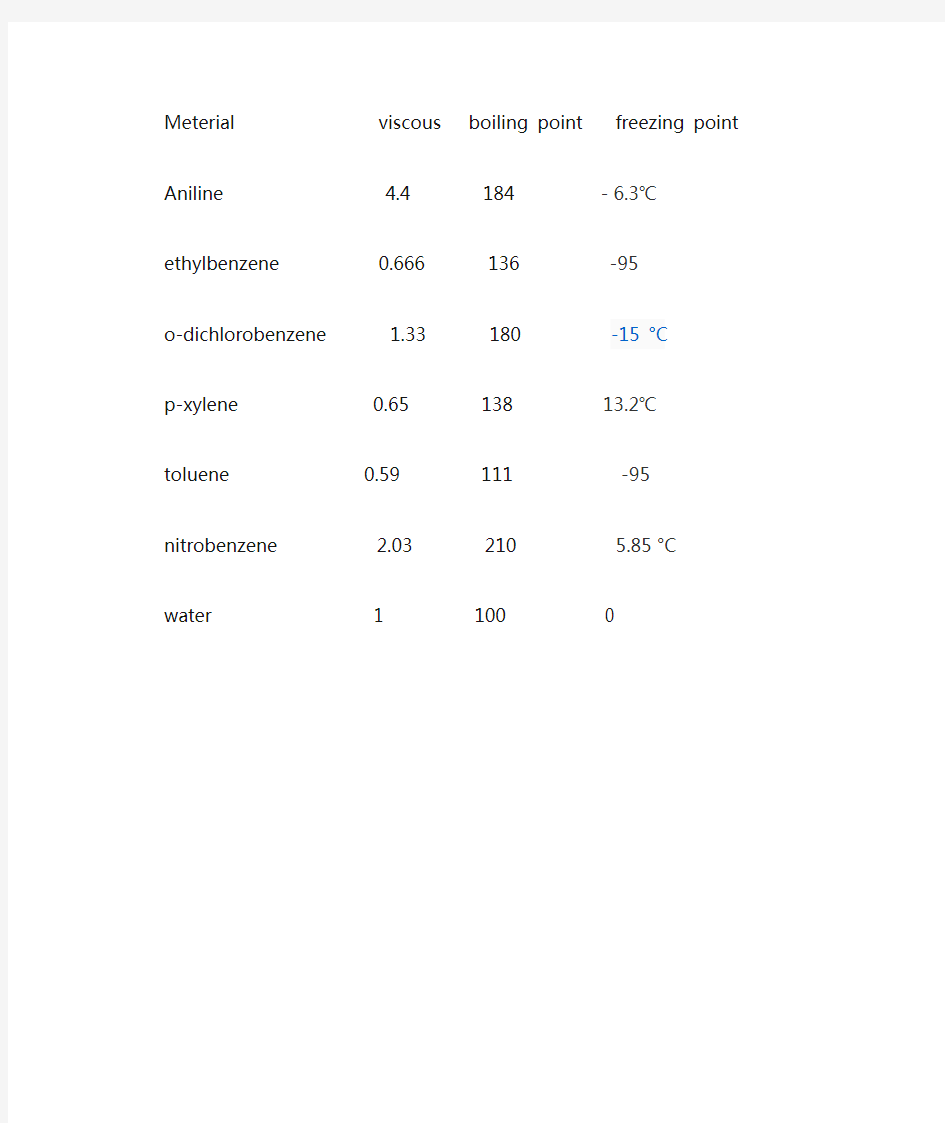
Meterial viscous boiling point freezing point Aniline 4.4 184 -6.3℃ethylbenzene 0.666 136 -95
o-dichlorobenzene 1.33 180 -15 °C
p-xylene 0.65 138 13.2℃toluene 0.59 111 -95 nitrobenzene 2.03 210 5.85 °C water 1 100 0
第十一章第一节《科学探究:熔点与沸点》 学习目标: 1、知道水有三种状态,且能在三种状态间相互转化;了解自然界中的水循环。 2、知道常见的一些晶体和非晶体;知道晶体有熔点、非晶体没有熔点。 3、了解晶体和非晶体在熔化时的区别;理解晶体和非晶体的熔化图像。 4、知道汽化及汽化的两种方式;理解液体的沸腾图像。 预习作业: 1、水有三种状态,它们分别是、、。并且,水的三种状态在一定条件下是可以的。 2、熔化是指物质从的过程。熔点是指。 3、固体分为和,其中有熔点没有熔点。例如 、、、等属于晶体,、等属于非晶体。 4、汽化是指物质从的过程。汽化的两种方式是。 5、晶体的熔点也会由于杂质的存在或外界压强的增大而,物质的沸点也会由于的增大而。 6、在1个标准大气压下,冰的熔点是,水的沸点是。 课堂练习: 1、已知液态氢的沸点是-253℃,固态氢熔点是-259℃,那么-260℃的氢是态,-255℃的氢是态,-250℃的氢是态,-259℃的氢是。 2、某些高山上的雪,为什么终年不化? 3、把一小块冰放在手心里,冰块会发生变化吗?手有什么感觉? 4、2008年初我国大部分地区持续降雪,形成天气,人们往冰冻的路面上撒盐。 这样做的目的是什么? 5、通过查阅一些晶体的熔点表可以知道,铝的熔点是660℃,能不能用铝壶在1000℃的火炉上烧水? 课后作业: 1.在松香、铜块、玻璃、白糖、食盐、海波中,属于晶体的是它们的共同特征是有一定的。 2.铅的熔点是328℃,那么温度为328℃的铅( ) A.一定是固态B.一定是液态 C.一定是固态和液态共存 D.可能是固态和液态共存 3.如图所示,烧瓶中的水停止沸腾后,若从烧瓶中往外抽气, 会看到水又沸腾起来,这是由于()
有机溶剂分类 一、烃类溶剂 1.烃 只含有碳氢两种元素的有机化合物叫烃。根据结构将烃类分为脂肪烃和芳香烃。脂肪烃包括脂肪链烃和脂环烃。开链结构的脂肪烃根据结构的饱和程度分为饱和链烃(烷烃)和不饱和链烃(烯烃和炔烃)。芳香烃是含有苯环特殊结构的烃类。根据具体结构分为单环芳烃、多环芳烃和稠环芳烃。 烃类溶剂根据来源分为两类:由石油分馏得到的烃类混合物溶剂叫石油溶剂油,简称溶剂油;由化工原料合成或精制得到的成分单一烃类溶剂是烃的纯溶剂。纯溶剂价格较高,通常只用于一些特殊用途中。 2.溶剂油 石油是由多种烃类组成的混合物,经过分馏处理得到不同沸点范围的产品。根据沸,抿范围通常把石油产品分为石油醚、汽油、煤油、柴油、润滑油、石蜡和沥青。其中沸点范围在30~90℃以戊烷和己烷为主要成分的石油醚和沸点范围在40~200℃烃分子含碳数在4~12的汽油,有很好的溶解性能。在工业生产中常做溶剂使用,称为溶剂油或溶剂汽油。近年来还开发出相当于煤油乃至轻柴油馏分做高沸点溶剂油,拓宽了溶剂油的概念。煤油是石油分馏时,沸点在175~325℃范围的馏分,由于馏程长所包含的烃类成分复杂。在一定情况下也可以做溶剂使用,如美国干洗业使用的干洗溶剂汽油(stoddard solvent)实际上是一种不易燃的煤油溶剂。因此广义上溶剂油包括多种沸程范围的烃类混合物以及己烷、苯、甲苯、二甲苯纯烃类溶剂。为了叙述上的方便,本书介绍的溶剂油是指由石油分馏得到的烃类混合物溶剂。 (1)溶剂油按沸程分类根据分馏过程的沸程,溶剂油大致分为三类:把沸程在100℃凋以下的称为低沸点溶剂油,如工业上的6号抽提溶剂油,沸程为60~90℃;把沸程在100~150℃的称为中沸点溶剂油,如橡胶溶剂油,沸程在80~120℃;把沸程高于150℃的称为高调沸点溶剂油,如油漆溶剂油,沸程为140—200℃,油墨溶剂油干点达360℃都属于高沸点溶剂油。从沸程范围看,溶剂油大多数属于汽油馏分。 (2)溶剂油的化学成分溶剂油是各种烃类的混合物,主要成分有开链烷烃、烯烃、环烷烃和芳香烃。由于烯烃化学性质活泼、安定性差,不适合作溶剂使用,所以一般溶剂油中含烯烃很少,成分以其他三类烃为主。 低沸程溶剂油,如6号抽提溶剂油,120号橡胶溶剂油,200号油漆溶剂油中主要成分是烷烃和环烷烃。有时称为脂肪烃类溶剂,脂肪烃溶剂油成分有直链烷烃、支链烷烃、环烷烃。由于不同结构烷烃的溶解性能不同,所以又可以根据其主要成分进一步分类,如以支链烷烃为主要成分的溶剂油,称为异构烷烃溶剂油,它的溶解性能优于一般脂肪烃溶剂油而高沸程溶剂油中甲苯、二甲苯等芳烃含量较大称为芳烃类溶剂油,如近年兴起的高沸点芳烃溶剂油主要成分就是分子中含9个碳原子的芳烃。 溶剂油的性能与其化学成分有密切关系,由于烃类的溶解能力顺序为:芳烃>环烷烃>链烷烃。所以相同沸程的溶剂油中含链烷烃、环烷烃多的比含芳烃较多的溶剂油苯胺点高、贝壳松脂丁醇值低,溶解能力差。 纯芳香烃溶剂油虽然溶解能力强,但毒性也大,因此目前工业上出现用高芳香烃溶剂油和低芳香烃溶剂油来代替苯、甲苯、二甲苯等纯芳香烃溶剂使用的趋势。这样虽然溶解能力稍有降低,但降低了溶剂油的毒性,也降低了生产成本。而且为降低溶剂油的毒性,各国对溶剂油中的芳香烃含量都作出限制,如油漆溶剂油中芳香烃的含量要求在15%以下。
熔点、沸点、凝固点与压强的关系原因分析 一、熔点、沸点、凝固点 1、凝固点 凝固点是晶体物质凝固时的温度,不同晶体具有不同的凝固点。在一定压强下,任何晶体的凝固点,与其熔点相同。同一种晶体,凝固点与压强有关。凝固时体积膨胀的晶体,凝固点随压强的增大而降低;凝固时体积缩小的晶体,凝固点随压强的增大而升高。在凝固过程中,液体转变为固体,同时放出热量。所以物质的温度高于熔点时将处于液态;低于熔点时,就处于固态。非晶体物质则无凝固点。 液-固共存温度浓度越高,凝固点越低,液体变为固体的过程叫凝固 2、沸点 饱和蒸汽压:在一定温度下,与液体或固体处于相平衡的蒸汽所具有的压力称为饱和蒸汽压。沸点:在一定压力下,某物质的饱和蒸汽压与此压力相等时对应的温度。沸腾是在一定温度下液体内部和表面同时发生的剧烈汽化现象。 液体沸腾时候的温度被称为沸点。浓度高,沸点高,不同液体的沸点是不同的, 几种不同液体的沸点/摄氏度(在标准大气压下) 液态铁:2750 液态铅:1740 水银(汞):357 亚麻仁油:287 食用油:约250 萘:218 煤油:150 甲苯:111 水:100 酒精:78 乙醚:35 液态氨:-33 液态氧:-183 液态氮:-196 液态氢:-253 液态氦:-268.9 所谓沸点是针对不同的液态物质沸腾时的温度。 液体开始沸腾时的温度。沸点随外界压力变化而改变,压力低,沸点也低。 沸点:液体发生沸腾时的温度;即物质由液态转变为气态的温度。当液体沸腾时,在其内部所形成的气泡中的饱和蒸汽压必须与外界施予的压强相等,气泡才有可能长大并上升,所以,沸点也就是液体的饱和蒸汽压等于外界压强的温度。液体的沸点跟外部压强有关。当液体所受的压强增大时,它的沸点升高;压强减小时;沸点降低。例如,蒸汽锅炉里的蒸汽压强,约有几十个大气压,锅炉里的水的沸点可在200℃以上。又如,在高山上煮饭,水易沸腾,但饭不易熟。这是由于大气压随地势的升高而降低,水的沸点也随高度的升高而逐浙下降。(在海拔1900米处,大气压约为79800帕(600毫米汞柱),水的沸点是93.5℃)。 在相同的大气压下,液体不同沸点亦不相同。这是因为饱和汽压和液体种类有关。在一定的温度下,各种液体的饱和汽压亦一定。例如,乙醚在20℃时饱和气压为5865.2帕(44
蒸馏及沸点的测定 杨高升有机化学教研室 (2007 年3 月9 日) 一、实验目的 1、了解测定沸点的原理与意义 2、学习并掌握蒸馏操作 二、实验原理 3、学习并掌握常量法(即蒸馏法)测定沸点的方法 1、沸点(boiling point, b.p.) ——液态物质的蒸汽压与其所处体系的压力相等时的温度 液态物质沸腾 液态与气态平衡 物质处于沸点时: 纯净的液态化合物在一定的压力下均有固定的沸点 不同化合物有不同的沸点 沸程范围反映液态物质的纯度
常用术语 ——将液态物质加热到沸腾变为蒸气,再将蒸气冷 凝为液体的过程 2、蒸馏(distillation) 沸程始馏温度~终馏温度 不同温度范围的馏出液 某一馏分之前的馏出液 最后没有蒸馏出来的物质 馏分 前馏分 残留物 蒸馏的用途 液体物质的分离与纯化 测定化合物的沸点 回收溶剂或浓缩溶液 液体化合物的 沸点相差较大 (>30 o C) 常压蒸馏
蒸馏方法 适于沸点较低且比较稳定的液体化合物适于沸点较高或较不稳定的液体化合物适于沸点较为接近的液体化合物 适于沸点较高(但有一定蒸汽压)、容易 分解且不溶于水的化合物 减压蒸馏 分馏 水蒸气蒸馏 冷凝水 冷凝水 3、常压蒸馏装置
三、实验步骤及结果 2、蒸馏装置的安装 3、蒸馏操作 (1)加料 (4)加热 (2)通冷却水 (5)接收馏出液 1、接好冷却水的进出水管 .. 将磁搅拌子小心放入圆底烧瓶 .. 将待蒸液体倒入圆底烧瓶 .. 安装好蒸馏装置 注意检查进出水管、冷凝管是否完好! 装、拆各练习三次 (3)开动磁搅拌 前馏分与主馏分要 用不同的瓶子接收 顺序不 得有误液体体积为 烧瓶容积的 2/3 ~ 1/3 4、沸程记录
判断有机物熔点沸点 的规律 有机物熔沸点规律 中学的有机化学知识系统性强,用归纳和演绎的方法很容易掌握各类有机物的化学性质。但对于其物理性质总觉得杂乱无章,无规律可循,其实有机物的熔、沸点高低也是由其结构决定的。有机物的晶体大多是分子晶体,它们的熔、沸点取决于有机物分子间作用力的大小,而分子间作用力与分子的结构(有无H键、有无极性基团、饱和程度)、分子量等有关。主要分为下面四个情况: 1.组成和结构相似的物质,分子量越大,其分子间作用力就越大。所以有机物中的同系物随分子中碳原子个数增加,熔、沸点升高。在通常状况下分子中含四个碳原子以下的烷烃、烯烃、炔烃是气体,含四个碳原子以上的是液体,含更多碳原子的是固体。 2.分子式相同时,直键分子间的作用力要比带支键分子间的作用力大,支键越多, 排列越不规则,分子间作用力越小。如: 分子间作用力:正戊烷>异戊烷>新戊烷。 沸点:30.07C>279C>95C 3?分子中元素种类和碳原子个数相同时,分子中有不饱和键的物质熔、沸点要低些。如:C2H6 C2H4硬脂酸油酸 熔点:-88.63C>-103.7C 69.5C>14.0C 4.分子量相近时,极性分子间作用力大于非极性分子间的作用力。分子中极性基团越多,分子间作用力越大。如:
分子间作用力:C2H5OH>CH3OCH3 C2H5CI>CH3CH2CH3 沸点:78.5C>34.51C 12.27C>0.5C 苯同系物看取代基位置 相同的取代物,邻位>间位>对位 女如:二甲苯有三种同分异构体:邻二甲苯、间二甲苯、对二甲苯。我们可以这样理解,把这些分子看作一个球体,这三种分子的体积依次增大,分子间的距离也增大,因而分子间作用力减小,熔沸点就降低。因此它们的沸点依次降低。 分子量相同看分子极性 如果有机物分子是极性分子,由于极性分子具有偶极,而偶极是电性的。因此,极性分子之间除了具有色散力外,还具有偶极之间的静电引力。这样,极性分子之间的分子间力比非极性分子要大得多,所以使沸点升高。例如分子量相同的丁烷和丙酮:分子量结构沸点(C) 丙酮58 CH3COCH3 56.2 丁烷58 CH3CH2CH2CH3 —0.5 丙酮分子中含有羰基,由于碳氧电负性不同,碳原子上带有部分正电荷,氧原子上带有部分负电荷。当这样的极性分子相互接近时,势必产生较大的分子间力,从而表现出沸点值较大程度地升高。 不要忘记看氢键 如果有机物分子间能形成氢键,在液态时,分子间就能通过氢键结合形成较大的缔合体。这样的液体沸腾气化时,不仅要破坏分子间的范德华力,而且还必须消耗较多的能量破坏分子间的氢键,因此,含有氢键的有机物较之分子量相近的其它有机物,应具有反常的高沸点。例如甲醇和乙烷: 分子量结构沸点(°C) 甲醇32 CH3OH 64.9 乙烷30 CH3—CH3 —88.6 醇的沸点反常高就是由于其分子间有较强的氢键而发生缔合。除了醇之外,酚、羧酸和胺等也含有氢键,其沸点也相应较高。
常用有机溶剂分类及干燥 第一类溶剂 是指已知可以致癌并被强烈怀疑对人和环境有害的溶剂。在可能的情况下,应避免使用这类溶剂。如果在生产治疗价值较大的药品时不可避免地使用了这类溶剂,除非能证明其合理性,残留量必须控制在规定的范围内,如: 苯(2ppm)、四氯化碳(4ppm)、1,2-二氯乙烷(5ppm)、1,1-二氯乙烷(8ppm)、1,1,1-三氯乙烷(1500ppm)。 第二类溶剂 是指无基因毒性但有动物致癌性的溶剂。按每日用药10克计算的每日允许接触量如下: 2-甲氧基乙醇(50ppm)、氯仿(60ppm)、1,1,2-三氯乙烯(80ppm)、1,2-二甲氧基乙烷(100ppm)、1,2,3,4-四氢化萘(100ppm)、2-乙氧基乙醇(160ppm)、环丁砜(160ppm)、嘧啶(200ppm)、甲酰胺(220ppm)、正己烷(290ppm)、氯苯(360ppm)、二氧杂环己烷(380ppm)、乙腈(410ppm)、二氯甲烷(600ppm)、乙烯基乙二醇(620ppm)、N,N-二甲基甲酰胺(880ppm)、甲苯(890ppm)、N,N-二甲基乙酰胺(1090ppm)、甲基环己烷(1180ppm)、1,2-二氯乙烯(1870ppm)、二甲苯(2170ppm)、甲醇(3000ppm)、环己烷(3880ppm)、N-甲基吡咯烷酮(4840ppm)、。第三类溶剂 是指对人体低毒的溶剂。急性或短期研究显示,这些溶剂毒性较低,基因毒性研究结果呈阴性,但尚无这些溶剂的长期毒性或致癌性的数据。在无需论证的
情况下,残留溶剂的量不高于0.5%是可接受的,但高于此值则须证明其合理性。这类溶剂包括: 戊烷、甲酸、乙酸、乙醚、丙酮、苯甲醚、1-丙醇、2-丙醇、1-丁醇、2-丁醇、戊醇、乙酸丁酯、三丁甲基乙醚、乙酸异丙酯、甲乙酮、二甲亚砜、异丙基苯、乙酸乙酯、甲酸乙酯、乙酸异丁酯、乙酸甲酯、3-甲基-1-丁醇、甲基异丁酮、2-甲基-1-丙醇、乙酸丙酯。 除上述这三类溶剂外,在药物、辅料和药品生产过程中还常用其他溶剂,如1,1-二乙氧基丙烷、1,1-二甲氧基甲烷、2,2-二甲氧基丙烷、异辛烷、异丙醚、甲基异丙酮、甲基四氢呋喃、石油醚、三氯乙酸、三氟乙酸。这些溶剂尚无基于每日允许剂量的毒理学资料,如需在生产中使用这些溶剂,必须证明其合理性。 一些溶剂因为种种原因总是含有杂质,这些杂质如果对溶剂的使用目的没有什么影响的话,可直接使用。可是在进行化学实验和进行一些特殊的化学反应时,必须将杂质除去。虽然除去全部杂质是有困难的,但至少应该将杂质减少到对使用目的没有妨碍的限度。除去杂质的操作称为溶剂的精制,故溶剂的精制几乎都要进行脱水,其次再除去其他的杂质。 1.溶剂的脱水干燥: 溶剂中水的混入往往是由于在溶剂制造,处理或者由于副反应时作为副产物带入的,其次在保存的过程中吸潮也会混入水分。水的存
熔点沸点凝固点与压强的关系原因分析 Coca-cola standardization office【ZZ5AB-ZZSYT-ZZ2C-ZZ682T-ZZT18】
熔点、沸点、凝固点与压强的关系原因分析 一、熔点、沸点、凝固点 1、凝固点 点是物质凝固时的温度,不同晶体具有不同的凝固点。在一定压强下,任何晶体的凝固点,与其熔点相同。同一种晶体,凝固点与压强有关。凝固时体积膨胀的晶体,凝固点随压强的增大而降低;凝固时体积缩小的晶体,凝固点随压强的增大而升高。在凝固过程中,液体转变为固体,同时放出热量。所以物质的温度高于熔点时将处于液态;低于熔点时,就处于固态。非晶体物质则无凝固点。 液-固共存温度浓度越高,凝固点越低,液体变为固体的过程叫凝固 2、沸点 饱和蒸汽压:在一定温度下,与液体或固体处于相平衡的蒸汽所具有的压力称为饱和蒸汽压。沸点:在一定压力下,某物质的饱和蒸汽压与此压力相等时对应的温度。沸腾是在一定温度下液体内部和表面同时发生的剧烈现象。 液体时候的温度被称为沸点。浓度高,沸点高,不同液体的沸点是不同的,几种不同液体的沸点/(在下) 液态铁:2750 液态铅:1740 (汞):357 亚麻仁油:287 食用油:约250 :218 煤油:150 :111 :100 :78 :35 液态氨:-33 液态氧:-183 液态氮:-196 液态氢:-253 液态氦: 所谓沸点是针对不同的液态物质沸腾时的温度。 液体开始沸腾时的温度。沸点随外界压力变化而改变,低,沸点也低。 沸点:发生沸腾时的;即物质由液态转变为气态的温度。当液体沸腾时,在其内部所形成的气泡中的饱和蒸汽压必须与外界施予的压强相等,气泡才有可能长大并上升,所以,沸点也就是液体的饱和蒸汽压等于外界压强的温度。液体的沸点跟外部压强有关。当液体所受的压强增大时,它的沸点升高;压强减小时;沸点降低。例如,里的蒸汽压强,约有几十个大气压,锅炉里的水的沸点可在200℃以上。又如,在高山上煮饭,水易沸腾,但饭不易熟。这是由于大
有机化学实验报告 实验名称:熔点、沸点及其测定 学院: 专业:化学工程与工艺 班级: 姓名:学号 指导教师: 日期: 一、实验目的 1、了解熔点测定的意义和应用;
2、掌握熔点测定的操作方法; 3、了解温度计的矫正方法。 二、实验原理 1、纯物质有固定的,短程熔点; 2、杂质对熔点的影响:降低熔点,扩大其熔点间隔。 三、主要试剂及物理性质 四、仪器装置 图1. Thiele管熔点测定装置 提勒管(b形管)特点:在侧管处用酒精灯加热,受热浴液沿管作上升运动促使整个b形管内浴液循环对流,使温度均匀而不需要搅拌。 五、实验步骤及现象 1、温度计的校正 ⑴0℃的测定校正:用100ml小烧杯装一定量混合均匀的冰水混合物,用
温度计测其温度,直至温度恒定读数,该数据即为0℃的校正值。 ⑵100℃的测定校正:取一定量的蒸馏水于电炉加热至沸腾,用温度计测 量其温度,直至温度恒定读数,该数据即为100℃的校正值。 2、毛细管熔点测定法 ⑴装样:取干燥、研细的待测样品放在称量纸上,将毛细管开口一端插入 样品中,使少量样品挤入熔点管中。取一支长玻璃管,垂直桌面,使毛细管在其中自由落下,将样品夯实。重复操作使所装样品约有2~3mm高为止。 ⑵安装:向b形管中加入石蜡油作为浴液,直到支管上沿。将已装好的毛 细管固定在温度计上,然后小心悬于b形管中,使温度计水银球处在b形管直管中部。 ⑶测定:在b形管弯曲部分加热。快速加热观察并记录样品刚开始熔化时 的温度,继续加热记录样品全部熔化时的温度;第二、三次测量时,减慢加热速度,每分钟升1℃左右,接近熔点时,每分钟约0.2℃,观察并记录实验数据。 六、实验结果
溶剂的定义 溶剂(solvent)这个词广义指在均匀的混合物中含有的一种过量存在的组分。狭义地说,在化学组成上不发生任何变化并能溶解其他物质(一般指固体)的液体,或者与固体发生化学反应并将固体溶解的液体。溶解生成的均匀混合物体系称为溶液。在溶液中过量的成分叫溶剂;量少的成分叫溶质。 溶剂也称为溶媒,即含有溶解溶质的媒质之意。但是在工业上所说的溶剂一般是指能够溶解油脂、蜡、树脂(这一类物质多数在水中不溶解)而形成均匀溶液的单一化合物或者两种以上组成的混合物。这类除水之外的溶剂称为非水溶剂或有机溶剂,水、液氨、液态金属、无机气体等则称为无机溶剂。 溶解现象 溶解本来表示固体或气体物质与液体物质相混合,同时以分子状态均匀分散的一种过程。事实上在多数情况下是描述液体状态的一些物质之间的混合,金与铜、铜与镍等许多金属以原子状态相混合的所谓合金也应看成是一种溶解现象。所以严格地说,只要是两种以上的物质相混合组成一个相的过程就可以称为溶解,生成的相称为溶液。一般在一个相中应呈均匀状态,其构成成分的物质可以以分子状态或原子状态相互混合。 溶解过程比较复杂,有的物质在溶剂中可以以任何比例进行溶解,有的部分溶解,有的则不溶。这些现象是怎样发生的,其影响的因素很多,一般认为与溶解过程有关的因素大致有以下几个方面: ⑴相同分子或原子间的引力与不同分子或原子间的引力的相互关系(主要是范德华引力); ⑵分子的极性引起的分子缔合程度; ⑶分子复合物的生成; ⑷溶剂化作用; ⑸溶剂、溶质的相对分子质量; ⑹溶解活性基团的种类和数目。 化学组成类似的物质相互容易溶解,极性溶剂容易溶解极性物质,非极性溶剂容易溶解非极性物质。例如,水、甲醇和乙醇彼此之间可以互溶;苯、甲苯和乙醚之间也容易互溶,但水与苯,甲醇与苯则不能自由混溶。而且在水或甲醇中易溶的物质难溶于苯或乙醚;反之在苯或乙醚中易溶的却难溶于水或甲醇。这些现象可以用分子的极性或者分子缔合程度大小进行判断。纤维素衍生物易溶于酮、有机酸、酯、醚类等溶剂,这是由于分子中的活性基团与这类溶剂中氧原子相互作用的结果。有的纤维素衍生物在纯溶剂中不溶,但可溶于混合溶剂。例如硝化纤维素能溶于醇、醚混合溶剂;三乙酸纤维素溶于二氯乙烷、甲醇混合溶剂。这可能是由于在溶剂之间,溶质与溶剂之间生成分子复合物,或者发生溶剂化作用的结果。总之,溶解过程能够发生,其物质分子间的内聚力应低于物质分子与溶剂分子之间的吸引力才有可能实现。 溶液浓度的表示方法 溶质在溶剂中溶解的多少,彼此间存在着相对量的关系,通常用以下几种方法表示:⑴质量分数 即混合物中某一物质的质量与混合物的质量之比,符号为ω。 物质B的质量分数(ωB)=物质B的质量(mB)/溶液的质量(m) 例如:氯化钠的质量分数ω(NaCl)=15%,即表示100g该溶液中含有NaCl 15g。 ⑵体积分数 通常用于表示溶质为液体的溶液浓度(略) ⑶物质的量的浓度
常用溶剂的沸点、溶解性和毒性 溶剂名称沸点(101.3kPa)溶解性毒性猋??瓌 液氨-33.35℃特殊溶解性:能溶解碱金属和碱土金属剧毒性、腐蚀性?!- 2埬q 液态二氧化硫-10.08 溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒4Z扖趹敍蠁 甲胺-6.3 是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃?|€gi懩 二甲胺7.4 是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性?_錣毬悭 石油醚不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似腦吨 乙醚34.6 微溶于水,易溶与盐酸.与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶麻醉性聮鬿杰廸竐 戊烷36.1 与乙醇、乙醚等多数有机溶剂混溶低毒性员婷疋 二氯甲烷39.75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,麻醉性强抒潣鞦 ? 二硫化碳46.23 微溶与水,与多种有机溶剂混溶麻醉性,强刺激性乽O 琳盬L 溶剂石油脑与乙醇、丙酮、戊醇混溶较其他石油系溶剂大採 7麓 丙酮56.12 与水、醇、醚、烃混溶低毒,类乙醇,但较大@?& 適赽K 1,1-二氯乙烷57.28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性e?糕€69C' 氯仿61.15 与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强麻醉性uo蓞乑棒 甲醇64.5 与水、乙醚、醇、酯、卤代烃、苯、酮混溶中等毒性,麻醉性,笒彠M 若烊 四氢呋喃66 优良溶剂,与水混溶,很好的溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒-? `q=8v 己烷68.7 甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。麻醉性,刺激性狸僪 J> 三氟代乙酸71.78 与水,乙醇,乙醚,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物鎓橌 蠿滗 1,1,1-三氯乙烷74.0 与丙酮、、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶低毒类溶剂淥曌瀕檙 四氯化碳76.75 与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强圤覇?_H 乙酸乙酯77.112 与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,麻醉性陻t 5W= 乙醇78.3 与水、乙醚、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,麻醉性 崌鶫駱 皜 丁酮79.64 与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮刣 苯80.10 难溶于水,与甘油、乙二醇、乙醇、氯仿、乙醚、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性 眈踂鼀 环己烷80.72 与乙醇、高级醇、醚、丙酮、烃、氯代烃、高级脂肪酸、胺类混溶低毒,中枢抑制作用秿?-+訑
科学探究熔点与沸点导 学案教案 集团标准化工作小组 [Q8QX9QT-X8QQB8Q8-NQ8QJ8-M8QMN]
第十一章第一节《熔点与沸点》导学案(2)第2课时 请你探究: 做一做:冰的熔化和水的沸腾实验 1.右图是冰的熔化实验装置图和冰熔化过 程的坐标图,从图中我么可以看出,冰是从 ___℃ 开始熔化的,熔化过程持续了_____min,冰在 熔化 过程中温度保持℃不变,这便是晶体 的与 非晶体的区别,即晶体在熔化过程中温度, 而非晶体在熔化过程中温度。 2.右图是水沸腾实验的装置图和水沸 腾时的 坐标图,从图中我们可以看出:水在沸腾 时温度保持,这个温度叫做它 的,但图中水沸腾时没有达到 100℃,原因可能是与 有关。 小组交流: 1.为什么不用酒精灯直接给盛有冰的试管加热,而要通过烧杯中的水间接试管加热 2.为使烧杯中的水尽快沸腾,有哪些好的方法 小组展示: (向全班汇报小组共同的见解,提出小组的疑问,由其他同学解答或教师点拨)
请你阅读: 阅读课本P6一7. 1.说出日常生活中,哪些固体是晶体,哪些是非晶体 2.通过查阅一些晶体的熔点表可以知道,铝的熔点是660℃,能不能用铝壶在1000℃的火炉上烧水 拓展提升: 小明和小红都想帮妈妈煮粥。小明认为粥锅里的水烧开后,可继续火烧得很旺,煮得満锅沸腾,这样会很快将粥煮好;小红则认为,沸腾后应改用小火,盖上锅盖,让锅内微微沸腾,将粥煮好。你认为谁的想法更合理,请说出理由。 巩固提高: 1.在松香、铜块、玻璃、白糖、食盐、海波中,属于晶体的是 它们的共同特征是有一定的。 2.铅的熔点是328℃,那么温度为328℃的铅( ) A.一定是固态B.一定是液态 C.一定是固态和液态共存D.可能是固态和液态共存 3.如图所示,烧瓶中的水停止沸腾后,若从烧瓶中往 外抽气,会看到水又沸腾起来,这是由于 () A.气压升高,水温升高 B.气压降低,水温升高 C.气压降低,水的沸点降低 D.气压升高,水的沸点降低 4.甲、乙两个烧杯里都有冰水混合物,甲杯里的冰少一些, 乙杯里的冰多一些,甲杯放在阳光下,乙杯放在背阴处在两杯里的冰都还未完全熔化时,比较它们的温度,则下列说法中正确是( ) A.甲杯水的温度高 B.乙杯水的温度高 C.两杯水的温度相同 D.无法比较温度的高低
个人收集整理-ZQ 首先,判断元素单质地熔沸点要先判断其单质地晶体类型,晶体类型不同,决定其熔沸点地作用也不同.金属地熔沸点由金属键键能大小决定;分子晶体由分子间作用力地大小决定;离子晶体由离子键键能地大小决定;原子晶体由共价键键能地大小决定.所以第一主族地碱金属熔沸点是由金属键键能决定,在所带电荷相同地情况下,原子半径越小,金属键键能越大,所以碱金属地熔沸点递变规律是:从上到下熔沸点依次降低.第七主族地卤素,其单质是分子晶体,故熔沸点由分子间作用力决定,在分子构成相似地情况下,相对分子质量越大,分子间作用力也越大,所以卤素地熔沸点递变规律是:从上到下熔沸点依次升高.用这样地方法去判断同主族元素地熔沸点递变规律就行了,因为理解才是最重要地.同周期地话,不太好说了.通常会比较同一类型地元素单质熔沸点,比如说比较、、地熔沸点,则由金属键键能决定,所带电荷最多,原子半径最小,所以金属键最强,故熔沸点是:<<.非金属元素一般不会比较它们单质之间地熔沸点,一般比较他们地氢化物地熔沸点.比较时要注意、、、他们地分子间除分子间作用力外,还有氢键,所以同主族氢化物熔沸点他们是最高地,其余地按分子间作用力大小排列.如氧族元素氢化物地熔沸点是:>>>;卤素:>>>.同周期比较地话,是从左至右熔沸点依次升高,因为气态氢化物地热稳定性是这样递变地.另外有时还要注意物质地类型,比如让你比较金刚石、钙、氯化氢地熔沸点,只要知道金刚石是原子晶体,熔沸点最高,其次是金属钙,最后是分子晶体氯化氢.还有原子晶体地:比较金刚石、晶体硅、碳化硅地熔沸点,那就要看共价键了,原子半径越小,共价键键能越大,故熔沸点:金刚石>碳化硅>晶体硅. 1 / 1
物质熔沸点高低的比较方法 陕西吴亚南主编 物质熔沸点的大小比较通常出现在高考试题中,而关于物质熔沸点的大小比较方法介绍的却又较少,且不集中。现将有关规律一并总结如下。 一、先将物质分类:从物质的晶体类型上一般分为分子晶 体,离子晶体,原子晶体和金属晶体。不同物质类别熔沸点的比较方法不同。一般情况下:原子晶体﹥离子晶体﹥分子晶体 1、对于分子晶体: a、结构相似时,相对分子质量越大分子间作用力越强 其熔沸点越高。如:CH4﹤SiH4﹤GeH4;CH4﹤C2H6﹤C3H8﹤C4H10 b、能形成分子间氢键时熔沸点陡然增高。如:H2O﹥ H2Te﹥H2Se﹥H2S(能形成氢键的元素有N,O,F) c、当形成分子内氢键时熔沸点降低。如:邻羟基甲苯 的熔沸点低于对羟基甲苯 d、对于烃类物质碳原子数相同时支链越多熔沸点越 低。 e、都能形成氢键时要比氢键的数目和强弱。如:H2O ﹥NH3﹥HF
f、组成和结构不相同但相对分子质量相同或相近时极 性越大熔沸点越高。如:CO﹥N2;CH3OH﹥C2H6 g、芳香烃中临﹥间﹥对 2、对于离子晶体:a、要看离子半径的大小和离子所带电 荷的多少,离子半径越小,离子所带电荷越多则离子键越强晶格能越大熔沸点越高。如:NaCl﹤MgCl2<MgO 3、原子晶体:要看原子半径的大小,原子半径越小作用力 越大,熔沸点越高。如:金刚石﹥二氧化硅﹥碳化硅﹥单晶硅 4、金属晶体:比金属离子的半径和离子所带电荷的多少。 如Na﹤Mg﹤Al 二、也可从物质在常温常压下的状态去分析。 常温常压下固体﹥液体﹥气体(熔沸点)如:碘单质﹥水﹥硫化氢 三、易液化的气体沸点较高。 四、注意: 1、熔点高不一定沸点也高。如I2和Hg 2、MgO和Al2O3由于晶格类型不同,氧化镁的熔沸点 高于氧化铝。 3、同主族元素形成的单质熔沸点的变化不能一言概 论。(一般是金属部分从上至下熔沸点降低,非金属 部分从上至下升高,但都有特例)。
常见的共沸混合物的组成及共沸点 共沸物,又称恒沸物,是指两组分或多组分的液体混合物,在恒定压力下沸腾时,其组分与沸点均保持不变。这实际是表明,此时沸腾产生的蒸汽与液体本身有着完全相同的组成。共沸物是不可能通过常规的蒸馏或分馏手段加以分离的。并非所有的二元液体混合物都可形成共沸物,科学堂在下列表格列出了一些常用的共沸物组成及其共沸点。这类混合物的温度-组分相图有着显著的特征,即,其气相线(气液混合物和气态的交界)与液相线(液态和气液混合物的交界)有着 共同的最高点或最低点。如此点为最高点,则称为正共沸物;如此点为最低点,则称为负共沸物。大多数共沸物都是负共沸物,即有最低沸点。值得注意的是:任一共沸物都是针对某一特定外压而言。对于不同压力,其共沸组分和沸点都将有所不同;实践证明,沸点相差大于30K的两个组分很难形成共(恒)沸物(如水与丙酮就不会形成共沸物)。 (a)与水形成的二元共沸物(水沸点100℃) 溶剂沸点/℃共沸点/℃含水量/% 溶剂沸点/℃共沸点/℃含水量/% 氯仿61.2 56.1 2.5 甲苯110.5 85.0 20 四氯化碳77.0 66.0 4.0 正丙醇97.2 87.7 28.8 苯80.4 69.2 8.8 异丁醇108.4 89.9 88.2 丙稀腈78.0 70.0 13.0 二甲苯137-40.5 92.0 37.5 二氯乙烷83.7 72.0 19.5 正丁醇117.7 92.2 37.5 乙睛82.0 76.0 16.0 吡啶115.5 94.0 42 乙醇78.3 78.1 4.4 异戊醇131.0 95.1 49.6 乙酸乙酯77.1 70.4 8.0 正戊醇138.3 95.4 44.7 异丙醇82.4 80.4 12.1 氯乙醇129.0 97.8 59.0 乙醚35 34 1.0 二硫化碳46 44 2.0 甲酸101 107 26 (b)常见有机溶剂间的共沸混合物 共沸混合物组分的沸点/℃共沸物的组成(质量)/% 共沸物的沸点/℃ 乙醇-乙酸乙酯78.3,78.0 30:70 72.0 乙醇-苯78.3,80.6 32:68 68.2 乙醇-氯仿78.3,61.2 7:93 59.4 乙醇-四氯化碳78.3,77.0 16:84 64.9 乙酸乙酯-四氯化碳78.0,77.0 43:57 75.0 甲醇-四氯化碳64.7,77.0 21:79 55.7 甲醇-苯64.7,80.4 39:61 48.3 氯仿-丙酮61.2,56.4 80:20 64.7 甲苯-乙酸101.5,118.5 72:28 105.4 乙醇-苯-水78.3,80.6,100 19:74:7 64.9
实验一有机化合物熔点和沸点的测定 一、有机化合物熔点的测定: (一)实验目的 1.了解有机化合物熔点、沸点的概念、测定的原理及意义。 2.掌握微量法测定熔点、沸点的操作技术。 物质熔点的测定是有机化学工作者经常用的一种技术,所得的数据可用来鉴定晶状的有机化合物,并作为该化合物纯度的一种指标。 测定的意义:可以鉴别未知的固态化合物和判断化合物的纯度。 (二)熔点测定原理 什么叫熔点——用物质的蒸气压与温度的关系理解。熔点的定义:固、液两态在标准大气压下达到平衡状态,即固相蒸气压与液相蒸气压相等时的温度。固态物质受热后,从开始熔化(初熔)至完全熔化(全熔)的温度范围就是该化合物的熔点(实际上是熔点范围。称为熔程或熔距。) 测熔点时几个概念:始熔(初熔)、全熔、熔点距、物质纯度与熔点距关系。 始熔(初熔)——密切注意熔点管中样品变化情况。当样品开始塌落,并有液相产生时(部分透明),表示开始熔化(初熔),即记录为初溶温度t1。 全熔——当固体刚好完全消失时(全部透明),则表示完全熔化(全熔)。记录温度t2 。 熔距或熔程——从初熔到全熔的温度范围。t1~t2为熔程。纯净物一般不超过0.5~10C 化合物的熔点是指在常压下该物质的固—液两相达到平衡时的温度。但通常把晶体物质受热后由固态转化为液态时的温度作为该化合物的熔点。纯净的固体有机化合物一般都有固定的熔点。在一定的外压下,固液两态之间的变化是非常敏锐的,自初熔至全熔(称为熔程) 纯净的固体有机化合物转化为液态时的温度不超过0.5-1℃。若混有杂质则熔点有明确变化,不但熔点距扩大,而且熔点也往往下降。
因此,熔点是晶体化合物纯度的重要标志。有机化合物熔点一般不超过350℃,较易测定,故可借测定熔点来鉴别未知有机物和判断有机物的纯度。 (三)熔点测定方法: 1)显微熔点测定仪《实验化学》第二版书上P104 2)数字熔点测定仪《实验化学》第二版书上P105 3)双浴式熔点测定器《实验化学》第二版书上P102 4)毛细管法测熔点,用b形管测熔点装置(本实验使用)及其它测定方法。(四)实验仪器及药品 毛细管法测熔点,用b形管测熔点装置(本实验使用) (1)实验仪器:b形熔点测定管、玻璃管(30—40cm)、温度计、酒精灯、表 面皿、毛细熔点管、指形管(沸点管) (2)药品:苯甲酸、尿素、苯甲酸加尿素混合物、酒精、 测定物导热液为甘油——测定完毕需回收,请倒回原瓶中 测定熔点装置图: (五)实验步骤及实验关键 1.样品填装——将0.1~0.2克待测样品粉末(干燥、研碎迅速)放在干净的 表面皿上聚成小堆,将毛细管开口垂直插入此小堆内将样品 挤入毛细管中,在桌面上踮几下,再在玻璃管中自由落下十 次左右,使样品填装结实、均匀、紧密,高度2~3mm为宜。 (因测定时到了初熔时样品塌落下来,如果中间有空隙,会
沸点56.2℃,折光率1.358 8,相对密度0.789 9。 普通丙酮常含有少量的水及甲醇、乙醛等还原性杂质。其纯化方法有: ⑴于250mL丙酮中加入2.5g高锰酸钾回流,若高锰酸钾紫色很快消失,再加入少量高锰酸钾继续回流,至紫色不褪为止。然后将丙酮蒸出,用无水碳酸钾或无水硫酸钙干燥,过滤后蒸馏,收集55~56.5℃的馏分。用此法纯化丙酮时,须注意丙酮中含还原性物质不能太多,否则会过多消耗高锰酸钾和丙酮,使处理时间增长。 ⑵将100mL丙酮装入分液漏斗中,先加入4mL10%硝酸银溶液,再加入3.6mL1mol/L氢氧化钠溶液,振摇10min,分出丙酮层,再加入无水硫酸钾或无水硫酸钙进行干燥。最后蒸馏收集55~56.5℃馏分。此法比方法⑴要快,但硝酸银较贵,只宜做小量纯化用。 二氧六环 沸点101.5℃,熔点12℃,折光率1.442 4,相对密度1.033 6。 二氧六环能与水任意混合,常含有少量二乙醇缩醛与水,久贮的二氧六环可能含有过氧化物(鉴定和除去参阅乙醚)。二氧六环的纯化方法,在500mL二氧六环中加入8mL浓盐酸和50mL水的溶液,回流6~10h,在回流过程中,慢慢通入氮气以除去生成的乙醛。冷却后,加入固体氢氧化钾,直到不能再溶解为止,分去水层,再用固体氢氧化钾干燥24h。然后过滤,在金属钠存在下加热回流8~12h,最后在金属钠存在下蒸馏,压入饥丝密封保存。精制过的1,4-二氧环己烷应当避免与空气接触。 吡啶 沸点115.5℃,折光率1.509 5,相对密度0.981 9。 分析纯的吡啶含有少量水分,供一般实验用。如要制得无水吡啶,可将吡啶与粒氢氧化钾(钠)一同回流,然后隔绝潮气蒸出备用。干燥的吡啶吸水性很强,保存时应将容器口用石蜡封好。 石油醚 石油醚为轻质石油产品,是低相对分子质量烷烃类的混合物。其沸程为30~150℃,收集的温度区间一般为30℃左右。有30~60℃,60~90℃,90~120℃等沸程规格的石油醚。其中含有少量不饱和烃,沸点与烷烃相近,用蒸馏法无法分离。 石油醚的精制通常将石油醚用其体积的浓硫酸洗涤2~3次,再用10%硫酸加入高锰酸钾配成的饱和溶液洗涤,直至水层中的紫色不再消失为止。然后再用水洗,经无水氯化钙干燥后蒸馏。若需绝对干燥的石油醚,可加入钠丝(与纯化无水乙醚相同)。 甲醇 沸点64.96℃,折光率1.328 8,相对密度0.791 4。 普通未精制的甲醇含有0.02%丙酮和0.1%水。而工业甲醇中这些杂质的含量达0.5%~1%。为了制得纯度达99.9%以上的甲醇,可将甲醇用分馏柱分馏。收集64℃的馏分,再用镁去水(与制备无水乙醇相同)。甲醇有毒,处理时应防止吸入其蒸气。 乙酸乙酯 沸点77.06℃,折光率1.372 3,相对密度0.900 3。 乙酸乙酯一般含量为95%~98%, 含有少量水、乙醇和乙酸。可用下法纯化:于1000mL乙酸乙酯中加入100mL乙酸酐,10滴浓硫酸,加热回流4h,除去乙醇和水等杂质,然后进行蒸馏。馏液用20~30g无水碳酸钾振荡,再蒸馏。产物沸点为77℃,纯度可达以上99%。
实验项目名称:微量法熔沸点测定 一、实验目的: 1. 了解熔点和沸点的测定意义 2. 掌握毛细观测熔沸点的方法 二、实验原理 纯物质有固定的熔沸点,而有固定的熔沸点的不一定是纯物质。通过混合法测定熔沸点可以验证物质的纯度。 熔点:在大气压下,固体化合物加热到由固态转变为液体,并且固、液两相处于平衡时的温度就是该化合物的熔点。溶距:被加热的纯固体化合物从始终至全溶的温度变化范围为溶距(熔点范围或溶程)纯固体化合物溶距不超过0.5~1℃,若含有杂质时,则其熔点比纯固体化合物的熔点低,且溶距变宽。 沸点:一个化合物的沸点,就是当它受热时其蒸汽压升高,当达到与外界大气压相等时,它开始沸腾,这是的液体温度及该液体的沸点 三、主要试剂及主、副产物的物理常数 酒精灯、b形管、石蜡油、温度计、橡胶圈、熔点管(由毛细管制备)、沸点管、待测样品。
待测粉末占熔点管3毫米左右,待测液占沸点管1厘米左右,石蜡液液面达b型管上支管面。 五、实验简单操作步骤 1、温度计的校正 用冰/水,沸水校正温度计。 2、熔点的测定 (1)样品装入 将熔点管开口端插入待测样品粉末中,然后倒置,使粉末进入熔点管闭口端。将熔点管放在空气冷凝管上口,自由落下,反复多次,使样品填实。 (2)熔点测定 将b形管垂直夹于铁架上,以石蜡油作浴液,石蜡油液面高度在叉管口处。用橡胶圈将熔点管捆绑于温度计上,使样品的部分置于水银球侧面中部,将此温度计装入开口橡皮塞中,刻度向外插入b形管中,用外焰进行加热。粗测样品的熔点。然后用第二支熔点管进行精测。在接近熔点15摄氏度时减慢加热速度为每分钟上升一摄氏度。记录初熔温度和全熔温度。平行精测一次。 3、沸点测定 (1)样品装入 用滴管吸取待测样品于沸点外管中,将干净的熔点管倒插入沸点
常见有机溶剂的性质 一、溶剂的定义 溶剂(solvent)这个词广义指在均匀的混合物中含有的一种过量存在的组分。狭义地说,在化学组成上不发生任何变化并能溶解其他物质(一般指固体)的液体,或者与固体发生化学反应并将固体溶解的液体。溶解生成的均匀混合物体系称为溶液。在溶液中过量的成分叫溶剂;量少的成分叫溶质。 溶剂也称为溶媒,即含有溶解溶质的媒质之意。但是在工业上所说的溶剂一般是指能够溶解油脂、蜡、树脂(这一类物质多数在水中不溶解)而形成均匀溶液的单一化合物或者两种以上组成的混合物。这类除水之外的溶剂称为非水溶剂或有机溶剂,水、液氨、液态金属、无机气体等则称为无机溶剂。 二、溶解现象 溶解本来表示固体或气体物质与液体物质相混合,同时以分子状态均匀分散的一种过程。事实上在多数情况下是描述液体状态的。一些物质之间的混合,金与铜、铜与镍等许多金属以原子状态相混合的所谓合金也应看成是一种溶解现象。所以严格地说,只要是两种以上的物质相混合组成一个相的过程就可以称为溶解,生成的相称为溶液。一般在一个相中应呈均匀状态,其构成成分的物质可以以分子状态或原子状态相互混合。 溶解过程比较复杂,有的物质在溶剂中可以以任何比例进行溶解,有的部分溶解,有的则不溶。这些现象是怎样发生的,其影响的因素很多,一般认为与溶解过程有关的因素大致有以下几个方面: ⑴相同分子或原子间的引力与不同分子或原子间的引力的相互关系(主要是范德华引力); ⑵分子的极性引起的分子缔合程度; ⑶分子复合物的生成; ⑷溶剂化作用; ⑸溶剂、溶质的相对分子质量; ⑹溶解活性基团的种类和数目。 化学组成类似的物质相互容易溶解,极性溶剂容易溶解极性物质,非极性溶剂容易溶解非极性物质。例如,水、甲醇和乙醇彼此之间可以互溶;苯、甲苯和乙醚之间也容易互溶,但水与苯,甲醇与苯则不能自由混溶。而且在水或甲醇中易溶的物质难溶于苯或乙醚;反之在苯或乙醚中易溶的却难溶于水或甲醇。这些现象可以用分子的极性或者分子缔合程度大小进行判断。纤维素衍生物易溶于酮、有机酸、酯、醚类等溶剂,这是由于分子中的活性基团与这类溶剂中氧原子相互作用的结果。有的纤维素衍生物在纯溶剂中不溶,但可溶于混合溶剂。例如硝化纤维素能溶于醇、醚混合溶剂;三乙酸纤维素溶于二氯乙烷、甲醇混合溶剂。这可能是由于在溶剂之间,溶质与溶剂之间生成分子复合物,或者发生溶剂化作用的结果。总之,溶解过程的发生,其物质分子间的内聚力应低于物质分子与溶剂分子之间的吸引力才有可能实现。 三、溶液浓度的表示方法 溶质在溶剂中溶解的多少,彼此间存在着相对量的关系,通常用以下几种方法表示: