浮游生物采样
- 格式:doc
- 大小:105.50 KB
- 文档页数:3


浮游动植物采样方法
一、浮游植物定量
用1L的塑料瓶,直接在采样点装满水,加10-15ml的鲁哥试剂,摇匀。
鲁哥试剂即将6g碘化钾溶于20ml水中,待其完全溶解后,将4g碘充分摇动,待其完全溶解后,定容至100ml,即配成鲁哥氏液。
二、浮游植物定性
定性样品用孔径约0.064 mm的25号浮游生物网在水面下约0.5 m处以适当的速度作“∞”字形来回拖动1~3 min,获得的浓缩样,放入50ml的白色方瓶中,添加适量的鲁哥氏液固定。
三、浮游动物定量
表层取水样10L(中层和底层取20L水样)过25号浮游生物网,获得的浓缩样,放入50ml的白色方瓶中,4%添加的福尔马林溶液。
福尔马林溶液即40%的甲醛与蒸馏水按照1:9的比例混合配制而成。
四、浮游动物定性
定性样品用孔径约0.064 mm的25号浮游生物网在水面下约0.5 m处以适当的速度作“∞”字形来回拖动1~3 min,获得的浓缩样,放入50ml的白色方瓶中,添加适量的鲁哥氏液固定。

浮游生物分层采样网安全操作及保养规程一、概述浮游生物分层采样网是海洋调查中常用的一种生物采样工具,它能够实现对水体中浮游生物的垂直分层采样。
在实际操作中,应严格遵守安全操作规程,做好设备保养和维护工作。
二、基本构造和工作原理浮游生物分层采样网主要由采样器、导向框、密封环、采样瓶等组成。
采样时,导向框带动采样瓶向下下沉,直至采到目标深度的水样。
采样完成后,采样器和密封环可将采集的样品封闭保存。
三、安全操作规程1. 准备工作a.工作前检查设备是否正常,如发现问题及时修复或更换;b.熟悉采样网的各部分结构,了解操作方法和注意事项;c.确认采样地点和波浪情况,根据海况选择合适的采样器和采样深度。
2. 采样过程a.确认采样位置和采样深度,调整导向框和采样器位置;b.从船上缓慢放下采样网,避免突然下沉或摇晃;c.当采样器到达目标采样深度时,拉动导向框并轻轻晃动采样器,使其封闭采样瓶;d.采样完成后,缓慢提升采样网,注意不要急拉采样网,避免采样瓶破裂。
3. 采样结束a.将采样瓶标记好,记录采样时间、深度、地点等信息,并进行初步处理;b.将采样器和采样瓶进行清洗和消毒,存放在合适的地方,准备维护保养。
四、保养规程1. 清洗消毒a.将采样器拆解,用淡盐酸或乙醛等消毒剂清洗并消毒采样瓶;b.在清洗过程中避免重物碰撞,可用棉被或泡沫等材料进行保护;c.清洗时,使用软毛刷或者纤维棒清理采集器的细小孔洞。
2. 保养维修a.采样器及密封环应该保持干燥,并且要检查是否有发霉、生锈现象,如有请及时更换或清理;b.采集器部分的管道连接处及零部件经常需要更换,必须向延保单位购买原装配件。
五、总结浮游生物分层采样网在海洋调查中起着重要的作用,但操作不当会对人员和设备造成危险,因此必须要制定科学规范操作流程,并根据不同场合进行调整。
合理的维护和保养工作不仅可以延长使用寿命,而且能够减少事故发生,确保性能稳定可靠。
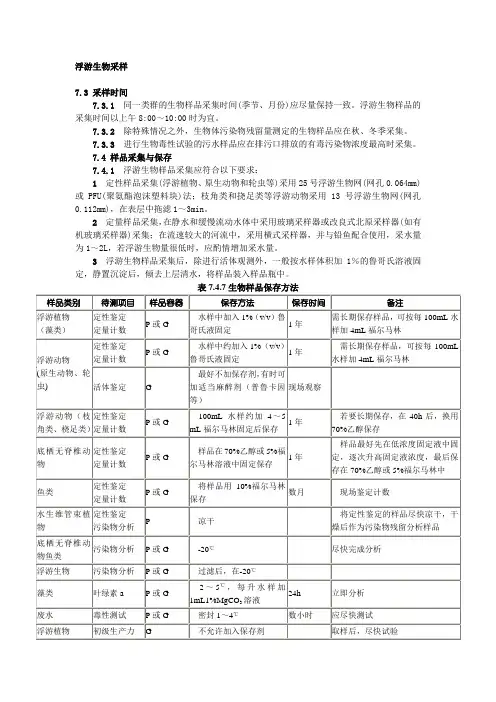
浮游生物采样7.3 采样时间7.3.1同一类群的生物样品采集时间(季节、月份)应尽量保持一致。
浮游生物样品的采集时间以上午8:00~10:00时为宜。
7.3.2除特殊情况之外,生物体污染物残留量测定的生物样品应在秋、冬季采集。
7.3.3进行生物毒性试验的污水样品应在排污口排放的有毒污染物浓度最高时采集。
7.4 样品采集与保存7.4.1浮游生物样品采集应符合以下要求:1定性样品采集(浮游植物、原生动物和轮虫等)采用25号浮游生物网(网孔0.064mm)或PFU(聚氨酯泡沫塑料块)法;枝角类和挠足类等浮游动物采用13号浮游生物网(网孔0.112mm),在表层中拖滤1~3min。
2定量样品采集,在静水和缓慢流动水体中采用玻璃采样器或改良式北原采样器(如有机玻璃采样器)采集;在流速较大的河流中,采用横式采样器,并与铅鱼配合使用,采水量为1~2L,若浮游生物量很低时,应酌情增加采水量。
3浮游生物样品采集后,除进行活体观测外,一般按水样体积加1%的鲁哥氏溶液固定,静置沉淀后,倾去上层清水,将样品装入样品瓶中。
表7.4.7生物样品保存方法微生物细菌总数总大肠菌群数粪性大肠菌数粪链球菌数灭菌玻璃瓶1~4℃<6h最好在采样后2h内完成接种,并进行培养。
如水样含有余氯或重金属含量高,可按500mL样品瓶分别加入0.3 mL10%硫代硫酸钠溶液或1mL15%EDTA溶液表B.16浮游生物分析记录表样品来源样品类型共页第页分析项目采样地点采样日期月日属名数量(个)指示意义优势种名绝对优势种生物密度(个/L)结果分析备注分析人员:年月日校核:年月日审核:年月日表B.17生物种类统计记录表样品来源样品类型共页第页12345分析人员:年月日校核:年月日审核:年月日。

水体浮游植物分析规范参考淡水生物资源调查技术规范DB43/T 432-2009➢水层设置水深小于3m时,只在中层采样,混合均匀水体,可以只采表层(0.5m)水样;水深3m~6m时,在表层、底层采样,其中表层水在离水面0.5m处,底层水在离泥面0.5m处;水深6m~10m时,在表层、中层、底层采样;水深大于10m时,在表层、5m、10m水深层采样,10m以下除特殊需要外一般不采样,对于深水湖泊,取样的水层可以将取样间隔加大,如0m,10m,20m,50m, 100m。
➢采样定量样品在定性采样之前用采水器采集,每个采样点取水样1L,贫营养型水体应酌情增加采水量。
泥沙多时需先在容器内沉淀后再取样。
分层采样时,取各层水样等量混匀后取水样1L。
大型浮游植物定性样品用25号浮游生物网在表层缓慢拖曳采集,注意网口与水面垂直,网口上端不要露出水面。
➢固定浮游植物样品立即用鲁哥氏液固定,用量为水样体积的1%~1.5%。
如样品需较长时间保存,则需加入37%~40%甲醛溶液,用量为水样体积的4%。
现行的一些规律性的方法为:取水样,500ml,加入5ml鲁格,虹吸到30-50ml,加入1ml甲醛。
➢水样的沉淀和浓缩固定后的浮游植物水样摇匀倒入固定在架子上的1L沉淀器中,2h后将沉淀器轻轻旋转,使沉淀器壁上尽量少附着浮游植物,再静置24h。
充分沉淀后,用虹吸管慢慢吸去上清液。
虹吸时管口要始终低于水面,流速、流量不能太大,沉淀和虹吸过程不可摇动,如搅动了底部应重新沉淀。
吸至澄清液的1/3时,应逐渐减缓流速,至留下含沉淀物的水样20mL~25(或30~40)mL,放入30(或50)mL的定量样品瓶中。
用吸出的少量上清液冲洗沉淀器2次~3次,一并放入样品瓶中,定容到30(或50)mL。
如样品的水量超过30(或50)mL,可静置24 h后,或到计数前再吸去超过定容刻度的余水量。
浓缩后的水量多少要视浮游植物浓度大小而定,正常情况下可用透明度作参考,依透明度确定水样浓缩体积见表3,浓缩标准以每个视野里有十几个藻类为宜。

浮游生物的测定实验报告一、采样(一)采样工具1.浮游生物网浮游生物网有两种类型,即定性网和定量网。
2、采水器(1)瓶式采水器(2)水生81型有机玻璃采水器:3、透明度盘(二)采样层次(深度)1、一般常规生物监测,在江河中,由于水不断流动,上下层混合较快,可不分层采样,在水面下0。
5m左右采样即可;2、在湖泊、水库中,若水深不超过2m,一般可仅在表层(0。
5m深处)取样,如果透明度很小,可在下层加取一样,并与表层样混合制成混合样;3、水深5m以内的可在水面下0。
5m,1m,2m,3m,4m处采样,混合均匀,从中取定量水样。
(三)采样方法及采样量1、定性样的采集用浮游生物定性网在选定的采样点于水面和0。
5m深处以每秒20,30cm的速度作“oo”形循回缓慢拖动,时间为5,10分钟(视生物多寡而定)。
2.定量样的采集采集定量样可用采水器和定量网,常用的是采水器。
采水器,一般来说,浮游生物密度低采水量就要多。
对于藻类,一般采水1,2升;对原生动物、轮虫及未成熟的微小甲壳动物,采水1,5升;成熟的甲壳动物则要10,50升。
定量网,可选择适当型号的网,放入距水底0。
5米处,然后垂直上拖,以0。
5米、秒的均匀速度拖取,所采水样的体积可按下列公式推算出来。
水样体积=πr2H,式中r为网口半径,H为拖取的深度。
(四)采样频率一般常规生物监测,每年采样应不少于两次,一般在春秋两季进行,若要了解浮游生物周年的变化,则一年四季都要采样,特殊需要,则根据具体情况增加采样次数。
采样要尽量在晴朗无风的天气进行。
二、样品的固定、浓缩和保存三、浮游生物的测定(一)定性测定(二)定量测定定量测定主要是计数所采集的定量样品中浮游生物的数量,也可进行容量(体积)或重量的测定,这里只介绍计数方法。
1、计数框及其使用计数框的容量有0。
1mL、1mL、5mL和8mL四种。
常用的计数框有两种:(1)塞奇威克一拉夫脱计数框(简称S-R计数框):该计数框长50mm,宽20mm,深lmm,总面积为1000mm2,总体积为lmL。

微生物浮游菌采样器的用途、使用细节1. 背景介绍随着海洋污染问题的日益严重,对微生物和浮游生物的监测需求越来越迫切。
微生物浮游菌采样器是浮游生物学中的一种采样工具,用于捕捉海洋中的浮游生物,采集样品并进行分析。
本文将介绍微生物浮游菌采样器的用途和使用细节。
2. 微生物浮游菌采样器的用途微生物浮游菌采样器主要用于海洋生物学、水文学、环境监测等领域。
在海洋环境中,浮游生物群落的类型和数量很大程度上反映了海洋生态系统的状态,包括生产力、营养盐循环等,因此浮游生物的采集对于评估海洋生态系统的状态非常重要。
微生物浮游菌采样器通常使用于不同水深下,从表层至底层采集水样,在采样过程中,它能同步记录水体的温度、溶解氧、盐度等水文物理学参数和浮游生物的相关题量,如五类胡索动物、水母、蓝藻等,还可对细菌、浮游生物、微型浮游生物等进行综合记录和分析。
通过这些浮游生物的样本,科学家能够研究海洋生物群落的数量和类型,在复杂的海洋环境中追踪微生物生态变化,评估海洋污染的影响,不仅可以用用在海洋科学领域,还可以在食品生产、生化调查、药物发现等领域广泛应用。
3. 微生物浮游菌采样器使用细节微生物浮游菌采样器的使用需要经过一定的操作步骤,包括:准备样品、安装采样器、进行采样、拆卸采样器和样品处理。
具体如下:3.1 准备样品在进行采样之前,首先需要准备好采样器和样品。
样品通常是指采样点的水体,而微生物浮游菌采样器则是采集采样样品的工具。
3.2 安装采样器安装好采样器后,需要选择合适的采样深度,防止取到水体的表面层会影响采集效果,通常建议在水深超过10米的深度范围外进行。
然后,将采样器放入水中,直至达到要求的深度,并按照说明书进行操作。
3.3 进行采样在采样过程中,需要进行一定的时间间隔和深度设定,以确保获取到准确的样品。
和采样深度一样,采样时间也需要进行适当的调整。
根据实际情况调整采样时间和深度,如果实验室要求采样时间和深度一致,则可以采用网格滤器,来控制在固定的时间和深度范围内进行采样。

浮游动植物采样方法
一、浮游植物定量
用1L的塑料瓶,直接在采样点装满水,加10-15ml的鲁哥试剂,摇匀。
鲁哥试剂即将6g碘化钾溶于20ml水中,待其完全溶解后,将4g碘充分摇动,待其完全溶解后,定容至100ml,即配成鲁哥氏液。
二、浮游植物定性
定性样品用孔径约0.064 mm的25号浮游生物网在水面下约0.5 m处以适当的速度作“∞”字形来回拖动1~3 min,获得的浓缩样,放入50ml的白色方瓶中,添加适量的鲁哥氏液固定。
三、浮游动物定量
表层取水样10L(中层和底层取20L水样)过25号浮游生物网,获得的浓缩样,放入50ml的白色方瓶中,4%添加的福尔马林溶液。
福尔马林溶液即40%的甲醛与蒸馏水按照1:9的比例混合配制而成。
四、浮游动物定性
定性样品用孔径约0.064 mm的25号浮游生物网在水面下约0.5 m处以适当的速度作“∞”字形来回拖动1~3 min,获得的浓缩样,放入50ml的白色方瓶中,添加适量的鲁哥氏液固定。

浮游动物生物量的测量方法自赵文《水生生物学》现存量:单位面积或体积中所存在生物体的数量或质量。
现存量若以个体数表示则可称为丰度或(数量)密度,单位为个/L。
若以质量表示则可称为生物量,单位为mg/L。
采集方法:一采水器采水后沉淀分离(适用原生动物、轮虫等小型浮游动物);二用网过滤(适用于枝角类、挠足类等甲壳动物)。
仪器:采水器,(25#)浮游生物网,显微镜,计数框(计数原生动物用0.1ml计数框,计数轮虫和甲壳动物用1ml计数框)解剖镜,毛细管,目测微尺一采集1 设站根据浮游动物的分布设站。
2 采水层次由水体的深度决定。
切不可之采一个表层或一个底层水样。
(据夏季调查,东湖B站(水深4m左右),在2m的水层区,甲壳动物的数量约占31%,而入2m一下的水层占69%左右。
同时还发现,在夏季,一般幼体喜欢在表层,成体在深层。
)分层方法:是每隔0.5m或1m,甚至2m取一个水样加以混合,然后取得一部分作为浮游动物定量之用。
许多水库或深水湖泊,水深20m以上,这种水体在夏季及冬季存在温跃层(或称变温层)。
由于在温跃层一下缺乏光照,浮游植物数量极少,依赖植物生存的浮游动物数量也相应减少。
如果从养殖角度而言,只取温水层以上的水层就足够了。
3 采水量浮游动物不但种类组成复杂,而且个体大小相差也极悬殊。
因此要根据它们在水体中的不同密度二采不同的水量。
(目前计数原生动物、轮虫的水样量以1L为宜,枝角类、桡足类则以10~50L较好。
)4 采集时间采样时间要尽量保持一致。
一般在上午8:00~10:00进行为好。
在长江中下游采集,如果采集四次,则春、夏、秋、冬各一次。
如果只采一次,则应在秋季(9、10月)进行为好。
(这是因为9~10月正是鱼类摄食旺季,为鱼类生长的最佳时期,如果此时有较高的现存量,则可认为该水体中有较大的供铒能力。
)浮游动物样品的固定,原生动物和轮虫可用碘液或福尔马林,加量同浮游植物(一般可与浮游植物合用同一样品)。


浮游动植物的采集和标本保存一、采集用具25号筛绢浮游生物网,13号筛绢浮游生物网,吸管,标本瓶(50毫升小塑料瓶、玻璃吸管和200毫升塑料广口瓶),标本夹,吸水纸,台纸,镊子,采集刀,塑料桶等,固定液:鲁哥氏液(即I一IK溶液)、福尔马林(甲醛)。
浮游生物网制作方法如下:①规格。
网口直径为20厘米,网袋长60厘米,网底应安装一个带阀门的集中杯。
网袋的质地为尼龙筛绢。
筛绢的号码及网孔大小,随采集对象的大小而定。
采集大型浮游动物时,用13号(0.112mm)筛绢,采集小型浮游藻类时,用25号(0.064mm)筛绢。
②制作方法。
取3~4毫米粗的铜丝或铅丝作一个直径20厘米的网口,用以支撑网口始终张开。
用金属或玻璃制作一个带阀门的集中杯(或购买),用来收集过滤到的浮游藻类。
在网袋的上下口处接一段白布,使筛绢不与金属直接接触,以免磨损筛绢。
网袋缝合处也应加缝2厘米长的白布条,以加固缝合处。
二、采集方法淡水生物分布很广,其中大多数生活在各种不同的水体中,此外还有些生活在潮湿的土壤表面、树皮、墙壁及石壁上,极少数种类生于长年积雪的高山上;少数种类与其它动植物共生;或寄生在别的生物体中。
因此,各种藻类在其具体的生活状态、藻体的大小、生活环境及每年的发生时期都有很大差异。
因此,采集浮游生物首先需要对以上情况有基本了解,以便确定相应的采集方法。
1.浮游藻类这些藻类个体微小,单细胞或群体,没有鞭毛,完全借水力漂浮在水中或具鞭毛在水体中仅有微弱的运动能力,采集这些藻类可视具体情况进行采集。
①在水面较大、较深的水体中,应用25号浮游生物网采集。
采集时应把网没入水面下并以大八字形(∞)来回缓缓捞取。
水色较清、藻类数量少时可多捞一会,反之可少捞一会。
最后将网垂直提出水面,打开底管阀门,把标本液注入标本瓶中。
特别应注意作好记录,编号并在标本瓶上贴好标签。
在定量采集时分别取水体上、中、下层水在水桶中混合均匀,然后取200毫升装入广口塑料瓶中。
手持式浮游菌采样器的操作方法及注意事项浮游菌采样器如何操作浮游菌采样器是一种的多孔吸入式微生物采集器。
它依据等速采样理论设计, 采样直接, 采集头口风速与干净室内风速保持基本一致,精准反映干净室内微生物的浓度。
办呢问重点介绍其操作方法及注意事项。
一、操作方法1、将采样器放置在工作台面上,用采样口直接采样。
如测量位置较高可使用采样管,把管子延长到所要采样的空间。
2、打开电源通电,依据选择的周期按设置键。
设置键可设置1~10、20、30~90分钟分18档调整,即每按1次设置键,加添10分钟。
3、将盛有培育基的培育皿置于转盘上,放上外罩,压紧压块使之外罩与底座密封。
4、调整刻度盘,旋转调整钮,使狭缝与培育基保持在2mm距离。
5、按启动键,本机待机15秒后,泵开始抽气,转盘开始360旋转,调整流量旋钮,使流量计浮子上端与50L刻度线相平。
采样完成,拧下外罩,快速把平皿上盖盖上并取出,并按上述方法放入新的平皿进行第二次采样(若使用采样管,则换上预先消毒过的第二根采样管)。
6、取出的平皿放置30~35℃培育箱培育,2天后计数。
7、使用完毕后,填写《检验仪器设备使用记录》。
二、浮游菌采样器注意事项1、本仪器不能长期接触腐蚀气体、液体。
2、采样开始,操作人员离开现场,以免人体上带的菌抽入。
3、至少每年校正仪器一次。
4、为达到检测结果,使用仪器前先预热30分钟。
5、仪器搬动时,应避开过大振动,以防内部损坏。
浮游菌采样器作为一种常用的检测仪器,它能够精准地反映出干净室内的微生物浓度,具有采样量大、性能稳定、操作简便等优点。
同时它也是一种的多孔吸入式微生物采集器,依据等速采样理论设计,采样直接, 采集头口风速与干净室内风速保持基本一致,精准反映干净室内微生物的浓度。
浮游菌采样器的长期使用显现问题是在所难免。
也并不是说厂家生产的产品质量有问题,无论什么东西使用时间长了都会有一些小毛病的,因此本身学会一些简单的浮游菌采样器维护和修理方法才是硬道理:浮游生物采样器使用中常见的故障及解决方法:1.接通电源,指示灯不亮(1)若仪器没有电压输出则检查保险ALL是否熔新;(2)若仪器有电压输出则检查指示灯是否烧坏;(3)若保险丝没有熔断则检查仪器的变压器是否由于电路局部短路而烧坏。
浮游菌采样量标准浮游菌是一类微生物,在水体中广泛存在,并对水质和生态环境具有重要影响。
为了准确评估水体中浮游菌的数量和种类,科学家们常常需要进行浮游菌的采样与检测工作。
为了确保采样的准确性和可比性,浮游菌采样量的标准是非常重要的。
1. 浮游菌样品的目的浮游菌样品的主要目的是为了研究水质、水生态环境等方面提供准确的数据和信息,以便科学家们能够更好地了解和评估水体的健康状况。
浮游菌样品可以用于浮游菌的分离培养、物种鉴定、群落结构分析等研究工作。
2. 浮游菌采样量的标准浮游菌的采样量标准通常与采样水体的体积和用途相关。
以下是一些通用的浮游菌采样量标准建议:•浮游菌培养研究:采样量应根据需要,一般建议每个采样点每次采取水样100 mL至500 mL为宜。
若需要分析浮游菌的生物量或未培养菌落形成单位(CFU/mL),则建议采样量应满足至少100~500 mL的需求。
•浮游菌群落结构研究:为了获取更全面的浮游菌群落结构信息,建议采集大体积样品,通常为每个采样点每次采取水样500 mL至1 L为宜。
这样可以提高分析的准确性,并更好地捕捉低丰度浮游菌。
•浮游菌多样性分析:为了具有较高的浮游菌多样性覆盖度,建议采集更大体积的样品,通常每个采样点每次采取水样1 L至5 L为宜。
这样可以最大限度地保留浮游菌的多样性,为后续的物种鉴定和分析提供更全面的数据支持。
需要注意的是,浮游菌采样量标准可能会因具体实验目的、水体类型和采样设备的不同而有所差异。
因此,在具体采样工作中,建议参考相关的研究文献和实验室标准进行操作。
3. 浮游菌采样技术要点除了采样量标准外,正确的浮游菌采样技术也是确保采样准确性的重要保障。
以下是一些浮游菌采样的技术要点:•采样器具的选择:应选择具有较好密封性能的采样瓶或容器,以避免样品在采样过程中的污染和损失。
•采样点的选择:应根据采样目的选择不同类型的采样点,如水库、河流、湖泊等,具体采样点的位置和深度应谨慎选择,以确保采样的代表性和准确性。
浮游菌采样的原理和方法
浮游菌采样是一种检测水体中浮游菌群落的方法。
其原理是通过在水体中采样,收集浮游菌,并进行后续的分析和鉴定。
浮游菌采样的方法有多种,常用的包括:
1. 网采法:使用特制的微孔滤膜过滤水样,将滤膜上的浮游菌收集下来。
该方法适用于水体中浮游菌数量较多的情况。
2. 垂直采样法:使用专门设计的浮游菌采样器,将采样器悬浮在水体中,并调节采样深度,使其能够从不同深度的水体中采集浮游菌。
3. 定点采样法:选取水体中特定的采样点,使用特制的浮游菌采样器将水样采集下来。
4. 浮游生物网采法:使用特制的浮游生物网,将水样潜入水中,用浮球浮在水面上,通过微调即可完成采样。
采样后,需要将采集到的浮游菌样品进行后续的分析和鉴定。
常用的分析方法包括显微镜观察、细胞计数、浮游菌种类鉴定等。
利用这些方法可以获得浮游菌在水体中的种类、数量、生态学特征等信息。
浮游植物的采集计数和定量方法浮游植物是水生态系统中重要的底层生物类群,对于水质评价、生态监测以及环境保护都具有重要的意义。
因此,准确、高效地采集、计数和定量浮游植物是水环境研究的关键步骤。
下面将介绍浮游植物的采集计数和定量方法。
一、浮游植物的采集方法:1.根据采样目的和特定环境条件选择合适的采样方法,常用的采样方法有以下几种:(1)铁丝网挡截式采样:在浮游植物出现较为集中的水域使用,将铁丝网固定在一个框架上,让水流通过铁丝网,实现浮游植物的挡截和收集。
(2)网捞式采样:适用于浮游植物密度较高的水域,用网捞将浮游植物从水中捞出。
(3)浮游植物捕集器的采集:常用的浮游植物捕集器有浮游植物网式捕集器、浮游植物漏斗捕集器、浮游植物湖泊型捕集器等。
2.采样前要选择合适的采样点,宜选择浮游植物密度较高的水域进行采样。
采样容器要先用水冲洗,尽量不带有任何异物,以避免对采样物质的污染。
3.采集浮游植物时应避免过度搅荡水体,以防浮游植物的破碎和污染。
4.采集样本时要注意保持样本的完整性,以确保后续的计数和分析的精确性。
二、浮游植物的计数方法:1.显微镜计数法:将采样的浮游植物样本放入显微镜下,通过目视计数的方式,记录不同种类的浮游植物数量。
2.染色计数法:采用一些常见的染色剂(如碘酒、卡内基氏溴酸可乐定等)将浮游植物样本染色后,在显微镜下对染色后的样本进行计数。
3.流式细胞仪计数法:利用流式细胞仪可以对样本中的细胞进行高效、自动化的计数和分析。
三、浮游植物的定量方法:1.干重法:将采集回来的样本在高温下干燥至恒定重量后,通过测量干物质的质量差值计算浮游植物的生物量。
2.叶绿素-a含量测定法:通过提取样本中的叶绿素-a,利用比色法测定其叶绿素-a的含量。
然后根据叶绿素-a的含量可以推算出浮游植物的生物量。
3.DNA分子量法:通过提取样本中的DNA,利用分子生物学技术测定其DNA的分子量。
再根据已建立的浮游植物DNA分子量和生物量的线性关系,可以推算出浮游植物的生物量。
浮游生物采样
7.3 采样时间
7.3.1同一类群的生物样品采集时间(季节、月份)应尽量保持一致。
浮游生物样品的采集时间以上午8:00~10:00时为宜。
7.3.2除特殊情况之外,生物体污染物残留量测定的生物样品应在秋、冬季采集。
7.3.3进行生物毒性试验的污水样品应在排污口排放的有毒污染物浓度最高时采集。
7.4 样品采集与保存
7.4.1浮游生物样品采集应符合以下要求:
1定性样品采集(浮游植物、原生动物和轮虫等)采用25号浮游生物网(网孔0.064mm)或PFU(聚氨酯泡沫塑料块)法;枝角类和挠足类等浮游动物采用13号浮游生物网(网孔0.112mm),在表层中拖滤1~3min。
2定量样品采集,在静水和缓慢流动水体中采用玻璃采样器或改良式北原采样器(如有机玻璃采样器)采集;在流速较大的河流中,采用横式采样器,并与铅鱼配合使用,采水量为1~2L,若浮游生物量很低时,应酌情增加采水量。
3浮游生物样品采集后,除进行活体观测外,一般按水样体积加1%的鲁哥氏溶液固定,静置沉淀后,倾去上层清水,将样品装入样品瓶中。
表7.4.7生物样品保存方法
微生物
细菌总数总大
肠菌群数粪性
大肠菌数粪链
球菌数
灭菌玻璃
瓶
1~4℃<6h
最好在采样后2h内完成接种,并进
行培养。
如水样含有余氯或重金属
含量高,可按500mL样品瓶分别加
入0.3 mL10%硫代硫酸钠溶液或
1mL15%EDTA溶液
表B.16浮游生物分析记录表
样品来源样品类型共页第页
分析项目采样地点采样日期月日
属名数量(个)指示意义
优势种名
绝对优势种
生物密度(个/L)
结果分析
备注
分析人
员:
年月日校核:年月日
审
核:
年月日
表B.17生物种类统计记录表
样品来源样品类型共页第页
12345
分析人员:年月日校核:年月日审核:年月日。