铜及其化合物性质归纳精编版
- 格式:docx
- 大小:34.75 KB
- 文档页数:4


铜的性质知识点总结
1. 物理性质
铜是一种金属元素,是周期表中的第29号元素,原子序数为29。
其原子量约为63.55。
在常温下,铜是一种固态金属,具有金属光泽,呈红色。
铜具有良好的导电性和导热性,是制造电线、电路板和散热器等电子元器件的重要材料。
2. 化学性质
铜是一种活泼的金属,在空气中会逐渐氧化形成氧化铜,并最终生成铜绿。
铜的化合价一般为+1和+2,它可以形成多种不同价态的化合物,如Cu2O和CuO等。
铜还可以形成多种配合物,它们具有丰富的颜色和化学反应活性。
3. 热性质
铜具有良好的导热性,是热传导的良好材料,因此常用于制造散热器和热交换器。
此外,铜可以在高温下与氧反应生成氧化铜,因此在高温下需避免使用铜制品。
4. 机械性质
铜是一种软金属,可以很容易地用冷或热加工方式制造成形,因此常用于制造金属制品和精密零件。
此外,铜具有高弹性,能够在一定程度上承受变形而不破裂。
5. 光电性质
铜具有较高的反射率和导电率,因此可以用来制造反射镜和电子元件。
此外,铜的表面可以很容易地氧化形成氧化铜保护膜,使其具有良好的耐蚀性。
6. 其他性质
铜是一种具有良好韧性和可塑性的金属,因此常用于制造铜制品、合金等材料。
此外,铜还具有较高的抗菌性能,可以抑制细菌的生长,因此常用于制造医疗器械和食品器具。
总之,铜是一种多功能的金属,具有良好的导电性、导热性、化学活性和机械性能,因此在工业生产和日常生活中得到广泛应用。
对于铜的性质,我们应该充分了解并加以利用,以推动现代化工业和科技的发展。

高中化学:铜元素知识点总结
一. 单质和化合物的性质:
1. Cu不能置换酸中氢,但可以和浓H2SO4、浓HNO3、稀HNO3反应。
2. Cl2能将Cu氧化成+2价,而单质S、I2等弱氧化剂只能将其氧化成+1价。
3. Cu能被、等离子氧化成。
4. Cu在乙醇的催化氧化反应中作为催化剂,其催化过程为:
5. Cu在潮湿的空气中能发生吸氧腐蚀表面生成一层绿色铜锈。
6. CuO能被H2还原为红色Cu单质。
其方程式为:
7. 新制的浊液作弱氧化剂可氧化醛及含醛基的其他烃的衍生物。
例:
8. 新制的浊液遇多羟基化合物(甘油、葡萄糖等)生成绛蓝色物质。
9. 受热分解:
10. CuSO4溶液中通入H2S气体,生成不溶于H2SO4的黑色沉淀。
方程式为:
二. 单质及化合物的用途
1. 铜单质导电性良好可用来做导线。
2. 利用为重金属离子能使蛋白质变性的特点,用胆矾、生石灰、水可制农药波尔多液。
3. 可用CuSO4固体检验乙醇中是否含水。
4. 还可用新制的Cu(OH)2浊液来检验病人是否患有糖尿病。
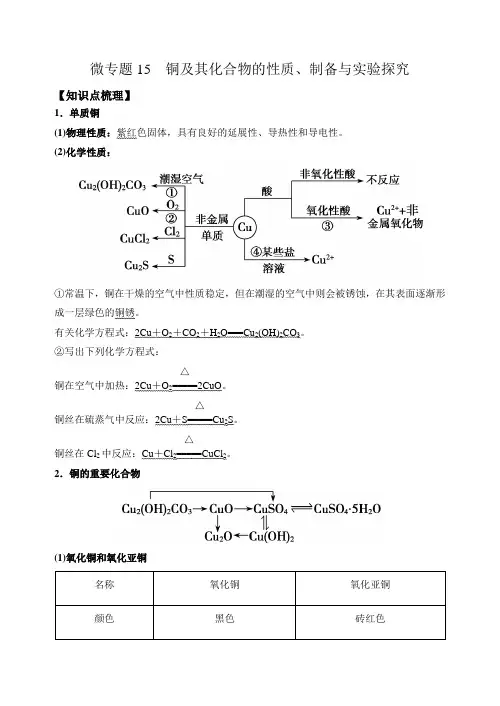
微专题15 铜及其化合物的性质、制备与实验探究【知识点梳理】1.单质铜(1)物理性质:紫红色固体,具有良好的延展性、导热性和导电性。
(2)化学性质:①常温下,铜在干燥的空气中性质稳定,但在潮湿的空气中则会被锈蚀,在其表面逐渐形成一层绿色的铜锈。
有关化学方程式:2Cu +O 2+CO 2+H 2O===Cu 2(OH)2CO 3。
②写出下列化学方程式:铜在空气中加热:2Cu +O 2=====△2CuO 。
铜丝在硫蒸气中反应:2Cu +S=====△Cu 2S 。
铜丝在Cl 2中反应:Cu +Cl 2=====△CuCl 2。
2.铜的重要化合物(1)氧化铜和氧化亚铜名称 氧化铜 氧化亚铜 颜色黑色砖红色与酸反应(H+) CuO+2H+===Cu2++H2OCu2O+2H+===Cu2++Cu+H2O(2)氢氧化铜①物理性质:蓝色不溶于水的固体。
②化学性质及应用:(3)铜盐①Cu2(OH)2CO3的名称为碱式碳酸铜,是铜绿、孔雀石的主要成分,受热分解可生成黑色的氧化铜,化学方程式:Cu2(OH)2CO32CuO+CO2↑+H2O。
②CuSO4·5H2O为蓝色晶体,俗称蓝矾、胆矾,其受热分解的化学方程式为CuSO4·5H2O CuSO4+5H2O,蓝色晶体受热转化为白色粉末。
无水CuSO4遇水变蓝色(生成CuSO4·5H2O),据此可用来检验水的存在。
(3)铜盐的毒性。
铜盐溶液有毒,主要是因为铜离子能与蛋白质作用,使蛋白质变性失去生理活性,因此人们利用这一性质用胆矾、熟石灰、水配成了波尔多液,用来杀灭植物的病毒。
3.铜及其化合物的制备(1)工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:(2)Cu2S是火法炼铜的重要原料之一,下面是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图:Cu 2S ――→O 2△Cu ――→焙烧 Cu 2O 、CuO ―――――→足量稀硫酸A ――→操作Ⅰ B ――――――――→蒸发、结晶、过滤胆矾4.废铜综合利用的常见流程框图模式【专题精练】1.将3.84g 铜粉与一定质量浓硝酸反应,当铜完全溶解时,收集到NO 、NO 2混合气体2.24L(标准状况下),则所消耗酸的物质的量是 A .0.1mol B .0.11molC .0.16molD .0.22mol【答案】D 【分析】根据铜和硝酸的反应,可知消耗的硝酸有两个去处,一个是被还原生成氮的氧化物,一个是生成硝酸铜,根据元素守恒可得答案。

铜知识点总结大全铜是一种常见的金属,具有良好的导电性和导热性,因此在工业和日常生活中广泛应用。
本文将从铜的化学性质、物理性质、应用领域和环境影响等方面进行详细总结。
一、化学性质1. 原子结构:铜的原子序数为29,原子核内有29个质子和中子,电子排布为2, 8, 18, 1。
2. 化学性质:铜是一种活泼的金属,可以与氧气、水蒸气和酸等发生化学反应。
在空气中,铜会氧化生成黑色的氧化铜,这是铜制品表面产生的一种自然保护膜。
3. 溶解性:铜在一些强氧化剂的作用下可以溶解,如浓硫酸、硝酸等,生成对应的盐。
二、物理性质1. 密度:铜的密度为8.96克/立方厘米,比较高,可以用来制作重物体。
2. 导电性:铜是一种极好的导电材料,电阻率为1.724×10^-8Ω•m,在电工和电子行业得到广泛应用。
3. 导热性:铜也具有良好的导热性,热导率为401W/(m•K),因此常被用来制作散热器、导热管等散热部件。
4. 融点:铜的融点为1083°C,属于高熔点金属,可以用于高温工艺中。
5. 耐腐蚀性:铜具有一定的耐腐蚀性,但在特定条件下会发生腐蚀,如在含有盐和酸的环境中容易受到侵蚀。
三、应用领域1. 电工电子:铜是电线、电缆的主要原材料,其优良的导电性使得电力传输更为高效稳定。
2. 工业制造:铜可以制作各类机械零部件、轴承、齿轮等,在机械制造领域应用广泛。
3. 建筑装饰:铜具有良好的韧性和可塑性,可以用于制作建筑装饰品、古董、雕塑等艺术品。
4. 医疗卫生:铜具有抗菌作用,可以用于医疗器械的制作,也可以制作铜制品来做抗菌表面处理。
5. 环保节能:铜是可回收再利用的金属材料,对环境的影响较小,也被广泛应用于节能设备和新能源领域。
四、环境影响1. 生产污染:铜的提炼和生产会产生气体、废水和固体废物,对环境造成一定污染。
2. 电磁辐射:电子产品中大量使用的铜线圈和导线会产生电磁辐射,对人体健康造成一定影响。
3. 废旧处理:大量废旧的铜制品需要进行回收处理,对环境和资源有一定影响。

铜及其化合物知识点铜是一种常见的金属元素,化学符号为Cu。
它具有良好的导电性和导热性,因此被广泛应用于电子、建筑和工业领域。
以下是一些关于铜及其化合物的知识点:- 物理性质:铜具有金属光泽,呈红褐色。
它的熔点为1083摄氏度,沸点为2567摄氏度。
铜是柔软的,并且具有良好的延展性和可塑性。
物理性质:铜具有金属光泽,呈红褐色。
它的熔点为1083摄氏度,沸点为2567摄氏度。
铜是柔软的,并且具有良好的延展性和可塑性。
- 化学性质:铜在常温下相对稳定,不容易被空气和水腐蚀。
然而,它会与一些酸和氧化剂发生反应,生成相应的化合物。
化学性质:铜在常温下相对稳定,不容易被空气和水腐蚀。
然而,它会与一些酸和氧化剂发生反应,生成相应的化合物。
- 铜离子:在化学反应中,铜原子往往失去2个电子,形成Cu2+离子。
这种离子具有蓝色,并且在化合物中起着重要的作用。
铜离子:在化学反应中,铜原子往往失去2个电子,形成Cu2+离子。
这种离子具有蓝色,并且在化合物中起着重要的作用。
- 铜的化合物:铜可以形成多种化合物,包括氧化物、硫化物、氯化物和硝酸铜等。
这些化合物在工业上有广泛的应用,如颜料、杀菌剂和催化剂等。
铜的化合物:铜可以形成多种化合物,包括氧化物、硫化物、氯化物和硝酸铜等。
这些化合物在工业上有广泛的应用,如颜料、杀菌剂和催化剂等。
- 应用领域:铜广泛应用于电子行业,如电线、导线和电路板等。
此外,它还用于建筑和装饰,如屋顶、管道和雕塑等。
应用领域:铜广泛应用于电子行业,如电线、导线和电路板等。
此外,它还用于建筑和装饰,如屋顶、管道和雕塑等。
以上是关于铜及其化合物的一些基本知识点。
了解铜的性质和应用领域,有助于我们更好地理解和应用这种重要的金属元素。
铜及其化合物知识点铜是一种常见的金属元素,化学符号为Cu。
它具有良好的导电性和导热性,因此被广泛应用于电子、建筑和工业领域。
以下是一些关于铜及其化合物的知识点:- 物理性质:铜具有金属光泽,呈红褐色。

2024年高考化学:铜及其化合物知识点汇总
01
铜及其化合物
一、铜
1. 物理性质:颜色:红色(紫红色)金属
2. 化学性质:价态:+1(不稳定) +2(稳定)
3. 与某些非金属单质反应:
(1)与氧气反应:
(2)与硫反应:
(3)与氯气反应:
4. 与酸反应:(非氧化性酸不反应)
5. 与某些盐反应:
二、铜的氧化物
1. CuO(黑色),(红色)
2. 与酸反应:
3. 与还原性物质(如、CO、C等)反应:
三、铜的氢氧化物及其反应
:蓝色物质,不溶性弱碱
1. 受热分解(是难溶碱的共性)
2. 弱氧化性:与新制氢氧化铜悬浊液反应
配制新制的悬浊液:
四、铜盐及其反应
碱式碳酸铜(铜绿)受热分解:。

铜及其化合物方程式一、铜的基本性质铜是一种优良的金属,具有良好的导电性和导热性,而且外观美观,因此在建筑、电器、通信等领域得到广泛应用。
下面是铜的一些基本性质:1.化学符号:Cu(铜)2.原子序数:293.相对原子质量:63.554.密度:8.96g/cm³5.熔点:1083℃6.沸点:2595℃7.电阻率:1.678μΩ·cm(20℃)8.自身电极势:+0.34V二、铜的化学性质铜是一种化学性质较为稳定的金属,不易被氧化,但在一些强氧化剂的作用下仍然会发生反应,下面介绍一些常见的铜的化学反应:1.铜与空气反应铜受空气的影响,会在表面形成一层氧化膜,通常为黑色或者绿色的铜绿。
这一氧化膜能够保护铜的表面,避免其继续被氧化。
有时,如果环境中的氧气和水汽充足,铜也会发生氧化反应,形成黑色的氧化层。
Cu + O2 → CuO2Cu + O2 → 2CuO2.铜与酸反应铜可以与稀酸反应(如稀硫酸),放出氢气并生成相应的铜盐。
但是铜不能与浓酸反应,因为浓酸的氧化性太强,会氧化铜。
Cu + 2H2SO4 + O2 → CuSO4 + SO2 + 2H2O3.铜与碱反应铜与碱类反应,生成相应的铜盐和水。
例如:Cu + 2NaOH → Cu(OH)2 + 2Na+4.铜与氯化氢反应铜在氯化氢的存在下,可以发生还原反应,放出氢气并生成二价的铜盐(CuCl2)。
例如:Cu + 2HCl → CuCl2 + H2三、铜的化合物铜的化合物广泛存在于自然界中,下面介绍一些常见的铜的化合物及其反应:1.氢氧化铜(Cu(OH)2)铜的氢氧化物在水中难溶,但在强碱性环境中溶解度却很大。
当铜离子与氢氧根离子作用,可以生成氢氧化铜:Cu2+ + 2OH- → Cu(OH)22.氧化铜(CuO)氧化铜是一种黑色或棕色的固体,常用于制备其他铜化合物。
氧化铜可以通过热分解碳酸铜而得到:CuCO3 → CuO + CO23.硝酸铜(Cu(NO3)2)硝酸铜是一种蓝色的晶体,能够溶于水,并在空气中逐渐失去其中的水分子。


铜的化工知识点总结一、铜的性质1. 物理性质铜的原子序数为29,原子量为63.55,属于过渡金属元素。
铜的密度为8.96克/立方厘米,熔点为1083摄氏度,沸点为2595摄氏度。
铜的导电性和导热性都很强,是一种重要的导电材料。
2. 化学性质铜在常温下不容易被氧化,但在高温、潮湿的环境下容易形成氧化铜。
铜能够形成不同的氧化态,其中最常见的是+1和+2价态。
铜与酸、碱、氧化剂等也能发生化学反应,广泛应用于化工生产中。
二、铜的制备1. 精炼铜的精炼方法主要包括火法、电解法和湿法等。
其中火法包括化铜和熔铜,电解法包括铜电解和氧化铜电解,湿法包括浮选法和浸出法等。
精炼方法的选择取决于铜矿石的品位和成分。
2. 合成除了从铜矿石中提取铜外,还可以通过化学合成方法来制备铜。
例如,将氧化铜和纯碱在高温下反应就能得到铜粉。
此外,还可以通过还原反应或电化学方法得到铜。
三、铜的应用1. 电子工业由于铜的良好导电性和导热性,广泛用于电子元器件、电缆、通讯设备等领域。
铜箔、铜线、铜箔板等产品在电子工业中得到广泛应用。
2. 建筑工业铜的抗腐蚀性和良好的可塑性使其成为一种理想的建筑材料,在建筑工业中用于制作屋顶、立面、管道等产品。
3. 化学工业铜在化学工业中被用作催化剂、还原剂、螯合剂等。
氨基乙醇胺、铜基催化剂、氧化铜等产品在化工生产中得到广泛应用。
4. 食品工业铜也被用作食品工业中的添加剂。
例如,用铜制成的锅具能有效杀灭细菌,保证食品安全。
5. 医药工业铜被用作医疗器械、药品原料等。
铜离子能抑制细菌生长,起到消毒杀菌的作用。
综上所述,铜是一种非常重要的化工原材料,具有良好的物理性质和化学性质,广泛应用于电子工业、建筑工业、化学工业、食品工业、医药工业等领域。
对铜的性质、制备和应用有一定的了解,有助于更好地利用铜资源,推动化工领域的发展。
高中铜知识点总结一、铜的性质1. 物理性质铜是一种黄色的金属,具有良好的导电性和导热性。
它的密度是8.96克/立方厘米,熔点为1083℃,沸点为2595℃。
在常温下,铜是一种延展性和韧性很强的金属,可以通过轧制、拉拔等工艺加工成各种形状的产品。
2. 化学性质铜是一种稳定的金属元素,不会与大多数非金属发生化学反应。
但是在空气中,铜会逐渐与氧气发生氧化反应而生成氧化铜。
此外,铜还能与一些非金属形成化合物,如与硫形成的硫化铜等。
3. 其他性质铜是一种良好的抗腐蚀材料,能够长期在空气中、水中以及一些酸性环境中保持稳定。
因此,铜制品被广泛应用于建筑、电子、化工等领域。
二、铜的用途1. 电工电气领域由于铜具有良好的导电性,因此被广泛用于制造导线、电缆、变压器、电机等电工电气产品。
在电子产品中,铜也是不可或缺的材料,如电路板、电子元件等都需要使用铜。
2. 建筑领域铜具有良好的耐腐蚀性和装饰性,因此在建筑领域有着广泛的应用。
铜制品如屋顶、管道、立柱、门窗等可以提高建筑的美观性和耐久性。
3. 化工领域铜在化工领域也有着广泛的应用,主要用于制造化工设备、催化剂、防腐蚀材料等。
此外,铜合金还可以用于制造船舶、飞机等交通工具的部件。
4. 冶金领域铜是一种重要的冶金原料,在冶金领域有着广泛的应用。
它被用于制造合金,如铜铝合金、铜镍合金等,以提高金属的性能和使用范围。
5. 生活用品在日常生活中,铜制品如厨具、餐具、工艺品等也很常见。
由于铜的良好性能和美观外观,这些产品深受消费者的喜爱。
三、铜的生产1. 铜矿石的开采铜主要以矿石的形式存在于自然界中,主要的矿石有黄铜矿、赤铜矿、硫铜矿等。
开采铜矿石的方式包括露天开采和井下开采,通常需要采用爆破、破碎、提矿等工艺。
2. 冶炼和提炼铜矿石经过破碎、浮选、熔炼等工艺,可提炼出高纯度的铜。
传统的冶炼方法包括火法冶炼和湿法冶炼,而现代的冶炼技术则多采用电炉、氧气炉等高效节能的设备。
3. 加工与制品提炼出的铜可进一步通过轧制、拉拔、挤压等工艺,生产成各种规格的铜板、铜管、铜棒等半成品,然后再加工成导线、管道、零部件等最终产品。
铜的知识点归纳总结一、铜的基本性质1. 化学性质:铜是一种活泼的金属元素,它可以与非金属发生化学反应,生成氧化物、硫化物等化合物。
2. 物理性质:铜是一种红色金属,具有良好的延展性和导电性,可以被轧制、拉制成各种形状的材料。
二、铜的生产和提炼1. 铜的矿石:铜存在于自然界中的矿石中,常见的铜矿石有黄铜矿、辉铜矿、赤铜矿等。
2. 铜的提炼:铜的提炼主要通过冶炼和电解两种方法进行。
冶炼是将铜矿石进行熔炼,从中分离出铜金属;电解是利用电解池将含铜的废料进行电解,将铜分离出来。
三、铜的应用领域1. 电工电气:铜具有良好的导电性和热导性,被广泛应用于电线、电缆、变压器等电气设备中。
2. 建筑装饰:铜具有良好的耐腐蚀性和装饰性,被用于建筑装饰、屋顶材料等领域。
3. 机械制造:铜合金具有良好的机械性能,被用于制造轴承、齿轮、工具等机械零件。
4. 化工材料:铜合金具有一定的抗腐蚀性和耐磨性,被用于制造化工设备、管道等。
四、铜的合金1. 铜合金的种类:铜合金是由铜与其他金属元素(如锌、锡、铝、镍等)组成的合金,常见的铜合金有黄铜、青铜、铜铝合金等。
2. 铜合金的性能:铜合金具有良好的机械性能、导电性能和耐蚀性能,被广泛应用于航空航天、船舶制造、汽车制造等领域。
五、铜的环境影响1. 铜的排放:铜矿山开采和冶炼过程中会产生大量的废水和废气排放,对周围环境造成污染。
2. 铜的回收利用:由于铜的资源稀缺,应该加强对废旧铜制品的回收利用,减少对自然资源的开采压力。
六、铜的相关标准1. 铜的国家标准:我国对铜的生产、加工、应用等领域制定了相关的标准,保障产品的质量和安全。
2. 国际标准:国际上也有一系列针对铜及其合金的标准,以便于国际贸易和技术交流。
综上所述,铜作为一种常见的金属元素,在各个领域都有着重要的应用价值,但同时也需要加强对其环境影响的监管和控制,推动资源的可持续利用和循环利用。
铜及其化合物性质归纳
精编版
MQS system office room 【MQS16H-TTMS2A-MQSS8Q8-MQSH16898】
铜及其化合物性质归纳
铜及其化合物的性质虽然在中学化学中没有专门介绍,但它们分散在中学教材的各个章节中。
在近几年高考题中经常出现铜及其化合物的影子,为便于同学们掌握它们的性质,现归纳如下:
一、铜
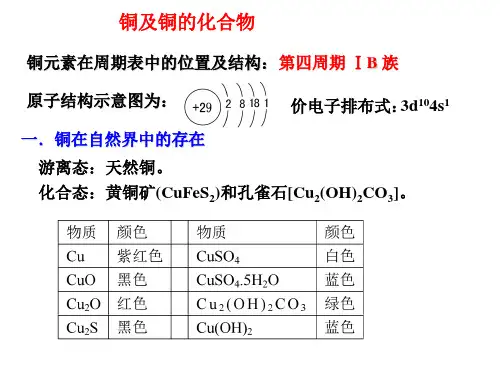
1、原子结构:原子序数为29,位于元素周期表中第4周期、第IB族,最外层有1个电子,常见化合价有+1、+2价。
2、物理性质:纯铜呈暗红色,属有色金属,导电导热性、延展性良好,焰色反应呈绿色。
3、化学性质:铜是一种较不活泼的金属,位于金属活动性顺序表中氢原子之后。
(1)与O
2的反应在空气中或O
2
中加热表面变黑:,利用此反应可除
去混在H
2、CO中的少量O
2。
(2)与O
2、CO
2
、H
2
O的作用
在潮湿的空气中铜可生成铜绿,。
(3)与其他非金属的反应
Cu在中燃烧生成棕黄色烟:;
在硫蒸气里燃烧生成黑色固体:
(4)与酸的反应
①与稀盐酸、稀不反应;
②与浓反应:
③与硝酸反应:
(浓)
(稀)
(5)与盐溶液反应:
二、铜的化合物
1、氧化物
CuO是不溶于水的碱性氧化物,具有较强的氧化性,在加热时能被CO、H
、C等还原:
2
,;可与酸反应:。
呈砖红色,可用于制红色玻璃,本身较稳定,但在酸液中易发生歧化反应生成Cu和。
2、
(1)难溶性碱,可与酸反应:。
(2)受热易分解:
(3)有弱氧化性,新制的悬浊液能氧化醛基化合物,本身被还原为,常用于醛基化合物的检验:。
(4)制备:可溶性铜盐与强碱反应:(蓝色絮状沉淀)。
3、铜盐
常见的铜盐有等。
(1)颜色:无水呈棕黄色,硫酸铜晶体(,又称胆矾或蓝矾)呈蓝色,其浓溶液呈绿色,无水硫酸铜呈白色,及其溶液呈蓝色。
常用无水硫酸铜白色粉末检验水蒸气或水的存在。
(2)化学性质
①水解性,其水溶液显弱酸性:。
②氧化性,与金属单质反应:。
③与强碱反应:。
④胆矾受热可失去结晶水变成白色粉末,过热时,会进一步分解出。
⑤可溶性铜盐能与H
S或反应生成黑色的沉淀,它难溶于强酸,常用于的
2
检验。
⑥易与形成络离子。