金属铁和铜及其化合物
- 格式:doc
- 大小:231.50 KB
- 文档页数:11

铁、铜及其化合物1、铁在氧气中燃烧3Fe+2O2Fe3O42、铁在氯气中燃2Fe+3Cl22FeCl33、铁和硫反应Fe+S FeS4、铁与碘单质反应Fe+I2FeI25、铁在高温时与水蒸气反应3Fe+4H2O(g)Fe3O4+4H267891011、FeO12、13、FeO14、Fe2O315、Fe2O3Fe2O3+6HNO3=2Fe(NO3)3+3H2O离子方程式Fe2O3+6H+=2Fe3++3H2O16、Fe2O3与氢碘酸(HI)反应的化学方程式Fe2O3+6HI=2FeI2+I2+3H2O离子方程式Fe2O3+6H++2I—=2Fe2++I2+3H2O17、Fe3O4与盐酸反应的化学方程式Fe3O4+8HCl=2FeCl3+FeCl2+4H2O离子方程式Fe3O4+8H+=2Fe3++Fe2++4H2O18、Fe3O4与稀HNO3反应的化学方程式3Fe3O4+28HNO3=9Fe(NO3)3+NO↑+14H2O离子方程式3Fe3O4+28H++NO3—=9Fe3++NO↑+14H2O19、Fe3O4与氢碘酸(HI)反应的化学方程式Fe3O4+8HI=3FeI2+I2+4H2O离子方程式Fe3O4+8H++2I—=3Fe2++I2+4H2O20、Fe(OH)2与盐酸反应的化学方程式Fe(OH)2+2HCl=FeCl2+2H2O离子方程式Fe(OH)2+2H+=Fe2++2H2O21、Fe(OH)2与稀HNO3酸反应的化学方程式3Fe(OH)2+10HNO3=3Fe(NO3)3+NO↑+8H2O离子方程式3Fe(OH)2+10H++NO3—=3Fe3++NO↑+8H2O22、Fe(OH)2与氢碘酸(HI)反应的化学方程式Fe(OH)2+2HI=FeI2+2H2O离子方程式Fe(OH)2+2H+=Fe2++2H2O23、Fe(OH)3与盐酸反应的化学方程式Fe(OH)3+3HCl=FeCl3+3H2O+3+24、25、26、27、Fe28写出29、303132、Fe写出3334、H235、KI36、—Fe(SCN)37、SO222Fe+SO2+Ba+2H2O=2Fe+BaSO4↓+4H铜在化合态中常见化合价为+2价(部分物质中显+1价)。


第12讲 铁铜及其化合物一 铁的位置和物理性质1.铁及其化合物间的主线Fe―→⎩⎪⎨⎪⎧FeO Fe 2O 3Fe 3O 4―→⎩⎨⎧Fe OH2Fe OH 3―→⎩⎨⎧FeSO 4·7H 2OFeCl 32.铁及其化合物间的转化关系3.铁元素的变价 (1)单质铁①生成+2价:铁与S 、H +、Cu 2+、I 2等反应生成+2价。
如:Fe +SFeS 、Fe +Cu 2+===Fe 2++Cu 。
①生成+3价:铁与Cl 2、Br 2等反应生成+3价。
如2Fe +3Cl 2=====点燃2FeCl 3。
①生成+2、+3价:铁与H 2O 、O 2反应生成Fe 3O 4。
3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
①铁与HNO 3反应:当Fe 过量生成+2价,3Fe +8H ++2NO -3===3Fe 2++2NO +4H 2O ; 当Fe 不足时生成+3价,Fe +4H ++NO -3===Fe 3++NO +2H 2O 。
(2)铁的化合物:FeO 、Fe 3O 4、Fe 2O 3、Fe(OH)2、Fe(OH)3、Fe 2+、Fe 3+等。
+2价铁具有还原性,与强氧化性物如HNO 3、Cl 2等发生氧化还原反应: 如:3FeO +10HNO 3===3Fe(NO 3)3+NO +5H 2O 。
+3价铁具有氧化性,与强还原性物质, 如:HI 、Fe 、Cu 、I -、S 2-等发生氧化还原反应,如:Fe 2O 3+6HI===2FeI 2+I 2+3H 2O,2Fe 3++Cu===2Fe 2++Cu 2+。
特别强调:①Fe 与一般酸反应生成Fe 2+,与酸的量无关,但Fe 与稀HNO 3反应时最终铁的价态与铁的量有关。
①铁与硫蒸气反应生成的是FeS 而不是Fe 2S 3;铁与碘蒸气反应生成的是FeI 2而不是FeI 3。
4.铁的氧化物特别强调:①FeO 、Fe 3O 4、Fe 2O 3与硝酸反应时均生成Fe 3+。


Fe 铜、铁及其化合物一、铁及其化合物1.物理性质:银白色,具有金属光泽;质地较软,有良好的导电性、延展性。
密度7.86 g/cm 3,熔沸点较高。
位置:第四周期,第Ⅷ 族 2.化学性质:(1)与非金属反应 Fe+S (I 2)FeS (FeI 2) 4Fe+3O 22Fe 3O 4 2Fe+3Cl 2(Br 2)2FeCl 3弱氧化剂 Fe 3+、H +、I 2、S 、铁后的金属阳离子(置换)… 强氧化剂 Cl 2、Br 2、HNO 3、浓H 2SO 4、MnO 4-(H +) … (2)与水反应 3Fe + 4H 2O(g)Fe 3O 4 + 4 H 2 ↑(置换)注意:铁在常温下不会和水发生反应,但在水和空气中O 2和CO 2的共同作用下,铁却很容易被腐蚀(生锈/电化学腐蚀) (3) 与酸反应a.与非氧化性酸反应 Fe +2H +== Fe 2++ H 2 b.与氧化性酸反应c.常温下,铁在冷浓硫酸,浓硝酸中发生钝化d.与浓硫酸反应:2Fe +6 H 2SO 4(浓)Fe 2(SO 4)3 +3SO 2 +6 H2Oe.与稀硝酸反应:①当Fe 少量时,离子方程式为:Fe + 4H ++ NO 3-== Fe 3++NO↑+2H 2O②当Fe 过量时,,离子方程式为:3Fe+8H ++2NO 3-== 3Fe 2++2NO↑+4H 2O ③当1:4<n( Fe) :n (HNO 3)<3:8 时,此情况下,Fe 3+和Fe 2+共存。
(4)与盐溶液反应:2Fe 3++ Cu = 2Fe 2++ Cu 2+ Fe + 2Fe 3+ = 3 Fe 2+ Fe + Cu 2+ = Fe 2++ Cu3.铁的氧化物FeO Fe 2O 3 Fe 3O 4 铁的化合价 +2 +3 +2、+3 颜色、状态黑色粉末红棕色粉末 黑色晶体 俗名 铁红 磁性氧化铁 水溶性 不溶于水 不溶于水 不溶于水氧化物类别碱性氧化物碱性氧化物Fe 2+Fe 3+与非氧化性酸反应FeO+2H + =Fe2+ +H2O Fe2O3+6H + =2Fe3+ +3H2O Fe3O4+8H + =2Fe3+ + Fe2++4H2O与还原剂反应(H2、CO、Al等) FeO+CO Fe+CO2Fe2O3+3CO2Fe+3CO23Fe3O4+8Al9Fe+4Al2O3用途用作红色油漆和涂料;赤铁矿是炼铁原料注:3FeO+10HNO3(稀)=3Fe(NO3)3+NO↑+5H2O4、铁的氢氧化物(1)Fe(OH)2的制备Fe(OH)2易被氧化,在制备时应注意:①FeSO4晶体中不能有 Fe3+;②配制后的FeSO4溶液中要加入少量铁粉;③配制溶液的蒸馏水以及所用NaOH溶液均须煮沸以除去其中溶解的氧气;实验:FeSO4溶液中加NaOH.①现象:生成白色沉淀,后又迅速转变为灰绿色,最后生成红褐色②Fe2+容易被氧化,所以FeSO4溶液要新配制.③为了防止滴加NaOH时带入空气,可将吸收NaOH的长滴管伸入FeSO4溶液液面下,再挤出NaOH溶液.④为了防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量煤油或其它密度比水小但不溶于水的有机物以隔绝空气.化学方程式: FeSO4 + 2NaOH = Fe(OH)2↓+Na2SO4 Fe2++ 2OH -= Fe(OH)2↓(白色)4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3(红褐色)(白色→灰绿色→红褐色)(2)Fe(OH)3的制备实验:FeCl3溶液中加NaOH溶液.①现象:生成红褐色沉淀②化学方程式:FeCl3+3NaOH= Fe(OH)3↓+3NaCl Fe 3++ 3OH -= Fe(OH)3↓(红褐色)③热稳性:Fe(OH)3对热不稳定,受热能失去水生成红棕色的Fe2O3粉末.化学方程式: 2Fe(OH)3Fe2O3 +3H2O[小结]难溶性或微溶性的碱受热不稳定,容易分解。

铁铜及其化合物重要方程式汇总金属及其化合物重要方程式汇总(三)铁、铜及其化合物1、铁与非金属单质反应:(1)Fe在纯O2中燃烧:化学方程式:;(2)Fe与S的反应:化学方程式:(3)Fe与Cl2点燃:化学方程式:;(4)Fe与I2的反应:化学方程式:;2、铁与水反应:(1)与水蒸汽反应:化学方程式:;(2)常温下,铁与水不起反应,但潮湿的空气里形成原电池,铁易被腐蚀,最终形成铁锈。
原电池反应:负极:正极:总反应:后续反应:3、铁与酸反应:(1)与非氧化性酸①铁和稀盐酸:化学方程式:;②铁和稀硫酸:化学方程式:;离子方程式:;(2)与氧化性酸(与浓硫酸、稀硝酸、浓硝酸)①常温下,浓硫酸和浓硝酸会使、钝化,加热反应。
②铁与浓硫酸:化学方程式:;③铁与足量浓硝酸:化学方程式:;离子方程式:;④少量铁与稀硝酸:化学方程式:;离子方程式:;⑤过量Fe与稀硝酸:化学方程式:;离子方程式:;4.铁与盐溶液反应:(1)铁和氯化铜溶液:化学方程式:离子方程式:;(2)除去FeCl2溶液中的FeCl3:化学方程式:;离子方程式:;第1页,共2页5.Fe3O4粉末和稀盐酸:化学方程式:;离子方程式:;6.CO还原磁性氧化铁(工业炼铁):化学方程式:;7.CO还原氧化铁(工业炼铁):化学方程式:;8.氧化铁和Al做铝热剂的铝热反应:化学方程式:9.向FeCl2溶液中通Cl2:化学方程式:;离子方程式:;10.向Fe(NO3)2溶液中滴加稀硝酸:化学方程式:;离子方程式:;11.向硫酸亚铁溶液滴加过量氨水,生成白色沉淀,迅速变灰绿色,最终变成红褐色:生成白色沉淀化学方程式:;离子方程式:;白色沉淀迅速变灰绿色最终变成红褐色,化学方程式_______________________________12.用氯化铁溶液制作铜制印刷电路板:化学方程式:;离子方程式:;13.Fe3+和I-不能大量共存,离子方程式_____________________________________________14.Fe3+和S2-不能大量共存,离子方程式____________________________________________15.Fe3+的检验:(1)常用硫氰化钾溶液:离子方程式:;(2)高浓度时加氢氧化钠溶液:离子方程式:;16.Fe2+的检验:(1)常用:先滴加硫氰化钾溶液,观察后,再加氯水:现象:;化学方程式:①;②;离子方程式:①;②;(2)高浓度时可以加氢氧化钠溶液:现象:;化学方程式:①;②;(3)当Fe2+和Fe3+共存时,用酸性高锰酸钾,现象是_______________________配平离子方程式:Fe2++MnO4-+H+=Fe3++Mn2++H2O第2页,共2页。


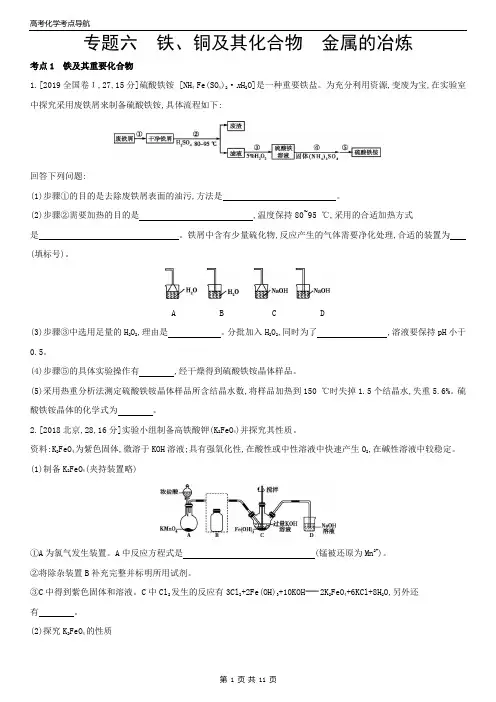
专题六铁、铜及其化合物金属的冶炼考点1 铁及其重要化合物1.[2019全国卷Ι,27,15分]硫酸铁铵 [NH4Fe(SO4)2·x H2O]是一种重要铁盐。
为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:回答下列问题:(1)步骤①的目的是去除废铁屑表面的油污,方法是。
(2)步骤②需要加热的目的是,温度保持80~95 ℃,采用的合适加热方式是。
铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为(填标号)。
A B C D(3)步骤③中选用足量的H2O2,理由是。
分批加入H2O2,同时为了,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时失掉1.5个结晶水,失重5.6%。
硫酸铁铵晶体的化学式为。
2.[2018北京,28,16分]实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)①A为氯气发生装置。
A中反应方程式是(锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂。
③C中得到紫色固体和溶液。
C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH2K2FeO4+6KCl+8H2O,另外还有。
(2)探究K2FeO4的性质①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。
为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:方案Ⅰ取少量a,滴加KSCN溶液至过量,溶液呈红色方案Ⅱ用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。
取少量b,滴加盐酸,有Cl2产生i.由方案Ⅰ中溶液变红可知a中含有离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由产生(用方程式表示)。
第二课时铁、铜及其化合物的应用——————————————————————————————————————[课标要求]1.认识铁、铜的物理性质和化学性质。
2.掌握铁、铜化合物的重要性质。
3.掌握Fe 2+、Fe 3+的检验方法及Fe 2+与Fe 3+的相互转化。
1.Fe 的物理特性:能被磁铁吸引;Cu 的物理特性:颜色为紫红色。
2.铁在一定条件下可与某些非金属单质(O 2、Cl 2等)、酸、盐溶液等发生反应, 是一种还原性较强的金属。
3.Fe 3+的溶液遇KSCN 溶液变成血红色,Fe 2+遇KSCN 不显红色,加入氯水后显血红色。
4.Fe 2+和Fe 3+相互转化:Fe 2+错误!Fe 3+。
5.在溶液中,Fe 3+呈棕黄色、Fe 2+呈浅绿色、Fe(SCN)3呈血红色、Cu 2+呈蓝色。
铁、铜的性质 Fe3+、Fe +2的检验1.铁的性质 (1)物理性质①与非金属的反应:);固体黑色火星四射,生成(4O 3Fe =====点燃2反应 3Fe +2O 2与O )。
色烟红棕剧烈燃烧,生成(32FeCl =====点燃2反应2Fe +3Cl 2与Cl ②与酸反应,与盐酸反应的离子方程式为Fe +2H +===Fe 2++H 2↑;常温下,Fe 遇浓H 2SO 4、浓HNO 3发生钝化。
③与盐溶液反应,与CuSO 4溶液反应的离子方程式为Fe +Cu 2+===Cu +Fe 2+。
2.铜的性质(1)物理性质紫红颜色:良好。
色;导电性、导热性和延展性:(2)化学性质①与非金属反应:与O2反应:2Cu+O2高温,2CuO;与Cl2反应:Cu+Cl2点燃,CuCl2。
(剧烈燃烧,生成棕黄色烟)②与盐溶液反应:与AgNO3溶液反应的离子方程式为Cu+2Ag+===Cu2++2Ag。
3.Fe3+、Fe2+的检验(1)检验方法(2)Fe3+与KSCN反应的离子方程式为Fe3++3SCN-===Fe(SCN)3。
铁和铜及其化合物知识点总结1、铁、铜性质① 2Fe + 3Cl22FeCl3② 2Fe + 3Br2 == 2FeBr3③ Fe + I2 == FeI2④ 3Fe + 2O2Fe3O4 ( +2价占1/3,+3价占2/3) ① Cu + O22CuO② Cu + Cl2CuCl2③ 2Cu + S Cu2S3Fe + 4H2O(g) Fe3O4 + 4H2↑2、铁及其化合物的主要反应:①氯化铁溶液中加入铁粉(除去氯化亚铁中的氯化铁):2FeCl3 + Fe == 3FeCl22Fe3+ + Fe == 3Fe2+②铁与硫酸铜反应(湿法炼铜):Fe + CuSO4 == FeSO4 + Cu Fe + Cu2+ == Fe2+ + Cu③氯化亚铁溶液中滴加氯水(除去氯化铁中的氯化亚铁):2FeCl2 + Cl2 == 2FeCl32Fe2+ + Cl2 == 2Fe3+ + 2Cl-④氢氧化亚铁在空气中变质:4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3⑤铜与氯化铁反应(用氯化铁腐蚀铜电路板):2FeCl3 + Cu == 2FeCl2 + CuCl22Fe3+ + Cu == 2Fe2+ + Cu2+3、Fe2+与Fe3+的相互转化:(1)Fe2+ → Fe3+:Fe2+与强氧化剂(如Cl2、Br2、O2、HNO3、KMnO4、浓H2SO4、H2O2等)反应时,被氧化成Fe3+:如:2Fe2+ + Cl2 == 2Fe3+ + 2 Cl−3Fe2+ + 4H+ + NO3− == 3Fe3+ + 2H2O + NO↑(2)Fe3+ → Fe2+:Fe3+与还原剂(如Zn、Fe、Cu、S2−、I−、H2S等)反应时,被还原成Fe2+:如:Fe + 2Fe3+ == 3Fe2+Cu + 2Fe3+ == Cu2+ + 2Fe2+2I− + 2Fe3+ == I2 + 2Fe2+4、Fe3+(黄色)的检验:实验①:向FeCl3溶液中加入几滴KSCN溶液,溶液显血红色Fe3+ + 3SCN− == Fe(SCN)3(血红色溶液)实验②:向FeCl3溶液加入NaOH溶液,有红褐色沉淀Fe3+ + 3OH− == Fe(OH)3↓Fe2+(浅绿色)的检验:实验①:向FeCl2溶液加入NaOH溶液Fe2+ + 2OH− == Fe(OH)2↓(白色)4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3(红褐色)实验②:加入KSCN溶液,无现象,再加入适量氯水,溶液显血红色1。
Fe及其化合物(一)过渡金属简介:1、组成:周期表中ⅢB—ⅡB(10个纵行),包括镧系、锕系,全为金属。
2、原子结构特点:最外层、次外层、甚至倒数第三层电子均未达到稳定结构(主族金属只有最外层电子未达到稳定结构)3、化性:化合价:多有变价易形成络合物:如[Fe(SCN)6]3-、[Cu(NH3)4]2+、[Ag(NH3)2]+等4、要求:掌握Fe及化合物,了解Cu、Ag、Zn的性质(二)Fe1、周期表中位置:第四周期Ⅷ族2、原子结构:1s22s22p63s23p63d64s23、物性:金属通性,银白金属光泽,密度:7.86g/cm3,熔沸点高,抗蚀力强,具有铁磁性说明:Fe在地壳中含量高,金属第二位(O、Si、 Al 、Fe)纯铁比比生铁熔沸点高,抗蚀力强,为什么?4、化性:H前金属,有变价,被强氧化剂氧化为Fe3+;被弱氧化剂氧化为Fe2+(1)与非金属单质:a、O2:室温下,干燥空气中,不易氧化室温下,潮湿空气中,发生电化腐蚀,最终生成Fe2O3点燃:3Fe + 2O2 = Fe3O4炼钢吹氧:2Fe+ O2 = 2FeOb、Cl2、Br2: 2Fe+ 3X2 = 2FeX3c、I2: Fe + I2 = FeI2d、S: Fe + S = FeS(2)酸:a、非氧化性强酸:Fe + 2H+ = Fe2+ + H2↑b、氧化性酸:HNO3、浓H2SO4等常温下:Fe遇浓H2SO4、浓HNO3钝化;加热反应:氧化产物为Fe 3+盐,还原产物为SO2、NO2、NO等Fe + 4HNO3 = Fe(NO3)3 + NO↑ + 2H2O【说明】1、运输浓H2SO4、浓HNO3的铁罐为何不能碰撞?2、清洗运输浓H2SO4的铁罐为何严禁烟火?(3)Fe后盐溶液——置换:Fe + Cu2+ = Fe2+ + Cu(4)与水蒸气反应(特性):3Fe + 4H2O = Fe3O4 + 4H2(高温条件)【说明】1、条件:炽热的铁与水蒸气反应2、常温下,铁与水不反应,但会发生吸氧腐蚀:(1)负极:Fe-2e = Fe2+正极:O2+ 2H2O+4e=4OH-;(2)Fe2++ 2OH- = Fe(OH)2;(3)4Fe(OH)2 +O2+ 2H2O = 4Fe(OH)3;(4)2Fe(OH)3 = Fe2O3·xH2O+ (3-x)H2O;最终生成铁锈:Fe2O3·xH2O【小结】铁有变价,遇强一些氧化剂生成+3价,与一些弱氧化剂生成+2价5、用途:铁合金:生铁、钢6、制备:铁的冶炼:2C(焦炭)+ O2 = 2COFe2O3 + 3CO = 2Fe + 3CO2(三)Fe的氧化物:FeO、Fe2O3、Fe3O4化学式FeO Fe2O3Fe3O4俗名铁红磁性氧化铁Fe的化合价+2+3+2(1/3)、+3(2/3)是否碱性氧化物是:Fe(OH)2是:Fe(OH)3否物性色状黑色粉末红棕色粉末黑色晶体水溶性不溶不溶不溶化性稳定性 6 FeO+ O2 = 2Fe3O4稳稳与水不反应不反应不反应与酸HCl FeO+ 2H+ = Fe2++ H2O Fe2O3+ 6H+ = 2Fe3++ 3H2O Fe3O4+8H+ =2Fe3++Fe2++ 3H2O HNO3溶解且Fe2+被氧化溶解溶解且Fe2+被氧化HI溶解溶解且Fe3+被还原溶解且Fe3+被还原H2、CO、Al FeO+ H2 = Fe+ H2O Fe2O3 + 3CO = 2Fe + 3CO23Fe3O4+ 8Al = 9Fe + 4Al2O3用途炼钢颜料、炼铁磁铁、炼铁【说明】Fe3O4为纯净物,可写成:FeO·Fe2O3或Fe(FeO2) 2——铁酸亚铁(四)Fe的氢氧化物:Fe(OH)2、Fe(OH)3:化学式Fe(OH)2Fe(OH)3物性白色胶状物,不溶于水Fe(OH)3红褐色固体,不溶于水化性酸HCl Fe(OH)2+2H+ = Fe2++ 2H2O Fe(OH)3+3H+ = Fe3++ 3H2OHNO3溶解且+2价Fe被氧化(?)溶解HI溶解溶解且+3价Fe被还原(?)O2常温4Fe(OH)2 +O2+ 2H2O = 4Fe(OH)3稳定加热2Fe(OH)3 = Fe2O3 + 3H2O制备原料可溶Fe2+加碱(NaOH或NH3·H2O)可溶Fe3+加碱(NaOH或NH3·H2O)现象白色絮状↓→灰绿色→红褐色↓红褐色↓原理Fe2++2OH-= Fe(OH)2↓Fe3++3NH3·H2O= Fe(OH)3↓+3 NH4+【练】制备Fe(OH)2的关键是什么?可采取哪些措施?关键:防氧化措施:配制Fe2+盐溶液时:(1)溶解前蒸馏水煮沸(2)加入少量铁粉(3)溶液上层价植物油;NaOH用长胶头滴管,伸入液面下挤出(五)Fe2+和Fe3+的盐Fe3+氧化剂:Cl2、Br2、O2、HNO3(HClO、H2O2、Na2O2、MnO4-)等还原剂:Fe、Cu、I-、H2S(S2-)、SO2(SO32-)等【说明】1、Fe2+的盐具有:弱氧化性,强还原性(1)氧化性:3Fe2+ + 2Al= 3Fe + 2Al3+(2)还原性:Fe2+的盐可被Cl2、Br2、HNO3等氧化为Fe3+,溶液由浅绿变棕黄色。
例:FeCl2中Cl2: 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-Fe2+与NO3- (H+)不共存:3Fe2+ + NO3- + 4H+ = 3Fe3+ + NO↑+ 2H2O2、Fe3+的盐只有氧化性:,遇Fe、Cu、I-、H2S(S2-)、SO2(SO32-)等,本身被还原为Fe2+,相应还原剂被氧化为:Fe2+、Cu2+、I2、S、H2SO4(或SO42-)例:FeCl2防氧化加铁粉:2Fe3+ + Fe = 3Fe2+;FeCl3腐蚀印刷电路板:2Fe3+ + Cu= 2Fe2+ + Cu2+;FeCl3使淀粉KI变蓝:2Fe3+ + 2I- = 2Fe2+ + I2FeCl3溶液中通H2S: 2Fe3+ + H2S = 2 Fe2+ + S↓+ 2H+FeCl3溶液中通SO2,再加BaCl2,有不溶于硝酸的沉淀:2Fe3+ + SO2 + 2H2O = 2 Fe2+ + SO42-+ 4H+Ba2++ SO42-= BaSO4↓3、Fe2+和Fe3+的除杂:(1)Fe2+含有Fe3+:加铁粉(2)FeCl3含有FeCl2:通Cl24、Fe2+和Fe3+的检验:序号试剂Fe2+Fe3+1观溶液颜色浅绿色棕黄色2加碱白色絮状↓→灰绿色→红褐色↓红褐色↓白絮↓→灰绿色→红褐色↓,气体红褐色↓,气体3Na2CO3(双水解)4H2S无现象棕黄变浅绿,有浅黄色沉淀5NH4SCN无现象血红色溶液Fe3+ + 6SCN- = [Fe(SCN)6]-6苯酚无现象紫色溶液5、Fe3+的水解:(1)FeCl3溶液有丁达尔现象:Fe3+ + 3H2O Fe(OH)3 + 3H+(2)FeCl3溶液蒸干、灼烧,产物为Fe2O3: FeCl3 + 3H2O = Fe(OH)3↓ + 3HCl↑2Fe(OH)3= Fe2O3 + 3H2O(3)FeCl3滴入沸水,搅拌,得红棕色胶体:FeCl3 + 3H2O = Fe(OH)3(胶体)+ 3HCl↑6、Fe2+和Fe3+的离子共存问题:NO3- (H+)、MnO4-、ClO-因氧化还原不共存OH-、S2-、SO32-、CO32-因复分解反应不共存Fe2+与S2-、I-、SO32-等因氧化还原不共存CO32-、HCO3-等因双水解不共存OH-等因复分解反应不共存SCN-、C6H5O-等因络合反应不共存7、Fe与稀HNO3反应的讨论:(1)HNO3过量时: Fe + 4HNO3 = Fe(NO3)3 + NO↑+ 2H2O(2)Fe过量时,继续发生:Fe + 2Fe(NO3)3= 3Fe(NO3)2总:3Fe + 8HNO3 = 3Fe(NO3)2 + 2NO↑+ 4H2O即:当n Fe:n HNO3↔[1/4,3/8]时,Fe与HNO3均充分反应,且均有1/4的HNO3被还原。
8、其他的Fe盐:(1)Fe(NH4)2(SO4)2,俗称摩尔盐,复盐,常用于氧化还原滴定:Fe2+被氧化(2)Na2FeO4:铁酸钠,用于自来水消毒和净化【练1】印刷电路废液的回收利用(FeCl3、FeCl2、CuCl2)原理:【思考1】已知:2Fe2+ + Br2 = 2Fe3+ + 2 Br-,2Fe3+ + 2I- = 2Fe2+ + I2,向含amolFeBr2和bmolFeI2的溶液中通Cl2,设通入Cl2的物质的量为x,填写下表:Cl2物质的量Cl I-Fe2+Fe3+Br-【思考2】Fe、Cu、 Fe2+、Fe3+、Cu2+的讨论:已知:2Fe3+ + Fe = 3Fe2+;2Fe3+ + Cu= 2Fe2+ + Cu2+则:(1)溶液中有Fe3+,还有(),无()(2)有Fe剩余时,还有(),无()(3)有Cu、Cu2+时,还有(),无()(4)有Fe3+、Cu2+时,还有(),无()(5)有Cu剩余时,还有(),无()可能()(6)有Cu2+时,还有(),无()可能()六、铜及重要化合物:(一)铜:1、物性:红色(或紫红色)金属光泽,金属通性2、化性:H后变价金属,较不活泼(1)与非金属单质:O2:Cu + O2 = 2CuO (加热由红变黑)Cl2:Cu + Cl2 = CuCl2(棕黄色烟)S:2Cu + S = Cu2S(黑色)【说明】Cl2、S与变价金属Fe、Cu反应的产物,可判断Cl2、S氧化性的强弱(2)与酸:非氧化性酸:不反应,H+不能氧化Cu氧化性酸:Cu+ 2H2SO4(浓) = CuSO4 + SO2↑+2H2OCu+ 4H2NO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O3Cu+ 8H2NO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O (3)与Fe3+: 2Fe3+ + Cu= 2Fe2+ + Cu2+;(4)潮湿空气中:2Cu+ O2 + CO2+ 2H2O=Cu2(OH)2CO3(铜绿、孔雀石)3、用途:电缆、原电池等(二)重要氧化物1、CuO:(1)物性:黑色粉末,不溶于水(2)化性:a、碱性氧化物通性:CuO + 2H+ = Cu2+ + H2Ob、受热分解: 2CuO = Cu2O + O2c、氧化性(高温下):CuO + H2 = Cu + H2O2CuO + C = Cu + CO23CuO + 2NH3= 3Cu + N2 + 3H2OCuO + CH3CH2OH = Cu + CH3CHO + H2O2、Cu2O:(1)物性:砖红色固体,不溶于水(2)化性:酸性条件下歧化(自身氧化还原):Cu2O + 2H+ = Cu2+ + Cu + H2O(溶液变蓝色)【练】如何检验Cu中是否含有Cu2O?加稀硫酸或盐酸,若溶液变蓝,则说明Cu中是否含有Cu2O (三)氢氧化物:Cu(OH)21、物性:蓝色固体,不溶于水2、化性:(1)碱的通性:Cu(OH)2+ 2H+ = Cu2+ + 2H2O(2)受热分解:Cu(OH)2 = CuO + H2O(3)弱氧化性:斐林试剂(碱过量)氧化醛基(—CHO)2Cu(OH)2 + R—CHO = Cu2O↓+ R—COOH + 2H2O(四)铜盐——蓝矾(胆矾):CuSO4·5H2O1、物性:蓝色晶体,易溶于水2、化性:(1)盐的通性(2)受热失水:CuSO4·5H2O(蓝)= CuSO4(白) +5H2O(3)氧化性:Cu2+ + Fe = Cu + Fe2+【说明】可用CuSO4粉末检验水的存在:由白变蓝【课后练习】1.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。