高中化学人教版选修五课时作业17乙醛的结构和性质
- 格式:doc
- 大小:87.00 KB
- 文档页数:7


课时作业17 乙醛的结构和性质时间:60分钟 分值:100分 班级:________ 姓名:________ 一、选择题(每小题5分,共55分)1.用分液漏斗可以分离的一组液体混合物是( )A .乙醛和水 B .苯酚和水C .乙醇和碘水D .苯和水解析:A 、C 溶液均互溶,苯酚和水若是较稀溶液也相互溶解,苯和水不溶,可以利用分液漏斗分离。
答案:D 2.下列反应中不属于氧化反应的是( )A .CH 3CHO +2Ag(NH 3)2OH ―→2Ag ↓+CH 3COONH 4+3NH 3+H 2O B .CH 3CHO +2Cu(OH)2CH 3COOH +Cu 2O ↓+2H 2O ――→△ C .2C 2H 5OH CH 3CH 2—O—CH 2CH 3+H 2O ――→浓H2SO4 △D .2CH 3CHO +O 22CH 3COOH ――→催化剂 解析:A 、B 、D 均是氧化反应,C 是取代反应。
答案:C 3.目前用乙烯制乙醛的过程分三步进行:①CH 2=CH 2+PdCl 2+H 2O ―→CH 3CHO +2HCl +Pd ②Pd +2CuCl 2―→PdCl 2+2CuCl ③2CuCl +O 2+2HCl ―→2CuCl 2+H 2O ,12下列叙述中正确的是( )A .CH 2=CH 2是还原剂,PdCl 2是氧化剂B .CuCl 是还原剂,O 2是氧化剂C .乙烯是还原剂,O 2是氧化剂D.PdCl2和CuCl2都是催化剂答案:CD4.区别乙醛、苯和溴苯最简单的方法是( )A.加入酸性高锰酸钾溶液振荡B.与新制的氢氧化铜溶液共热C.加蒸馏水后振荡D.加硝酸银溶液后振荡解析:利用三者在水中溶解度的不同加以区别,乙醛溶于水,苯不溶于水且密度比水小,故有机层在水的上层,溴苯不溶于水且密度比水大,故有机层在水的下层。
答案:C5.对于乙醛的结构、性质、用途和制法叙述正确的是( )①看成是—CH3和—CHO直接相连的化合物 ②所有原子都在一个平面上 ③其沸点比氯乙烷高,比乙醇低 ④易溶于水的原因是分子中含有—CH3 ⑤具有还原性 ⑥工业上可大量用于制乙醇 ⑦工业上通常用乙烯氧化法和乙炔水化法制乙醛A.①②③⑥B.②④⑤⑦C.①③④⑥D.①③⑤⑦解析:乙醛中由于有—CH3存在,一定是空间结构;乙醛易溶于水的原因不是—CH3而是—CHO,实际上烃基是憎水基,不溶于水;乙醛造价比乙醇高,不能用高价原料制低价产品。




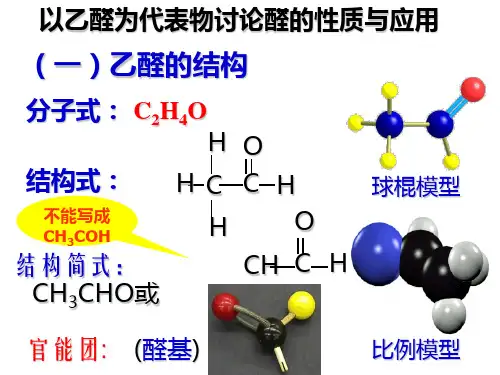

乙醛的结构性质和制备乙醛(化学式:CH3CHO),也被称为乙醛酸,是一种无色、易燃的液体有机化合物。
乙醛是最简单的醛类化合物,广泛应用于工业和日常生活中。
下面将详细介绍乙醛的结构、性质和制备方法。
结构:乙醛的分子式为CH3CHO,其结构由一个碳原子和一个氧原子连接而成,碳原子上有一个甲基基团(-CH3)。
乙醛的结构中存在一个醛基(-CHO)。
性质:1.物理性质乙醛是一种无色的液体,有辛辣的气味。
其密度为0.79 g/cm³,熔点为-123.5°C,沸点为20.2°C,蒸气压为440 mmHg(在25°C)。
2.化学性质乙醛具有明显的醇、酮和酸的性质。
其下面是一些典型的化学性质:-氧化性:乙醛能够与氧气作用生成乙酸。
-还原性:乙醛能够被醇或银反应生成对应的氧的化合物。
-加成反应:乙醛可以进行羰基的加成反应,生成羟基化合物。
-氧杂可替代反应:乙醛与氨反应生成乙醯胺。
制备方法:1.乙醛的工业生产通常通过合成气(H2和CO的混合物)的催化氧化得到。
反应方程式为:2CH4+O2->2CH3CHO-合成气由天然气或煤制气中产生,混合比例为3:1,通过催化剂加热至反应温度(约250-300°C)。
-合成气在催化剂的作用下,发生氧化反应生成乙醛。
2.乙醛还可以通过乙醇的脱水反应制备。
反应方程式为:CH3CH2OH->CH3CHO+H2O-乙醇与强酸催化剂如浓硫酸或磷酸进行反应-在高温条件下,乙醇被分解为乙醛和水。
3.光氧化法也是一种制备乙醛的方法。
反应方程式为:2CH4+O2->2CH3CHO-乙烷(C2H6)或丙烷(C3H8)加氧气在紫外光(如太阳光)的作用下,通过自由基反应生成乙醛。
总结:乙醛是一种广泛应用于工业和日常生活中的有机化合物。
其结构由一个碳原子和一个氧原子连接而成,碳原子上有一个甲基基团。
乙醛具有明显的醇、酮和酸的性质,可以进行氧化、还原、加成反应以及氧杂可替代反应。

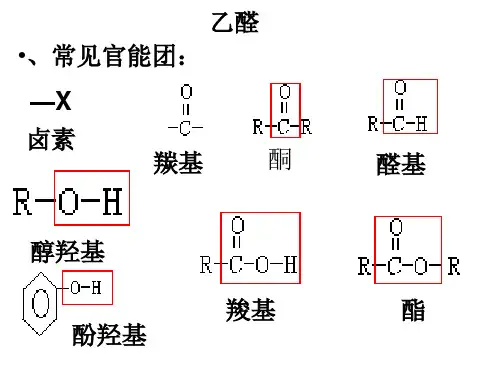

高中化学学习材料唐玲出品高二化学(选修)醛的结构和性质一、乙醛(1)乙醛的结构和物理性质乙醛的分子式:,结构简式:。
是一种无色、具有刺激性气味的液体,密度比水,易,能跟水、乙醇、乙醚、氯仿互溶。
(2)乙醛的化学性质①加成反应:,②氧化反应:a.银镜反应,此反应可用于检验醛基的存在。
[注意]:(1)银氨溶液配制中试剂滴加顺序和溶液的浓度和溶剂的相对用量;(2)有关化学反应的离子方程式:(3)有关现象:(4)反应条件:溶液应为_______性,须在____________中加热;(5)醛基(-CHO)生成物(Ag)有何量的关系?b.与新制的Cu(OH)2反应,此反应也可用于检验醛基的存在。
[注意]: (1)新制Cu(OH)2的配制中试剂滴加顺序,溶液的浓度和试剂相对用量;(2)反应条件:溶液应为___________性,须加热到沸腾(3)有关现象:二、醛类1、饱和一元醛的通式为,重要的醛有甲醛。
2、甲醛:分子式_______结构简式_______相当于有______个醛基常温下为态,易溶于水,俗称福尔马林,具有具有杀毒、防腐能力。
①加成反应:,②氧化反应:a.银镜反应b.与新制的Cu(OH)2反应 ____________三、醛基的氧化性和还原性的比较醛基的氧化性醛基的还原性组成变化加氢加氧结构变化—CHO→—CH2OH —CHO→—COOH反应类型醇、醛、酸相互转化关系:醇醛酸四、练习1、下列物质中,分子里的所有原子肯定不可能在同一平面上的是:( )A、乙炔B、苯甲醛C、异戊二烯D、丙烯醛(CH2=CH-CHO)2、为使区别乙醛、苯和溴苯的方法最简便,试剂最易获得,应选用的试剂是:( )A、新制C u(O H)2悬浊液B、水C、酸性KMnO4溶液D、AgNO3溶液3、某有机物的化学式为C5H10O,它能发生银镜反应和加成反应。
若将它与H2加成,所得产物结构简式可能是:( )A、(CH3)3CCH2OHB、(CH3CH2)2CHOHC、CH3(CH2)3CH2OHD、CH3CH2C(CH3)2OH4、已知柠檬醛的结构简式为:CH3-C(CH3)=CH CH2CH2C(CH3)=CH-CHO,根据已有知识判断下列说法不正确的是:( )A、可使KMnO4溶液褪色B、可与银氨溶液反应生成银镜C、可使溴水褪色D、被催化加氢的最后产物的结构简式为C10H20O5、醛类因易被氧化为羧酸,而易使酸性高锰酸钾溶液或溴水褪色,已知柠檬醛结构(见上题) 试用简便方法,检验柠檬醛分子中含碳碳双键。
课时作业17 乙醛的结构和性质时间:60分钟 分值:100分班级:________ 姓名:________一、选择题(每小题5分,共55分)1.用分液漏斗可以分离的一组液体混合物是( )A .乙醛和水B .苯酚和水C .乙醇和碘水D .苯和水解析:A 、C 溶液均互溶,苯酚和水若是较稀溶液也相互溶解,苯和水不溶,可以利用分液漏斗分离。
答案:D2.下列反应中不属于氧化反应的是( )A .CH 3CHO +2Ag(NH 3)2OH ―→2Ag ↓+CH 3COONH 4+3NH 3+H 2OB .CH 3CHO +2Cu(OH)2――→△CH 3COOH +Cu 2O ↓+2H 2OC .2C 2H 5OH ――→浓H 2SO 4△CH 3CH 2—O —CH 2CH 3+H 2O D .2CH 3CHO +O 2――→催化剂2CH 3COOH解析:A 、B 、D 均是氧化反应,C 是取代反应。
答案:C3.目前用乙烯制乙醛的过程分三步进行:①CH 2=CH 2+PdCl 2+H 2O ―→CH 3CHO +2HCl +Pd ②Pd +2CuCl 2―→PdCl 2+2CuCl ③2CuCl +12O 2+2HCl ―→2CuCl 2+H 2O ,下列叙述中正确的是( )A .CH 2=CH 2是还原剂,PdCl 2是氧化剂B .CuCl 是还原剂,O 2是氧化剂C .乙烯是还原剂,O 2是氧化剂D .PdCl 2和CuCl 2都是催化剂答案:CD4.区别乙醛、苯和溴苯最简单的方法是()A.加入酸性高锰酸钾溶液振荡B.与新制的氢氧化铜溶液共热C.加蒸馏水后振荡D.加硝酸银溶液后振荡解析:利用三者在水中溶解度的不同加以区别,乙醛溶于水,苯不溶于水且密度比水小,故有机层在水的上层,溴苯不溶于水且密度比水大,故有机层在水的下层。
答案:C5.对于乙醛的结构、性质、用途和制法叙述正确的是()①看成是—CH3和—CHO直接相连的化合物②所有原子都在一个平面上③其沸点比氯乙烷高,比乙醇低④易溶于水的原因是分子中含有—CH3⑤具有还原性⑥工业上可大量用于制乙醇⑦工业上通常用乙烯氧化法和乙炔水化法制乙醛A.①②③⑥B.②④⑤⑦C.①③④⑥D.①③⑤⑦解析:乙醛中由于有—CH3存在,一定是空间结构;乙醛易溶于水的原因不是—CH3而是—CHO,实际上烃基是憎水基,不溶于水;乙醛造价比乙醇高,不能用高价原料制低价产品。
答案:D6.在一定条件下,由A 、B两种有机物组成的气态混合物,无论A、B的含量如何变化,完全燃烧10mL这种混合物,消耗O2的量都不改变。
这两种有机物可能是()A.C2H6O C2H4B.C2H4O C2H4C.C2H4O2C2H6D.C2H6O C2H2解析:把有机物写成烃和水或烃和二氧化碳的形式来判断(因为水和二氧化碳不耗氧),简便而快捷。
C2H6O看成C2H4·H2O;C2H4O看成C2H2·H2O;C2H4O2看成CH4·CO2答案:A7.某学生做完实验后,采用以下方法分别清洗所用仪器:①用稀硝酸清洗做过银镜反应的试管;②用酒精清洗做过碘升华的烧杯;③用浓盐酸清洗做过高锰酸钾分解实验的试管;④用盐酸清洗长期存放氯化铁溶液的试剂瓶;⑤用氢氧化钠溶液清洗盛过苯酚的试管。
你认为他的操作()A.②不对B.③④不对C.④⑤不对D.全部正确解析:①稀硝酸可以溶解银镜反应生成的银单质;②碘可以溶在酒精中;③高锰酸钾热分解的残留的不溶物是二氧化锰,但跟浓盐酸反应;④长期存放氯化铁溶液的试剂瓶,可能由于氯化铁水解生成氢氧化铁沉淀,可以利用盐酸洗涤;⑤苯酚微溶于水,但可以和氢氧化钠溶液反应,生成水溶性的苯酚钠。
答案:D8.下列反应中,乙醛作氧化剂的是()A.乙醛与氢气反应B.乙醛与银氨溶液反应C.乙醛与氧气反应D.乙醛与新制的Cu(OH)2反应解析:乙醛与O2、银氨溶液、新制Cu(OH)2等发生氧化反应时作还原剂,乙醛与H2反应时作氧化剂。
答案:A9.由乙炔和乙醛组成的混合气体,经测定其中C元素的质量分数为72%,则混合气体中氧元素的质量分数为()A.32% B.22.65%C.19.56% D.2.14%解析:将乙醛的分子式变形:C2H4O→C2H2·H2O。
故乙炔和乙醛中“C2H2”的质量分数为72%×1312=78%,则混合气体中氧元素的质量分数为:(1-78%)×1618=19.56%。
答案:C10.下列实验能获得成功的是()A.苯与浓溴水反应制溴苯B.在浓溴水中加几滴苯酚观察到白色沉淀C.将乙醛滴入银氨溶液中制银镜D.1mol/L CuSO4溶液2mL和0.5mol/L NaOH溶液4mL混合后加入40%乙醛溶液0.5mL,加热煮沸观察沉淀颜色解析:苯与液溴在FeBr3的催化作用下发生取代反应生成。
答案:B11.在2HCHO+NaOH(浓)―→HCOONa+CH3OH中,HCHO(甲醛)() A.仅被氧化B.未被氧化,未被还原C.仅被还原D.既被氧化,又被还原解析:在有机反应中,有机物去氢或加氧的反应是氧化反应,有机物去氧或加氢的反应是还原反应。
答案:D二、简答题(共45分)12.(12分)某饱和有机物A是中性液体,它能和金属钠反应放出氢气,可以肯定A中有基存在,在铜催化下,A能被氧化成B,B与新制的氢氧化铜加热至沸腾,生成C和红色沉淀D,由此可以证明B分子中含有基,1体积B蒸气完全燃烧需要4倍体积的氧气,则(写结构简式):A_______________,B________________,C______________,D________________。
解析:A是醇,B是醛,由于是饱和有机物,所以B为C n H2n O,耗氧为n+m4-12,由题设关系m=2n,n+m4-12=4,n=3,即可推出此题。
答案:羟;醛;A:CH3CH2CH2OH;B:CH3CH2CHO;C:CH3CH2COOH;D:Cu2O13.(12分)甲、乙两个化学兴趣小组,分别做乙醇催化氧化并验证产物的实验。
甲组实验设计如图1所示,乙组实验设计如图2所示,密闭系统内空气很少。
请填写下列空白:(1)甲组要完成全部实验内容,以下步骤中正确的顺序是________(填序号,步骤可重复)。
①加热②检查装置的气密性③向A中缓缓鼓入干燥的空气④取下D 装置(2)甲、乙两组实验中,给定的A、B、E、H中需要加热的是________(填编号)。
(3)反应开始后,C中观察到的现象是_____________________。
(4)写出F中发生反应的化学方程式_______________________。
解析:(1)气体制备与性质实验,一般按组装仪器,再检验装置的气密性,最后进行制取与检验的顺序进行,故甲组中操作顺序为②①③④①或②③①④①。
(2)CH 3CH 2OH 的催化氧化条件为Cu 加热,对无水乙醇进行汽化制取乙醇蒸气,故A 、B 、E 、H 装置都需要加热。
(3)CH 3CH 2OH 发生氧化的过程中生成水,则CuSO 4粉末变蓝。
(4)生成的CH 3CHO 与银氨溶液在热水浴条件下发生银镜反应:CH 3CHO +2Ag(NH 3)2OH ――→△ CH 3COONH 4+2Ag ↓+3NH 3+H 2O 。
答案:(1)②①③④①(或②③①④①) (2)A 、B 、E 、H(3)CuSO 4粉末变为蓝色 (4)CH 3CHO +2Ag(NH 3)2OH ――→△ CH 3COONH 4+2Ag ↓+3NH 3+H 2O14.(13分)向溴水中加入足量乙醛溶液,可以看到溴水褪色。
对产生此现象的原因有如下三种猜想:①溴水与乙醛发生了取代反应;②溴水与乙醛发生了加成反应;③溴水将乙醛氧化成乙酸。
为探究到底哪一种猜想正确,一研究性学习小组提出了如下两种方案:方案一:检验褪色后溶液的酸碱性。
方案二:测定反应前溴水中Br 2的物质的量和反应后Br -的物质的量。
(1)方案一是否可行?________,理由是________________。
(2)假设测得反应前溴水中Br 2的物质的量为a mol 。
①若测得反应后n (Br -)=________mol ,说明溴水与乙醛发生了取代反应; ②若测得反应后n (Br -)=________mol ,则说明溴水与乙醛发生了加成反应; ③若测得反应后n (Br -)=________mol ,则说明溴水将乙醛氧化成乙酸。
解析:本题以研究性的探究实验为载体,综合考查实验设计、化学计算、氧化还原反应等方面的知识。
①如果溴水与乙醛发生了取代反应,每反应1 mol Br 2,将产生1 mol HBr 。
②如果溴水与乙醛发生了加成反应,将不会有Br -生成。
③如果溴水将乙醛氧化成乙酸,每反应1 mol Br 2将产生2 mol HBr 。
答案:(1)不可行 乙醛的取代反应和氧化反应均有HBr 生成,反应后的溶液均呈酸性(2)a02a15.(8分)某饱和一元醛A的溶液0.88g,与足量的银氨溶液反应后析出4.32g Ag。
求A的分子式,并写出结构简式。
答案:A:C2H4O;CH3CHO。