碱金属原子光谱;电子自旋
- 格式:ppt
- 大小:1.83 MB
- 文档页数:31


第四章:碱金属原子和电子自旋锂、钠、钾、铷、铯、钫化学性质相仿、都是一价、电离电势都比较小,容易被电离,具有金属的一般性质。
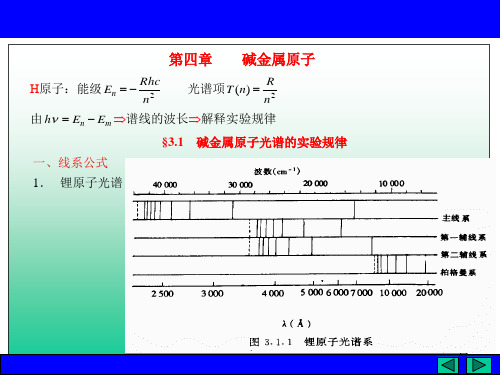
一、碱金属原子的光谱1、四个线系(锂为例):其他碱金属光谱系相仿,只是波长不同主线系:波长范围最广,第一条线是红色的,其余在紫外,系限2299.7埃;第一辅线系(漫线系):在可见部分;第二辅线系(锐线系):第一条线在红外,其余在可见部分;伯格漫线系(基线系):全在红外。
2、巴尔末氢原子光谱规律: ,5,4,3),1-21(1~22===n nR v H λ 碱金属原子光谱:2*∞-~~nR v v n = R 为里德伯常数,当,所以∞v ~是线系限的波数,且有效量子数*n 不是整数,Δ==-*n TR n 3、碱金属原子的光谱项:22*Δ)-(n R n R T == 4、同一线系的有效量子数与主量子数差别不大;与某一量子数对应不同线系的有效量子数差别明显,引进角量子数加以区分:5、每一线系线系限波数恰好是另一线系第二谱项值中最大的那个。
共振线:主线系第一条。
6、碱金属原子氢原子能级的比较n 很大时,碱金属原子能级 很接近氢原子能级;n 较小时,碱金属原子能级 与氢原子能级相差大; 且n 相同,l 不同的能级高低差别很大。
二、原子实极化和轨道贯穿:原子=原子实+价电子1、原子实:碱金属原子中的电子具有规则组合,共同点是在一个完整的结构之外,多余一个电子,这个完整而稳固的结构称为原子实。
由于原子实的存在,发生原子实的极化和轨道在原子实中的贯穿。
2、价电子:原子实外的那个电子称作价电子。
价电子在较大的轨道上运动,与原子实结合不是很强,容易脱离。
它决定元素的化学性质,在较大的轨道上运动。
3、原子实的极化:由于价电子的电场的作用,原子实中带正电的原子核和带负电的电子的中心发生微小相对位移,于是负电的中心不再在原子核上,形成一个电偶极子。
① 角量子数l 小:轨道偏心率大(椭圆),极化强,能量影响大;② 角量子数l 大:轨道偏心率小(接近圆),极化弱,能量影响小。



一、实验目的(1)通过所学的理论知识解释碱金属光谱与氢原子光谱的异同点(2)分析碱金属原子的谱线规律并用实验证明之(3)学会光栅光谱仪的使用方法(及其结构),校准光谱仪并正确测定钠原子光谱(4)由钠原子光谱的波长显示计算光谱项,量子缺和主量子数,学会用里德伯表解决这一复杂问题(5)绘制钠原子能级图及氢原子能级图,并作对比(6)根据钠原子黄双线波长差,估算钠原子实有效电荷数和内部磁场(7)查找相关文献,对本次实验结果进行讨论分析,试图寻找创新点二、实验原理A、钠原子光谱(1)碱金属原子的光谱和氢原子光谱相似,但在能级和谱线系种类方面有所不同(如下表所示)。
我们可以用原子实的极化和轨道贯穿理论很好地解释差别。
注:①为主量子数,为有效量子数,称量子缺、②主要取决于轨道量子数 , 越小,电子轨道的偏心率越大,量子缺也越大。
(2)在(1)表中公式(*)还可写成()()表示(,)跃迁到(,),把作为固定项,记作,固定,()则一系列构成一个光谱线系,用符号表示各线系。
分别用表示。
B、原子实有效电荷数和内部磁场估算(1)由于电子自旋的两种取向(电子磁矩或,为玻尔磁子),钠原子价电子轨道运动产生磁场B与相互作用,产生附加能或即能级发生分裂,两能级间的能量差为,对应于谱线分裂,精细结构,已知可推出原子内部磁场大小B。
(h ,c ,为常量)(2)又谱线双重能级的间隔可用波数差表示,已知n ,l ,即可推出有效电荷数。
(,为常量)三、实验装置WGD-8型组合式多功能光栅光谱仪、钠光谱灯、汞灯、计算机四、实验内容使用光电倍增管接受方式测定钠原子光谱线五、实验步骤①把光栅光谱仪上的接收方式选择开关扳到光电倍增管位置②将光栅光谱仪电源上的负高压置零,然后先接通光谱仪电源,再接通计算机电源③调节光电倍增管电压至500~800V④从计算机程序菜单中选择“WGD--8A”倍增管系统(启动),系统自动初始化⑤用汞的三条谱线校准光谱仪的波长,把汞灯放于入射狭缝处,调入射/出射狭缝宽度0.05mm左右,后打开汞灯⑥选择软件窗口“参数设置”项,设置参数:模式:E 扫描时间:0.025 nm 增益:2 负高压:3最大值:1000 最小值:0 起始波长:200 nm 终止波长:800 nm重复次数:1次⑦选择“单程”,开始扫描。