(完整版)高一化学必修一:离子共存、离子的检验和推断考点汇总(1),推荐文档
- 格式:docx
- 大小:130.09 KB
- 文档页数:8

离子共存与离子推断知识点
离子共存与离子推断,这可真是个奇妙的世界啊!就好像一个复杂而又充满魅力的谜题,等待着我们去揭开它神秘的面纱。
在这个世界里,各种离子相互交织,有的能和谐共处,有的却一见面就“打架”。
你说神奇不神奇?比如说,氢离子和氢氧根离子,那可真是水火不容啊,碰到一起就会发生反应,生成水。
这就好比两个脾气不对付的人,见面就掐!但有些离子呢,却能友好地呆在一起,就像好朋友一样。
离子共存有着严格的条件呢!比如溶液的酸碱性,某些离子在酸性环境中能愉快玩耍,到了碱性环境可能就不行啦。
这多像人换了个环境,有的适应得很好,有的就会水土不服。
再比如离子之间的反应,有些会生成沉淀,有些会产生气体,这些都会影响它们能不能共存。
这就如同生活中的各种规则和限制,决定了我们的行为和选择。
离子推断就更有意思啦!通过一些已知的信息,像侦探一样去推断出未知的离子。
这就像是拼图游戏,每一个线索都是一块拼图,我们要把它们拼凑起来,才能看到完整的画面。
有时候一个小小的实验现象,或者一个数据,都可能是关键的线索呢!难道这还不够让人兴奋吗?
我们来想想,如果没有对离子共存和离子推断的深入理解,那化学世界会变成什么样呢?很多化学反应可能就无法进行准确的分析和解释,就好像失去了方向的船只。
而且,在实际应用中,比如在环境监测、医学检测等领域,离子共存和离子推断可是起着至关重要的作用呢!难道我们不应该好好掌握它们吗?
总之,离子共存与离子推断是化学中非常重要且有趣的部分,它们就像一把钥匙,能打开化学世界的大门,让我们看到其中的精彩和奥秘。
我们要不断探索,不断学习,才能真正领略到它们的魅力啊!。



离子共存及离子检验与推断【学问回顾】1.写出下列离子反应方程式:(1)在氢氧化钙溶液中滴加碳酸钠溶液(2)向氨水中滴加盐酸(3)氧化铜粉末加入稀硫酸(4)铁屑放入硫酸铜溶液2.水污染问题是当前全世界关注的焦点问题。
我们每一个人都应当自觉地爱护水资源,防止污水的任凭排放。
化学试验过程中往往会产生污水,污水中的重金属离子如Cu2+、Ba2+、Ag+对水的污染作用很强。
某次化学试验后,回收的废液中可能含有Cu2+、Ba2+、Ag+。
(1)请你用试验的方法检验该废液中是否含有这些离子,写出你的试验方案及相关反应的离子方程式。
(2)若废液中存在Cu2+、Ba2+、Ag+这三种离子,你认为该废液应当进行怎样的处理后才能够倒掉?写出你设计的废液处理方案及相关反应的离子方程式。
一、离子反应的应用(一)离子共存:同一溶液中若离子间能发生离子反应,则离子之间不能在溶液中大量共存;若离子间不反应,则可以大量共存。
1.“不共存”状况归纳:(1)在溶液中某此离子能相互反应生成难溶性物质时,这些离子就不能大量共存。
如SO42-与Ba2+、Pb2+、Ag+;OH-与Cu2+、Fe3+、Mg2+、Al3+、Zn2+;Ag+与Cl-、Br-、I-、CO32-、SO32-、S2-;Mg2+、Ca2+、Ba2+与CO32-、SO32-、PO43-;S2-与Cu2+、Pb2+等(2)离子间能结合生成难电离的物质时,则这些离子不能大量共存。
如H+与OH-、ClO-、CH3COO-、HPO42-、H2PO4-、F―、S2―OH-与HCO3-、HS-、HSO3-、H2PO4-、HPO42-、H+等不能大量共存。
(3)离子间能结合生成挥发性物质时,则这些离子不能大量共存。
如:H+与CO32-、SO32-、S2-、HCO3-、HSO3-、HS-OH-与NH4+等不能大量共存。
2.附加隐含条件的应用规律:(1)溶液无色透亮常见的有色离子:Cu2+(蓝色)、Fe3+(黄色)、Fe2+(浅绿色)、MnO4-(紫红色)等(2)强碱性溶液不能大量共存的有H+、NH4+、Mg2+、Al3+、Ca2+、Zn2+、Fe3+、Cu2+、Fe2+、Pb2+、Ag+、HCO3-等(3)强酸性溶液不能大量共存的有OH-、HCO3-、HS-、S2-、SO32-、HSO3- 、CO32-、CH3COO-等(二)离子检验与推断:1、常见离子的检验方法依据离子性质不同而在试验中所表现出的现象不同,可把检验离子的方法归纳为三种类型:①生成沉淀;②生成气体;③显现特殊颜色。

2019高考化学总复习02 化学物质及其变化(5)离子共存、离子的检验和推断(1)(含解析)新人教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019高考化学总复习02 化学物质及其变化(5)离子共存、离子的检验和推断(1)(含解析)新人教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019高考化学总复习02 化学物质及其变化(5)离子共存、离子的检验和推断(1)(含解析)新人教版的全部内容。
离子共存、离子的检验和推断李仕才基础巩固1.(2018年安徽省宣城市一中高三二模)下列各组中的离子,因发生氧化还原反应而不能大量共存同一溶液中的是()A.Fe2+、SO错误!、Fe3+、Cl-B.S2-、Cu2+、Na+、Cl-C.H+、SO错误!、Cu2+、OH-D.Fe2+、H+、Mg2+、NO错误!解析:本题考查离子共存问题。
A.该组离子之间不反应,可大量共存,故A不选;B.S2-、Cu2+结合生成沉淀,因复分解反应不能共存,故B不选;C。
H+、Cu2+分别与OH-结合生成水、沉淀,因复分解反应不能共存,故C不选;D.Fe2+、H+、NO错误!发生氧化还原反应,不能共存,故D选。
答案:D2.(2018年江西省九江市二中高三一模)在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )A.Na+、K+、NO-3、Cl-B.Na+、Fe2+、SO2-4、NO-3C.Cu2+、Na+、SO错误!、OH-D.Ba2+、SO2-,3、NO错误!、K+解析:本题考查离子共存问题.A.酸性溶液中该组离子之间不反应,可大量共存,且离子均为无色,故A选;B.酸性溶液中H+、Fe2+、NO-,3发生氧化还原反应不能共存,且Fe2+为浅绿色,与无色不符,故B不选;C.Cu2+为蓝色,与无色不符,Cu2+、OH-结合生成沉淀不能共存,且酸性溶液中不能大量存在OH-,故C不选;D。

高中化学离子共存及除杂一、离子共存知识梳理:(一)判断原理:物质与物质之间若能发生氧化还原反应、复分解反应(常见为酸碱盐的反应)或者络合反应都不能共存。
(二)常见酸和酸根:首先了解高中阶段常见强酸:HCl、HNO3、H2SO4、HBr、HI、HClO4、HIO3其他的大多为弱酸,要特别注意有机酸和酚类大多为弱酸,例如甲酸,乙酸,草酸等。
多元弱酸的酸式盐所对应的阴离子如HCO3-、HSO3-、H2PO4-、HPO42-等这些离子都是与氢离子反应成酸,与碱反应成正盐。
弱酸的酸根:即弱酸的阴离子或对应正盐阴离子如:CO32-、SO32-、PO43-、CH3COO-等都容易与氢离子反应。
(三)氧化还原常见氧化剂强弱顺序:F2>Cl2>Br2>Fe3+>I2>SO2>S 高锰酸钾溶液的酸性越强,氧化性越强。
常见还原性强弱顺序:S2->SO3(2-)>I->Fe2+>Br->Cl->F-常见的氧化剂有:活泼的金属单质,如X2(卤素)、O2、O3、S等高价金属阳离子,如Cu²+,Fe3+等或H+高价过较高价含氧化合物,如MnO2、KMnO4、K2Cr2O7、HNO3、H2SO4(浓)、KClO3、HClO等4过氧化物,如Na2O2、H2O2等常见的还原剂有活泼或较活泼的的金属,如K,Na,Mg,Al,Zn,Fe等低价金属阳离子,如Fe3+,Sn2+等非金属阳离子,如Cl-,B-,I-,S2-等某些非金属单质,如H2,C,Si在含可变化合价的化合物中,具有中间价态元素的物质(单质或化合物)即可作氧化剂,又可做还原剂,例如Cl2,H2O2,Fe2+,H2SO3等既具有氧化性,又具有还原性。
(四)水解能水解的离子:弱酸根离子和不活泼金属的阳离子2.常见双水解反应:Al2+(CO32- HCO3- S2- HS- SO32- SiO32- AlO2- ClO4-)Fe3+(CO32-HCO3-AlO2- SiO32-ClO-)Cu2+(CO32-HCO3AlO2-SiO32-)Al3+Fe3+Fe2+ CO32-HCO3-(四)常见络合反应FeCl3+3KSCN= Fe(SCN)3血红色+3KCl Fe(SCN)3也作为判断三价铁离子存在的标志。

高中化学离子共存知识点总结8篇第1篇示例:高中化学离子共存知识点总结在高中化学学习过程中,离子共存是一个非常重要的知识点,涉及到化学反应的进行和产物的判断。
离子共存是指在溶液中同时存在两种或两种以上的离子。
在实际生活和实验中,离子通常是以离子固体的形式存在,通过溶解可以形成溶液。
1. 离子溶液的电导性离子是带有电荷的粒子,因此溶解在水中形成的离子固体在水中会形成带电的离子溶液。
带电的离子会导致溶液的电导性增加,其中离子的浓度越高,电导性越强。
通过电导实验可以判断离子是共存还是单独存在。
2. 离子溶液的化学反应离子在溶液中会发生各种化学反应,例如酸碱中和反应、氧化还原反应、络合反应等。
不同离子之间的反应会产生不同的化学物质,这些化学物质的性质和溶液中的离子有关。
3. 离子共存的判断在观察一种溶液时,如果存在多种离子,则需要通过化学实验鉴定其中所含的离子种类。
通常使用的方法有析出法、沉淀法、鉴定法等。
通过这些方法可以准确地判断出溶液中所含的离子种类。
4. 常见的离子共存情况常见的离子共存情况有氯离子和硫酸根离子、氯离子和硝酸根离子、氢氧化物离子和硫酸根离子等。
这些共存情况在化学实验和生活中都有一定的应用,需要我们进行仔细的观察和分析。
5. 离子溶液的应用离子共存的知识在化学实验和工业生产中有着广泛的应用。
比如在水处理中,需要判断水中离子的种类和浓度,以确定水质的好坏;在矿产资源开发中,也需要通过分析离子种类来选择合适的提取方法等。
离子共存是化学学习中的一个重要知识点,需要我们掌握好离子的性质、化学反应和鉴定方法,才能更好地进行化学实验和问题解决。
希望以上内容对大家有所帮助,希望大家能够在学习中加深对离子共存知识的理解。
【文章字数已达上限,如需更多知识请继续咨询。
】第2篇示例:高中化学离子共存知识点总结在高中化学学习中,离子共存是一个重要的知识点。
离子是带电的原子或者分子,当两种或两种以上的离子在一起时,就会形成离子共存。

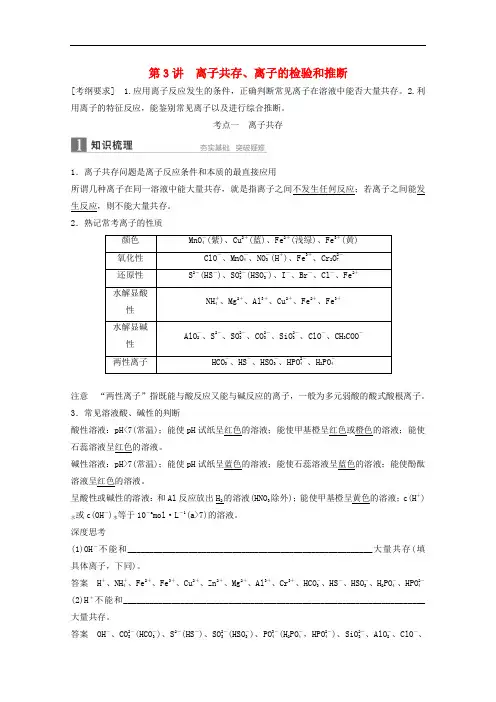
第3讲 离子共存、离子的检验和推断[考纲要求] 1.应用离子反应发生的条件,正确判断常见离子在溶液中能否大量共存。
2.利用离子的特征反应,能鉴别常见离子以及进行综合推断。
考点一 离子共存1.离子共存问题是离子反应条件和本质的最直接应用所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.熟记常考离子的性质颜色 MnO -4(紫)、Cu 2+(蓝)、Fe 2+(浅绿)、Fe 3+(黄)氧化性 ClO -、MnO -4、NO -3(H +)、Fe 3+、Cr 2O 2-7 还原性 S 2-(HS -)、SO 2-3(HSO -3)、I -、Br -、Cl -、Fe 2+水解显酸性 NH +4、Mg 2+、Al 3+、Cu 2+、Fe 2+、Fe 3+水解显碱性 AlO -2、S 2-、SO 2-3、CO 2-3、SiO 2-3、ClO -、CH 3COO -两性离子HCO -3、HS -、HSO -3、HPO 2-4、H 2PO -4注意 “两性离子”指既能与酸反应又能与碱反应的离子,一般为多元弱酸的酸式酸根离子。
3.常见溶液酸、碱性的判断酸性溶液:pH<7(常温);能使pH 试纸呈红色的溶液;能使甲基橙呈红色或橙色的溶液;能使石蕊溶液呈红色的溶液。
碱性溶液:pH>7(常温);能使pH 试纸呈蓝色的溶液;能使石蕊溶液呈蓝色的溶液;能使酚酞溶液呈红色的溶液。
呈酸性或碱性的溶液:和Al 反应放出H 2的溶液(HNO 3除外);能使甲基橙呈黄色的溶液;c(H +)水或c(OH -)水等于10-a mol·L -1(a>7)的溶液。
深度思考(1)OH -不能和________________________________________________________大量共存(填具体离子,下同)。
答案 H +、NH +4、Fe 2+、Fe 3+、Cu 2+、Zn 2+、Mg 2+、Al 3+、Cr 3+、HCO -3、HS -、HSO -3、H 2PO -4、HPO 2-4 (2)H +不能和_____________________________________________________________________大量共存。

离子共存、离子的检验和推断在化学中,离子共存也是很常见的现象。
因此,对离子的检验和推断起着至关重要的作用。
下面我们将深入探讨离子共存、离子的检验和推断的相关知识。
离子共存的原因在实验化学中,离子共存较为常见。
离子在其溶液中相互作用,形成共存体系。
通常,离子共存有以下几个原因:1.离子的化学性质:具有相同化学性质的离子,在同一条件下,会倾向于在同一溶液中存在,形成离子共存体系。
2.溶质溶剂间的相互作用:离子与溶质、溶剂之间的相互作用也会导致离子的共存。
3.实验条件:控制不佳、实验条件差等原因,也可能导致离子的共存。
离子的检验离子检验指的是通过化学方法,检测出样品中是否存在某些特定的离子。
其中,常用的离子检验包括:阳离子1.铵离子:加入Nessler试液,若出现黄色,则存在铵离子。
2.钠离子:加入酸性铁氰化钠试液和苯酚红指示剂,若出现红色,则证明存在钠离子。
3.钙离子:加入硫酸铵试液和草酸试液,若出现白色沉淀,则存在钙离子。
4.铁离子:加入硫氰酸钾试液和苯酚红指示剂,若出现红色,则证明存在铁离子。
阴离子1.氯离子:加入银氨试液,若出现白色沉淀,则存在氯离子。
2.硫酸根离子:加入钡盐试液,若出现白色沉淀,则存在硫酸根离子。
3.硝酸根离子:加入密度较大的硝酸银试液,若出现白色沉淀,则存在硝酸根离子。
4.碳酸根离子:加入盐酸,若产生气体,则证明存在碳酸根离子。
离子推断离子推断指的是通过已知的离子检验结果,推测出未知物质样品中的离子种类和数量。
离子的推断通常按照递推法进行。
确定阳离子1.质量作用定律:根据它和阴离子的相对比例,从几个阳离子中确定一组可能的组合。
2.离子比例法:通过阳离子和阴离子的相对比例,推断出组成物质的阳离子的种类。
3.等电点法:根据相对质量和等电点,选择出可能存在的阳离子组合。
确定阴离子1.除去有机酸根离子、硝酸根离子、碳酸根离子:根据阳离子的推断结果,排除掉已知的有机酸根离子、硝酸根离子、碳酸根离子。

2025年高考化学复习考点突破及考法探究—离子共存、离子的检验与推断(解析版)考点一离子共存知识点1离子共存的实质几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
知识点2离子不能大量共存的原因1.离子之间相互结合生成难溶物质或微溶物。
如Ca2+和C O32−生成CaCO3,H+和Si O32−生成H2SiO3,Cu2+和OH-生成Cu(OH)2等。
阳离子不能大量共存的阴离子Ba2+、Ca2+、Pb2+、Ag+CO2-3、SO2-3、SO2-4、SiO2-3、PO3-4Cu2+、Fe2+OH-、S2-、CO2-3、SiO2-3Mg2+、Zn2+OH-、CO2-3、AlO-2、SiO2-3H+SiO2-3、AlO-22.离子之间相互结合生成气态物质及挥发性物质。
如H+和S2-生成H2S,H+和HC O3-生成CO2等。
离子不能大量共存的离子H+S2O2-3、SO2-3、HSO-3、CO2-3、HCO-3、S2-、HS-OH-NH+43.离子之间相互结合生成弱电解质。
如H与CH3COO、OH、P O43−等分别结合生成弱电解质CH3COOH、H2O、H3PO4等。
4.离子之间彼此促进水解。
①常见的因发生相互促进的水解反应而不能大量共存的离子如下:a.Al3+与CO2-3、HCO-3、S2-、HS-、AlO-2、SiO2-3。
b.Fe3+与CO2-3、HCO-3、AlO-2、SiO2-3。
②NH+4与CH3COO-、CO2-3、HCO-3、S2-等能发生相互促进的水解反应,但反应程度仍较小,能大量共存。
5.离子之间发生氧化还原反应。
如Fe2+、S2-、I-、S O32−分别与N O3-(H+)、ClO-因发生氧化还原反应而不能大量共存;Fe3+与S2-、I-等因发生氧化还原反应而不能大量共存。
氧化性离子还原性离子ClO-、MnO-4(H+)、NO-3(H+)、Fe3+、Cr2O2-7、FeO2-4Fe2+(可与Fe3+共存)、S2-、I-、SO2-3、HS-、HSO-3 6.离子之间能发生络合反应。
第 3 讲离子共存、离子的检验和推断[ 考纲领求 ]1.应用离子反应发生的条件,正确判断常有离子在溶液中可否大量共存。
2.利用离子的特色反应,能鉴别常有离子以及进行综合推断。
考点一离子共存1. 离子共存问题是离子反应条件和本质的最直接应用所谓几种离子在同一溶液中能大量共存, 就是指离子之间不发生任何反应; 若离子之间能发生反应,则不能够大量共存。
2. 熟记常考离子的性质颜色MnO 4-(紫 )、 Cu 2+(蓝 )、 Fe 2+(浅绿 )、 Fe 3+(黄 )氧化性ClO -、 MnO --+3+2-4 、 NO 3 (H )、 Fe 、 Cr 2O 7还原性 S2--2 -- -、 Br --2+(HS ) 、SO 3 (HSO 3 )、 I 、 Cl 、 Fe水解显酸性 NH4+、Mg2+、Al3+、 Cu 2+、Fe 2+、 Fe 3+水解显碱性[来 [Al(OH) -2-2-2-2---源 4] 、 S 、 SO 3 、CO 3 、 SiO 3 、 ClO 、 CH 3COOm]两性离子HCO 3-、 HS -、 HSO 3-注意 “ 两性离子 ” 指既能与酸反应又能与碱反应的离子, 一般为多元弱酸的酸式酸根 离子。
3. 常有溶液酸、碱性的判断酸性溶液: pH<7( 常温 );能使 pH 试纸呈红色的溶液; 能使甲基橙呈红色或橙色的溶液;能使石蕊试液呈红色的溶液。
碱性溶液: pH>7( 常温 );能使 pH 试纸呈蓝色的溶液;能使石蕊试液呈蓝色的溶液;能使酚酞试液呈红色的溶液。
呈酸性或碱性的溶液:和Al 反应放出 H 2 的溶液 (HNO 3 除外 );能使甲基橙呈黄色的溶+)水或 c(OH ---1(a>7)的溶液。
液; c(H )水 等于 10 a mol L ·深度 思 考(1)OH -不能够和 ________________________________________________________ 大量共存 (填详尽离子,下同 )。
第3 讲离子共存、离子的检验和推断[考纲要求] 1.应用离子反应发生的条件,正确判断常见离子在溶液中能否大量共存。
2.利用离子的特征反应,能鉴别常见离子以及进行综合推断。
考点一离子共存1.离子共存问题是离子反应条件和本质的最直接应用所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.熟记常考离子的性质颜色MnO-4 (紫)、Cu2+(蓝)、Fe2+(浅绿)、Fe3+(黄)氧化性ClO-、MnO-4 、NO-3 (H+)、Fe3+、Cr2O2-还原性S2-(HS-)、SO2-(HSO-3 )、I-、Br-、Cl-、Fe2+水解显酸性NH+4 、Mg2+、Al3+、Cu2+、Fe2+、Fe3+水解显碱性[ 来源: ][Al(OH)4]-、S2-、SO2-、CO2-、SiO2-、ClO-、CH3COO-两性离子HCO-3 、HS-、HSO-3离子。
3.常见溶液酸、碱性的判断酸性溶液:pH<7(常温);能使pH 试纸呈红色的溶液;能使甲基橙呈红色或橙色的溶液;能使石蕊试液呈红色的溶液。
碱性溶液:pH>7(常温);能使pH 试纸呈蓝色的溶液;能使石蕊试液呈蓝色的溶液;能使酚酞试液呈红色的溶液。
呈酸性或碱性的溶液:和Al 反应放出H2的溶液(HNO3除外);能使甲基橙呈黄色的溶液;c(H+)水或c(OH-)水等于10-a mol·L-1(a>7)的溶液。
深度思考(1)OH-不能和大量共存(填具体离子,下同)。
答案H+、NH+4 、Fe2+、Fe3+、Cu2+、Zn2+、Mg2+、Al3+、Cr3+、HCO-3 、HS-、HSO-3 (2) H+不能和大量共存。
答案OH-、CO2-(HCO-3 )、S2-(HS-)、SO2-(HSO-3 )、SiO2-、[Al(OH)4]-、ClO-、F-、CH3COO-、NO-2(3)CO 2-不能和大量共存。
答案H+、Mg2+、Ba2+、Ca2+、Fe3+、Al3+、Fe2+、Cu2+(4)SO 2-不能和大量共存。
答案H+、MnO-4 、NO-3 (H+)、Mg2+、Ba2+、Fe3+、Al3+、Fe2+、Cu2+(5)Fe3+不能和大量共存。
]答案OH-、I-、SO2-、ClO-、CO2-(HCO-3 )、S2-(HS-)、[Al(OH)4]-、SCN-(6)Al3+不能和大量共存。
答案OH-、SO2-、ClO-、CO2-(HCO-3 )、S2-(HS-)、[Al(OH)4]-(7)I-不能和大量共存。
答案Fe3+、NO-3 (H+)、MnO-4 、ClO-、Cr2O2-(8)NO-3 (H+)不能和大量共存。
答案CO2-(HCO-3 )、SiO2-、ClO-、CH3COO-、S2-(HS-)、Fe2+、SO2-(HSO -3 )、I-反思归纳判断一些常见离子能否和其他离子大量共存时,一般从以下几个方面考虑:(1)CO 2-考虑生成气体和沉淀;(2)SO 2-考虑生成气体、沉淀和其还原性;(3)Fe3+考虑生成Fe(OH)3、双水解及其氧化性;(4)Al3+考虑生成Al(OH)3、双水解;(5)I-只考虑其还原性;(6)NO-3 (H+)考虑酸性及NO -3 在酸性条件下的强氧化性。
题组一无限制条件的离子大量共存的判断1.在水溶液中能大量共存的一组离子是( )A.HCO-3 、H+、NO-3 、Na+B.Na+、Cu2+、OH-、SO2-C.Mg2+、H+、[Al(OH)4]-、SO2-D.NH+4 、K+、Br-、NO-3答案D解析 A 项,H+与HCO -3 反应;B 项,Cu2+与OH-反应;C 项,H+与[Al(OH)4]-反应。
2.在水溶液中能大量共存的一组是( )A.Ba2+、Na+、SO2-、Cl-B.MnO-4 、SO2-、H+、K+C.[Al(OH)4]-、Mg2+、K+、HCO-3D.K+、Na+、NO-3 、SO2-答案D解析 A 项,Ba2+与SO 2-反应;B 项,MnO-4 、H+、SO 2-发生氧化还原反应;C 项,[Al(OH)4]-存在于强碱溶液中,Mg2+、HCO -3 不能存在。
题组二题干中有限制条件的离子大量共存的判断3.将足量的SO2通入下列各溶液中,所含离子还能大量共存的是( )A.K+、SiO2-、Cl-、NO-3B.H+、NH+4 、Al3+、SO2-C.Na+、Cl-、MnO-4 、SO2-D.Na+、CO2-、CH3COO-、HCO-3答案B解析 A 中SiO 2-能与SO2反应;C 中MnO -4 能与SO2发生氧化还原反应;D 中CO 2-、CHCOO-、HCO -3 均能与SO2反应。
34.在酸性溶液中,下列各组离子能大量共存且溶液为无色透明的是( )A.Na+、K+、OH-、Cl-B.Na+、Cu2+、SO2-、NO-3C.Mg2+、Na+、SO2-、Cl-D.K+、Na+、NO-3 、CO2-答案C解析A 项,H+与OH-反应;B 项,Cu2+有颜色;D 项,H+与CO 2-反应。
题组三选项中有限制条件的离子大量共存的判断5.下列各组离子在指定的溶液中,能大量共存的打“√”,不能大量共存的打“×”(1)含有大量Fe3+的溶液:Na+、SCN-、Cl-、I-( )(2)含有大量NO -3 的溶液:H+、Fe2+、Cl-、SO2-( )(3)常温下,pH=12 的溶液:K+、Cl-、SO2-( )(4)c(H+)=0.1 mol·L-1 的溶液:Na+、NH+4 、SO2-、S2O2-( )(5)使pH 试纸显蓝色的溶液:Cu2+、NO-3 、Fe3+、SO2-() (6)与铝粉反应放出H2的无色溶液:NO-3 、Al3+、Na+、SO2-( )(7)使红色石蕊试纸变蓝的溶液:SO2-、CO2-、Na+、K+( )c(H+)(8)常温下c(OH-)=1×10-12 的溶液:K+、[Al(OH)4]-、CO2-、Na+( )(9)中性溶液:Fe3+、Al3+、NO-3 、SO2-( )(10)使甲基橙变红色的溶液:Mg2+、K+、SO2-、SO2-( )(11)c(H+)水=10-12 mol·L-1 的溶液:Na+、K+、CO2-、SO2-() (12)使酚酞变红色的溶液:Na+、Cu2+、Fe2+、NO-3 ( )(13)0.1 mol·L-1 的Na2CO3溶液:Al3+、SO2-、Cl-、K+( )答案(1)× (2)× (3)√ (4)× (5)×(6)×(7)√ (8)√ (9)× (10)× (11)× (12)×(13)×反思归纳警惕题干中的常见“陷阱”考点二离子的检验和推断1.常见离子的检验方法根据离子性质不同而在实验中所表现出的现象不同,可把检验离子的方法归纳为三种类型:①生成沉淀;②生成气体;③显现特殊颜色。
和氯水氯水后变血红色溶液,无变化,再加氯水Fe3+KSCN 溶液血红色苯酚溶液紫色Na+、K+Pt(Fe)丝和稀盐酸火焰分别呈黄色、紫色K+要透过蓝色钴玻璃片观察焰色常见的溶液中有颜色的离子有MnO-4 ——呈紫色,Cu2+——呈蓝色,Fe2+——呈浅绿色,Fe3+——呈黄色。
沉淀的颜色:Cu(OH)2——蓝色沉淀,Fe(OH)3——红褐色沉淀。
解题时特别注意题干条件是“无色透明”还是“澄清透明”。
深度思考1.向某溶液中加入BaCl2溶液,有白色沉淀生成,再加入稀盐酸,沉淀不消失,能否判断溶液中存在SO2-4?答案不能,若溶液中存在Ag+,也有相同的现象发生。
2.向某溶液中加入Ca(OH)2溶液,有白色沉淀生成,能否判断溶液中一定存在CO2-?答案不能,若溶液中存在SO2-、HCO-3 ,也有相同的现象。
3.向某溶液中滴入稀盐酸,产生能使澄清石灰水变浑浊的气体,能否判断溶液中一定存在CO2-?答案不能,若溶液中存在HCO-3 、SO2-、HSO-3 ,也有相同的现象。
4.向某溶液中滴入BaCl2溶液,产生白色沉淀,再加入稀HNO3,白色沉淀不溶解,能否确定溶液中一定存在SO2-?答案不能,若溶液中存在SO 2-或Ag+,也有相同现象。
5.向某溶液中加入稀NaOH 溶液,把湿润无色酚酞试纸放在试管口,试纸不变红,则溶液中一定不存在NH+4 ,该判断是否正确?为什么?答案判断错误,检验NH +4 时,应加入浓NaOH 溶液,并加热,且用湿润的红色石蕊试纸。
6.向某溶液中滴加氯水,再加入KSCN 溶液,溶液变血红色,则溶液中一定存在Fe2+,该判断是否正确?为什么?答案判断错误,检验Fe2+时,应先加KSCN,再加氯水,否则,Fe3+干扰结果的判断。
7.做某溶液的焰色反应实验,火焰呈黄色,则溶液中一定存在钠元素,不存在钾元素,该判断是否正确?为什么?答案判断错误,钾的焰色反应必须透过蓝色钴玻璃片才能观察到。
题组一排除干扰,确定离子1.关于某无色溶液中所含离子的鉴别,下列判断正确的是( )A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在B.通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在C.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时,可确定有SO2-存在D.加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO 2-存在答案B解析Cl-、SO 2-均能与Ag+形成不溶于稀盐酸的白色沉淀,A 错;I2遇淀粉变蓝,通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,则溶液中有I-存在,B 对;SO 2-与Ba(NO)2反应形成BaSO3沉淀,加入稀盐酸后在H+、NO -3 的作用下可转化为3BaSO4沉淀,C 错;能使澄清石灰水变浑浊的CO2-、HCO-3 、SO 2-或HSO-3 ,D 错。
2.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )解析本题主要考查常见离子的鉴别,意在考查学生的实验能力。
A 项加入BaCl2溶液得到白色沉淀,原溶液中可能含有SO 2-或SO 2-或Ag+;B 项溶于CCl4呈紫色的为I2,即原溶液中含有I-;C 项观察K+的焰色反应应透过蓝色钴玻璃,排除Na+的干扰;D 项检验NH +4 应加入浓NaOH 溶液,且需要加热。
反思归纳无色溶液中离子检验的一般思路气体是CO2或SO2,原溶液中可能存在的离子是“”“”At the end, Xiao Bian gives you a passage. Minand once said, "people who learn to learn are very happy people.". In every wonderful life, learning is an eternal theme. As a professional clerical and teaching position, I understand the importance of continuous learning, "life is diligent, nothing can be gained", only continuous learning can achieve better self. Only by constantly learning and mastering the latest relevant knowledge, can employees from all walks of life keep up with the pace of enterprise development and innovate to meet the needs of the market. This document is also edited by my studio professionals, there may be errors in the document, if there are errors, please correct, thank you!。