分子轨道理论
- 格式:ppt
- 大小:2.15 MB
- 文档页数:44


分子轨道理
分子轨道(Molecular Orbital, MO)理论是描述分子电子结构的重要理论之一,它不仅可以用来解释分子性质,还能预测分子的化学反应。
分子轨道理论最早由德国化学家恩斯特·洪德(Ernst Hückel)和罗伯特·穆勒(Robert Mulliken)提出,它是从分子的原
子轨道出发,通过其线性组合得到的分子轨道来描述分子电子云的。
分子轨道理论的基本假设是:分子中的每一个电子都能够占据一个空间中的分子轨道,这个分子轨道可以由两个或多个原子的原子轨道以一定比例线性叠加得到。
根据叠加方式的不同,分子轨道可分为成键分子轨道(Bonding Molecular Orbital, BMO)和反键分子轨道(Anti-Bonding Molecular Orbital, ABMO)两种
类型。
成键分子轨道是由原子轨道同相叠加得到的,与成键但未叠加的原子轨道相比,成键分子轨道的电子密度在原子间区域增加,使原子间的距离缩短,因此能够形成共价键。
反键分子轨道则是由原子轨道异相叠加得到的,电子密度在原子间区域减小,反应了电子数目的减少,导致原子间的距离拉长,从而阻碍了化学键的形成。
分子轨道理论还可以用于解释和预测分子的光谱性质,如吸收光谱、紫外-可见光谱和荧光光谱等。
分子轨道理论可以通过
构建分子轨道的线性组合来预测光谱峰位和强度,从而推断分子的结构和构象。
此外,分子轨道还可以用于模拟并预测分子的反应性质,如电荷传递、电子转移和原子转移等反应。
总之,分子轨道理论是化学中非常重要的理论之一,它为我们理解分子结构、性质和反应提供了重要的工具和方法。

电子结构与分子轨道理论电子结构与分子轨道理论是化学领域中的重要概念,用于描述和解释原子、分子的性质和反应行为。
本文将介绍电子结构和分子轨道理论的基本原理,并探讨其在化学研究中的应用。
一、电子结构理论电子结构理论是描述原子中电子在不同能级上分布的理论框架,主要包括量子力学、波动力学等概念。
根据电子结构理论,原子中的电子分布在不同的能级上,每个能级可以容纳一定数量的电子。
电子的能级由量子数来描述,包括主量子数、角量子数、磁量子数和自旋量子数。
在电子结构理论中,著名的斯莱特规则可以用来确定电子分布的次序。
斯莱特规则认为,电子会先填充低能级的轨道,再填充高能级的轨道,且每个能级上的轨道容量是有限的。
这些规则为解释元素周期表的排列提供了关键线索。
二、分子轨道理论分子轨道理论是描述分子中电子分布的理论模型。
根据这一理论,分子中的原子轨道叠加形成了分子轨道,其中电子的运动不再局限于单个原子核,而是分布在整个分子空间中。
分子轨道理论主要基于线性组合原理,即将单个原子轨道组合成分子轨道,从而形成不同的能级。
分子轨道可以分为成键轨道和反键轨道,其中成键轨道是电子双占的轨道,反键轨道则是未被电子占据的轨道。
根据分子轨道理论,我们可以解释分子的稳定性和反应性质。
成键轨道的形成使得分子变得稳定,而反键轨道的存在则会影响分子的反应性能。
通过分子轨道理论,我们可以预测分子的形状、电子的分布等重要性质。
三、电子结构与分子轨道理论的应用电子结构与分子轨道理论在化学研究中有广泛的应用。
首先,它可以解释和预测原子和分子的光谱性质。
根据电子的能级分布和跃迁规则,我们可以解释物质在不同波长下的吸收和发射行为。
其次,电子结构与分子轨道理论在描述和设计催化剂、药物等化学物质时也起到了重要作用。
理解分子轨道的能级分布和电子云密度分布可以帮助我们设计具有特定活性和选择性的催化剂,或者优化药物分子的生物活性。
此外,电子结构与分子轨道理论还在材料科学中发挥着重要作用。
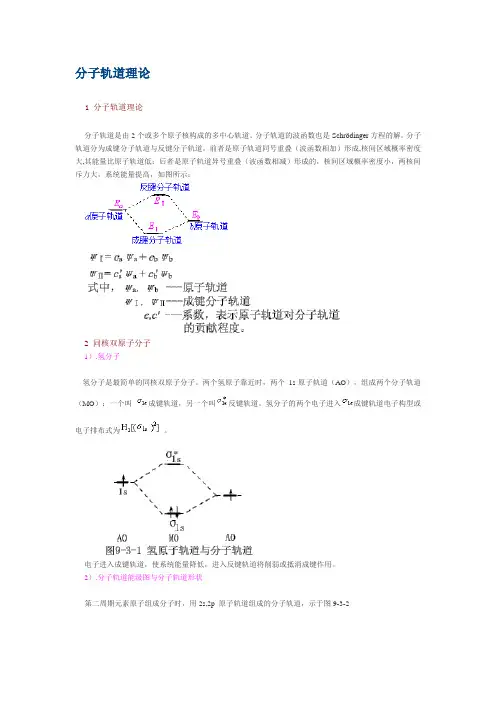
分子轨道理论1 分子轨道理论分子轨道是由2个或多个原子核构成的多中心轨道。
分子轨道的波函数也是Schrödinger方程的解。
分子轨道分为成键分子轨道与反键分子轨道,前者是原子轨道同号重叠(波函数相加)形成,核间区域概率密度大,其能量比原子轨道低;后者是原子轨道异号重叠(波函数相减)形成的,核间区域概率密度小,两核间斥力大,系统能量提高,如图所示:2 同核双原子分子1).氢分子氢分子是最简单的同核双原子分子。
两个氢原子靠近时,两个1s原子轨道(AO),组成两个分子轨道(MO):一个叫成键轨道,另一个叫反键轨道。
氢分子的两个电子进入成键轨道电子构型或电子排布式为。
电子进入成键轨道,使系统能量降低,进入反键轨道将削弱或抵消成键作用。
2).分子轨道能级图与分子轨道形状第二周期元素原子组成分子时,用2s,2p 原子轨道组成的分子轨道,示于图9-3-2由图可见,分子轨道的数目等于用于组合原子轨道数目。
两个2s原子轨道组成两个分子轨道和,6个2p原子轨道组成6个分子轨道,其中两个是σ分子轨道(和)4个是π分子轨道(两个和两个)。
相应的原子轨道及分子轨道的形状如图下所示。
由图可见:●成键轨道中核间的概率密度大,而在反键轨道中,则核间的概率密度小。
●一对2p z 原子轨道以“头碰头”方式组合形成分子轨道,时,电子沿核间联线方向的周围集中;一对2p x(2p y)原子轨道以“肩并肩”方式组合形成分子轨道,时,电子分布在核间垂直联线的方向上。
3).氧分子O2共有16个电子,O2的电子构型:O2分子有两个自旋方式相同的未成对电子,这一事实成功地解释了O2的顺磁性。
O2中对成键有贡献的是(σ2p)2和(π2p)4这3 对电子,即是一个σ键和两个π键。
O2的两个π键是三电子π键,反键轨道中的一个电子削弱了键的强度,一个三电子π键相当于半个键,故O2的叁键实际上与双键差不多。
4).氮分子N2的分子轨道能级图与O2比较,只是在和的相互位置有区别。

分子轨道理论及基态与激发态分子轨道理论基本概念一、分子轨道:(molecular orbital) 描述分子中电子运动的波函数,指具有特定能量的某电子在相互键合的两个或多个原子核附近空间出现的概率最大的区域。
分子轨道由原子轨道线性组合而成。
二、成键三原则:能量相近、最大重叠、对称性匹配。
只有对称性相同的两个原子轨道才能组成分子轨道。
σ对称:一个原子轨道,取X轴作为对称轴,旋转180°,轨道符号不变。
如S,Px,d x2-y2为σ对称。
π对称:一个原子轨道,取X轴作为对称轴,旋转180°,轨道符号改变。
Py,Pz,d xy是π对称。
由σ对称的原子轨道组成的键——σ键由π对称的原子轨道组成的键——π键三、成键轨道与反键轨道分子轨道与原子轨道的联系:轨道守恒——2个原子轨道线性组合,产生2个分子轨道;能量守恒——2个分子轨道的总能量等于2个原子轨道的总能量;能量变化——每个分子轨道的能量不同于原子轨道的能量组合结果—定会出现能量高低不同的两个分子轨道。
——这是原子轨道线性组合的方式不同所致。
波函数同号的原子轨道相重叠,原子核间的电子云密度增大,形成的分子轨道的能量比各原子轨道能量都低,成为成键分子轨道。
波函数异号的原子轨道相重叠,原子核间的电子云密度减小,形成的分子轨道的能量比各原子轨道能量都高,成为反键分子轨道。
四、电子填入分子轨道时服从以下原则:1、能量最低原理:电子在原子或分子中将优先占据能量最低的轨道。
2、保利不相容原理:在同一原子或分子中、同一轨道上只能有两个电子,且自旋方向必须相反。
3、洪特规则:在能量相同的轨道中(简并轨道),电子将以自旋平行的方式、分占尽可能多的轨道基态与激发态当分子中的所有电子都遵从构造原理的这三个原则时,分子所处的最低能量状态——基态。
通常情况下,分子处于基态。
激发态:当分子获取能量后,分子中的电子排布不完全遵从构造原理,分子处于能量较高的状态——激发态,是原子或分子吸收一定的能量后,电子被激发到较高能级但尚未电离的状态。

分子轨道理论简介文章来源:/newsite/Web%20Page/GeneralChem/kechengneirong/09/9-4-1.htm价键理论着眼于成键原子间最外层轨道中未成对的电子在形成化学键时的贡献,能成功地解释了共价分子的空间构型,因而得到了广泛的应用。
但如能考虑成键原子的内层电子在成键时贡献,显然更符合成键的实际情况。
1932年,美国化学家Mulliken RS和德国化学家Hund F 提出了一种新的共价键理论——分子轨道理论(molecular orbital theory),即MO法。
该理论注意了分子的整体性,因此较好地说明了多原子分子的结构。
目前,该理论在现代共价键理论中占有很重要的地位分子轨道理论的要点1.原子在形成分子时,所有电子都有贡献,分子中的电子不再从属于某个原子,而是在整个分子空间范围内运动。
在分子中电子的空间运动状态可用相应的分子轨道波函数ψ(称为分子轨道)来描述。
分子轨道和原子轨道的主要区别在于:(1)在原子中,电子的运动只受1个原子核的作用,原子轨道是单核系统;而在分子中,电子则在所有原子核势场作用下运动,分子轨道是多核系统。
(2)原子轨道的名称用s、p、d…符号表示,而分子轨道的名称则相应地用σ、π、δ…符号表示。
2.分子轨道可以由分子中原子轨道波函数的线性组合(linear combination of atomic orbitals,LCAO)而得到。
几个原子轨道可组合成几个分子轨道,其中有一半分子轨道分别由正负符号相同的两个原子轨道叠加而成,两核间电子的概率密度增大,其能量较原来的原子轨道能量低,有利于成键,称为成键分子轨道(bonding molecular orbital),如σ、π轨道;另一半分子轨道分别由正负符号不同的两个原子轨道叠加而成,两核间电子的概率密度很小,其能量较原来的原子轨道能量高,不利于成键,称为反键分子轨道(antibonding molecular orbital),如σ*、π*轨道。

什么是分子轨道理论
分子轨道理论(Molecular Orbital Theory,简称MO理论)是1932年由美国化学家马利肯(R.S.Mulliken)及德国物理学家洪特(F.Hund)提出的一种描述多原子分子中电子所处状态的方法。
该理论认为原子形成分子后,电子不再属于个别的原子轨道,而是属于整个分子的分子轨道,分子轨道是多中心的。
分子轨道由原子轨道组合而成,形成分子轨道时遵从能量近似原则、对称性一致(匹配)原则、最大重叠原则,即通常说的“成键三原则”。
在分子中电子填充分子轨道的原则也服从能量最低原理、泡利不相容原理和洪特规则。
以上信息仅供参考,建议查阅化学专业书籍文献或咨询化学专业人士获取更全面更准确的信息。

分子轨道理分子轨道是描述分子中电子运动状态的波函数。
主要有4种类型的分子轨道:σ轨道、π轨道、非键轨道和反键轨道。
这些轨道的形状和能量级别决定了分子中电子的排布和化学性质。
下面将详细介绍这几种分子轨道的特征和相关理论。
首先是σ轨道。
σ轨道是分子中电子云最密集的轨道,具有球对称的形状。
它沿着化学键的轴向分布,所以也被称为轴向轨道。
σ轨道可以由两个原子轨道叠加而成,每个原子提供一个电子。
根据平面对称性的不同,σ轨道可以分为σ-s和σ-p轨道,前者为电子密度在分子中心沿轴向对称的轨道,后者为电子密度在分子平面中的两个方向上对称的轨道。
σ轨道主要参与形成化学键,是稳定的分子轨道。
接下来是π轨道。
π轨道具有两个相互垂直的环面,分别在化学键的上、下两侧。
与σ轨道不同,π轨道是运动在较大空间范围内的,所以也被称为侧向轨道。
π轨道可以由两个平行的原子轨道叠加而成,每个原子提供一个电子。
根据能级的不同,π轨道可以细分为π-s和π-p轨道,两者的电子密度在平面内的分布形式不同。
π轨道在化学键的形成中起到重要作用,决定了分子的共轭结构和反应性质。
非键轨道是分子中存在于原子之间的轨道。
它们是离域的电子轨道,不通过化学键与特定原子相关联。
非键轨道的能量相对较高,电子密度较低。
由于非键轨道的存在,分子可以吸收外部能量激发电子至非键轨道,从而进行各种光化学和电化学反应。
反键轨道与化学键中的σ和π轨道相对应,具有相同的空间分布形式,但电子的运动方向相反。
反键轨道的能级相对较高,电子密度较低。
它们主要参与分子中电子的排斥和共振现象,以及反应中的电荷转移。
分子轨道理论是通过量子力学的计算方法和原理来描述分子中电子的分布和运动状态,为解释分子光谱和化学反应提供了依据。
根据分子轨道理论,可以计算分子轨道的能级、形状和电子密度,并预测分子的化学性质。
分子轨道理论的成功应用包括描述分子的电子结构、解释分子间相互作用、预测分子的稳定性和反应性,以及设计新的功能分子。


分子轨道理论求键级
分子轨道理论是一种用来描述分子结构和性质的理论,它是基于量子力学的原理,可以用来计算分子的能量、结构和性质。
分子轨道理论可以用来求解分子的键级,即分子中原子之间的键的强度。
键级是指原子之间的键的强度,它可以用来衡量分子的稳定性。
分子轨道理论可以用来计算分子的键级,它可以用来描述分子中原子之间的键的强度。
分子轨道理论的基本原理是,分子中的原子可以用轨道来描述,每个原子的轨道都是由一系列的数学方程来描述的。
这些方程可以用来计算分子中原子之间的键的强度。
分子轨道理论可以用来计算分子的键级,它可以用来描述分子中原子之间的键的强度。
分子轨道理论可以用来计算分子的能量、结构和性质,它可以用来求解分子的键级,从而可以衡量分子的稳定性。
因此,分子轨道理论是一种有效的方法,可以用来求解分子的键级,从而可以衡量分子的稳定性。
它可以用来计算分子的能量、结构和性质,从而可以更好地理解分子的结构和性质。

分子轨道理论的基本概念分子轨道理论是描述分子内电子结构的理论框架,它是理解分子化学和化学反应的重要工具。
在分子轨道理论中,分子中的电子被认为存在于由原子核构成的分子轨道中,这些分子轨道是原子轨道的线性组合。
通过分子轨道理论,我们可以更好地理解分子的稳定性、反应性以及光谱性质。
本文将介绍分子轨道理论的基本概念,包括分子轨道的构成、分子轨道的类型以及分子轨道的能级顺序等内容。
1. 分子轨道的构成在分子轨道理论中,分子轨道是由原子轨道线性组合而成的。
原子轨道可以是原子的1s、2s、2p等轨道,它们在形成分子时会相互叠加、重叠并形成新的分子轨道。
分子轨道的构成可以通过线性组合原子轨道(Linear Combination of Atomic Orbitals,LCAO)方法来描述。
在LCAO方法中,原子轨道的波函数被线性组合,从而形成分子轨道的波函数。
通过适当的线性组合系数,可以得到不同类型的分子轨道,如σ轨道、π轨道等。
2. 分子轨道的类型根据分子轨道的对称性和能量特征,可以将分子轨道分为不同类型。
其中,σ轨道是沿着两原子核之间轴向的对称轨道,具有较高的电子密度;π轨道则是垂直于两原子核之间轴向的对称轨道,电子密度主要集中在两原子核之间的区域。
此外,还有δ轨道、φ轨道等其他类型的分子轨道,它们在不同的分子结构中扮演着重要的角色。
这些不同类型的分子轨道在分子的形成和反应中起着至关重要的作用。
3. 分子轨道的能级顺序分子轨道的能级顺序是指不同类型的分子轨道在能量上的排布顺序。
一般来说,σ轨道的能量较低,π轨道的能量次之,而δ轨道、φ轨道等能级较高。
这种能级顺序的排布对于分子的稳定性和反应性具有重要影响。
例如,在烯烃分子中,π轨道的能级较低,因此烯烃具有较高的反应活性;而在芳香烃中,芳香环中的π轨道形成了稳定的共轭体系,使得芳香烃具有较高的稳定性。
4. 分子轨道的叠加和排斥在分子轨道理论中,分子轨道之间存在叠加和排斥的相互作用。
分子轨道理
分子轨道理论是一种解释分子化学性质的理论,主要应用于复杂化学物质的计算和设计。
该理论结合量子力学和分子对称性理论,通过对分子中原子轨道的组合和相互作用的分析,得出分子轨道能级和电子分布,进而预测分子性质及其反应活性。
其主要内容包括:
1. 原理:分子轨道理论的核心原理是“波函数线性组合原理”,即分子轨道是由原子轨道按照一定的线性组合方式组成的。
线性组合系数称为“分子轨道系数”。
2. 能级:分子轨道能级是由原子轨道相互作用而形成的,其数目等于参与组合的原子轨道数目。
能级顺序和大小与分子轨道系数及原子轨道能级之间的相互作用有关。
3. 分子轨道类型:根据分子轨道能级和分子轨道系数的不同,分子轨道可分为sigma(σ)轨道、pi(π)轨道、delta(δ)轨道等。
4. 分子轨道的对称性:分子对称性对分子轨道的能级和分子性质有很大影响。
相同对称性的原子轨道组合会形成对称性相同的分子轨道。
5. MO图解:MO图是分子轨道理论的重要表述方式,用于描述分子中电子的能级和分布情况。
其结构为横坐标为分子轨道能级,纵坐标为分子轨道系数的坐标轴。
6. 应用:分子轨道理论可应用于物理、化学、生物等领域,如
化学反应机理、分子光谱学、药物设计等。
7. 限制和局限:分子轨道理论适用于与原子轨道相似的分子,但对于复杂分子和高能态的描述有一定局限性。