第7章 自洽场分子轨道理论简介概论
- 格式:ppt
- 大小:286.50 KB
- 文档页数:8

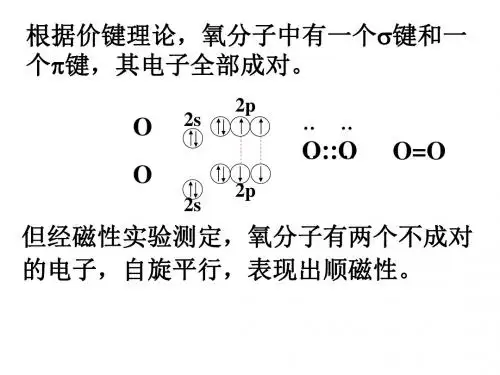



分子轨道理论简介一种化学键理论,是原子轨道理论对分子的自然推广。
其基本观点是:物理上存在单个电子的自身行为,只受分子中的原子核和其他电子平均场的作用,以及泡利不相容原理的制约;数学上则企图将难解的多电子运动方程简化为单电子方程处理。
因此,分子轨道理论是一种以单电子近似为基础的化学键理论。
描写单电子行为的波函数称轨道(或轨函),所对应的单电子能量称能级。
对于任何分子,如果求得了它的系列分子轨道和能级,就可以像讨论原子结构那样讨论分子结构,并联系到分子性质的系统解释。
有时,即便根据用粗糙的计算方案所得到的部分近似分子轨道和能级,也能分析出很有用处的定性结果。
理论⒈原子在形成分子时,所有电子都有贡献,分子中的电子不再从属于某个原子,而是在整个分子空间范围内运动。
在分子中电子的空间运动状态可用相应的分子轨道波函数ψ(称为分子轨道)来描述。
分子轨道和原子轨道的主要区别在于:⑴在原子中,电子的运动只受1个原子核的作用,原子轨道是单核系统;而在分子中,电子则在所有原子核势场作用下运动,分子轨道是多核系统。
分子轨道理论⑵原子轨道的名称用s、p、d…符号表示,而分子轨道的名称则相应地用σ、π、δ…符号表示。
⒉分子轨道可以由分子中原子轨道波函数的线性组合(linearcombinationofatomicorbitals,LCAO)而得到。
有几个原子轨道就可以可组合成几个分子轨道,其中有一部分分子轨道分别由对称性匹配的两个原子轨道叠加而成,两核间电子的概率密度增大,其能量较原来的原子轨道能量低,有利于成键,称为成键分子轨道(bondingmolecularorbital),如σ、π轨道(轴对称轨道);同时这些对称性匹配的两个原子轨道也会相减形成另一种分子轨道,结果是两核间电子的概率密度很小,其能量较原来的原子轨道能量高,不利于成键,称为反键分子轨道(antibondingmolecularorbital),如σ*、π*轨道(镜面对称轨道,反键轨道的符号上常加"*"以与成键轨道区别)。

分子轨道理论1. 引言分子轨道理论是化学中的一种重要理论,它用量子力学的原理解释了分子的电子结构和化学性质。
本文将介绍分子轨道理论的基本概念、应用以及相关的计算方法。
2. 基本概念2.1 原子轨道在分子轨道理论中,首先要了解的是原子轨道。
原子轨道是描述单个原子中电子运动的波函数。
根据量子力学的原理,一个原子可以存在多个不同的原子轨道,每个原子轨道都对应着不同的能量状态。
2.2 分子轨道当两个或更多个原子靠近形成化学键时,原子轨道会互相重叠,形成新的分子轨道。
分子轨道描述的是电子在整个分子中的运动状态。
根据分子轨道理论,分子轨道可以分为两类:成键分子轨道和反键分子轨道。
成键分子轨道对应着电子的主要分布区域,而反键分子轨道则对应着电子分布相对较少的区域。
2.3 分子轨道能级分子轨道能级与原子轨道能级类似,分子轨道的能量随着轨道的能级增加而增加。
有时,分子轨道能级之间会有一定的能隙,这种能隙反映了分子稳定性的特征。
3. 分子轨道的应用分子轨道理论可以解释大量的化学现象和性质,下面列举了几个常见的应用:3.1 化学键的形成分子轨道理论提供了解释化学键产生的机制。
当两个原子靠近并形成化学键时,原子轨道会发生线性组合形成分子轨道。
通过分子轨道理论,我们可以理解不同类型的化学键(如共价键、离子键和金属键)是如何形成的以及其性质的差异。
3.2 分子轨道的能级顺序分子轨道理论还可以预测分子轨道的能级顺序,从而解释分子的化学性质。
能级较低的分子轨道通常具有较高的稳定性,从而决定了分子的化学反应性质。
3.3 分子光谱在分子光谱中,分子轨道理论被广泛应用。
分子轨道理论可以解释分子在吸收或发射光的过程中所发生的能级跃迁,从而解释不同光信号的产生和分子结构的变化。
4. 分子轨道的计算方法4.1 原子轨道模型著名的原子轨道计算方法包括Hartree-Fock方法和密度泛函理论。
这些方法通过求解原子的薛定谔方程,得到原子轨道及其能量。




分子轨道理论的基本概念分子轨道理论是描述分子内电子结构的理论框架,它是理解分子化学性质和反应机理的重要工具。
在分子轨道理论中,分子中的电子被认为存在于由原子核构成的分子轨道中,这些分子轨道是原子轨道的线性组合。
通过分子轨道理论,我们可以更好地理解分子的几何构型、键合性质以及光谱性质等。
本文将介绍分子轨道理论的基本概念,包括分子轨道的形成、分子轨道的种类以及分子轨道的能级结构等内容。
1. 分子轨道的形成在分子轨道理论中,分子轨道是由原子轨道线性组合而成的。
原子轨道的线性组合可以形成成键轨道、反键轨道和非键轨道。
成键轨道是电子密度较高的轨道,对应于化学键的形成;反键轨道是电子密度较低的轨道,对应于化学键的解离;非键轨道则是与化学键无关的轨道。
通过原子轨道的线性组合,可以得到分子轨道的波函数,从而描述分子中电子的运动状态。
2. 分子轨道的种类根据分子轨道的对称性质,可以将分子轨道分为成键轨道和反键轨道。
成键轨道是对称性较高的轨道,电子密度主要集中在分子轴附近,有利于化学键的形成;反键轨道是对称性较低的轨道,电子密度较低,不利于化学键的形成。
在分子轨道理论中,成键轨道和反键轨道是相互作用的,它们共同决定了分子的稳定性和反应性。
3. 分子轨道的能级结构分子轨道的能级结构对分子的性质具有重要影响。
在分子轨道理论中,分子轨道的能级可以通过原子轨道的能级线性组合得到。
成键轨道的能级一般比原子轨道的能级低,而反键轨道的能级一般比原子轨道的能级高。
在填充电子时,按照泡利不相容原理和洪特规则,电子首先填充到能量最低的分子轨道中,直到填满所有电子。
通过对分子轨道的能级结构进行分析,可以预测分子的稳定性和反应性。
4. 分子轨道理论的应用分子轨道理论在化学领域有着广泛的应用。
通过分子轨道理论,可以解释分子的几何构型、键合性质、磁性质、光谱性质等。
例如,通过分子轨道理论可以解释为什么氧气是磁性的,以及为什么双键比单键更容易发生加成反应等。