敲除鼠的构建
- 格式:doc
- 大小:25.50 KB
- 文档页数:2

基因敲除小鼠的制作方法基因敲除小鼠是一种常用的遗传工具,在科学研究中被广泛应用于功能基因组学和疾病模型研究。
基因敲除是指通过特定技术手段,将小鼠体内的目标基因完全沉默或失活,从而研究该基因在发育、生理以及疾病机制中的功能。
本文将介绍基因敲除小鼠的制作方法,包括设计目标基因的敲除载体、胚胎干细胞的筛选和注射、外显子敲除策略的选择等。
1.设计目标基因的敲除载体敲除载体是嵌入目标基因的重要工具。
它通常包含正向与反向的同源臂(homology arms)以及选择标记(如抗生素抗性基因)。
同源臂的长度通常在2-5 kb之间,确保在同源重组时准确而有效地替代目标基因。
此外,敲除载体中还应该包含可诱导甲基化的Cre-loxP重组体系或者FLP-FRT重组体系,以用于后续的基因定向敲除或基因重新组装。
2.筛选胚胎干细胞胚胎干细胞是从内胚层发育而来的多潜能细胞,可以分化为整个鼠体的各种组织和器官。
敲除载体首先需要通过电转或霰粒枪等手段转染到胚胎干细胞系中。
转染后,胚胎干细胞需要进行抗生素筛选,以过滤未转染的细胞。
为了确保目标基因的敲除率,可以使用增强绿色荧光蛋白(eGFP)等标记基因,通过荧光显微镜观察转染细胞的表达情况。
3.敲除载体注射到小鼠受精卵中一旦确认胚胎干细胞中存在敲除载体,接下来就是将胚胎干细胞植入小鼠受精卵。
这个步骤一般由经验丰富的研究人员或者专业公司进行。
首先,选择合适的受精卵(通常为C57BL/6J小鼠品系),然后利用显微操作技术,将敲除载体注射到受精卵的核酸注入腔。
注射后,将受精卵转入对应营养液中培养一定时间,以期达到最佳着床率。
4.敲除鼠胚移植到配子体内经过培养后,将敲除的胚胎植入雌性激素准备好的代孕小鼠(通常为白色的株系,如ICR)。
移植后,将代孕小鼠继续养育,直至分娩。
5.验证敲除小鼠的敲除效果通过提取敲除小鼠的DNA,可以利用PCR、Southern blot和DNA测序等技术验证敲除效果。

完全性基因敲除大鼠构建技术原理及流程完全性基因敲除大鼠是通过CRISPR/Cas9基因敲除技术,针对靶基因设计和构建gRNA与Cas9表达质粒,造成目的基因的功能区域被敲除,获得全身所有的组织和细胞中都不表达该基因的大鼠模型。
完全性基因敲除包括:移码突变、片段基因敲除、双/多基因敲除。
移码突变鼠的建系原则与流程1、通过针对靶基因设计、构建相应的gRNA质粒,体外转录为RNA后,与Cas9 mRNA一起原核显微注射获得测序鉴定阳性的F0代杂合子大鼠;2、F0代杂合子大鼠与野生型大鼠进行交配,获得PCR和测序鉴定阳性的F1代杂合子大鼠;3、选择来自同一只F0代大鼠,基因型一致的F1代大鼠,达到性成熟后进行互配,可获得F2代大鼠。
对获得的F2代大鼠进行PCR及测序鉴定,理论上,F2代大鼠中25%为纯合子,50%为杂合子,25%为野生大鼠。
片段基因敲除鼠的建系原则与流程1、通过针对靶基因不同位点设计、构建相应的一对gRNA质粒,体外转录为RNA后,与Cas9 mRNA一起原核显微注射获得测序鉴定阳性的F0代杂合子大鼠;2、F0代杂合子大鼠与野生型大鼠进行交配,获得PCR鉴定阳性的F1代杂合子大鼠;3、选择来自同一只F0代大鼠,基因型一致的F1代大鼠,达到性成熟后互配,可获得F2代大鼠。
对获得的F2代大鼠进行PCR及测序鉴定,理论上,F2代大鼠中25%为纯合子,50%为杂合子,25%为野生大鼠。
双(多)基因敲除鼠的建系原则与流程1、通过针对两个靶基因分别设计、构建相应的gRNA质粒,体外转录为RNA后,与Cas9 mRNA一起原核显微注射获得测序鉴定阳性的F0代多基因杂合子大鼠;2、F0代杂合子大鼠与野生型大鼠进行交配,获得PCR和测序鉴定阳性的F1代双基因杂合子大鼠;3、选择双基因杂合子大鼠进行杂交,获得F2代大鼠。
对获得的F2代大鼠进行PCR及测序鉴定。

Gla基因敲除小鼠构建技术原理
基因敲除小鼠是什么?是否就是我们平日所说的实验室用的小白鼠?其实小鼠有很多种,小白鼠只是其中一种,通常普通的小白鼠多被药厂用作临床试验,而基因敲除的小鼠,则用于更尖端的生物医学研究。
基因敲除小鼠技术原理:是先在小鼠的胚胎干细胞上通过基因重组的办法进行基因修饰——就是将胚胎干细胞中的靶向基因改掉,然后将“修饰”后的胚胎干细胞植入小鼠的早期胚胎,生成嵌合体小鼠。
这种嵌合体小鼠长大后,体内同时存在被“修饰”过的基因和未被“修饰”的基因。
下面是,Gla基因敲除小鼠介绍
基因名:Gla
别名:A;Ags
NCBI号:11605
品系背景:C57BL/6N
修饰方式:conventional knockout
表型提示:MGI:1347344
品系描述:Gla位于小鼠的X号染色体,采用CRISPR/Cas9技术,设计sgRNA,通过应用高通量电转受精卵方式,获得Gla基因敲除小鼠,性成熟后取精子冻存。

条件性敲除小鼠(CKO)原理、构建与应用基因敲除小鼠作为研究基因功能重要工具,应用十分广泛,然而实际操作中大家常常遇到这样问题:①靶基因敲除造成小鼠胚胎致死无法生育;②研究靶基因在某一阶段或者某一个组织的表达情况,那么全敲小鼠并不能满足我们的研究要求。
条件性基因敲除小鼠(CKO)就应运而生了,完美地解决了上面2个棘手问题。
今天,我们就为大家介绍一下条件性基因敲除小鼠的原理、构建、鉴定与应用。
一、条件性敲除小鼠(Conditional knockout mice, CKO)原理条件性基因敲除小鼠:使靶基因缺失仅发生于小鼠生命周期的某一阶段或某一特定的组织,而在其它组织或细胞表达正常,从而使对小鼠基因组的修饰的范围和时间处于一种可控状态。
如下为全敲和条件性敲除的对比:1. 技术原理通过染色体位点特异性重组酶系统Cre-LoxP或Flp-FRT来实现的。
在待敲除目的基因一个或多个重要外显子两端各放置一个LoxP (或FRT)序列,得到flox(Flankedby LoxP)小鼠。
将flox小鼠与带有组织特异性表达的Cre(或Flp)的小鼠交配繁殖,以获得在特定组织里把目标基因敲除掉的小鼠,即条件性基因敲除小鼠。
鉴于这2种技术基本原理一致,Cre-LoxP系统更多用于动物体内编辑,下面就以Cre-LoxP具体介绍。
2. Cre/LoxP系统组成Cre-LoxP系统源于 P1噬菌体,可以介导位点特异的DNA重组。
该系统含有两种成分:LoxP位点:一段长34bp的DNA序列,为重组酶识别的位点:含有两个13 bp的反向重复序列和一个8 bp的核心序列。
Cre重组酶:为一种酶,由343个氨基酸组成的单体蛋白;具有位点特异性,可使LoxP片段间的基因序列被删除或重组。
根据LoxP位点方向分以下三类重组方式:⑴两个LoxP位点方向相同:如果两个LoxP位点位于一条DNA 链上,且方向相同,Cre重组酶能有效切除两个LoxP位点间的序列;如图下①所示。


38基于CRISPR/Cas9技术的TRPS1基因敲除小鼠模型的构建李腾雁,刘文杰,赵宏,蔡建强*(国家癌症中心/ 国家肿瘤临床医学研究中心/ 中国医学科学院北京协和医学院肿瘤医院肝胆外科,北京 100021)李腾雁 博士研究生中国医学科学院北京协和医学院肿瘤医院肝胆外科目的:基于CRISPR/Cas9技术构建敲除TRPS1基因的杂合子小鼠,并进行鉴定。
方法: C57BL/6N小鼠自行交配后,使用Cas9/sgRNA注射受精卵的方法构建基因敲除小鼠,对可遗传的小鼠基因型进行鼠尾检测,TRPS1杂合子敲除小鼠分别与野生型小鼠交配,获得具有稳定基因型的小鼠。
结果:本实验通过使用Cas9/sgRNA注射受精卵的方法,所有繁殖小鼠经鼠尾基因型鉴定,证实成功构建了18只TRPS1基因敲除的杂合子小鼠。
结论:基于CRISPR/Cas9技术成功构建了敲除TRPS1基因的杂合子小鼠。
关键词:CRISPR/Cas9;TRPS1;结直肠癌;基因敲除小鼠摘要基金支持:国家自然科学基金(81672461) ;国家自然科学基金(81972311) ;深圳市“医疗卫生三名工程”(SZSM202011010)首都卫生发展科研专项项目(2018-1-4021);中国医学科学院医学与健康科技创新工程(2016-I2M-1-001,2017-12M-4-002) *通信作者:蔡建强************************Generation of TRPS1 knockout mice by CRISPR/Cas9-mediated gene targetingAbstractObjectives: This study aimed to construct and identify heterozygous mice knocked out of TRPS1 gene based on CRISPR/ Cas9 technology.Methods: After self-mating of C57BL/6N mice, TRPS1 knockout mice were constructed by injecting fertilized eggs with Cas9/sgRNA, and the mouse genotypes of heritable mice were detected by tail. TRPS1 heterozygous knockout mice were mated with wild-type mice to obtain mice with stable genotypes.Results: In this experiment, the fertilized eggs were injected with cas9 / sgRNA, all breeding mice were identified by tail genotype, 18 TRPS1 knockout heterozygous mice were successfully constructed.Conclusion: In this study, we successfully constructed TRPS1 knockout heterozygous mice based on CRISPR / cas9 technology, which provided a research platform for further research on the role of TRPS1 in the occurrence, development and possible liver metastasis of colorectal cancer at the animal level.Keywords: CRISPR/Cas9; TRPS1; Colorectal cancer; Gene knockout mouseLi Tengyan, Liu Wenjie, Zhao Hong, Cai Jianqiang*(National Department of Hepatobiliary Surgery, National Cancer Center/National Clinical Research Center for Cancer/ Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China)我国结直肠癌(colorectal cancer,CRC)的发病率和死亡率均保持上升趋势。

apoa5基因敲除仓鼠模型的构建方法
ApoA5基因是人体中一个重要的脂质代谢相关基因,它编码的蛋白质可以调节血浆三酰甘油水平。
因此,研究ApoA5基因的功能和作用对于了解脂质代谢的机制以及相关疾病的发生发展具有重要意义。
为了更好地研究ApoA5基因的功能,科学家们利用基因敲除技术构建了ApoA5基因敲除仓鼠模型。
ApoA5基因敲除仓鼠模型的构建方法主要包括以下几个步骤:
1.设计ApoA5基因敲除的引物
首先,科学家们需要设计一对特异性引物,用于扩增ApoA5基因的外显子序列。
引物的设计需要考虑到引物的长度、GC含量、Tm值等因素,以确保引物的特异性和扩增效率。
2.构建ApoA5基因敲除载体
将引物扩增得到的ApoA5基因外显子序列克隆到敲除载体中,构建ApoA5基因敲除载体。
敲除载体通常包括两个同向的荧光蛋白基因,用于筛选敲除细胞株。
3.转染和筛选
将ApoA5基因敲除载体转染到仓鼠胚胎干细胞中,利用荧光蛋白筛选出ApoA5基因敲除细胞株。
筛选出的细胞株需要进行PCR验证和Southern blotting确认。
4.建立ApoA5基因敲除仓鼠模型
将ApoA5基因敲除细胞株注射到野生型仓鼠的受精卵中,通过胚胎移植技术建立ApoA5基因敲除仓鼠模型。
建立的仓鼠模型需要进行PCR验证和Southern blotting确认。
通过以上步骤,科学家们成功地构建了ApoA5基因敲除仓鼠模型。
这个模型可以用于研究ApoA5基因的功能和作用,以及与脂质代谢相关的疾病的发生发展机制。
同时,这个模型也为开发相关疾病的治疗方法提供了新的思路和途径。

HTT基因敲除小鼠构建技术原理HD小鼠模型是目前应用最广泛的HD哺乳动物模型,包括HD转基因小鼠模型、基因敲入(knock in, KI)小鼠模型,以及条件性表达N-端突变HTT的HD小鼠模型。
HD转基因小鼠通过转基因过表达mHTT的N-端片段,包括表达变异HTT exon1对应蛋白片段的R6/2及R6/1模型以及表达更长片段的N171-82Q模型等。
这些N-端片段均包含mHTT中的polyQ序列,而亨廷顿蛋白片段化在疾病的发生过程中具有重要作用,其产生的N-端片段具有高毒性,并且易聚集。
然而,此类模型由于只具有变异HTT基因的5′端序列,且往往有多个拷贝,在遗传学方面与HD病人不一致。
此外,此类模型的表型往往出现早(小鼠出生后几周至十几周),这与大多数HD病人也不一致。
而基因敲入可以精确地将突变基因插入到基因组中相同的位置,建立更接近于人类HD的动物模型。
近期,由中美两国研究人员联合发布了一篇关于HTT小鼠模型研究,提出了一种表型更为准确的HD小鼠模型——BAC226Q转基因小鼠。
在内源性HTT启动子和调节元件的控制下,转基因BAC226Q小鼠体内表达了含有226个CAG-CAA重复序列的全长人HTT。
为了确定全长人HTT序列在转基因FVB小鼠基因组中的拷贝数和插入位点,研究采用了全基因组测序,结果显示在FVB小鼠基因组的8号染色体Chr8:46084002处插入了两个人类HTT拷贝。
与11月龄的另一种亨廷顿模型BACHD小鼠及野生型小鼠进行比较,实验结果显示BAC226Q小鼠中226Q突变亨廷顿蛋白条带的分子量高于BACHD小鼠中97Q突变亨廷顿蛋白条带的分子量。
而在蛋白质印记实验结果显示,2个月或11个月的BAC226Q小鼠中未检测到Htt蛋白片段。
图3 BAC226Q转基因小鼠的产生[9](A)将全长人类突变HTT插入小鼠基因组的示意图。
(B)通过Western blot分析了 BAC226Q、非转基因同窝小鼠和 BACHD(97Q)小鼠中Htt蛋白的表达水平。
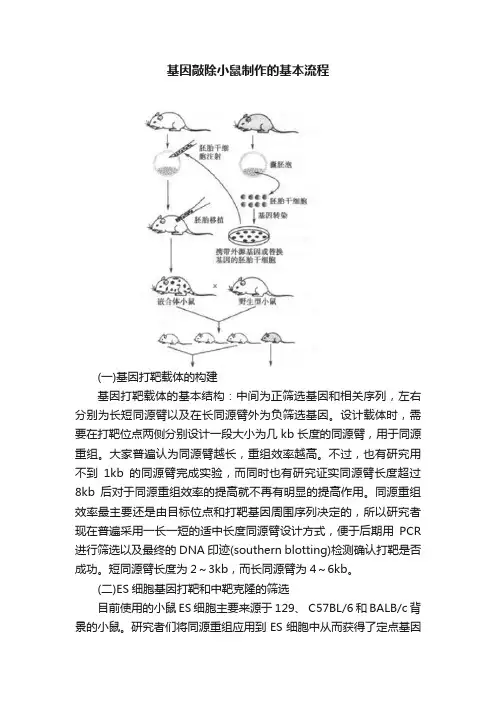
基因敲除小鼠制作的基本流程(一)基因打靶载体的构建基因打靶载体的基本结构:中间为正筛选基因和相关序列,左右分别为长短同源臂以及在长同源臂外为负筛选基因。
设计载体时,需要在打靶位点两侧分别设计一段大小为几kb长度的同源臂,用于同源重组。
大家普遍认为同源臂越长,重组效率越高。
不过,也有研究用不到1kb的同源臂完成实验,而同时也有研究证实同源臂长度超过8kb后对于同源重组效率的提高就不再有明显的提高作用。
同源重组效率最主要还是由目标位点和打靶基因周围序列决定的,所以研究者现在普遍采用一长一短的适中长度同源臂设计方式,便于后期用PCR 进行筛选以及最终的DNA印迹(southern blotting)检测确认打靶是否成功。
短同源臂长度为2~3kb,而长同源臂为4~6kb。
(二)ES细胞基因打靶和中靶克隆的筛选目前使用的小鼠ES细胞主要来源于129、 C57BL/6和BALB/c背景的小鼠。
研究者们将同源重组应用到ES细胞中从而获得了定点基因修饰的目的,通过将DNA片段导入细胞中,利用片段上的宿主细胞同源臂进行同源重组,将目的基因置换插入细胞基因组中整合表达。
在ES细胞中进行同源重组需要将打靶载体进行线性化后,通过诸如电转染(electroporation)、核转染等手段导入细胞中,研究已经证明线性化载体更有利于同源重组的发生。
目前,基因打靶事件的确定通常是首先用PCR反应筛选中靶的ES 细胞克隆。
PCR引物的设计原则是一个引物位于同源臂外,另一个引物位于载体内。
用PCR扩增同源臂短臂,成功的基因打靶克隆会有扩增产物出现。
阳性克隆还需要Southem blotting分析进一步验证。
确定正确后,用于下一步的ES细胞显微注射,一体以产生嵌合体小鼠。
(三)ES细胞克隆的胚胎显微注射和胚眙移植筛选得到的中靶细胞通过显微注射的方式注入到囊胚期胚胎的囊胚腔中,然后将囊胚移植到如假孕母鼠体内,从而产生子代嵌合小鼠。
(四)基因敲除小鼠培育嵌合小鼠需与野生型小鼠交配,以实现基因修饰生殖系传递。

巨噬细胞条件敲除小鼠构建步骤巨噬细胞条件敲除小鼠的构建,这可不是一件简单的事儿啊!就好像盖房子,得一步一步来,每一步都要稳稳当当的。
首先呢,咱得选择合适的小鼠品系。
这就好比是挑选盖房子的地基,得结实牢固才行。
不同的品系可能有着不同的特点和适用性,得仔细琢磨琢磨。
然后就是设计针对巨噬细胞的条件敲除策略啦。
这就像是给房子设计一个独特的风格,要精准又巧妙。
得确定好要敲除的基因片段,可不能有一点儿差错。
接下来,得准备各种工具和材料,就像盖房子时准备砖块、水泥啥的。
这里面包括各种试剂、酶啊等等,一个都不能少。
有了这些,就可以开始进行基因编辑的操作啦。
这可是个精细活儿,就跟雕刻大师精心雕琢一件艺术品似的。
要小心翼翼地把不需要的基因部分去掉,换上我们想要的条件。
之后,把编辑好的细胞培养起来,让它们好好生长发育。
这就好比是看着房子一点点建起来,充满了期待。
等细胞培养好了,就得把它们移植到小鼠体内啦。
这就像是给房子添上最后一块瓦片,得稳稳当当放好。
移植之后,还得密切观察小鼠的情况。
看看它们是不是健康,有没有出现啥问题。
这就像随时检查房子有没有裂缝啥的。
经过一段时间的等待和观察,如果一切顺利,那就恭喜啦,我们的巨噬细胞条件敲除小鼠就初步构建成功啦!但这还不算完哦,还得对它们进行各种检测和验证,确保真的达到了我们想要的效果。
你说这是不是很不容易啊?但当看到这些经过精心构建的小鼠,就像看到自己亲手盖起来的漂亮房子一样,那种成就感简直无与伦比!所以啊,可别小瞧了这每一个步骤,每一个环节都至关重要呢!只有认真对待,才能得到我们想要的结果呀,你说是不是呢?。

基因敲除小鼠的实验流程1.设计基因敲除小鼠实验方案在开始实验之前,需要明确研究目的,确定需要敲除的基因,并设计相应的实验方案。
一般可以使用 CRISPR-Cas9 系统来实现基因敲除,在设计基因敲除实验方案时,需要选择合适的 sgRNA 序列,以及设计恰当的引物用于检测突变。
2.获得基因敲除小鼠的胚胎干细胞为了实现基因敲除,需要获得基因敲除小鼠的胚胎干细胞。
一种常用的方法是利用胚胎干细胞对外源DNA的高度易感性,将敲除基因的质粒DNA转染到小鼠胚胎干细胞中。
3.筛选敲除基因的胚胎干细胞株系将转染了敲除基因的胚胎干细胞以悬浮培养的方式进行培养,培养一段时间后,利用一定的筛选条件来筛选出含有敲除基因的胚胎干细胞株系。
筛选条件可包括对抗生素的使用或筛选标记基因的表达。
4.制备敲除基因小鼠的固定胚胎干细胞系通过体外培养,将敲除基因的胚胎干细胞系定植在培养皿上,培养数代以后,将其冻存,以备后续的实验使用。
5.实施敲除基因小鼠的胚胎干细胞基因改造将固定的胚胎干细胞系重新激活,转染 Cas9 和 sgRNA,利用CRISPR-Cas9 系统使这些细胞具有敲除基因的突变。
6.识别敲除基因的胚胎干细胞阳性克隆株对转染了 Cas9 和 sgRNA 的胚胎干细胞进行筛选,通过 PCR、Western blot、Southern blot等技术方法识别出敲除了目标基因的阳性克隆株。
7.将敲除基因的胚胎干细胞注入小鼠的早期胚胎取出已受精的小鼠卵母细胞,利用显微操作将敲除基因的胚胎干细胞注入到小鼠的早期胚胎中。
利用体外受精或者通过体内或体外的胚胎移植方式将基因敲除干细胞注入受体小鼠。
8.制备基因敲除小鼠的嵌合小鼠将已注入敲除基因的胚胎干细胞的受体小鼠进行嵌合以产生基因敲除小鼠。
嵌合可以通过体内或体外的胚胎移植方式进行。
9.筛选识别基因敲除小鼠对产生的嵌合小鼠进行筛选,确认敲除基因是否成功。
可以通过 PCR、Western blot、Southern blot等技术方法对小鼠体细胞或组织进行分析。
基因敲除鼠的构建方法
基因敲除鼠是一种重要的遗传工具,它们能够帮助科学家们研究基因在生物学过程中的作用。
基因敲除鼠构建方法主要包括以下步骤: 1. 设计基因敲除鼠的目标基因序列,选择合适的外显子或内含
子进行靶向敲除。
2. 制备CRISPR/Cas9系统,包括Cas9蛋白、sgRNA以及质粒载体等。
3. 将CRISPR/Cas9系统导入到鼠胚胎干细胞中,使用
CRISPR/Cas9系统导致目标基因的敲除。
4. 鉴定敲除鼠胚胎干细胞中基因敲除的效率,通过PCR、Western blot等方法验证敲除效果。
5. 将基因敲除鼠胚胎干细胞注入到新生小鼠的内脏器官进行移植,培养出基因敲除小鼠。
基因敲除鼠的构建方法是一项复杂的工程,需要科学家们对基因编辑技术的熟练掌握和实验经验。
通过基因敲除鼠的研究,科学家们能够更加深入地了解基因在生物体内的作用,为疾病治疗和新药研发提供更为有效的手段。
- 1 -。
基因敲除小鼠原理基因敲除是一种常用的遗传工程技术,它通过人为地改变生物体的基因组,使得某个特定基因在生物体中失去功能。
基因敲除技术在动物模型研究中得到了广泛的应用,特别是在小鼠模型的构建中发挥着重要作用。
下面将介绍基因敲除小鼠的原理及其应用。
基因敲除小鼠原理。
基因敲除小鼠是指通过基因工程技术,将小鼠的某个特定基因进行改变,使得该基因在小鼠体内失去功能。
基因敲除小鼠的构建通常分为以下几个步骤:1. 选择目标基因,首先需要选择需要敲除的目标基因,通常选择与某种疾病或生理过程相关的基因作为目标。
2. 构建敲除载体,将目标基因的敲除载体导入到小鼠的胚胎干细胞中,使得目标基因在胚胎干细胞中发生敲除。
3. 胚胎干细胞筛选,经过敲除载体导入后,对胚胎干细胞进行筛选,筛选出发生了基因敲除的干细胞。
4. 小鼠胚胎的移植,将发生了基因敲除的胚胎干细胞移植到受精小鼠卵母细胞内,通过体外培育和移植到母体小鼠子宫内,使得基因敲除小鼠的胚胎发育成熟。
5. 基因敲除小鼠的鉴定,对出生的小鼠进行基因型分析,确认是否成功构建了基因敲除小鼠模型。
基因敲除小鼠的应用。
基因敲除小鼠模型在生物医学研究中有着广泛的应用,主要包括以下几个方面:1. 功能基因研究,通过敲除特定基因,可以研究该基因在生物体内的功能及其对生物体生理过程的影响,为相关疾病的研究提供重要的实验模型。
2. 疾病模型构建,基因敲除小鼠模型可用于构建各种疾病模型,如肿瘤模型、免疫缺陷病模型等,用于研究疾病的发病机制及寻找治疗方法。
3. 药物筛选,基因敲除小鼠模型可用于药物的筛选和评价,通过观察敲除某个基因后对药物疗效的影响,为新药的研发提供重要参考。
4. 基因治疗研究,基因敲除小鼠模型可用于基因治疗的研究,通过敲除某个致病基因或导入正常基因,探索基因治疗的可行性及疗效。
总结。
基因敲除小鼠模型是一种重要的生物医学研究工具,通过对特定基因的敲除,可以研究该基因在生物体内的功能及其对生理过程的影响,为相关疾病的研究提供重要的实验模型。
Park2基因敲除小鼠模型构建技术原理1、背景信息神经退行性疾病(Neurodegenerative diseases)多发于老年群体,具有病情发展缓慢、发病率高、治愈率低等特点,对患者的健康生活造成较大的影响。
常见的多为遗传和环境风险因素共同作用导致的复杂神经退行性疾病,阿尔茨海默病( Alzheimer's disease,AD) 和帕金森病(Parkinson's disease,PD)是中枢神经退行性疾病中发病率分别位居第一、第二的疾病。
尽管临床症状和神经病理学特征具有显著差异,但帕金森病与阿尔茨海默病具有部分共同的遗传病因。
Park2基因敲除小鼠可用于神经退行性疾病的研究。
PARK2基因又称Parkin基因,其表达产物为Parkin蛋白,1998年Kitada等发现该基因突变可导致常染色体隐性遗传性青少年型帕金森综合征。
据文献报道PARK2的表达在维持神经系统功能方面具有重要作用。
Parkin通过抑制线粒体依赖性和非依赖性细胞凋亡来增强细胞存活。
Parkin被定性为具有抗糖酵解和抗氧化能力的关键肿瘤抑制因子。
突变与线粒体功能障碍有关,导致帕金森病的神经元死亡和肿瘤发生中的异常代谢。
2、基因信息● Gene symbol: Prkn● Gene name: parkin RBR E3 ubiquitin protein ligase● Gene IDsMGI: 1355296NCBI Gene: 50873● 位置:位于小鼠17号染色体上3、应用模拟人类常染色体隐性幼年帕金森病患者中最常见的外显子3缺失突变,可用于帕金森病,多巴胺调节,黑质纹状体功能,线粒体功能、肿瘤形成或其他神经生物学的研究。
4、品系状态冻存精子,活体5、技术CRISPR/Cas9技术。
基因敲除小鼠的制备流程基因敲除小鼠已经成为现代生命科学基础研究和药物研发领域不可或缺的实验动物模型,在生命科学、人类医药和健康研究领域中发挥着重要的作用。
基于胚胎干细胞的基因打靶技术、EGE技术(基于Crispr cas9技术)是当下比较火热的基因敲除小鼠制备技术。
利用这两种技术制备基因敲除小鼠的流程是什么样的?一、基于胚胎干细胞的基因打靶技术制备基因敲除小鼠的流程:1.课题设计,订购课题BAC菌;2.按照课题设计,完成打靶载体设计和构建;3.将重组载体电转到胚胎干细胞中,用G418筛选转染后的胚胎干细胞,得到阳性克隆;4.进一步通过PCR和southern blot杂交技术(基因敲除小鼠检测金标准)对上一步得到的阳性克隆进行筛选,得到稳定整合外源基因的胚胎干细胞阳性克隆;5.将胚胎干细胞阳性克隆注射到小鼠囊胚中,并植入到假孕小鼠的子宫内;6.得到嵌合鼠,并获得F1阳性杂合子小鼠。
基于胚胎干细胞的基因打靶技术制备基因敲除小鼠是目前为止唯一一个可以满足几乎所有基因组修饰要求的打靶技术,但目前只应用在小鼠的基因敲除上,而且其周期长工作量大。
二、利用EGE技术(基于Crispr cas9技术)制备基因敲除小鼠的流程1.设计构建识别靶序列的sgRNA;2.设计构建致靶基因切割的EGE系统载体质粒;3.利用百奥赛图自主开发的UCA试剂盒对sgRNA/Cas9进行活性检测;4.设计构建打靶载体;5.体外转录sgRNA/Cas9 mRNA;6.小鼠受精卵原核注射sgRNA/Cas9 mRNA和打靶载体;7.获得Fo代小鼠,利用PCR对Fo代小鼠进行基因型鉴定;8.获得F1代小鼠,利用PCR和southern blot杂交技术(基因敲除小鼠检测金标准)对F1代小鼠进行基因型鉴定。
虽然EGE技术(基于Crispr cas9技术)制备基因敲除小鼠看似比基于胚胎干细胞的基因打靶技术制备基因敲除小鼠流程繁琐,其实不然,EGE技术(基于Crispr cas9技术)系统构建简单,基因敲除/敲入效率高,速度快,可实现多基因、多物种基因敲除/敲入,最快2个月即可得到F0代阳性鼠,5个月得到F1F1代杂合子小鼠。
条件性基因敲除大鼠构建技术原理及流程
条件性基因敲除大鼠是通过把两个LoxP位点插入到目的基因的一个或几个重要外显子的两端以制备出有两个floxed大鼠。
该floxed大鼠在与表达Cre重组酶大鼠杂交之前,该基因表达正常;当floxed大鼠与组织特异性表达Cre酶的大鼠进行杂交后,可实现在特定的组织或细胞中敲除该基因,而在其它组织或细胞中该基因表达正常。
建系原则与流程:
1、与野生型大鼠杂交:阳性CRISPR-Pro大鼠(+/flox)与野生型大鼠(+/+)杂交,获得F1代杂合子大鼠(+/flox);
2、挑选一对F1代杂合子大鼠(+/flox)进行自交,获得F2代纯合子大鼠(flox/flox)。
如何设计条件性基因敲除小鼠模型摘要:小鼠和大鼠可谓是生命科学实验室里的明星,成功的小鼠和大鼠模型可谓是“生命科学的好帮手”。
很多人可能想自己设计或是了解条件性基因敲除小鼠,在此做个小结,供大家参考。
小鼠和大鼠可谓是生命科学实验室里的明星,成功的小鼠和大鼠模型可谓是“生命科学的好帮手”。
很多人可能想自己设计或是了解条件性基因敲除小鼠,在此做个小结,供大家参考。
条件性基因敲除小鼠的设计利用了Cre/LoxP或Flipe/Frt原理。
它们都是位点特异性重组酶系统。
这里以Cre/LoxP系统为例。
比如在待敲除的一段目标DNA序列的两端各放置一个loxP序列,得到flox(flanked by loxP)小鼠。
将flox小鼠与带有细胞特异性表达Cre 的小鼠交配繁殖,以获得在特定细胞里把目标基因敲除掉的小鼠,即条件性基因敲除小鼠。
此外,若与控制Cre表达的其他诱导系统(比如CreERT2)相结合,还可以对某一基因同时实现时空两方面的调控。
Cre/loxP系统来源于噬菌体,可以介导位点特异的DNA重组。
该系统含有两个组成成分:一个是一段长34bp的DNA序列(LoxP序列),含有两个13 bp的反向重复序列和一个8 bp的核心序列。
LoxP的方向由中间这8个碱基决定。
这段LoxP序列是Cre重组酶识别的位点。
令一个组成部分是Cre重组酶。
它是由噬菌体编码的一种由343个氨基酸组成的蛋白。
Cre可以介导两个LoxP位点的重组,从而引起两个LoxP之间DNA序列的缺失。
如果将Cre重组酶cDNA通过基因工程的手段置于组织或细胞特异性启动子之下,可以得到Cre组织/细胞特异性表达的Cre小鼠,也叫Cre工具小鼠。
跟Flox小鼠交配之后,可以得到条件性基因敲除小鼠。
所谓Flox小鼠是指在某个基因的某个外显子两侧各放一个LoxP序列。
这段序列就是Flanked by LoxP,也就叫做Flox小鼠。
这种Flox小鼠一般要通过设计构建打靶载体、胚胎干细胞重组、囊胚显微注射、和嵌合体小鼠传代来获得。
如何设计条件性基因敲除小鼠模型
摘要:
小鼠和大鼠可谓是生命科学实验室里的明星,成功的小鼠和大鼠模型可谓是“生命科学的好帮手”。
很多人可能想自己设计或是了解条件性基因敲除小鼠,在此做个小结,供大家参考。
小鼠和大鼠可谓是生命科学实验室里的明星,成功的小鼠和大鼠模型可谓是“生命科学的好帮手”。
很多人可能想自己设计或是了解条件性基因敲除小鼠,在此做个小结,供大家参考。
条件性基因敲除小鼠的设计利用了Cre/LoxP或Flipe/Frt原理。
它们都是位点特异性重组酶系统。
这里以Cre/LoxP系统为例。
比如在待敲除的一段目标DNA序列的两端各放置一个loxP序列,得到flox(flanked by loxP)小鼠。
将flox小鼠与带有细胞特异性表达Cre 的小鼠交配繁殖,以获得在特定细胞里把目标基因敲除掉的小鼠,即条件性基因敲除小鼠。
此外,若与控制Cre表达的其他诱导系统(比如CreERT2)相结合,还可以对某一基因同时实现时空两方面的调控。
Cre/loxP系统来源于噬菌体,可以介导位点特异的DNA重组。
该系统含有两个组成成分:一个是一段长34bp的DNA序列(LoxP序列),含有两个13 bp的反向重复序列和一个8 bp的核心序列。
LoxP的方向由中间这8个碱基决定。
这段LoxP序列是Cre重组酶识别的位点。
令一个组成部分是Cre重组酶。
它是由噬菌体编码的一种由343个氨基酸组成的蛋白。
Cre可以介导两个LoxP位点的重组,从而引起两个LoxP之间DNA序列的缺失。
如果将Cre重组酶cDNA通过基因工程的手段置于组织或细胞特异性启动子之下,可以得到Cre组织/细胞特异性表达的Cre小鼠,也叫Cre工具小鼠。
跟Flox小鼠交配之后,可以得到条件性基因敲除小鼠。
所谓Flox小鼠是指在某个基因的某个外显子两侧各放一个LoxP序列。
这段序列就是Flanked by LoxP,也就叫做Flox小鼠。
这种Flox小鼠一般要通过设计构建打靶载体、胚胎干细胞重组、囊胚显微注射、和嵌合体小鼠传代来获得。
这种小鼠跟Cre工具小鼠交配,由于Cre的表达,介导两个LoxP位点序列的重组,从而敲除两个LoxP之间的序列。
由于不同Cre工具小鼠的Cre表达有组织/细胞特异性,就可以达到在不同组织、细胞里特异性敲除目的基因的目标。
比如上皮细胞、胸腺细胞、T细胞、B细胞、心肌细胞、肠道、肺脏等。
那如何设计条件性基因敲除小鼠呢?这里所说的设计主要是Flox小鼠的设计。
所谓条件性敲除,是说除了特定细胞外,其它细胞里面没有任何的基因表达异常。
一般情况下,不要在第一个外显子前面放置LoxP序列。
因为第一个外显子前面一般是启动子。
放置LoxP 序列有可能会破坏或改变启动子活性。
条件性敲除一般是敲掉最早引起移码突变的外显子。
这样的话,最好不要敲除有起始密码子ATG的外显子。
否则的话,基因可能会利用ORF
内的ATG编码一个缺少部分N端序列的蛋白,这个蛋白很可能有全部或部分野生蛋白的功能。
在选择要敲除的外显子的时候(各放一个LoxP在一个外显子的两侧),该外显子的碱基数目不能是3N,否则新基因pre-RNA拼接得到的mRNA不能产生移码突变。
会产生一个
与野生蛋白相比少了一段中间序列的新蛋白。
如果一个外显子的碱基数目是3N+1或3N+2,敲除这个外显子之后会产生移码突变,就可以达到基因敲除的目的。
筛选要敲除(Floxed)的外显子的时候,一般是从最上游的外显子开始筛选适合敲除的外显子。
需要注意的是,一般的DNA分析软件不能确定内含子和外显子的边界,需要仔细核对。
95%以上的边界遵循
gt/ag边界原则。
也可以在Ensembl上查一个基因的外显子和内含子。
这个网站上的结果绝大部分是正确的。
但也需要仔细核对。
毕竟基因敲除小鼠研发是一个时间比较长的过程,需要特别小心。
前期做多少的考虑都不嫌多。
这些原则只是对一般课题的考虑。
特殊情况需要特殊处理。
比如,如果只是想敲除一个基因的某个特定domain,或是如果一个基因有一个很大的外显子,这个时候即使这个外显子的碱基数目是3N,也可以对其进行敲除。