6-二级反应及其他简单级数反应
- 格式:ppt
- 大小:654.50 KB
- 文档页数:19
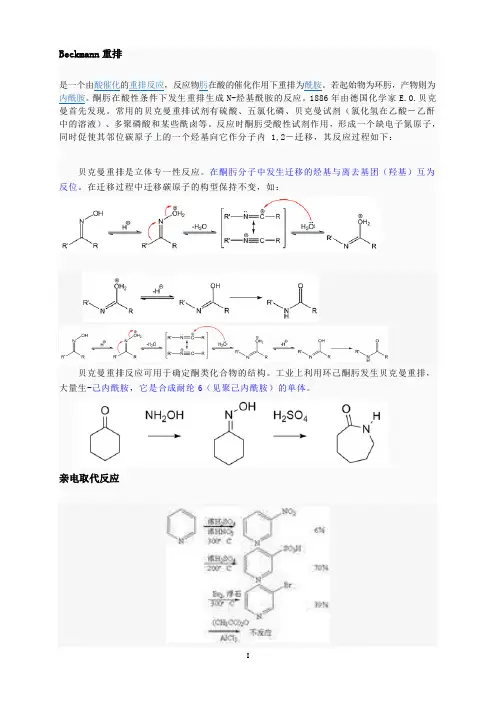
Beckmann重排是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。
若起始物为环肟,产物则为内酰胺。
酮肟在酸性条件下发生重排生成N-烃基酰胺的反应。
1886年由德国化学家E.O.贝克曼首先发现。
常用的贝克曼重排试剂有硫酸、五氯化磷、贝克曼试剂(氯化氢在乙酸-乙酐中的溶液)、多聚磷酸和某些酰卤等。
反应时酮肟受酸性试剂作用,形成一个缺电子氮原子,同时促使其邻位碳原子上的一个烃基向它作分子内 1,2-迁移,其反应过程如下:贝克曼重排是立体专一性反应。
在酮肟分子中发生迁移的烃基与离去基团(羟基)互为反位。
在迁移过程中迁移碳原子的构型保持不变,如:贝克曼重排反应可用于确定酮类化合物的结构。
工业上利用环己酮肟发生贝克曼重排,大量生-己内酰胺,它是合成耐纶6(见聚己内酰胺)的单体。
亲电取代反应亲电取代反应一种亲电试剂取代其它官能团的化学反应,这种被取代的基团通常是氢,但其他基团被取代的情形也是存在的。
亲电取代是芳香族化合物的特性之一.芳香烃的亲电取代是一种向芳香环系,如苯环上引入官能团的重要方法。
其它另一种主要的亲电取代反应是脂肪族的亲电取代。
亲电加成反应亲电加成反应是烯烃的加成反应,是派电子与实际作用的结果。
派键较弱,派电子受核的束缚较小,结合较松散,因此的作为电子的来源,给别的反应物提供电子。
反应时,把它作为反应底物,与它反应的试剂应是缺电子的化合物,俗称亲电试剂。
这些物质又酸中的质子,极化的带正电的卤素。
又叫马氏加成,由马可尼科夫规则而得名:“烯烃与氢卤酸的加成,氢加在氢多的碳上”。
广义的亲电加成亲反应是由任何亲电试剂与底物发生的加成反应。
在烯烃的亲电加成反应过程中,氢正离子首先进攻双键(这一步是定速步骤),生成一个碳正离子,然后卤素负离子再进攻碳正离子生成产物。
立体化学研究发现,后续的卤素负离子的进攻是从与氢离子相反的方向发生的,也就是反式加成。
如丙烯与HBr的加成:CH-CH=CH+ HBr → CH-CHBr-CH2第一步,HBr电离生成H和Br离子,氢离子作为亲电试剂首先进攻C=C双键,形成这样的结构:第二步,由于氢已经占据了一侧的位置,溴只能从另外一边进攻。
![具有简单级数的反应[整理版]](https://uimg.taocdn.com/d1dc7073ae1ffc4ffe4733687e21af45b307fead.webp)
具有简单级数的反应化学反应中,表示反应速率与浓度之间的参数的关系,或表示浓度等参数与时间关系的方程称为化学反应的速率方程,也称为动力学方程。
在化学反应的速率方程中,各物浓度相的指数之代数和就称为该反应的级数。
在这些反应中存在具有简单级数的反应,以下就讨论这些具有简单级数的反应,介绍其速率方程式的微分式、积分式以及他们的速率常数k 的单位和半衰期等各自的特征。
一级反应:凡是反应速率只与物质浓度的一次方呈正比关系者称为一级反应。
设有以下一级反应 t=0 C A (0)=a C P (0)=0t=t C A =a-x C P =x 反应速率方程微分式有对其作不定积分得 ln(a-x)=-k 1t+C对其作定积分有 ln[a/(a-x)]= k 1tk 1=1/t ln[a/(a-x)]从反应物起始浓度a 和t 时刻的浓度a-x 即可算出速率常数k 1,一级反应的速率常数单位为1/(时间)。
取反应物消耗了一半所需时间作半衰期,则t 1/2=ln2/ k 1一级反应的特征有3点:1.速率常数的单位是时间的倒数;2.一级反应半衰期与反应物起始浓度无关;3.lnC A 与t 呈线性关系。
二级反应:反应速率和物质浓度的二次方成正比者称为二级反应。
通式为(1)A+B P+…… r= k 2[A][B](2)2A P+…… r= k 2[A] ²若A 和B 起始浓度相同,反应(1)的速率方程可写成dx/dt=k 2(a-x) ²移项作不定积分得: 1/(a-x)= k 2t+C作定积分得: 1/(a-x)-1/a= k 2tk 2=1/t*x/[a(a-x)]其半衰期为 t 1/2=1/k 2a二级反应的半衰期与一级反应不同,它与反应物的起始浓度成反比。
二级反应的特点:1.速率常数的单位是1/[(浓度)(时间)];2.半衰期与反应物的起始浓度成反比;3.1/(a-x)与t 呈线性关系。
若A 和B 起始浓度不相同则反应(1)的速率方程为dx/dt=k 2(a-x)(b-x)a 和b 分别为A 、B 起始浓度,x 为t 时刻已反应物质的量。

简单级数反应的特点总结一、简单级数反应的动力学方程对于单向反应aA→P,若以[A]o,x,y分别表示反应物A的起始浓度,已反应的部分浓度及已反应的百分数,则其t 时刻的剩余浓度[A]应为:[A]=[A]o-ax=[A]o(1-y)而(一)一级反应反应速率与物种浓度成正比的反应为一级反应,其速率方程为:分离变量,积分,则得一级反应的动力学方程:或根据上述各式,可以看出一级反应具有下列特征:(1)若以ln{A] 对t作图,可得一斜率为(-ak),截距为ln[A]o的直线。
(2)若化学计量系数a=1,则可见,上式浓度项是以比值的形式出现的,因此任何与浓度成比例的物理量均可代替之而无须监测真实的浓度,且不影响k的值。
其量纲为(时间)-1,可用s-1,min-1或h-1等表示之。
(3)若y=1/2 ,即反应物浓度[A]降低到其初始值的一半所需时间称为"半衰期",以t1/2表示,则有表明半衰期与反应物的起始浓度无关。
(4)若定义反应物A的平均寿命为该反应物由开始反应到通过反应而消耗完全的平均经历时间,则其平均寿命为可见,若a=1,则一级反应的平均寿命的倒数即为其反应速率常数。
又由式容易看出,当=(ak)-1时,[A]=[A]o/e ,即反应物浓度下降到其起始值的1/e 。
这一关系提供了测量一级反应平均寿命的方法。
(二)二级反应二级反应有纯二级和混二级两种类型。
如果反应的计量方程为aA+bB+…→P+…则二种速率表示式分别为类型Ⅰ-d[A]/adt=k[A]2类型Ⅱ-d[A]/adt=k[A][B]先讨论类型Ⅰ。
对式移项,积分可得:由之可得纯二级反应具有如下特征:(1)若以1/[A] 对t 作图,可得一斜率为ak 的直线。
(2)若在不同的反应时间t1,t2,…t n测得反应物A的浓度是[A]1,[A]2,…[A]n,则([A]o-[A]1)/at1[A]o[A]1=([A]o-[A]2)/at2[A]o[A]2=…=([A]o-[A]n)/at n[A]o[A]n=k=常数(3)速率常数k的量纲为浓度-1·时间-1,常用单位为mol-1·dm3·s-1。

催化剂是一种能够提高化学反应速率的物质,它参与反应但在反应结束时不被消耗。
反应级数(reaction order)则是用来描述反应速率与各反应物浓度之间的关系的指标。
反应级数可以根据实验数据来确定,通常以简单的整数表示。
以下是几种常见的反应级数:
1.一级反应:当反应速率正比于某个反应物的浓度,即速率与该反应物浓度的一次方成正
比时,称为一级反应。
一级反应的速率方程一般形式为:rate = k[A],其中[A]表示反应物A的浓度,k为速率常数。
2.二级反应:当反应速率正比于某个反应物浓度的平方,即速率与该反应物浓度的二次方
成正比时,称为二级反应。
二级反应的速率方程一般形式为:rate = k[A]^2,其中[A]表示反应物A的浓度,k为速率常数。
3.零级反应:当反应速率与反应物浓度无关,即速率不随反应物浓度变化而改变时,称为
零级反应。
零级反应的速率方程为:rate = k,其中k为速率常数。
需要注意的是,上述是一些常见的反应级数示例,实际反应可能存在复杂的级数关系,甚至可能不符合整数级数。
因此,在确定反应级数时,通常需要通过实验数据和动力学研究来得出准确的结论。






第六章化学动力学6.1 化学反应速率方程6.1-1 化学反应速率表示法6.1-2 化学反应的速率方程①基元反应和总(包)反应②反应级数和反应速率常数6.2 具有简单级数反应的速率公式6.2-1 一级反应6.2-2 二级反应6.2-3 三级反应6.2-4 零级反应6.2-5 反应级数的测定6.3 几种典型的复杂反应6.3-1 对峙反应(可逆反应)6.3-2 平行反应6.3-3 连续反应6.3-4 稳态假定和决速步骤6.4 反应速率与温度的关系6.4-1 Arrenius公式6.4-2 活化能的概念及从实验求活化能6.5 基元反应速率理论6.5-1 碰撞理论6.5-2 过渡态理论6.6 溶液中的反应6.6-1 扩散控制反应6.6-2 溶剂对反应速率的影响6.6-3 离子强度的影响6.7 催化反应6.7-1 催化作用及其特征6.7-2 酸碱催化6.8 光化学6.8-1 光化学基本定律6.8-2 光合作用6.8-3 空气的光化学定义:研究化学反应速率的学科基本任务:1)研究浓度、温度、介质和催化剂等反应条件对反应速率的影响2)阐明化学反应的机理和研究物质结构和它们反应性能之间的关系6.1化学反应速率方程6.1-1化学反应速率表示法常以反应物或产物浓度随时间变化率来表示。
由于在一般的反应式中反应物与生成物的计量系数常不相同,故[reagent][resultant]d ddt dt≠于是引入:反应进度ξ对于aA bB gG hH +→+反应速率11111G A B Hdc dc dc dc d r V dt a dt b dt g dt h dtξ==−=−==V:反应系统的体积r:整个反应速率量纲:浓度.时间-1(mol.dm -3.s -1)反应速率的实验测定:通过测定反应物(生成物)浓度随时间变化z 化学法:化学分析方法测定浓度,采取骤冷、稀释、移去催化剂,加入阻化剂等使反应停止或减慢特点:直接,但费时较多,操作不便z 物理法:物理性质随时间变化来衡量速率(压力、体积、颜色、电导等)特点:迅速,不必中断反应,非直接,找出浓度变化⇔物理性质6.1-2化学反应的速率方程z 在一定温度下,表示反应速率与浓度的函数关系(微分形式)或表示浓度与时间关系的方程(积分形式)成为化学反应的速率方程(动力学方程)。

第二节 具有简单级数的化学反应
一、零级反应
对于反应 →A 产物
化学反应速率与反应物浓度的零次方成正比的反应称为零级反应 A 0A A A k c k dt
dc ==-
与浓度无关 ⎰⎰-=t 0c c A
dt dc A 0,A 得t k c c A 0,A A -= 特征:
1)速率常数的单位:浓度.时间-1
2)A c 与t 呈直线关系
3)半衰期A
0.A 212k c t =
与反应物初始浓度成正比。
二、一级反应
1.化学反应速率与反应物浓度的一次方成正比的反应称为一级反应。
如:
A A A dc v kc dt
=-= 或 A
A
dc kdt c =- 积分,00A A c t
A A c dc k dt
dt -=⎰⎰ 得:,0
ln A A A c k t c = 或,01ln A A A
c t k c = 如果用χA 表示t 时刻反应物A 的转化率,则
,0,0A A A A c c c χ-=
2.一级反应的特征 ① ㏑{ c A /[c ] }与t /[t]作图成为直线关系。
直线的斜率-k ,
② 一级反应速率常数k 的单位,[k]=[时间]-1,。
化学反应动力学的基础知识化学反应动力学是研究化学反应速率、反应机理以及反应难易程度的重要分支学科。
它通过实验方法、理论分析以及计算机模拟等手段,探究化学反应中的原子、分子之间的物质转化过程及机理。
化学反应动力学的发展史也与人们对化学反应认识的深化和加强密不可分。
以下从反应速率、速率常数、反应级数、速率方程、温度效应等方面介绍一些化学反应动力学的基础知识。
一、反应速率化学反应速率是指单位时间内反应物消失量或产物生成的量。
反应速率的大小在很大程度上决定着化学反应的快慢。
为了研究反应速率,通常要对反应物的浓度进行监测,以便得出反应速率随时间变化的规律,并在当中寻找反应速率的影响因素。
二、速率常数速率常数是定义在特定的温度下,各相同级数的反应物在单位时间内消失(或生成)的物质数与各反应物浓度乘积的积的比值。
在一定的反应条件下,速率常数是不随反应进行而改变的,与反应物的浓度及反应温度有关,在化学反应的机理研究中具有重要的地位。
三、反应级数反应级数是指一个反应中某一物质浓度与反应速率之间的关系。
简单来说,就是反应速率随着反应物浓度的变化而变化的趋势。
反应级数可以分为单级反应、双级反应、多级反应等。
对于不同类型的反应,反应级数的表达式也不同。
四、速率方程速率方程是指通过实验手段所测得的反应速率与各反应物浓度之间的关系式。
速率方程的表达式可以通过实验方法或理论研究的手段得出,在化学反应过程的研究中具有重要的意义。
通常情况下,速率方程可以分为一级反应、二级反应及其他级数反应。
在一些具有明显反应机理的反应当中,通过理论分析可以得到该反应的速率方程,从而加深对该反应的理解。
五、温度效应温度是影响化学反应速率的一个重要因素,它对反应速率的影响可以通过理论或实验方法进行研究。
实验表明,恒定压力下,反应速率大致随温度升高而增加,且不同反应速率的温度变化趋势可能不同。
根据阿累尼乌斯方程以及各分子在温度变化下的动能变化规律,可以得出“油滴实验”式、光化学反应式等与温度效应相关的化学反应机制。
反应的级数名词解释概述:在化学反应的研究中,我们经常会遇到反应级数这一概念。
反应级数是描述反应速率与反应物浓度之间关系的一个关键参数。
本文将对反应级数进行解释,并探讨不同级数对反应速率的影响。
反应级数的定义:反应级数是用来表征化学反应速率与反应物浓度之间的关系的参数。
它描述了当反应物浓度发生变化时,反应速率的变化趋势。
反应级数以反应物浓度为指数,决定了反应速率与反应物浓度的函数关系。
零级反应:零级反应是指反应速率与反应物浓度无关的情况。
在零级反应中,反应速率恒定,不受反应物浓度的影响。
这意味着无论反应物浓度如何变化,反应速率都保持不变。
零级反应常见于某些酶催化的反应或饱和反应条件下。
一级反应:一级反应是指反应速率与某个反应物浓度的一次方成正比的情况。
一级反应的速率方程可以表示为r = k[A],其中r为反应速率,k为速率常数,[A]为反应物A 的浓度。
一级反应的速率与反应物浓度成正比,即反应物浓度每增加一倍,反应速率也会增加一倍。
二级反应:二级反应是指反应速率与某个反应物浓度的二次方成正比的情况。
二级反应的速率方程可以表示为r = k[A]^2,其中r为反应速率,k为速率常数,[A]为反应物A的浓度。
二级反应的速率与反应物浓度的平方成正比,即反应物浓度每增加一倍,反应速率会增加四倍。
多级反应:除了零级、一级和二级反应之外,还存在其他级数的反应。
多级反应是指反应速率与某个反应物浓度的高于一次方的整数幂关系。
在多级反应中,速率方程总是包含反应物浓度的指数。
多级反应的速率常数通过实验测定,可以推导出其级数。
反应级数对反应速率的影响:不同级数的反应对反应速率有着不同的影响。
零级反应的速率恒定,与反应物浓度无关;一级反应的速率与反应物浓度成正比,反应物浓度越高,速率越快;二级反应的速率与反应物浓度的平方成正比,反应速率随着反应物浓度的增加而大幅增加。
结论:反应级数是描述反应速率与反应物浓度之间关系的重要参数。