2017高中化学专题1第一单元核外电子排布与周期律第1课时原子核外电子的排布同步习题苏教版必修2
- 格式:doc
- 大小:53.00 KB
- 文档页数:4


专题1 微观结构与物质的多样性第一单元核外电子排布与周期律§1-1-1原子核外电子的排布[教学目标]1、知识与技能目标(1)了解元素原子核外电子排布的基本规律,能用原子(离子)结构示意图表示原子(离子)的核外电子排布(2)了解原子核外电子的排布规律,元素的金属性和非金属性,元素的化合价、原子半径等随元素核电核数呈周期性变化的规律,认识元素周期率。
2、过程与方法目标培养学生分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。
[教学重、难点] 构成原子的微粒间的关系和核外电子排布规律。
培养分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。
了解假说、模型等科学研究方法和科学研究的历程。
[教学过程][复习提问]1.构成原子的粒子有哪些,它们之间有何关系?2.为什么原子不显电性?3.为什么说原子的质量主要集中原子核上?[引言]我们已经知道,原子是由原子核和电子构成的,原子核的体积很小,仅占原子体积的几千亿分之一,电子在原子内有“广阔”的运动空间。
在这“广阔”的空间里,核外电子是怎样运动的呢?[板书]原子核外电子的排布[交流与讨论1]原子在核外是怎样运动的?[回顾]原子结构模型的演变1.道尔顿原子结构模型:2.汤姆逊原子结构模型:3.卢瑟福原子有核模型4. 玻尔原子结构模型:[讲述]电子的运动具有区别于宏观物体的几大特征:(1)质量很小(9.109×10-31kg);(2)带负电荷;(3)运动空间范围小(直径约10-10m) ;(4)运动速度快(接近光速)。
因此,电子的运动特征就与宏观物体的运动有着极大的不同一一它没有确定的轨道。
[交流与讨论2]观察1-18号元素原子结构示意图,分析原子核外排布的规律。
[归纳]按能量高低分层排布。
(能量由低到高)K L M N O P Q ……1 2 3 4 5 6 7 ……[交流与讨论3]P3核外电子排布的规律:1.电子是在原子核外距核由近及远、能量由低至高的不同电子层上分层排布;2.每层最多容纳的电子数为2n2(n代表电子层数);3.电子一般总是尽先排在能量最低的电子层里,即最先排第一层,当第一层排满后,再排第二层,等等。

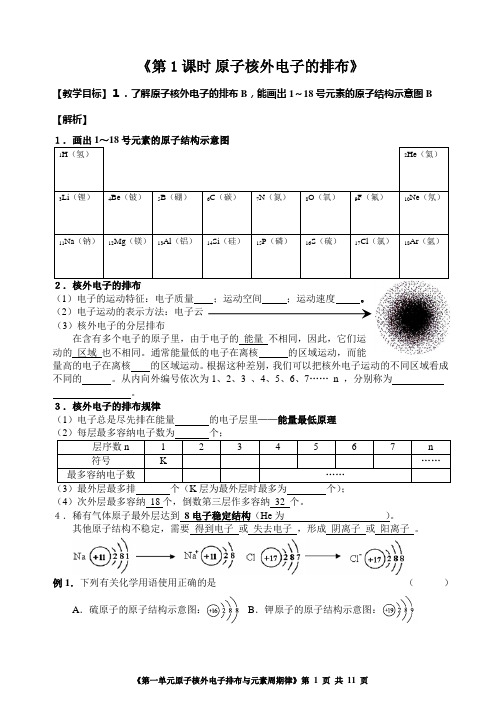
《第1课时原子核外电子的排布》【教学目标】1.了解原子核外电子的排布B,能画出1~18号元素的原子结构示意图B 【解析】(1)电子的运动特征:电子质量;运动空间;运动速度。
(2)电子运动的表示方法:电子云(3)核外电子的分层排布在含有多个电子的原子里,由于电子的能量不相同,因此,它们运动的区域也不相同。
通常能量低的电子在离核的区域运动,而能量高的电子在离核的区域运动。
根据这种差别,我们可以把核外电子运动的不同区域看成不同的。
从内向外编号依次为1、2、3 、4、5、6、7……n ,分别称为。
3.核外电子的排布规律(1)电子总是尽先排在能量的电子层里——能量最低原理)最外层最多排个(层为最外层时最多为个)(4)次外层最多容纳18个,倒数第三层作多容纳32 个。
4.稀有气体原子最外层达到8电子稳定结构(He为)。
其他原子结构不稳定,需要得到电子或失去电子,形成阴离子或阳离子。
例1.下列有关化学用语使用正确的是()A.硫原子的原子结构示意图:B.钾原子的原子结构示意图:C.氯离子的离子结构示意图:D.原子核内有10个中子的氧原子:《第1课时 原子核外电子的排布》练习1.下列有关Si 4214的说法不正确的是()A .Si 4214原子核内含有14个质子B .Si 4214的原子序数为14C .Si 4214的核外电子数为14D .Si 4214原子核内含有42个中子2.某微粒的核外电子的数目分别为:K 层2个,L 层8个,M 层8个,该微粒是( )A .氩原子B .钾离子C .氯离子D .无法确定3.某元素的原子核外有三个电子层,其最外层电子数是次外层电子数的一半,则此元素是( )A .SB .C C .SiD .Cl 4.下列表示式书写正确的是 ( )A .Cl -的结构示意图B .铝原子的结构示意图C .S 2-的结构示意图D .镁原子的结构示意图5.与Ne 的核外电子排布相同的离子是 ( )A .ClB .Na +C .K +D .S 2-6.某元素的原子最外层电子数为次外层电子数的3倍,则该元素原子核内质子数为( )A .3B .7C .8 .D .107.元素A 的原子获得2个电子或元素B 的原子失去3个电子后,它们的电子排布均与氖原 子的电子排布相同。


第1课时 原子核外电子的排布目标与素养:1.了解元素原子核外电子排布的基本规律。
(宏观辨识与微观探析)2.了解核外电子能量高低与分层排布的关系,能够写出常见简单原子的原子结构示意图。
(宏观辨识与微观探析)一、原子结构 1.原子的构成 (1)(2)在多电子原子里,电子的能量不同。
(3)在离核较近的区域运动的电子的能量较低,在离核较远的区域运动的电子能量较高。
2.电子层(1)概念:在多电子原子里,把电子运动的能量不同的区域简化为不连续的壳层,称为电子层。
(2)不同电子层的表示及能量关系(1)钠原子的结构示意图如下,请注明其意义(2)常见微粒结构示意图 氟原子:;镁原子:。
二、原子核外电子排布的规律 1.完成下列表格如19号元素K,由于受最外层电子数不超过8个的限制,其原子结构示意图为,而不能是。
1.判断正误(正确的打“√”,错误的打“×”)(1)F-和Na+的核外电子数均为10,故离子的结构示意图均为。
( )(2)O原子中含有的8个电子能量相同。
( )(3)电子总是尽量先排布在能量低的电子层。
( )(4)所有原子均由质子、中子、电子构成,缺一不可。
( )[提示](1)×(2)×(3)√(4)×2.排布在下列各电子层上的一个电子,所具有的能量最低的是( )A.K层B.L层 C.M层 D.N层[答案] A3.(1)S的原子结构示意图为____________。
(2)表示的微粒符号为________。
[答案](1) (2)Mg2+2.离子结构示意图①当主族中的金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与上一周期的稀有气体原子相同的电子层结构(电子层数相同,每层上所排的电子数也相同)。
如Mg:→Mg2+:。
②非金属元素的原子得电子形成简单离子时,形成和同周期的稀有气体原子相同的电子层结构。
如F:→F-:。
【典例1】下列粒子的结构示意图中,错误的是( )A.②③④⑤ B.①④⑤⑥ C.①②⑤⑥ D.①②④⑤D[①错误,K层最多只能容纳2个电子;②错误,Cl的核电荷数为17,最外层电子数为7;④错误,最外层电子不能超过8个;⑤错误,L层上电子为8个,M层上电子为5个。
1.1原子核外电子的排布
1.下列说法不正确的是 ( )
A .原子核外每层最多容纳的电子数为2n 2
(n 为电子层序数)
B .同一原子M 层上的电子数一定比L 层上的电子数多
C .如果原子只有一个电子层,该原子的核电荷数不超过2
D .核电荷数1~18的元素,每层电子数都满足2n 2个电子的元素只有2种
2.下列粒子的结构示意图中,错误的是( )
A .②③④⑤
B .①④⑤⑥
C .①②⑤⑥
D .①②④⑤
3.下列微粒的示意图中表示阴离子的是( )
4.某元素原子的最外层电子数与次外层电子数相同,且最外层电子数与次外层电子数之和小于8,该元素为( )
A .锂
B .铍
C .氦
D .钙
5.根据下列原子某层的电子数,能确定该元素的原子序数的是( )
A .K 层上有2个电子
B .L 层上有3个电子
C .次外层有8个电子
D .最外层有5个电子
6.某元素原子的核外有2个电子层,最外层有6个电子,该元素原子核内质子数为( )
A .6
B .8
C .14
D .16
7.在核电荷数为1~18的元素中,下列说法错误的是( )
A .最外层电子数与电子层数相等的元素为H 、Be 、Al
B .最外层电子数与核内质子数相等的元素为H 、He
C .最外层电子数为2的元素都是金属元素
D .最外层电子数是次外层电子数12
的元素为Li 、Si
8.下列各组微粒中,均具有10个电子的是( )
A .K +和O 2-
B .Na 和F -
C .H 2O 和NH +4
D .OH -和F 2 9.有A 、B 两种原子,A 原子的M 层比B 原子的M 层少3个电子,B 原子的L 层电子数恰好是A 原子的L 层电子数的2倍,A 和B 分别是 ( )
A .硅原子和钠原子
B .硼原子和氢原子
C .氯原子和碳原子
D .碳原子和铝原子
10.有A 、B 、C 、D 四种元素,A 元素是地壳中含量最多的金属元素;B 元素的原子M 层电子数比L 层少1个电子;C 元素的原子得到2个电子、D 元素的原子失去1个电子所得到的微粒都具有与氖原子相同的电子层结构。
回答下列问题:
(1)上述四种元素中C 的名称是________;
(2)画出B 元素原子的结构示意图________;
(3)写出下列方程式:
单质D 在单质C 中燃烧的化学方程式_______________;
A 的氢氧化物和D 的氢氧化物反应的离子方程式______________________。
11.有几种元素的微粒的电子层结构如图所示: 其中:
(1)某电中性微粒X 一般不与其他元素的原子反应,X 的化学符号是________。
(2)某微粒Y 的盐溶液,加入AgNO 3溶液时会出现白色沉淀,则这种微粒的化学符号是________。
(3)某微粒Z 氧化性很弱,但得到电子后成为一种还原性强的中性原子,且这种原子有一个单电子,这种微粒的化学符号是________。
(4)某微粒M 具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的化学符号是________。
12.A +、B +、C -
、D 、E 五种微粒(分子或离子),它们分别含有10个电子,已知它们有
如下转化关系: ①A ++C -――→△
D +E↑
②B ++C -―→2D
(1)写出①的离子方程式:_______________________________________,
写出②的离子方程式:_______________________________________。
(2)除D 、E 外,请再写出两种含10个电子的分子:_________________。
(3)除A +、B +外,请再写出两种10个电子的阳离子:
________________。
13.在第n 电子层中,当它作为原子的最外层时,其最多容纳的电子数与第(n -1)层相同;当它作为原子的次外层时,其最多容纳的电子数比(n -1)层多10个,则对此电子层的判断正确的是( )
A .必为K 层
B .必为L 层
C .必为M 层
D .可为任意层 13 C
14.现有四种元素A 、B 、C 、D ,已知A -核外有18个电子;B 原子最外层电子数比D 原子核外电子数多2个,B 原子比D 原子多2个电子层:D +核外没有电子;C 元素原子核外电子比B 元素的原子核外电子少2个。
(1)C 的原子结构示意图为________;A -的结构示意图为________。
(2)四种元素的简单离子中与氖具有相同核外电子排布的是________(填离子符号)。
(3)C 的单质与水反应的离子方程式为___________________。
15.A 、B 、C 、D 四种元素,它们原子的核电荷数均小于18,且依次递增,A 原子核内仅有一个质子,B 原子的电子总数与D 原子的最外层电子数相等。
A 原子与B 原子的最外层电子数之和与C 原子的最外层电子数相等,D 原子有两个电子层,最外层电子数是次外层电子数的3倍。
(1)试推断它们各是什么元素,写出它们的元素符号:
A________,B________,C________,D________。
(2)画出C 原子的原子结构示意图________,D 离子的离子结构示意图________。
(3)写出由这四种元素组成一种化合物的化学式________。
(4)写出实验室制取D 2的化学方程式__________。
(5)写出B 单质与浓H 2SO 4反应的化学方程式_______________________。
答案
1 B
2 D
3 D
4 B
5 B
6 B
7 C
8 C
9 D
10 (1)氧元素 (2)
(3)2Na +O 2=====点燃Na 2O 2
Al(OH)3+OH -===AlO -
2+2H 2O
11 (1)Ar (2)Cl - (3)K + (4)S 2-
12 (1)NH +4+OH -=====△
NH 3↑+H 2O
H 3O ++OH -===2H 2O (2)Ne 、CH 4
(3)Na +、Mg 2+
14
(2)Al 3+、Na +
(3)2Na +2H 2O===2Na ++2OH -+H 2↑ 15 (1)H C N O
(3)NH 4HCO 3或(NH 4)2CO 3
(4)2H 2O 2=====MnO 2
2H 2O +O 2
(5)C +2H 2SO 4(浓)=====△
CO 2↑+2SO 2↑+2H 2O。