核外电子排布规律
- 格式:ppt
- 大小:2.53 MB
- 文档页数:9

原子核外电子排布规律①能量最低原理:电子层划分为K<L<M<O<P<Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子。
③最外层最多只能容纳8个电子(K层为最外层时不能超过2个)次外层最多只能容纳18个电子(K层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:(1)离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的。
阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH4、N3、NH2、NH3、NH4、O2、OH H2O、H3O F HF、Ne、Na Mg2、Al3等。
②18电子粒子:SiH4、P3、PH3、S2、HS H2S、Cl HCl、Ar、K Ca2、PH4等。
特殊情况:F2、H2O2、C2H6、CH3OH③核外电子总数及质子总数均相同的阳离子有:Na NH4、H3O F OH NH2;HS Cl前18号元素原子结构的特殊性:(1)原子核中无中子的原子:11H(2)最外层有1个电子的元素:H、Li、Na;最外层有2个电子的元素:Be、Mg、He (3)最外层电子总数等于次外层电子数的元素:Be、Ar(4)最外层电子数等于次外层电子数2倍的元素:C ;是次外层电子数3倍的元素:O ;是次外层电子数4倍的元素:Ne(5)最外层电子数是内层电子数一半的元素:Li、P(6)电子层数与最外层电子数相等的元素:H、Be、Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He例外)(2)在元素周期表中,同周期的ⅡA、ⅢA族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。

原子处于基态时,其核外电子的排布遵循三条重要原则:
(1)泡利不相容原理(:一个原子轨道最多只能容纳两个自旋相反的电子,或者在一个原子中不可能存在4个量子数完全相同的两个电子;
(2)能量最低原理:在不违背泡利原理的条件下,电子优先占据能量较低的原子轨道,即电子按低能轨道顺序向高能轨道逐一填充,使整个原子体系能量处于最低状态;
(3)洪特规则:在能量相等(等价)的轨道上电子尽可能以相同的自旋方向分占不同的轨道;当等价轨道上电子处于全充满、半充满时,原子能量较低,比较稳定。

原子核外电子排布规律①能量最低原理:电子层划分为K〈L<M<O<P〈Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则。
②每个电子层最多只能容纳2n2个电子。
③最外层最多只能容纳 8个电子(K层为最外层时不能超过2个)次外层最多只能容纳18个电子(K层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾、简单例子得结构特点:(1)离子得电子排布:主族元素阳离子跟上一周期稀有气体得电子层排布相同,如钠离子、镁离子、铝离子与氖得核外电子排布就是相同得。
阴离子更同一周期稀有气体得电子排布相同:负氧离子,氟离子与氖得核外电子排布就是相同得。
(2)等电子粒子(注意主要元素在周期表中得相对位置)①10电子粒子:CH、N、NH、NH、NH、O、OH、HO、HO、F、HF、Ne、Na、Mg、Al等。
②18电子粒子:SiH、P、PH、S、HS、HS、Cl、HCl、Ar、K、Ca、PH等。
特殊情况:F、HO、CH、CHOH③核外电子总数及质子总数均相同得阳离子有:Na、NH、HO等;阴离子有:F、OH、NH; HS、Cl等。
前18号元素原子结构得特殊性:(1)原子核中无中子得原子:H(2)最外层有1个电子得元素:H、 Li、Na;最外层有2个电子得元素:Be、Mg、He(3)最外层电子总数等于次外层电子数得元素:Be、Ar(4)最外层电子数等于次外层电子数2倍得元素:C ;就是次外层电子数3倍得元素:O ;就是次外层电子数4倍得元素:Ne(5)最外层电子数就是内层电子数一半得元素:Li、P(6)电子层数与最外层电子数相等得元素:H、Be、Al(7)电子总数为最外层电子数2倍得元素:Be(8)次外层电子数就是最外层电子数2倍得元素:Li、Si元素周期表得规律:(1)最外层电子数大于或等于3而又小于8得元素一定就是主族元素,最外层电子数为1或2得元素可能就是主族、副族或0族元素,最外层电子数为8得元素就是稀有气体(He例外)(2)在元素周期表中,同周期得ⅡA、ⅢA族元素得原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差25(3)同主族、邻周期元素得原子序数差①位于过渡元素左侧得主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差得数分别为2,8,8,18,18,32②位于过渡元素左侧得主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。

原子核外电子排布应遵循的三大规律(一)泡利不相容原理:
1.在同一个原子里,没有运动状态四个方面完全相同的电子存在,这个结论叫泡利不相容原理。
泡利:奥地利物理学家,1945年获诺贝尔物理学奖。
2.根据这个原理,如果有两个电子处于一个轨道(即电子层电子亚层电子云的伸展方向都相同的轨道),那么这两个电子的自旋方向就一定相反。
3.各个电子层可能有的最多轨道数为,每个轨道只能容纳自旋相反的两个电子,各电子层可容纳的电子总数为2个。
(二)能量最低原理:
1.在核外电子的排布中,通常状况下,电子总是尽先占有能量最低的原子轨道,只有当这些原子轨道占满后,电子才依次进入能量较高的原子轨道,这个规律叫能量最低原理。
2.能级:就是把原子中不同电子层和亚层按能量高低排布成顺序,象台阶一样叫做能级。
(1)同一电子层中各亚层的能级不相同,它们是按,,d,f的次序增高。
不同亚层:nE4S , E4d >E5S,n≥3时有能级交错现象。
3.电子填入原子轨道顺序:1 22 33 43d4 54d5 64f5d6 75f6d7,能级由低渐高。
(三)洪特规则:
1.在同一亚层中的各个轨道上,电子的排布尽可能单独分占不同的轨道,而且自旋方向相同,这样排布整个原子能量最低。
2.轨道表示式和电子排布式:
轨道表示式:一个方框表示一个轨道
电子排布式:亚层符号右上角的数字表示该亚层轨道中电子的数目
3.洪特规则的特例:
同一电子亚层中当电子排布全充满、半充满、全空比较稳定。
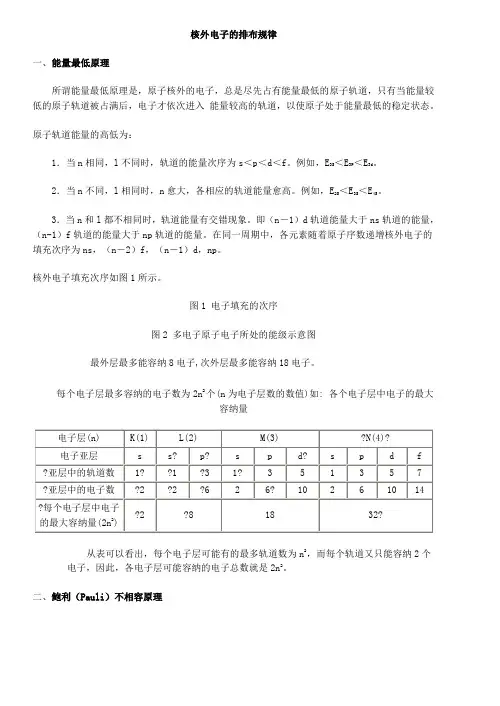
核外电子的排布规律一、能量最低原理所谓能量最低原理是,原子核外的电子,总是尽先占有能量最低的原子轨道,只有当能量较低的原子轨道被占满后,电子才依次进入能量较高的轨道,以使原子处于能量最低的稳定状态。
原子轨道能量的高低为:1.当n相同,l不同时,轨道的能量次序为s<p<d<f。
例如,E3S<E3P<E3d。
2.当n不同,l相同时,n愈大,各相应的轨道能量愈高。
例如,E2S<E3S<E4S。
3.当n和l都不相同时,轨道能量有交错现象。
即(n-1)d轨道能量大于ns轨道的能量,(n-1)f轨道的能量大于np轨道的能量。
在同一周期中,各元素随着原子序数递增核外电子的填充次序为ns,(n-2)f,(n-1)d,np。
核外电子填充次序如图1所示。
图1 电子填充的次序图2 多电子原子电子所处的能级示意图最外层最多能容纳8电子,次外层最多能容纳18电子。
每个电子层最多容纳的电子数为2n2个(n为电子层数的数值)如: 各个电子层中电子的最大容纳量从表可以看出,每个电子层可能有的最多轨道数为n2,而每个轨道又只能容纳2个电子,因此,各电子层可能容纳的电子总数就是2n2。
二、鲍利(Pauli)不相容原理鲍利不相容原理的内容是:在同一原子中没有四个量子数完全相同的电子,或者说在同一原子中没有运动状态完全相同的电子。
例如,氦原子的1s轨道中有两个电子,描述其中一个原子中没有运动状态的一组量子数(n,l,m,ms)为1,0,0,+1/2,另一个电子的一组量子数必然是1,0,0,-1/2,即两个电子的其他状态相同但自旋方向相反。
根据鲍利不相容原理可以得出这样的结论,在每一个原子轨道中,最多只能容纳自旋方向相反的两个电子。
于是,不难推算出各电子层最多容纳的电子数为2n2个。
例如,n=2时,电子可以处于四个量子数不同组合的8种状态,即n=2时,最多可容纳8个电子,见下表。
在等价轨道中,电子尽可能分占不同的轨道,且自旋方向相同,这就叫洪特规则。

精心整理原子核外电子排布规律①能量最低原理:电子层划分为K<L<M<O<P<Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子。
③最外层最多只能容纳8个电子(K层为最外层时不能超过2个)次外层最多只能容纳18个电子(K层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:(1)离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的。
阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH4、N-3、NH-2、NH3、NH+4、O-2、OH-、H2O、H3O+、F-、HF、Ne、Na+、Mg+2、Al+3等。
②18电子粒子:SiH4、P-3、PH3、S-2、HS-、H2S、Cl-、HCl、Ar、K+、Ca+2、PH+4等。
特殊情况:F2、H2O2、C2H6、CH3OH③核外电子总数及质子总数均相同的阳离子有:Na+、NH+4、H3O+等;阴离子有:F-、OH-、NH-2;HS-、Cl-等。
前18号元素原子结构的特殊性:(1)原子核中无中子的原子:11H(2)最外层有1个电子的元素:H、Li、Na;最外层有2个电子的元素:Be、Mg、He(3)最外层电子总数等于次外层电子数的元素:Be、Ar(4)最外层电子数等于次外层电子数2倍的元素:C;是次外层电子数3倍的元素:O;是次外层电子数4倍的元素:Ne(5)最外层电子数是内层电子数一半的元素:Li、P(6)电子层数与最外层电子数相等的元素:H、Be、Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He例外)(2)在元素周期表中,同周期的ⅡA、ⅢA族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。

核外电子排布规律总结原子核外电子排布规律①能量最低原理:电子层划分为KvLvMvOvPv对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子③最外层最多只能容纳8个电子(K层为最外层时不能超过2个)次外层最多只能容纳18个电子(K层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:⑴离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的。
阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10 电子粒子:CH4、N3、NH,、NH3、NH4、O2、OH、H, O H3O、F、HF、Ne Na、Mg2、Al 3等。
②18 电子粒子:SiH4、P3、Pli、S2、HS、H2S、Cl 、HCI、Ar、K、Ca2、PH^ 等。
特殊情况:F2、H2O2、C2H6、CI^OH③核外电子总数及质子总数均相同的阳离子有:Na、NH、H3O等;阴离子有:F、OH、NH, ;HS 、CI 等。
前18号元素原子结构的特殊性:(1)原子核中无中子的原子:;H(2)最外层有1个电子的元素:H、Li、Na;最外层有2个电子的元素:Be、Mg He(3)最外层电子总数等于次外层电子数的元素:Be Ar(4)最外层电子数等于次外层电子数2倍的元素:C ;是次外层电子数3倍的元素:O ;是次外层电子数4倍的元素:Ne(5)最外层电子数是内层电子数一半的元素:Li、P(6)电子层数与最外层电子数相等的元素:H、Be Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2 的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He例外)(2)在元素周期表中,同周期的U A、川A族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6 7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即I A、U A 族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即川A〜%A族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。

原子核外电子排布规律①能量最低原理:电子层划分为K<L<M<O<P<Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子。
③最外层最多只能容纳 8个电子(K层为最外层时不能超过2个)次外层最多只能容纳18个电子(K层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:(1)离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的。
阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH4、N-3、NH-2、NH3、NH+4、O-2、OH-、H2O、H3O+、F-、HF、Ne、Na+、Mg+2、Al+3等。
②18电子粒子:SiH4、P-3、PH3、S-2、HS-、H2S、Cl-、HCl、Ar、K+、Ca+2、PH+4等。
特殊情况:F2、H2O2、C2H6、CH3OH③核外电子总数及质子总数均相同的阳离子有:Na+、NH+4、H3O+等;阴离子有:F-、OH-、NH-2; HS-、Cl-等。
前18号元素原子结构的特殊性:(1)原子核中无中子的原子:11H(2)最外层有1个电子的元素:H、 Li、Na;最外层有2个电子的元素:Be、Mg、He(3)最外层电子总数等于次外层电子数的元素:Be、Ar(4)最外层电子数等于次外层电子数2倍的元素:C ;是次外层电子数3倍的元素:O ;是次外层电子数4倍的元素:Ne(5)最外层电子数是内层电子数一半的元素:Li、P(6)电子层数与最外层电子数相等的元素:H、Be、Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He例外)(2)在元素周期表中,同周期的ⅡA、ⅢA族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。

原子核外电子排布规律 IMB standardization office【IMB 5AB- IMBK 08- IMB 2C】原子核外电子排布规律①能量最低原理:电子层划分为K<L<M<O<P<Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子。
③最外层最多只能容纳8个电子(K层为最外层时不能超过2个)次外层最多只能容纳18个电子(K层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:(1)离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的。
阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH4、N?3、NH?2、NH3、NH?4、O?2、OH?、H2O、H3O?、F?、HF、Ne、Na?、Mg?2、Al?3等。
②18电子粒子:SiH4、P?3、PH3、S?2、HS?、H2S、Cl?、HCl、Ar、K?、Ca?2、PH?4等。
特殊情况:F2、H2O2、C2H6、CH3OH③核外电子总数及质子总数均相同的阳离子有:Na?、NH?4、H3O?等;阴离子有:F?、OH?、NH?2;HS?、Cl?等。
前18号元素原子结构的特殊性:(1)原子核中无中子的原子:11H(2)最外层有1个电子的元素:H、Li、Na;最外层有2个电子的元素:Be、Mg、He(3)最外层电子总数等于次外层电子数的元素:Be、Ar(4)最外层电子数等于次外层电子数2倍的元素:C;是次外层电子数3倍的元素:O;是次外层电子数4倍的元素:Ne(5)最外层电子数是内层电子数一半的元素:Li、P(6)电子层数与最外层电子数相等的元素:H、Be、Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He例外)(2)在元素周期表中,同周期的ⅡA、ⅢA族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。

①能量最低原理:电子层划分为K<L<M<O<P<Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子。
③最外层最多只能容纳8个电子(K层为最外层时不能超过2个)次外层最多只能容纳18个电子(K层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:(1)离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的。
阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH4、N3、NH2、NH3、NH4、O2、OH、H2O、H3O、F、HF、Ne、Na、Mg2、Al3等。
②18电子粒子:SiH4、P3、PH3、S2、HS、H2S、Cl、HCl、Ar、K、Ca2、PH4等。
特殊情况:F2、H2O2、C2H6、CH3OH③核外电子总数及质子总数均相同的阳离子有:Na、NH4、H3O等;阴离子有:F、OH、NH2;HS、Cl等。
前18号元素原子结构的特殊性:(1)原子核中无中子的原子:11H(2)最外层有1个电子的元素:H、Li、Na;最外层有2个电子的元素:Be、Mg、He (3)最外层电子总数等于次外层电子数的元素:Be、Ar(4)最外层电子数等于次外层电子数2倍的元素:C ;是次外层电子数3倍的元素:O ;是次外层电子数4倍的元素:Ne(5)最外层电子数是内层电子数一半的元素:Li、P(6)电子层数与最外层电子数相等的元素:H、Be、Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He例外)(2)在元素周期表中,同周期的ⅡA、ⅢA族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。

原子核外电子排布规律
原子核外电子排布规律:电子总是尽先排布在能量最低的电子层里;每个电子层最多只能排布2n2个电子;K层为最外层时,最多只能容纳两个电子;其它各层为最外层时,最多只能容纳8个电子;次外层最多不超过18个电子。
原子核外电子排布规律是指介绍原子核外电子的排布规律,主要有泡利不相容原理、能量最低原理、洪特定则、不相容原理等。
1、泡利不相容原理:每个轨道最多只能容纳两个电子,且自旋相反配对。
2、能量最低原理:电子尽可能占据能量最低的轨道。
3、洪特规则:当电子排布在同一能级(能量相同)的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相同。
原子核atomic nucleus简称“核”。
位于原子的核心部分,由质子和中子两种微粒构成。
而质子又是由两个上夸克和一个下夸克组成,中子又是由两个下夸克和一个上夸克组成。
原子核极小,它的直径在10m~10m之间,体积只占原子体积的几千亿分之一,在这极小的原子核里却集中了99.96%以上原子的质量。
原子核的密度极大,核密度约为
10^17kg/m,即1m的体积如装满原子核,其质量将达到10^14t,即1百万亿吨。
感谢您的阅读,祝您生活愉快。
v核外电子层排布
核外电子的分层排布规律:
1、第一层不超过2个,第二层不超过8个;
2、最外层不超过8个。
每层最多容纳电子数为2n2个(n代表电子层数),即第一层不超过2个,第二层不超过8个,第三层不超过18个;
3、最外层电子数不超过8个(只有1个电子层时,最多可容纳2个电子)。
4、最低能量原理:电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
5、泡利原理:每个原子轨道里最多只能容纳2个电子,且自旋状态相反。
6、洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。