多组分-相平衡-化学平衡小结
- 格式:ppt
- 大小:503.01 KB
- 文档页数:32


第五章 相平衡相律f=C-φ+2 对渗透平衡 f=C-φ+3 浓度限制条件必须在同一相中应用,例:开始时仅有NH 4Cl (s) NH 4Cl (s)= NH 3(g)+HCl(g) R ’=1 开始时已有NH 3(g) 或HCl(g) NH 4Cl (s)= NH 3(g)+HCl(g) R ’=0 CaCO 3(s)=CaO(s)+CO 2(g) R ’=0NH 4HCO 3(s)=NH 3(g) + CO 2(g) + H 2O(g) R ’=2 在同时平衡体系中独立组分数确定的简便方法:独立组分数C=N 元素的数目应用条件:(1)体系达同时平衡 (2)体系中无浓度限制条件(即R ’=0) (3) 构成化合物的元素至少有一种以单质形式存在于体系中 在习题中,以上三条件一般均满足例如:某体系平衡时存在C(s)、H 2O(g)、CO(g)、CO 2(g)、H 2(g)五种物质, 求该体系的独立组分数C :解:H 2O(g) 中的 H 元素以单质H 2(g)存在于平衡体系中,以上三条件均满足 体系中元素为:C ,H , O 3种 所以独立组分数 C=3此题按常规解,则需先写出体系中独立的化学反应:CO 2(g)+H 2(g)------ H 2O(g)+CO(g) CO 2(g)+C(s)------ 2CO(g) C =S -R -R'=5-2-0=3例:下列化学反应,同时共存并到达平衡(温度在900~1200 K 范围内): CaCO 3(s)=CaO(s)+CO 2(g) CO 2(g)+H 2(g)=CO(g)+H 2O(g)CaCO 3(s)+H 2(g) =H 2O(g)+CO(g)+CaO(s) 问该体系的自由度为_______。
[答] 体系中元素为:C ,H , O Ca 4种 所以独立组分数 C=4 因为(1) + (2)=(3) 所以R =2 。
S =6 ,C =6-2=4 ∴f =4-3+2=3单组分系统的相平衡一.克拉贝龙(Clapeyron)方程VT HV S dT dp ∆∆=∆∆= (克拉贝龙方程) 适用于纯物质的两相平衡。

化学平衡小结化工生产及与应用有关的化学研究中,人们最关心的问题莫过于化学反应的方向及反应平衡时的转化率,因为它关系到在一定条件下,反应能否按所希望的方向进行、最终能得到多少产物,反应的经济效益如何。
在化学发展史上,这一问题曾经长期困扰着人们,而从理论上彻底阐明这一原理的是美国化学家吉布斯。
在十九世纪的五、六十年代,热力学仅处于热机效率的研究阶段,而化学还基本上是一门经验科学。
是吉布斯在1874年提出和相平衡问题,进而从理论上根本解决了这一难题,并因此打破了物理与化学两大学科的界限,为物理化学这一理论化学学科的建立奠定了基础。
吉布斯在热力学发展史和化学发展史上做出了巨大贡献,可以说是他将热力学引入了化学,使热力学在化学中焕发了强有力的生命力,同时使化学成为一门有理论指导的科学。
第一节1.摩尔反应进度的吉布斯函数变T、p且W’= 0时,一化学反应的进度为d时,有:设有化学反应:对于多组分系统在()T,p下,-ΔrGm为反应的推动力,常称为化学亲合势在一定的温度和压力下,总Gibbs自由能最低的状态就是反应系统的平衡状态。
亦即反应进行的最大限度。
ΔrGm=0为化学反应的平衡条件。
第二节一、理想气体反应的等温方程理想气体混合物中组分B的化学势为二、理想气体反应的标准平衡常数⒊Kn与Kθ的关系4.理想气体反应的K0、Kc0、Ky及Kn5.标准态压力对标准平衡常数的影响说明:(1)Kθ、Kcθ、Ky 和Kn 中只有Kθ是国家规定的标准平衡常数。
(2)Kθ、Kcθ和Kp 与温度有关而与压力无关,而Ky 和Kn 与总压力有关。
(3)当νBB∑=0时,Kθ=Kcθ=Ky=Kn=Kp 6.有凝聚态物质参与的理想气体反应在有凝聚相物质参与的理想气体反应中,标准平衡常数K0中不出现凝聚相物质。
第三节物理法:测定平衡反应系统某一物理量,如压力、气体体积、折射率、电导、光吸收等来计算平衡组成,一般不会影响平衡。
化学法:例如通过化学滴定来测定平衡组成,一般需用降温、移走催化剂、加入溶剂冲淡等方法中止反应。


高中化学平衡知识点整理在高中化学学习中,平衡是一个十分重要且基础的概念。
平衡反应是指在一个封闭系统中,反应物转变为生成物的速率相等时达到的一种动态平衡状态。
平衡反应又可以细分为物理平衡和化学平衡。
下面对高中化学平衡知识点进行整理。
1. 平衡反应的特点在平衡反应中,反应物和生成物的浓度保持不变,但它们仍在转化,并处于动态平衡状态。
平衡反应的速率恒定且相等,这也是动态平衡的一种表现。
2. 平衡常数平衡常数是用来描述一个反应达到平衡时反应物和生成物浓度的比例。
平衡常数通常用Kc、Kp来表示,取决于反应方程式中各物质的浓度或分压。
3. 影响平衡位置的因素平衡位置的位置取决于平衡常数以及反应温度、压力等因素。
当平衡常数Kc大于1时,表示生成物浓度较高;当Kc小于1时,表示生成物浓度较低。
4. 平衡常数的计算平衡常数的计算需要通过反应方程式来确定各物质浓度或分压,从而得出平衡常数的数值。
平衡常数的大小可以告诉我们反应的进行方向。
5. 平衡位置的变化通过调节温度、压力或者浓度等因素,可以改变平衡位置。
Le Chatelier原理指出,在受到外界因素影响时,系统会通过调整以恢复平衡,以维持平衡动态状态。
6. 平衡常数与反应热力学反应在不同温度下的平衡常数会发生变化,这与热力学原理有关。
反应的焓变和熵变可以帮助我们理解平衡常数变化的原因。
以上就是对高中化学平衡知识点的整理,希望可以帮助大家更好地理解平衡反应的相关概念。
学习化学需要多加练习和实验,加深对平衡反应的理解,有助于提高学习效果。
愿大家取得更好的成绩!。

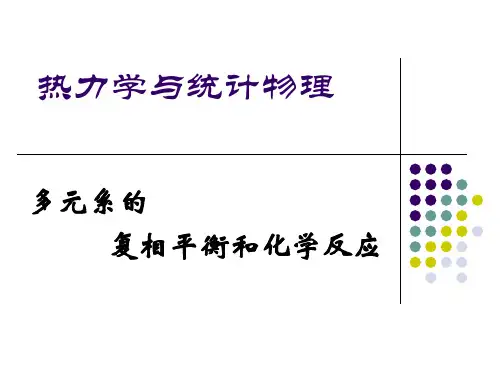
分离的概念:分离是利用混合物中各组分在物理性质或化学性质上的差异,通过适当的装置或方法,使各组分分配至不同的空间区域或者在不同的时间一次分配至同一空间区域的过程。
分离的形式1.组分离(族分离):性质相近的一类组分从混合物体系中分离。
例如:药物和石油的分离。
2.单一分离:将某种化合物以纯物质的形式从混合物中分离出来。
3.多组分相互分离:混合物中所有组分相互分离(复杂天然产物分离为纯组分)4.特定组分分离:将某一感兴趣物质从中分离(其余物质混合在一起)5.部分分离:每种物质都存在于被分开的几个部分中,对每一个部分而言,是以某种物质为主,含有少量其他组分(每种物质都存在于被分开的几个部分)富集:目标化合物浓度在某空间增加浓缩:溶剂与溶质的相互分离纯化:目标产物中除去杂质纯度:表示纯化产物主组分含量高低或所含杂质多少的概念。
重结晶是化学合成中最常用的提纯手段分离科学的表述:是研究从混合物中分离、富集或纯化某些组分以获得相对纯物质的规律及其应用的学科。
分离技术应用原因:1.实际样品的复杂性2.分析方法灵敏度的局限性干扰的消除:1.控制实验条件2.使用掩蔽剂3.分离满足对灵敏度的要求:1.选择灵敏度高的方法2.富集评价分离效果:1.干扰成分减少至不再干扰2.待测组分有效回收质量分数> 1% 回收率> 99.9 % 以上质量分数0.01% ~1% 回收率> 99 %质量分数< 0.01 % 回收率> 95 % 或更低分离的目的:①分析操作的样品前处理②确认目标物质的结构③获取单一纯物质或某类物质以作他用④除掉有害或有毒物质:例如污水排放分离技术的特点:①分离对象物质种类繁多②分离目的各不相同③分离规模差别很大④分离技术形形色色⑤应用领域极为广泛分离科学的内容:1.研究分离过程的共同规律(热力学、动力学、平衡)2.研究基于不同分离原理的分离方法、分离设备及其应用分分离的基本原则:1.离因子尽可能高;2.分离剂或能量尽可能少;3.产品纯度尽可能高;4.设备极可能便宜;5.操作尽可能简单;6.分离速度尽可能快。

作业55-1指出下列平衡体系中的物种数,组分数,相数和自由度数。
(1)CaSO4的饱和水溶液【解答】S=2, C=2, Φ=2, f=C-Φ+2=2(2)5 g氨气通入1 dm3水中,在常温常压下与蒸汽平衡共存【解答】S=3(NH3,H2O,NH4OH),C=2,Φ=2, f=2(虽为常温常压,但并没有确定值。
)(3)Na+,Cl-,K+,NO3-,H2O(l)达平衡【解答】S=5,C=4(有一个电中性条件),Φ=1,f=5(4)NaCl(s),KCl(s), NaNO3(s)与KNO3(s)的混合物与水平衡【解答】S=5,C=5,Φ=5,f=C-Φ+2=2。
(本题若同时考虑离子种类数,则S=9,但由于同时存在四个电离子方程式,因此C=5)5-2在水、苯、苯甲酸体系中,若任意指定下列事项,则体系中最多可能有几个相?并各举一例说明之。
(1)指定温度;【解答】S=3,C=3,f=C-Φ+1=4-Φ,Φ=4(温度指定)max如H2O(l),C6H6(l),C6H5COOH(s),气相。
(2)指定温度与水中苯甲酸的浓度;【解答】Φ=3,H2O(l),C6H6(l),气相。
依题意,当指定水中苯甲max酸的浓度后,苯相中苯甲酸浓度也随之而定,同时,固相消失。
(3)指定温度、压力与苯中苯甲酸的浓度。
【解答】Φ=2,即液相,气相。
max5-4 试求下述体系的自由度并指出变量是什么? (1)在p θ压力下,液体水与水蒸汽达平衡; 【解答】C=1,Φ=2,f=0(无变量) (2)液体水与水蒸汽达平衡;【解答】C=1,Φ=2,f=1(温度或压力)(3)25℃和p θ压力下,固体NaCl 与其水溶液成平衡; 【解答】C=2,Φ=2,f=0(4)固态NH 4HS 与任意比例的H 2S 及NH 3的气体混合物达化学平衡;【解答】C=2,Φ=2,f=2 (5)I 2(s)与I 2(g)成平衡。
【解答】C=1,Φ=2,f=15-6 已知苯胺的正常沸点为185℃,请依据Truton 规则求算苯胺在2666 Pa 时的沸点。

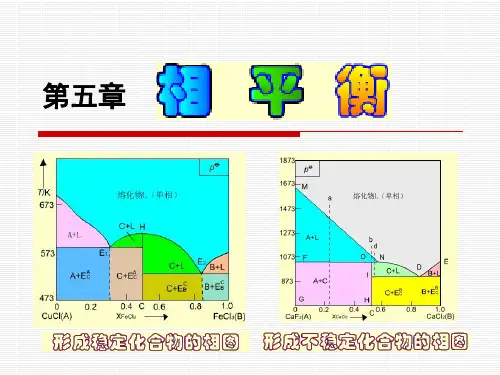
第六章 多组分系统的相平衡我们把系统中具有相同强度状态的一切均匀部分的总体称为相,即在一个相内具有相同的强度状态,例如在纯物质的一个相内应具有相同的压力、温度等。
而具有相同成分的,强度状态相同的均匀部分,称为多组分系统。
把由强度状态不同的部分组成的系统称为非均相或多相系统,也称复相系统。
在纯物质的多相系统中,处于平衡的各相的温度和压力都是相同的,例如我们所熟知的处于平衡中的液态水与水蒸气就是这样。
但在多组分的多相系统中,当系统内部处于平衡时,除各相温度和压力必须相同外,还应具备其他附加条件,这是在本章中将要研究的。
和前面一样,这里所讨论的系统将不考虑表面作用,以及其它外势场如电场或磁场等的影响,固体不变形。
此外,系统内也不发生化学反应。
6-1 多相系统的热力性质由前可知,一个包含r 个组分的均勾相,如果它们在温度T 和压力p 时处于热平衡和力平衡状态,那么自由焓可表成式1ri i G n μ=∑, 其中,,ji i T P n G n μ⎛⎫∂= ⎪∂⎝⎭ 式中,每个化学势都是T 、p 和相应组分的摩尔分数的函数。
如果这个相内有,,idT dP dn 微小变化时,则相应的自由焰的变化将如下式所示∑++-=riidn uvdp sdT dG 1若有一个包含ϕ个相的多相系统,各相都是各自均匀比而且都处于均匀的温度T 和压力p下,则此多相系统的总自由焓G 将是所有各相的自由始之相,即(1)(1)(2)(2)()()111rrri ii iiiG n n n ϕϕμμμ=++⋅⋅⋅+∑∑∑如果系统内发生一无限小的过程,过程中所有各相都有温度变化dT 和压力变化d P ,则自由焓的变化将为(1)(1)(1)(1)(2)(2)(2)(2)()()()()i ii iiidG S dT VdP dn SdT VdP dn SdT VdP dn ϕϕϕϕμμμ=-++-++-⋅⋅⋅-++∑∑∑因为熵和容积为广延量,所以多相系统S,V 为各相之和(1)(1)(2)(2)()()iiiiiidG SdT VdP dn dn dn ϕϕμμμ=-++++⋅⋅⋅+∑∑∑在一个多相系统中,平衡的问题在于找出备相处于化学平衡时在各化学势之间应存在的方程或方程组。
[收稿时间]2020-02-18[基金项目]四川师范大学2019年“课程思政”示范课程。
[作者简介]毛双(1972-),男,四川广元人,博士,副教授,研究方向:物理化学。
[摘要]课程思政建设是当前专业课程教学改革的重要内容。
文章结合高等学校化学类专业物理化学课程相关教学内容与教学要求的建议以及化学类专业人才培养目标,以“水的相图”教学为例,研讨在物理化学课程教学中培养学生的科学素养、正确的世界观与方法论、家国情怀与献身精神、创新意识与实践能力。
[关键词]课程思政;物理化学课程;课程改革[中图分类号]G641[文献标识码]A [文章编号]2095-3437(2021)04-0097-04University Education引言习近平总书记在全国高校思想政治工作会议上强调:要用好课堂教学这个主渠道,思想政治理论课要坚持在改进中加强,提升思想政治教育亲和力和针对性,满足学生成长发展需求和期待,其他各门课都要守好一段渠、种好责任田,使各类课程与思想政治理论课同向同行,形成协同效应[1]。
课程思政是课程教育的重要组成部分,是课程教书育人功能的本意。
课程思政就是要把思想政治工作贯穿于教育教学全过程,坚持立德树人,推动思政课程和课程思政协同育人的创新发展,使其他课程与思想政治理论课同向同行。
专业课教师利用其独特优势,运用学科思维,提炼专业课中蕴含的德育因素及价值理念,并在潜移默化中将其转化为学生精神层面的指引,这正是课程思政的主要体现。
课程思政旨在知识传授与价值引领并行,构建全程育人、全方位育人格局[2]。
高校大学生的思想政治认知和学习环节已经不能仅限于传统的、显性的思想政治理论课,其他课程同样需要承担思政教育的功能,并且能够利用专业课程内容丰富、学科内涵拓展性广和师资力量雄厚的特点,在践行立德树人的根本任务上提供新的育人途径[3]。
物理化学是研究化学体系中物质的结构及其变化规律的科学。
它借助数学、物理等基础科学的理论及其提供的实验手段,研究化学体系中最普遍的宏观规律和理论,肩负着服务后续专业课程和培养创新能力两大任务[4-7]。
第五章 多组分系统热力学与相平衡(一)主要公式及其适用条件1、拉乌尔定律 A *A A x p p =式中*A p 是与溶液在同一温度下纯A 液体的饱和蒸气压。
此式适用于理想液态混合物中的任一组分或理想稀溶液中的溶剂A 。
2、亨利定律 B B ,B x k p x =式中k x ,B 为溶液的组成用摩尔分数x 表示时溶质B 的亨利系数,其值与溶质、溶剂的性质及温度有关。
亨利定律也可以c B 、b B 等表示,但相应的亨利系数的大小和单位皆不相同。
此式只适用于理想稀溶液中的性质。
3、理想液态混合物中任一组分B 的化学势表示式 B B B ln x RT +=O μμ在理想液态混合物的温度下,p =p O =100kPa 的纯B(l)的状态定为B 的标准态,相应的化学势O B μ称为B 的标准化学势。
4、理想稀溶液化学势的表示式(1)溶剂A A A A ln x RT +=O μμ温度为T 、p =p O =100kPa 下,纯(A )的状态定为溶剂的标准状态。
(2)溶质B B ,B B ln x RT x +=O μμ)/ln(B ,B O O +=c c RT c μ=)/ln(B ,B O O +b b RT b μ同一种溶质B 在温度T 、p =p O =100kPa 下,用不同的组成表示化学势时,标准状态不同,O B μ不同,但B μ为定值。
5、稀溶液的依数性(1)蒸气压降低 B *A A *A *A A /)(/x p p p p p =-=∆式中x B 为溶质B 的摩尔分数。
此式适用于只有A 和B 两个组分形成的理想液态混合物或稀溶液中的溶剂。
(2)凝固点降低 ∆T f = K f b B式中O ∆=A m,fus A 2*f f /)(H M T R K ,称为溶剂A 的凝固点降低常数,它只与溶剂A 的性质有关。
此式适用于稀溶液且凝固时析出的为纯A(s),即无固溶体生成。
(3)沸点升高 ∆T b = K b b B式中O ∆=A m,vap A 2*/)(H M T R K b b ,称为沸点升高常数,它只与溶剂的性质有关。