终点误差
- 格式:ppt
- 大小:702.00 KB
- 文档页数:24

终点误差的名词解释是什么在探讨终点误差时,首先我们需要明确什么是终点,终点一般指的是完成某项任务或达成某个目标的位置、状态或条件。
终点误差是指在任务达成过程中所发生的不准确或不完美的偏差,即与最理想状态之间的差距。
终点误差是人们在追求目标过程中所面临的常见情况,无论是个体还是组织,都难以完全避免。
它可能源自多个因素,包括行为、态度、知识、技能、资源、环境等等。
因此,要理解和应对终点误差,我们需要审视其各种表现形式以及其背后的原因。
一种常见的终点误差是行为上的偏差。
在追求目标的过程中,个体或组织可能会因为种种原因偏离最佳行动路径,导致最终达成的结果与预期有所差距。
例如,一个销售团队可能采取了错误的销售策略,导致销售额低于预期;一个个人可能因为缺乏主动性而错过了提升职业技能的机会。
这些行为上的终点误差可以通过改变行为模式、增加认知和培养技能来纠正。
另一种终点误差是态度上的偏差。
个体或组织在追求目标时可能因为情绪、动机、价值观等方面的变化而导致终点与期望之间的差距。
例如,一个员工可能由于工作压力过大而产生消极情绪,影响了工作表现;一个企业可能因为市场竞争的变化而需要调整经营策略。
这些态度上的终点误差可以通过调整心态、设定新的期望和提供支持来解决。
此外,知识和技能方面的终点误差也是常见的。
个体或组织在追求目标时可能由于缺乏专业知识或相关技能而无法达到预期的终点。
例如,一个应聘者在求职面试中由于缺乏相关工作经验而遭遇拒绝;一个企业在新技术推广中因为员工缺乏相关培训而无法提高工作效率。
这些知识和技能上的终点误差可以通过学习培训、知识分享和合作交流来纠正。
同时,资源和环境方面的终点误差也不可忽视。
个体或组织在追求目标过程中可能由于种种外部条件的限制而无法实现最佳结果。
例如,一个创业者在争取投资时由于资金不足而限制了企业发展;一个研究团队在科研过程中由于设备条件限制而无法达到理想的研究成果。
这些资源和环境上的终点误差可以通过寻找合适的支持、资源整合和创新解决方案来克服。

滴定分析中滴定终点误差问题分析摘要:滴定分析是化学分析中最常见的一种定量分析方法,它既是检验化学特性的一种重要手段,又是测定化学成分的一种重要手段。
由于滴定法是一种高质量、高水平的滴定法,它可以为化学试验和原材料生产提供可靠的数据分析,提高生产效率,提高试验精度,提高滴定终点的精度,提高滴定分析的精度。
文章介绍了滴定法的基本内涵,介绍了滴定法的重要意义,并对滴定法中存在的误差进行了分析,以期对其进行化学特性的分析和评价。
关键词:滴定分析;滴定终点;问题分析引言:滴定法是化学试验中非常重要的一项检测技术,尽管不能直接用于生产,但是对提高产品质量和优化生产过程起到了积极的作用。
与国外先进国家比较,我国的滴定法技术发展相对滞后,这直接造成了其总体质量低下、滴定终点偏差较大,严重影响了其检测的质量。
一、滴定法的概念与功能滴定分析法是根据滴定指标的颜色变化来判定滴定终点,再根据测定液的用量来确定最后的测定值,其主要有两种:手工滴定和点位滴定。
根据滴定目的和计算公式,将滴定分析分为四大类:酸碱滴定、配位滴定、氧化还原滴定、沉淀滴定。
在化学分析中,化学滴定法的结果不仅会直接影响到有关数据的准确性,还会对建筑工程质量产生重要的影响。
从当前情况来看,国内的滴定分析技术虽然有了很大的进展,但由于自身存在的问题,限制了其发展。
在这样的环境下,为了保证工程质量,必须要保证滴定的准确度。
具体地说,可以通过滴定法产生一份完整的数据分析报告,以此作为相关的生产操作指南;其次,通过对运行状况的监测和反馈,可以使原材料生产过程中出现的问题得到及时的反映。
二、滴定法中的终点误差分析1.滴定点的判定标准不清目前,国内有关部门和企业已形成了比较完备的检测系统,但是缺乏专门的滴定检验部门,往往是由科研人员兼|职,这就造成了很多问题,比如滴定终点的误差。
另外,在滴定终点的测定中,往往以颜色的改变为基础,缺乏一个统一的判断标准,使得滴定终点的确定往往会出现较大的偏差。


络合滴定一、终点误差:终点误差的意义:Et== 设在终点时,加入的滴定剂Y的物质的量为CY,epVep,溶液中金属离子M的物质的量为CM,epVep,通过推导可得2、林邦终点误差公式:公式中== ,决定误差的正负。
为按计量点时体积计算的金属离子的浓度。
公式表明:当一定时,KMY值越大,络合滴定突跃越大,终点误差越小。
若金属离子未发生副反应,则用代替计算.二、直接准确滴定金属离子的条件:影响络合反应的因素:⑴、待测金属离子的浓度CM(也与滴定剂的浓度)有关⑵、络合物的条件形成常数KMY⑶、对滴定准确度的要求(Et的大小)⑷、指示剂的选择(决定的大小和检测终点的敏锐性)三、络合滴定中酸度的选择与控制:(1)、缓冲溶液和辅助络合剂的作用:M + H2Y ===MY + 2H 随着滴定剂与金属离子反应生成相应的络合物,溶液的酸度会逐渐增高,减小了MY 的条件常数,降低滴定反应的完全程度;而且还可能影响指示剂的变色点和自身的颜色,导致终点误差变大,因此酸度对络合滴定的影响是多方面的,需要加入缓冲溶液予以控制。
常用的缓冲体系:酸性:HAc-NaAc,(CH2)6N4–HCl 碱性:NH3-NH4Cl 当在较低的酸度下滴定时,常需加入辅助络合剂如氨水、酒石酸和柠檬酸等,但同时又引起络合效应,应注意控制其浓度。
注意:选择缓冲溶液时,不仅要考虑它的缓冲范围和缓冲容量,还要注意可能引入的副反应。
(2)、单一金属离子滴定的最高酸度和最低酸度:1、最高酸度:(最低PH值)由知当CM一定时,K至少应达到某一数值(最小值),才有可能对该金属离子直接准确滴定。
由于酸效应时影响络合滴定最主要的因素,假如金属离子不发生副反应,则KMY仅受酸效应的影响,其大小由决定,也就是说溶液的酸度存在着一个高限,这一最高允许酸度称为最高酸度①、lg (max)==lgKMY-lgKMY(min)②、当CM,sp==0.010mol/L,== 0.2时,由得lgKMY(min)==8 ()lg (max)==lgKMY-8 ③、酸效应曲线(林邦曲线):横坐标用lg (lgKMY)表示,纵坐标是各金属离子对应的滴定最高酸度。

滴定终点误差产生的原因概述滴定法是一种常用的定量化学分析方法,常用于测定溶液中某种物质的浓度。
滴定终点误差是在滴定过程中测定终点的误差,它可能对分析结果产生重大影响。
本文将详细介绍滴定终点误差产生的原因,并探讨如何最小化这些误差,以提高滴定方法的准确性和可靠性。
滴定终点误差的定义滴定终点误差是指在滴定过程中,测定终点与实际滴定终点之间的差异。
滴定的终点是指试剂完全反应完毕,指示剂颜色发生明显变化的那一点。
滴定终点误差主要包括仪器误差和操作误差两方面。
仪器误差仪器误差是指在实验过程中,由于仪器的限度、不确定度以及仪器的测量原理等因素造成的误差。
滴定过程中常用的仪器包括滴定管、点滴瓶、容量瓶、分液漏斗、滴定管和PH计等。
这些仪器的准确度和灵敏度对于滴定结果的准确性和可靠性起着重要作用。
操作误差操作误差主要是操作者在实验过程中由于技术能力、经验水平、操作失误等方面的原因导致的误差。
操作误差包括试剂的加入、试剂摇匀、滴定液滴加速度、滴定剂的选择和使用、PH值的测定等方面的误差。
原因分析下面将详细分析滴定终点误差产生的一些常见原因。
1. 滴定仪器的不准确度滴定仪器的准确度和稳定性对滴定结果的准确性起着决定性的作用。
如果仪器的刻度线模糊不清,或者刻度线标定不准确,就会导致滴定液的滴加量出现误差,进而引起滴定终点误差。
2. 称量误差在进行溶液配制过程中,如试剂的称量误差过大,就会导致滴定液浓度的变化,从而影响滴定终点的准确性和可靠性。
因此,在滴定实验中,准确称量试剂要求非常严格。
3. 储存条件和试剂质量试剂的储存条件和质量对滴定终点误差也有一定的影响。
例如,试剂的稳定性受到光、热、湿和氧化等因素的影响。
如果试剂质量不稳定,就会导致滴定过程中试剂浓度的波动,进而引起滴定终点误差。
因此,在滴定实验中,需要严格控制试剂的储存条件和质量。
4. 操作者的技术能力和经验水平操作者的技术能力和经验水平对滴定终点误差也有重要影响。


终点误差的定义终点误差(end point,以et表示)又称滴定误差。
滴定分析中,利用指示剂的变色来确定滴定终点,滴定终点与等当点不一致时所产生的误差,称为终点误差,它表示该滴定方法的系统误差。
来源从理论上谈,电解应当在抵达等当点时完结,但实际上很难刚好电解至这一点,因此电解误差总是存有的。
电解误差就是容量分析误差的关键来源,就是使用任何电解方法时首先必须考量的问题。
除电解误差外,试样的称量、溶液体积的测量、指示剂的消耗等也可以影响容量分析的准确度,并增添一定的误差。
由于溶液体积测量的误差为0.1%~0.2%,而试样的称量,指示剂的消耗两项所增添的误差都比较大,所以电解误差只要掌控在这一数值以下就可以了。
影响因素根据相同电解分析建议的精准度,若天平的精确度无法达至选定的建议,就可以导致实际重量与秤重量的误差,从而引发实际电解终点与建议的不能合乎,导致时程的计算误差。
对一定的体系来说,终点离等当点愈近,滴定误差就愈小,因此应当根据等当点的情况来选择合适的指示剂。
但是对不同的体系,等当点附近的突跃大小是不同的。
终点离等当点近,滴定误差未必小;终点离等当点远,滴定误差也未必大。
以酸碱滴定为例,如果以0.1μ氢氧化钠溶液滴定不同强度的一元酸,所产生的滴定误差足以说明以上论述(见表)。
由滴定曲线条目中图1所示的曲线可以看出,氢氧化钠滴定盐酸时,等当点附近突跃大,表明加入少量氢氧化钠引起较大的ph变化。
因此,即使终点离等当点远些(δph为2.7ph单位),所引起的滴定误差仍很小,只有 0.1%。
在滴定硼酸时,等当点附近ph变化缓慢,说明要改变较大的ph需要加较多的滴定剂,这时即使能找到在等当点变色的指示剂,但由于人眼判断终点会产生0.3ph单位的误差,即终点与等当点相差±0.3ph单位,所造成的滴定误差很大,达到±2.8%。
显然,氢氧化钠不能准确滴定硼酸。

终点误差是指在化学反应中滴定分析实验测试的最终结果与实际结果之间存在的误差大小。
终点误差在氧化还原滴定分析中也被广泛应用,一般滴定的绝对精度不能超过1%,也就是说所有滴定结果的终点误差之和应该小于或等于最终结果的1%。
在氧化还原滴定分析中,由于反应本身的复杂性,终点误差的程度也比较大。
氧化还原滴定分析中的终点误差是由两个因素引起的:一是过度氧化和还原反应没有准确控制;另一个因素是电位滴定反应终点的识别可能会出错。
在氧化还原滴定实验中,可能的误差源包括:1、检测仪器的误差:滴定仪器的精度和稳定性决定了滴定结果的准确性。
2、控制反应的精确性:一般滴定化学反应反应需要控制,控制反应温度、pH以及反应时间等是关键,以降低出现误差的概率。
如果控制反过程不够准确,会累积误差,影响滴定结果。
3、调整反应过程:仪器检测和控制反应过程有了误差,误差会随着反应过程累积,所以控制反应过程对减少终点误差的影响是至关重要的。
4、校准控制死角:死角是指滴定仪器反应过程中出现的误差,如果有死角,会影响终点误差大小,所以需要及时校准仪器死角,以降低终点误差。
此外,氧化还原滴定还可能受到样品稀释、滴定反应液配置、氧化还原反应抗性和参比电解质的稳定性等因素的影响,这些因素都可能影响到氧化还原滴定实验的准确性,也会引起终点误差。
尽管氧化还原滴定分析中的终点误差可能较大,但只要采取正确的措施,一定可以将终点误差降到较小。
最重要的是要定期校准仪器,使仪器能准确反映实际滴定实验结果;另外,要确保氧化还原反应准确控制,确保反应液稳定,样品正确稀释,以及确保滴定过程正确无误操作等,这样才能保证滴定结果终点误差较小。

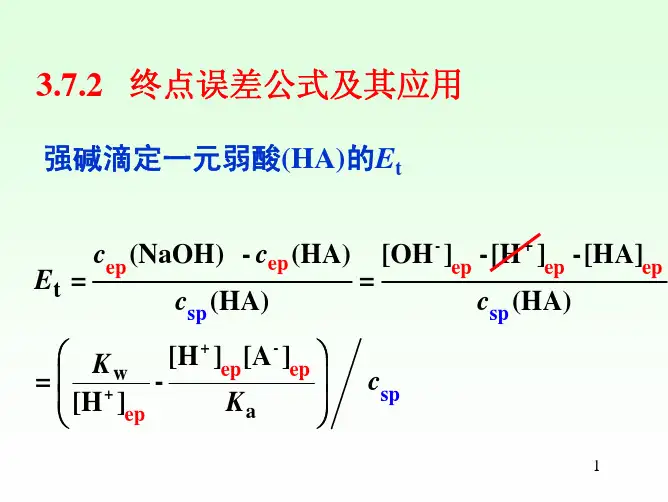
强碱滴定弱酸的终点误差公式
根据酸碱滴定反应的化学方程式和溶液浓度的定义,可以得到强碱滴定弱酸的终点误差公式如下:
终点误差 = 滴定剂的体积× 滴定剂的浓度× 滴定剂的终点误差系数 / 被滴定物的体积
滴定剂的体积指的是滴定过程中一滴滴加的强碱溶液的总体积;滴定剂的浓度为强碱溶液的准确浓度;滴定剂的终点误差系数是指强碱溶液的终点误差与其体积的关系系数;被滴定物的体积指的是滴定过程中被滴定的弱酸溶液的总体积。
需要注意的是,真实的终点误差公式可能会受到实验条件、仪器精度和操作技巧等因素的影响,因此上述公式仅作为理论推导的参考。
在实际操作中,为了减小终点误差,一般会进行多次滴定并取平均值以提高结果的准确性。

终点误差的定义终点误差(EndPointError,简称EPE)是动作系统控制中一种衡量最终位置误差的重要指标,它反映了系统的精度和性能水平,在一些控制工程中有着重要的应用。
终点误差可以定义为在控制结束时,目标轨迹到达目标位置的距离,也可以定义为在控制结束时,末端位置与目标轨迹的距离。
显然,终点误差取决于控制结束时的位置,所以它是由目标开始控制到控制结束时间内所消耗的位置误差,以及控制结束时末端位置到目标位置的距离构成的。
EPE可以用来评估控制系统的表现。
如果系统的EPE较小,表示系统的控制性能较高,而EPE较大则表示控制性能较低。
此外,EPE也可以反映系统的精度,可以用来衡量系统的精度水平。
EPE也可以用于分析系统的稳定性。
如果系统的EPE不断变化,表明系统没有达到稳定性,这有可能是由于系统模型参数或控制参数发生变化所致。
在这种情况下,需要进行参数优化,以确保系统的稳定性和精度。
此外,EPE还可以用于分析系统的抗干扰性。
如果系统的EPE在面临外边界的外界干扰情况下不断增大,则表明系统的抗干扰性较差,这可能是由于系统模型不够准确或者控制参数的设置不合理所致。
在这种情况下,需要对系统模型和控制参数进行改进,以改善系统的抗干扰性。
考虑到EPE可以作为衡量控制系统性能和精度的重要指标,因此它已经成为各种控制应用中不可或缺的一部分,如机械臂控制、机器人控制、自动机控制等等。
EPE在控制系统中占据重要地位,任何能够提高EPE的方法都值得研究。
综上所述,终点误差是动作系统控制中一种重要的指标,它是反映控制系统性能和精度的重要指标,并且可以用于衡量控制系统的稳定性和抗干扰性。
因此,终点误差是很多控制工程应用中不可或缺的一环,任何能够改善EPE的方法都值得探讨。