2019届一轮复习人教版 原子结构 化学键 学案 (1)
- 格式:doc
- 大小:1.34 MB
- 文档页数:16

第6讲 原子结构 化学键考纲解读合考查,命题形式以选择题为主。
命题分析高考真题考点一 原子的组成和结构1.(2015江苏单科,2,2分)下列有关氯元素及其化合物的表示正确的是( )A.质子数为17、中子数为20的氯原子Cl B.氯离子(Cl -)的结构示意图:C.氯分子的电子式:D.氯乙烯分子的结构简式:H 3C —CH 2Cl答案 C2.(2014山东理综,8,5分)根据原子结构及元素周期律的知识,下列推断正确的是( )A.同主族元素含氧酸的酸性随核电荷数的增加而减弱B.核外电子排布相同的微粒化学性质也相同C.Cl -、S 2-、Ca 2+、K +半径逐渐减小2好教育云平台——教育因你我而变2017年高考“最后三十天”专题透析 D Cl 与Cl 得电子能力相同答案 D3.(2013课标Ⅰ,9,6分)短周期元素W 、X 、Y 、Z 的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( )A.W 2-、X +B.X +、Y 3+C.Y 3+、Z 2-D.X +、Z 2-答案 C4.(2013江苏单科,2,2分)下列有关化学用语表示正确的是( )A.丙烯的结构简式:C 3H 6B.氢氧根离子的电子式:图:C.氯原子的结构示意D.中子数为146、质子数为92的铀(U)原子U答案 B5.(2015重庆理综,8,15分)某汽车安全气囊的产气药剂主要含有NaN 3、Fe 2O 3、KClO 4、NaHCO 3等物质。
当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN 3是气体发生剂,受热分解产生N 2和Na,N 2的电子式为 。
(2)Fe 2O 3是主氧化剂,与Na 反应生成的还原产物为 (已知该反应为置换反应)。
(3)KClO 4是助氧化剂,反应过程中与Na 作用生成KCl 和Na 2O 。
KClO 4含有化学键的类型为 ,K 的原子结构示意图为 。
(4)NaHCO 3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 。

高三化学一轮复习 第一章 第1节 原子结构学案【预习要求】 1、了解元素、核素、同位素的含义。
2、了解原子构成。
懂得质量数和的关系,掌握原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的关系。
3、了解原子核外电子排布。
【课前预习案】 【知识梳理】一、原子及原子核的组成1、构成原子的粒子及其性质、作用注意:⑴原子核:几乎集中原子的全部质量,但其体积却只占整个原子体积的千亿分之一。
其中的质子、中子通过强相互作用集合在一起,使原子核十分“坚固”,在化学反应时不会发生变化。
另外原子核中蕴含着巨大的能量—原子能(即核能)。
⑵中子数、质子数约等于中子、质子的相对质量。
⑶不是所有的原子核都有质子和中子两种微粒,如 中无中子。
⑷电子:带1个单位的负电荷,质量很小。
与原子的化学性质密切相关,特别是最外层电子数及排布决定了原子的化学性质。
2、原子的表示方法: X A Z 表示一个 数 为Z , 数 为A 的原子。
3、构成原子的粒子间的关系(1)质量关系:对原子X A Z : 质量数(A )= +注意:质量数是在忽略原子内电子的质量,并将原子核内所有的质子和中子的相对质量取近似整数(两者均为1)相加所得之和。
所以,质量数只对原子而言,不能说元素的质量数。
【例1】放射性同位素钬16667Ho 的原子核内的中子数与核外电子数之差是( ) A .32 B .67 C .99 D .166 (2)电性关系:对原子X AZ : 质子数(Z )= = 。
对阳离子X A Z n+:质子数=电荷数 核外电子数。
对阴离子X A Z n-:质子数=核外电子数 电荷数。
二、元素、核素、同位素 1、元素定义:具有相同的 同一类原子的总称。
说明:相对质量 带电荷作 用原子核 质子 1.007 一个质子带一个单位的正电荷决定元素的种类、核电荷数 中子 1.008不带电与质子数一起决定核素的种类 电子5.484x10-4一个电子带一个单位的负电荷电子数特别是最外层电子数决定元素的化学性质①决定元素种类的因素是核电荷数。

2019-2020年高考化学一轮复习 5.1 原子结构教学案一. 内容及其解析 1.内容: 原子结构。
2.解析: 高考化学对原子结构、同位素的考查,经常以重大科技成果为背景,充分突出基础知识与科学研究的统一。
主要考点:(1)质子数、中子数、质量数的关系,原子组成的表示:(2)同位素的判断:同位素的相对原子质量与元素相对原子质量的计算;(3)核外电子排布知识运用于元素的推断;(4)微粒半径大小的比较,(5)10e -18e -的种类及之间的反应。
二.目标及其解析目标: 1.了解原子、离子、元素等概念的含义2.理解原子序数、核电荷数、质子数、中子数、核外电子数、以及质量数与质子数、中子数之间的相互关系3.了解同素异形体的概念及同位素的概念4.掌握并正确书写常见元素的名称、符号、离子符号 5.掌握原子结构示意图6.了解相对原子质量的定义7.掌握有关相对原子质量的计算解析:1、 原子结构及构成原子的微粒间的关系2、 原子核外电子排布规律3、 同位素的概念及平均相对原子质量的计算4、 常见元素的名称、符号、离子符号、原子结构示意图。
三.教学问题诊断分析关于“位、构、性”三者之间的关系是本节的重点和难点,教师要注意采用启发引导的方法,可结合已学过的碱金属、卤素的知识,培养学生的分析、判断能力。
师生共同推导得出结论,总之要让学生参与到教学中来。
四.教学过程设计 (一)教学基本流程知识梳理→例题精析→目标检测 (二)教学情景第I 课时一、原子的构成1.原子的构成原子(A Z X)原子核核外电子(Z 个) 质子(Z 个) 中子(A-Z)个——决定元素种类——决定同位素种类——最外层电子数决定元素的化学性质⑴原子核:带正电,几乎集中了原子的全部质量,体积只占原子体积的千亿分之一。
⑵质子:带一个单位正电荷,单位质子和中子的质量基本相同,约为单位电子质量的1836倍。
质子数决定了元素的种类。
⑶中子:不带电。
中子数与质子数一起决定了同位素的种类。
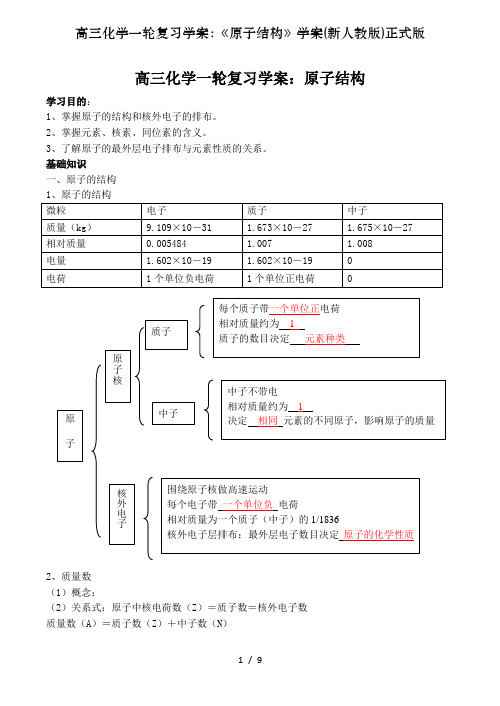
高三化学一轮复习学案:原子结构学习目的:1、掌握原子的结构和核外电子的排布。
2、掌握元素、核素、同位素的含义。
3、了解原子的最外层电子排布与元素性质的关系。
基础知识一、原子的结构1、原子的结构2、质量数(1)概念:(2)关系式:原子中核电荷数(Z)=质子数=核外电子数质量数(A)=质子数(Z)+中子数(N)阳离子中AZ X n+:核外电子数= Z-n质量数(A)=质子数(Z)+中子数(N)阴离子中AZ X m-:核外电子数= Z+m质量数(A)=质子数(Z)+中子数(N)3、原子结构的表示方法:二、核素1、元素:具有相同质子数的同一类原子的总称。
2、核素:把具有一定数目质子和一定数目中子的一种原子称为核素。
一种原子就是一种核素,一种元素可能包括几种核素。
3、同位素:质子数相同而中子数不同的同一元素的不同核素互称为同位素。
(1)氢元素的三种核素(2)性质:a、同位素的化学性质相同,物理性质有一定差别。
b、天然存在的同一元素的各同位素所占的百分组成不变。
(3)应用:①金属探伤②消除静电③治疗肿瘤④示踪原子,跟踪研究化学反应⑤作核燃料⑥用14C考古⑦环保治污等4、元素的相对原子质量(1)定义:由各种天然核素相对原子量与其原子百分组成计算出的平均值。
(2)计算式: M =M1×n1 % + M2×n2 % + M3×n3 % +…同位素3517Cl的相对原子质量为34.969,在自然界占75.77%(原子数的百分含量),3717Cl为36.966,在自然界中占24.23%,则Cl的相对原子质量为:34.969×75.77%+36.966×24.23% =35.45(3)元素的近似相对原子质量:用质量数代替核素的相对原子质量,求其平均值。
例如氯元素的近似相对原子质量为:35ⅹ75.77%+37ⅹ24.23%=35.48三、核外电子的分层排布1.核外电子运动特征:(1)核外电子的特征:a:电子的质量极___(____kg);b:电子绕核运动是在_______的空间(原子的直径约___m)中进行;c:电子绕核作__速运动(运动的速度接近__,约为__)。
![[精品]新人教版高三化学一轮复习19原子结构导学案及答案](https://img.taocdn.com/s1/m/571254c919e8b8f67c1cb9b2.png)
原子结构编号 19班级_______ 组别姓名【习目标】1、了解原子的构成及原子序、核电荷、质子、中子、核外电子之间的关系;能够辨析元素、核素、同位素的含义2、小组合作讨论,探究相对原子质量、相对分子质量的定义,并能进行有关计算3、以极度的热情,全力以赴投入习,体验习的快乐。
【使用说明】利用一节课,认真阅读课本,完成案,下课收齐。
下节课修改10 分钟后,讨论10分钟,小组内知识互查,师生探究、生展示20分钟,巩固落实5分钟。
标有★★的B层可不做,标有★或★★的层可不做。
【课前导】一、原子构成1、表示原子或核素的符号是_______,意义是________________________________________2、构成原子的各微粒的作用在质子确定后,决定__________种类决定________________种类原子核质量 近似相对原子质量质子 核电荷 决定_________种类原子 决定整个原子显不显电性最外层电子电子 决定____________________________核外电子电子排布 电子层3、 原子序、核电荷、质子、中子、核外电子(包括原子、阴阳离子)之间的关系(1)质量(2)原子的核电荷(3)阳离子的核外电子(4)阴离子的核电荷【练习1】、我国稀土资丰富。
下列有关稀土元素14462Sm 与15062Sm 的说法正确的是( )A .14462Sm 与15062Sm 互为同位素B.144Sm与15062Sm的质量相同62.144Sm与15062Sm是同一种核素62D.144Sm与15062Sm的核外电子和中子均为6262【练习2】、下列叙述错误的是()A、13和14属于同一种元素,它们无为同位素B、1H和2H是不同的核素,它们的质子相等、14和15N的质量相等,它们的中子不等D、6L和7L的电子相等,中子也相等4、等电子微粒(注意主要元素在周期表中的位置关系)(1)10电子微粒①原子_______ ②分子___________________________③阴离子______________________ ④阳离子_________________________(2)根据上述方法找出18电子微粒_____________________________________________________________________________________________________________ __★【练习3】、已知A、B、、D是中中常见的四种不同粒子,它们之间存在如图所示+⑴如果A、B、、D均是10电子的粒子,请写出A、D的式:A___________ D_______________⑵如果A和是18电子的粒子,B和D是10电子的粒子,请写出:①A与B在溶液中反应的离子方程式为:___________________________________②根据上述离子方程式,可以判断与B结合质子的能力大小是(用式或离子符号表示)_________________________________________________。

第1讲原子结构与性质[考纲要求]1.了解原子核外电子的运动状态、能级分布和排布原理,能正确书写1~36号元素原子核外电子、价电子的电子排布式和轨道表达式。
2.了解电离能的含义,并能用以说明元素的某些性质。
3.了解电子在原子轨道之间的跃迁及其简单应用。
4.了解电负性的概念,并能用以说明元素的某些性质。
考点一原子结构知识梳理1.能层与能级(1)能层(n):在多电子原子中,核外电子的____是不同的,按照电子的____差异将其分成不同能层。
通常用________________表示相应的第一、二、三、四、五、六、七……能层,能量依次升高。
(2)能级:同一能层的电子的____也可能不同,又将其分成不同的能级,通常用________等表示,同一能层里,各能级的能量按________的顺序升高,即__________。
2.原子轨道(1)原子轨道:表示电子在原子核外的一个空间运动状态。
电子云轮廓图给出了电子在________________的区域。
(2)①相同能层上原子轨道能量的高低:____________。
②形状相同的原子轨道能量的高低:____________。
③同一能层内形状相同而伸展方向不同的原子轨道的能量相等,如n p x、n p y、n p z轨道的能量相等。
3.基态原子的核外电子排布(1)能量最低原理:即电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
下图为构造原理示意图,即基态原子核外电子原子轨道排布顺序图:(2)泡利原理每个原子轨道里最多只能容纳____个电子,且自旋状态____。
如2s轨道上的电子排布为,不能表示为。
(3)洪特规则当电子排布在同一能级的不同轨道时,基态原子中的电子总是________占据一个轨道,且自旋状态相同。
如2p3的电子排布为,不能表示为或。
洪特规则特例:当能量相同的原子轨道在____(p6、d10、f14)、____(p3、d5、f7)和____(p0、d0、f0)状态时,体系的能量最低,如:24Cr的电子排布式为________________________________________________________________________。
物质结构与性质物质结构探微观 千万变化装心间知考点 明方向 满怀信心正能量知识点 网络线 引领复习曙光现 )释疑难 研热点 建模思维站高端原子结构与性质命题规律:1.题型:Ⅱ卷T35填空题(选做)。
2.考向:常见的命题角度有原子核外电子的排布规律及其表示方法、原子结构与元素电离能和电负性的关系及其应用。
各考查点相对独立,难度不大。
方法点拨:1.理解核外电子排布三原则及应用2.基态原子核外电子排布的四种表示方法3.从第一电离能和电负性的两种角度理解金属性和非金属性递变规律1.(1)(2018·全国卷Ⅱ)基态Fe原子价层电子的电子排布图(轨道表达式)为!!!###,基态S原子电子占据最高能级的电子云轮廓图为!!!__哑铃(纺锤)__###形。
(2)(2018·全国卷Ⅰ)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为!!!__D__###、!!!__C__###(填标号)。
(3)(2018·全国卷Ⅲ)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。
第一电离能I1(Zn)!!!__大于__###I1(Cu)(填“大于”或“小于”)。
原因是!!!__Zn核外电子排布为全满稳定结构,较难失电子__###。
(4)(2017·全国卷Ⅱ)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。
第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是!!!__同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大__###;氮元素的E1呈现异常的原因是!!!__N原子的2p轨道为半充满状态,具有额外稳定性,故不易结合一个电子__###。
(5)(2018·全国卷Ⅰ) Li2O是离子晶体,其晶格能可通过如图的Born-Haber循环计算得到。
可知,Li原子的第一电离能为!!!__520__###kJ·mol-1,O=O键键能为!!!__498__###kJ·mol-1,Li2O晶格能为!!!__2908__###kJ·mol-1。
2019年高考化学一轮复习精品资料1.了解原子核外电子的排布原理及能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子、价电子的排布。
了解原子核外电子的运动状态。
2.了解元素电离能的含义,并能用以说明元素的某些性质。
3.了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。
4.了解电负性的概念,知道元素的性质与电负性的关系。
一、原子核外电子排布原理1.能层、能级与原子轨道(1)能层(n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。
通常用K、L、M、N、O、P、Q……表示相应的第一、二、三、四、五、六、七……能层,能量依次升高。
(2)能级:同一能层里的电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f等表示,同一能层里,各能级的能量按s、p、d、f的顺序升高,即E(s)<E(p)<E(d)<E(f)。
(3)原子轨道:表示电子在原子核外的一个空间运动状态。
电子云轮廓图给出了电子在核外经常出现的区域,这种电子云轮廓图也就是原子轨道的形象化描述。
原子轨道轨道形状轨道个数s 球形 1p 纺缍形 32.基态原子核外电子排布的三个原理(1)能量最低原理:电子尽先占有能量低的轨道,然后依次进入能量较高的轨道,使整个原子的能量处于最低状态。
即原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。
如图为构造原理示意图:(2)泡利原理在一个原子轨道中,最多只能容纳2个电子,并且这两个电子的自旋状态相反。
(3)洪特规则当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,并且自旋状态相同。
洪特规则特例:当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低,如:24Cr的电子排布式为1s22s22p63s23p63d54s1。
3.原子(离子)核外电子排布式(图)的书写(1)核外电子排布式:按电子排入各能层中各能级的先后顺序,用数字在能级符号右上角标明该能级上排布的电子数的式子。
第一单元原子结构与元素的性质1.了解原子核外电子的运动状态、能级分布和排布原理,能正确书写1~36号元素原子核外电子、价电子的电子排布式和轨道表达式。
2.了解电离能的含义,并能用以说明元素的某些性质。
3.了解电子在原子轨道之间的跃迁及其简单应用。
4.了解电负性的概念,并能用以说明元素的某些性质。
原子核外电子的排布[知识梳理]1.核外电子的排布特征(1)电子云用小点的疏密来描述电子在原子核外空间出现的机会的大小所得到的图形。
(2)电子层(又称为能层)①在多电子原子中,核外电子的能量是不同的。
能量不同的电子在核外不同的区域内运动,这种不同的区域称为电子层。
②习惯上人们用英文字母n表示电子层。
原子中由里向外的电子层数可取1、2、3、4、5等正整数,对应的电子层符号分别为K、L、M、N、O等。
每一电子层最多容纳的电子数为2n2。
③离核越近的电子层,能量越低。
不同电子层的能量是不连续的。
(3)原子轨道(又称为能级)①在多电子原子中,同一电子层的电子,能量也可能不同,不同能量的电子分占在不同的原子轨道,不同形状的原子轨道分别用s、p、d、f表示。
②原子轨道有不同的形状:s轨道呈球形,p轨道呈纺锤形,d轨道和f轨道较复杂。
形状相同的原子轨道在原子核外空间还有不同的伸展方向。
2.原子核外电子排布的原理(1)能量最低原理电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
如图为原子核外电子排布的轨道能量顺序图:(2)泡利不相容原理每个原子轨道最多容纳2个电子,并且自旋状态相反。
(3)洪特规则当电子排布在不同轨道时,原子中的电子总是优先单独占据一个轨道,并且自旋状态相同。
洪特规则特例:当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低,如24Cr的电子排布式为1s22s22p63s23p63d54s1。
3.原子核外电子排布的表示方法(1)基态原子:处于最低能量的原子。
基础课1 原子结构 化学键(对应学生用书P 100) 考点一 原子的构成1.原子的构成2.原子内的等量关系(1)质量数(A )=质子数(Z )+中子数(N );(2)质子数=原子序数=核电荷数=核外电子数; (3)阳离子:质子数=核外电子数+电荷数; (4)阴离子:质子数=核外电子数-电荷数。
3.微粒符号周围数字的含义4.元素、核素、同位素(1)元素、核素、同位素的关系(2)同位素的特征①同一元素的各种核素的中子数不同,质子数相同,化学性质几乎完全相同,物理性质差异较大。
②同一元素的各种稳定核素在自然界中所占的原子百分数(丰度)不变。
(3)几种重要的核素①原子(即核素)的相对原子质量一个原子(即核素)的质量与12C质量的112的比值。
一种元素有几种同位素,就有几种不同核素的相对原子质量。
②元素的相对原子质量是按该元素各种天然同位素原子所占的原子百分比算出的平均值。
如:A r(Cl)=A r(35Cl)×a%+A r(37Cl)×b%。
(1)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子(√)(2)不同的核素可能具有相同的质子数,也可能质子数、中子数、质量数均不相同(√)(3)核聚变如21H+31H―→42He+10n,因为有新微粒生成,所以该变化是化学变化(×)(4)核外电子排布相同的微粒,其质子数一定相同(×)(5)H+与质子的相对质量相同(√)5.核外电子排布(1)核外电子排布规律(2)原子结构示意图(3)核外电子排布与元素性质的关系①金属元素原子的最外层电子数一般小于4,较易失去电子,形成阳离子,表现出还原性,在化合物中均显正化合价。
②非金属元素原子的最外层电子数一般大于或等于4,较易获得电子,活泼非金属原子易形成阴离子。
在化合物中主要显负化合价。
③稀有气体元素的原子最外层为8电子(氦为2电子)稳定结构,不易失去或得到电子,通常表现为0价。
下图为几种粒子的结构示意图,完成以下填空。
(1)属于阳离子结构的粒子是________(填编号,下同)。
(2)具有稳定性结构的原子是________________。
(3)只能得电子的粒子是________;只能失电子的粒子是________;既能得电子,又能失电子的粒子是________。
答案:(1)③⑤⑧(2)②(3)③⑤①④⑥⑦⑧题组一原子结构及微粒间的关系1.(2018·鞍山一中月考)月球表面土壤里有一种非常有用的资源——3He,它是可控核聚变的原料,关于3He的叙述正确的是()A.3He和4He是同种原子B.3He和4He互为同位素C.核聚变时,原子核发生了变化,发生的是化学变化D .在3He 中存在:质子数=中子数=核外电子数 答案:B2.某元素的一个原子形成的离子可表示为b a X n-,下列说法正确的是( )A.b a X n -含有的中子数为a +bB.b a X n -含有的电子数为a -nC .X 原子的质量数为a +b +nD .1个X 原子的质量约为b 6.02×1023 g答案:D3.已知阴离子R 2-的原子核内有n 个中子,R 原子的质量数为m ,则ω g R 原子完全转化为R 2-时,含有电子的物质的量是( )A.m -n -2ω·m molB .ω(m -n )n molC.ω(m -n -2)mmolD .ωm(m -n +2)mol解析:选D R 原子的质子数为(m -n )个,其核外电子数也为(m -n )个,所以R 2-的核外电子数为(m -n +2)个,而ω g R 原子的物质的量为ωm mol ,所以形成的R 2-含有的电子的物质的量为ωm(m -n +2)mol ,故选D 。
求一定质量的某物质中微粒数的答题模板物质的质量――→÷摩尔质量(来自质量数)物质的量――→×一个分子或离子中含某粒子个数指定粒子的物质的量――→×N A粒子数题组二 相对原子质量的含义及辨析4.(2018·上海同济中学月考)月球上的每百吨32He 聚变所释放出的能量相当于目前人类一年消耗的能量,地球上氦元素主要以42He 的形式存在。
已知一个12C 原子的质量为a g ,一个32He 原子的质量为b g ,N A 为阿伏加德罗常数。
下列说法正确的是( )A.32He 比42He 多一个中子B .氦元素的近似相对原子质量为3.5 C.32He 的相对原子质量为12b a D.32He 的摩尔质量为bN A解析:选C 32He 比42He 少一个中子,A 错误;不能确定核素的原子百分含量,因此不能计算氦元素的近似相对原子质量,B 错误;一个原子的真实质量与一个12 6C 原子质量的112的比值是该核素的相对原子质量,因此32He 的相对原子质量为12ba ,C 正确;32He 的摩尔质量为bN A g·mol -1,D 错误。
5.铟产业被称为“信息时代的朝阳产业”,具有多种同位素。
元素周期表中铟的数据如图,下列说法完全正确的是( )49 In铟5s 25p 1114.8A .铟元素的质量数是114B .铟元素的相对原子质量是114.8C .一个铟原子的质量为114.8D .一个铟原子的相对原子质量为114.8 答案:B题组三 核外电子排布规律及原子结构示意图6.(2018·榆林模拟)在第n 电子层中,当它作为原子的最外层时,容纳电子数最多与(n -1)层相同。
当它作为原子的次外层时,其电子数比(n -1)层多10个,则此电子层是( )A .K 层B .L 层C .M 层D .N 层解析:选C 由原子核外电子排布规律知,最外层最多容纳电子数为8,则次外层电子数也应为8,若为次外层时,其电子数比(n -1)层多10个,则此次外层必为18个电子,故必为M 层电子。
7.在短周期元素中,若某元素原子的最外层电子数与其电子层数相等,则符合条件的元素有( )A .1种B .2种C .3种D .4种答案:C8.已知某离子的结构示意图为。
试回答:(1)当x -y =10时,该粒子为________(填“原子”“阳离子”或“阴离子”)。
(2)当y =8时,粒子可能为(填符号):________、________、________、________、________。
(3)写出y =3与y =7的元素最高价氧化物对应的水化物之间发生反应的离子方程式: ________________________________________________________________________ ________________________________________________________________________。
答案:(1)原子(2)Ar Cl-S2-K+、Ca2+(3)Al(OH)3+3H+===Al3++3H2O短周期常见原子的12个核外电子排布规律(1)最外层电子数为1的原子有H、Li、Na;(2)最外层电子数为2的原子有He、Be、Mg;(3)最外层电子数与次外层电子数相等的原子有Be、Ar;(4)最外层电子数是次外层电子数2倍的原子是C;(5)最外层电子数是次外层电子数3倍的原子是O;(6)最外层电子数是次外层电子数4倍的原子是Ne;(7)次外层电子数是最外层电子数2倍的原子有Li、Si;(8)内层电子总数是最外层电子数2倍的原子有Li、P;(9)电子层数与最外层电子数相等的原子有H、Be、Al;(10)电子层数为最外层电子数2倍的原子有Li;(11)最外层电子数是电子层数2倍的原子有He、C、S;(12)最外层电子数是电子层数3倍的原子有O。
考点二离子键和共价键1.化学键(1)概念:相邻原子间强烈的相互作用。
(2)分类:2.离子键、共价键的比较(1)由活泼金属与活泼非金属形成的化学键不一定都是离子键,如AlCl 3中Al —Cl 键为共价键。
(2)非金属元素的两个原子之间一定形成共价键,但多个原子间也可能形成离子键,如NH 4Cl 等。
正误判断,正确的划“√”,错误的划“×” (1)所有物质中都存在化学键( × )(2)由活泼金属元素与活泼非金属元素形成的化学键都是离子键( × )(3)非金属元素的两个原子之间一定形成共价键,但多个原子间也可能形成离子键( √ )(4)原子最外层只有一个电子的元素原子跟卤素原子结合时,所形成的化学键一定是离子键( × )(5)不同种非金属双原子间形成的共价键一定是极性键( √ ) 3.化学键的表示方法 (1)电子式①概念:在元素符号周围用“·”或“×”来代表原子的最外层电子(价电子)的式子。
②书写(2)结构式在化学上常用一根短线表示一对共用电子,这样得到的式子叫做结构式。
4.化学键与物质类别的关系5.离子化合物与共价化合物比较题组一电子式和结构式的书写1.请写出下列常见微粒的电子式:(1)离子化合物。
MgCl2:________________________,Na2O:________________________,Na2O2:________________________。
(2)非金属单质及共价化合物。
N2:________,H2O:________,CO2:________。
HClO:________________,CCl4:________________,H2O2:________________,NH3:________________。
答案:(1)(2)2.写出下列物质的结构式:O2:__________;H2O:__________;CO2:__________;H2O2:________________;HClO:________________。
答案:O===O H—O—H O===C===O H—O—O—H H—O—Cl3.用电子式表示下列化合物的形成过程:Na2S:____________________________________________________________;CaCl2:___________________________________________________________;CH4:____________________________________________________________;CO2:____________________________________________________________。
答案:题组二8电子结构的判断4.含有极性键且分子中各原子都满足8电子稳定结构的化合物是()A.CH4B.CH2===CH2C.CO2D.N2解析:选C CH4、CH2===CH2中氢不满足8电子稳定结构,A、B项错;N2中只含有非极性键且为单质,D项错。