溶解热的测定实验报告 (南昌大学)-推荐下载
- 格式:pdf
- 大小:255.76 KB
- 文档页数:4

物化实验报告溶解热的测定_KCl、KNO3实验报告:溶解热的测定——KCl、KNO3一、实验目的1.学习和掌握溶解热测定的原理和方法。
2.通过实验测定KCl和KNO3在水中溶解的热效应。
3.比较相同浓度下KCl和KNO3的溶解热效应差异。
二、实验原理溶解热是指物质在溶解过程中所伴随的热量变化。
当物质溶解时,其分子或离子会从固态或晶体状态分散到溶剂中,这一过程通常会吸收或释放热量。
溶解热的测定有助于了解物质溶解过程中的热力学性质。
溶解热的测定通常采用量热计进行。
量热计可以准确地测量溶液温度的变化,并以此来计算溶解热。
根据Arrhenius公式,溶解热与温度有关,因此,通过测量不同温度下的溶解热,可以评估温度对物质溶解热效应的影响。
三、实验步骤1.准备实验器材:500ml烧杯、电子天平、量筒、水浴锅、保温杯、恒温水浴、热量计等。
2.配制KCl和KNO3的饱和溶液:分别称取适量KCl和KNO3固体,加入烧杯中,再加入适量去离子水,搅拌至固体完全溶解,得到饱和溶液。
3.测量溶解热:将保温杯中的去离子水倒入量热计中,插入电子天平,记录初始温度T1。
分别将KCl和KNO3的饱和溶液倒入量热计中,记录溶解后的温度T2。
根据温度差和水的质量,计算溶解热。
4.重复测量:为了确保实验结果的准确性,可以重复以上步骤几次,每次测量不同的浓度。
5.数据处理和分析:整理实验数据,根据溶解热的计算公式,比较相同浓度下KCl和KNO3的溶解热效应差异。
四、实验结果与讨论1.实验数据:以下是实验测定的KCl和KNO3在水中溶解的热效应数据。
2.结果分析:从上表可以看出,相同浓度下,KCl的溶解热效应比KNO3高。
随着浓度的增加,两种物质的溶解热效应都逐渐增大。
这表明在溶解过程中,KCl分子或离子从固体分散到水中的吸热过程比KNO3更为显著。
此外,KCl和KNO3的溶解热效应与Arrhenius公式中的常数相关联,这意味着溶解热的温度依赖性较强。

溶解热的测定实验报告实验目的,通过本实验,我们旨在通过测定物质的溶解热来探究其热力学性质,并通过实验数据的分析,掌握溶解热的测定方法和步骤。
实验仪器与试剂,实验仪器包括热量计、热量计杯、电磁搅拌器、温度计等;实验试剂为待测物质和溶剂。
实验原理,在本实验中,我们将待测物质与溶剂混合,并通过测定混合物的温度变化来计算溶解热。
根据热力学原理,当物质溶解时,会吸收或释放一定量的热量,而溶解热则是单位物质在溶解过程中吸收或释放的热量。
实验步骤:1. 将热量计杯置于热量计中,加入一定量的溶剂,并记录溶剂的初始温度。
2. 将待测物质加入热量计杯中,并迅速搅拌均匀,记录混合物的最终温度。
3. 根据温度变化和溶剂的热容量,计算出溶解热的值。
实验数据处理:根据实验数据和原理公式,我们可以计算出待测物质的溶解热。
在实验中,我们需要注意控制实验条件,确保实验数据的准确性和可靠性。
同时,还需要进行数据处理和分析,得出溶解热的准确数值。
实验结果与讨论:通过实验数据处理,我们得到了待测物质的溶解热值,并对实验结果进行了讨论和分析。
在讨论中,我们可以比较不同物质的溶解热值,探讨其在热力学上的差异和特点,从而加深对溶解热的理解。
结论:在本次实验中,我们成功测定了待测物质的溶解热,并通过数据分析得出了准确的结果。
通过本实验,我们对溶解热的测定方法和步骤有了更深入的了解,为进一步研究物质的热力学性质奠定了基础。
总结,通过本次实验,我们不仅学习了溶解热的测定方法和步骤,还掌握了实验数据处理和分析的技巧。
实验中的经验和收获将对我们今后的实验和研究工作产生积极的影响。
同时,我们也意识到在实验中需要严格控制实验条件,确保实验数据的准确性和可靠性。
致谢,在此,特别感谢实验指导老师对我们实验过程中的指导和帮助,以及实验室工作人员对实验设备和试剂的准备工作。
同时也感谢实验小组成员的合作和努力,共同完成了本次实验。
参考文献:1. 《物理化学实验指导》,XXX,XXX出版社,201X年。

一、实验目的1. 了解溶解热的定义、分类及其测定方法。
2. 掌握电热补偿法测量溶解热的基本原理和操作步骤。
3. 通过实验,测定硝酸钾在水中的积分溶解热,并计算微分溶解热、积分冲淡热和微分冲淡热。
4. 分析实验误差,提高实验操作技能。
二、实验原理溶解热是指在恒温、恒压条件下,将一定量的溶质溶解于溶剂中时所产生的热效应。
溶解热分为积分溶解热和微分溶解热。
积分溶解热是指在恒温、恒压条件下,1mol 溶质溶解在一定量的溶剂中时所产生的热效应。
微分溶解热是指在恒温、恒压条件下,在大量给定浓度的溶液中加入1mol溶质时所产生的热效应。
溶解热可以通过绝热测温式量热计进行测量。
该量热计在绝热恒压条件下工作,通过测量溶液温度的变化,计算出溶解热。
三、实验仪器与药品1. 仪器:保温瓶、磁力搅拌器、热敏电阻测温装置、加热器、直流稳压稳流电源、精密毫安表、秒表、容量瓶(500ml)、烧杯(1000ml)、温度计、研钵、称量瓶、分析天平(公用)、高精度万用表(公用)。
2. 药品:KNO3(AR)。
四、实验步骤1. 搭建实验装置,要求装置具有良好的绝热性能。
2. 量取500mL去离子水注入保温瓶中,开动磁力搅拌器,用电加热方法调节水温,使之尽量接近室温,输出温度基本保持不变。
3. 调节惠斯通电桥的调节旋钮,使输出温度为5度。
待温度基本稳定后,记录约4min。
4. 打开电源开关,设定电源输出的电压值(20V以上)和电流值(0.95A)。
5. 按下电源的输出按键,开始加热,温度上升至7度时(以无纸记录仪上显示的数值为准)停止加热。
待温度稳定后,记录温度。
6. 重复步骤4-5,进行多次实验,求取平均值。
五、数据处理1. 计算硝酸钾的摩尔质量。
2. 根据实验数据,计算硝酸钾在水中的积分溶解热。
3. 根据积分溶解热,计算微分溶解热、积分冲淡热和微分冲淡热。
六、实验结果与分析1. 硝酸钾的摩尔质量为101.1g/mol。
2. 硝酸钾在水中的积分溶解热为-10.26 kJ/mol。

大学物理实验报告课程名称:大学物理实验实验名称:冰的比熔化热的测量学院名称:机电工程学院专业班级:车辆工程151班********学号:**********实验地点:基础实验大楼D508实验时间:第二周周三下午15:45开始一、实验目的:1.理解熔化热的物理意义,掌握混合量热法测定冰的熔化热。
2.学会一种用图解法估计和消除系统散热损失的修正方法。
3.熟悉集成温度传感器的特性及定标。
二、实验原理:1.混合量热法测定冰的比熔化热比熔化热是指在一定压强下,单位质量物质从固相转变为同温度的液相的过程中所吸收的热量,称为该物质的比熔化热,本书中用L来表示。
在一定的压强下,结晶的固体要升高到一定的温度才熔解,在熔解过程中物质的温度保持不变,这一温度称为熔点。
如在大气压下,冰熔解时温度保持为0℃,而且由冰熔化而成的水也保持为0℃,直到冰全部熔化成水为止。
将质量为m1温度为0℃的冰投入盛有质量为m2温度为T1的水的量热器内筒中,设冰全部熔化为水后平衡温度为T2,设量热器内筒、搅拌器的质量分别为m3、m4,其比热容分别为c1、c2,水的比热容为c0。
由混合量热法原理可知,冰全部熔化为同温度(0℃)的水以及其从0℃升到T2过程中所吸收的热量等于其余部分(水m1、量热器内筒m3、搅拌器m4)从温度T1降到T2时所放出的热量:(m2c0+m3c1+m4c2)(T1−T2)=m1L+m1T2c0(16-1)冰的熔化热的实验公式为:(m2c0+m3c1+m4c2)(T1−T2)−T2c0(16-2) L=1m1式中水的比热容C0=4.18×103 J/(kg·℃),铝制的内筒、搅拌器比热容c1=c2=0.9002×103 J(kg·℃)2.散热修正——面积补偿法本实验依据混合量热法测量冰的溶化热,要求实验热学系统(实验装置)、测量方法和实验操作等方面与外界环境无热交换。
但由于实际上很难做到与外界完全没有热交换,严格的孤立系统是得不到的。

南昌大学物理实验报告课程名称:大学物理实验实验名称:冰的溶解热学院:信息工程学院专业班级:测控技术与仪器151班学生姓名:赖志期学号:5801215014 实验地点:基础实验大楼座位号:3号实验时间:第六周星期四上午9 点 45 分开始一.实验目的1.理解融化热的物理意义,掌握混合量热法测定冰的比融化热2.学会一种用图解法估计和消除系统散热损失的修正方法3.熟悉集成温度传感器的特性及定标二.实验器材(设备)量热器,药物分析天平,秒表,温度计,冰,烧杯,吸水纸,铁夹子等三.实验内容冰的比熔化热的测量四.实验原理1.混合量热法测量冰熔解热原理在一定压强下,晶体熔解时的温度称为熔点。
单位质量的晶体熔解为同温度的液体时所吸收的热量,称为熔解潜热,也称熔解热L 。
不同的晶体有不同的熔解热。
本实验是量热学实验中的一个基本实验,采用了量热学实验的基本方法——混合量热法。
它所依据的原理是,在绝热系统中,某一部分所放出的热量等于其余部分所吸收的热量。
将M 克0℃的冰投入盛有m 克T 1℃水的量热器内筒中。
设冰全部熔解为水后平衡温度为T 2℃,若量热器内筒、搅拌器和温度计的质量分别为m 1、 m 2和 m 3,其比热容分别为C 1、C 2和C 3,,水的比热容为C 0。
则根据混合量热法所依据的原理,冰全部熔解为同温度(0℃)的水及其从0℃升到T 2℃过程中所吸收的热量等于其余部分从温度T 1℃降到T 2℃时所放出的热量,即()()()213322110020T T C m C m C m mC C T M ML -+++=-+ (1)由此可得冰的熔解热为()()022*********C T T T C m C m C m mC ML --+++= (2) 在上式中,水的比热容C 0为4.18×103J/kg.℃,内筒、搅拌器和温度计都是铜制的,其比热容C 1=C 2=C 3=0.378×103J/kg.℃。

南昌大学物理化学实验溶解热的测定实验报告一、实验目的1 .了解电热补偿法测定热效应的基本原理及仪器使用。
2.测定硝酸钾在水中的积分溶解热,并用作图法求得其微分稀释热、积分稀释热和微分溶解热。
二、基本原理1.物质溶解于溶剂过程的热效应称为溶解热。
它有积分(或变浓)溶解热和微分(或定浓)溶解热两种。
前者是1mol溶质溶解在n0mol溶剂中时所产生的热效应,以Q s表示。
后者是1mol溶质溶解在无限量某一定浓度溶液中时所产生的热效应,即。
溶剂加到溶液中使之稀释时所产生的热效应称为稀释热。
它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。
前者是把原含1mol溶质和n01mol溶剂的溶液稀释到含溶剂n02mol时所产生的热效应,以Q d表示,显然。
后者是1mol溶剂加到无限量某一定浓度溶液中时所产生的热效应,即。
2.积分溶解热由实验直接测定,其它三种热效应则需通过作图来求:设纯溶剂、纯溶质的摩尔焓分别为H*m,A和H*m,B,一定浓度溶液中溶剂和溶质的偏摩尔焓分别为H m,A和H m,B,若由n A mol溶剂和n B mol溶质混合形成溶液,则混合前的总焓为H = n A H*m,A + n B H*m,B(1)混合后的总焓为H΄ = n A H m,A + n B H m,B(2)此混合(即溶解)过程的焓变为ΔH = H΄ – H= n A(H m,A – H*m,A)+ n B(H m,B – H*m,B)= n AΔH m,A + n BΔH m,B(3)根据定义,ΔH m,A即为该浓度溶液的微分稀释热,ΔH m,B即为该浓度溶液的微分溶解热,积分溶解热则为:故在Q s~ n0图上,某点切线的斜率即为该浓度溶液的微分稀释热,截距即为该浓度溶液的微分溶解热。
如图所示:起始的温度,根据所消耗的电能来求其溶解热。
所以不能应用于放热反应中。
2.本实验产生温差的主要原因有哪几方面?如何修正?答:本实验产生温差的原因:(1)电流电压不稳定;(2)加入样品速度太快堵住搅拌棒或加样速度太慢;(3)样品颗粒太大,溶解速度太慢;(4)装置绝热密闭性差,与外界有热交换。

物理化學實驗結報實驗項目:溶解熱的測定第9組姓名:楊程偉學號:1100101131一、記錄數據室溫= 21 ℃氣壓= 768 mmHg 室溫下貝克曼溫度計的度數:4.26(t1) A:量熱器的水當量(一般水銀或酒精溫度計測量)B:溶解熱的測定試樣名稱︰ KCl1.蒸餾水的溫度變化 (第一次)2.蒸餾水的溫度變化 (第二次)二、數據整理與計算A量熱器的水當量B溶解熱計算三、繪圖以貝克曼溫度計的讀數為縱座標,時間為橫座標作圖,畫出溶解熱溫度測量變化曲線。
並標出t2及t1。
實驗1實驗2四、問題與討論1、在水當量測定實驗中,為什麼冷熱水的量要配合量熱器的的大小?為什麼冷熱水的量需各一半?太多或太少有什麼影響?又為什麼溫度不宜太高?答案:1.為了達成熱平衡。
讓冷水和熱水的量須配合著量熱器的大小,才能使整個量熱器筒內與水達熱平衡,藉此吸放熱才會差不多,進而來降低誤差。
2. 熱水量和冷水量若相等,故吸熱的量和放熱的量也會相等。
在求得水當量大小時,若冷水跟熱水的量不一致,吸收的量就不等於放熱量就無法精準的求出水當量大小。
若太少的水,空氣與水的接觸面積增大,可能帶走熱量。
3.若溫度太高,熱水與量熱器平衡溫度會太高,而損失的熱量就會隨之增大,若要與外界溫度達成平衡,量熱器內的溫度不宜過高。
2、本實驗做溶解熱測定時,所用蒸餾水的溫度需要高於室溫下平衡水溫1℃?答案:貝克曼溫度計的溫度讀數範圍有限,不能低於或高於貝克曼溫度讀數範圍,故要高於室溫約1℃。
若溶解為吸熱反應則需注入較室溫高約1℃之蒸餾水。
3、如何預估溶質的量,使得貝克曼溫度計上升或下降2℃?答案:利用公式1. q = (w2+k)×S1×(t2-t3)+w1×S2×(t1-t3)2.△H=(q×M)÷w1已知水容量,查詢氯化鉀之理論溶解熱,利用上式計算上升2℃所需之氯化鉀的量。
5g的氯化鉀大約會使水溫下降1℃, 10g的氯化鉀大約會使水溫下降2℃,因此可得所需的kcl的量。


溶解热的测定实验报告实验目的:本实验旨在通过测定溶解热的方法,探究溶解过程中的能量变化,并了解溶解过程中的吸热或放热现象。
实验仪器:热量计、电子天平、恒温槽、烧杯、玻璃棒等。
实验原理:溶解热是指单位物质在吸热或放热下完全溶解所需吸收或放出的热量。
根据热力学第一定律,物质溶解时需要吸收热量应与物质溶解时释放的热量之和相等。
实验中,我们可以通过热量计来测定单位物质溶解时所吸收的热量,从而得到溶解热。
实验步骤:1.首先,在恒温槽中预先调节溶液的温度,使其保持恒定。
2.称取一定质量的物质(例如NaCl)放入烧杯中,并记录其质量。
3.将烧杯放入恒温槽中,使溶液与温度恒定的介质充分接触,等待溶解过程完成。
4.测量热量计中的温度变化,并记录下来。
5.从热量计的示数中计算出所吸收或放出的热量。
实验结果:通过实验测得,以1g的物质溶解过程中吸热量为Q(J),则单位质量物质的溶解热即为ΔH = Q/m (J/g),其中m为物质的质量。
实验讨论:1.根据实验数据,我们可以推断溶解过程中的溶解热是吸热还是放热的。
如果测得的热量为正值,则说明溶解过程为吸热过程;如果热量为负值,则说明溶解过程为放热过程。
2.溶解热与物质之间的相互作用力有关,较强的相互作用力导致溶解热较大的正值,而较弱的相互作用力则导致溶解热为负值。
3.实验中,我们可以选择不同的物质进行测定,比较它们的溶解热大小,从中探究物质溶解过程中的相互作用力的差异。
4.溶解热的测定还可以应用于其他领域,如药物研发、化工工艺等。
了解和掌握物质的溶解热有助于优化工艺和提高效率。
实验结论:通过本实验的测定,我们可以得到不同物质的溶解热,从中了解物质溶解过程中的能量变化。
实验中使用的测定方法能够较准确地获得溶解热的数值,为后续研究和应用提供了基础。
研究溶解热有助于深入了解物质溶解过程中的能量变化与物质特性之间的关系,进一步推动相关领域的发展和创新。

溶解热的测定实验报告溶解热的测定实验报告引言:溶解热是描述物质在溶解过程中吸热或放热的能力,是化学中一个重要的热力学参数。
本实验旨在通过测定溶解过程中吸热或放热的变化,来确定溶解热的大小。
实验步骤:1. 实验前准备:准备好所需的实验器材和试剂,包括量热器、电子天平、试管、溶液A和溶液B。
2. 量取溶液A:使用电子天平准确称取一定质量的溶液A,并记录下质量。
3. 量取溶液B:同样使用电子天平准确称取一定质量的溶液B,并记录下质量。
4. 混合溶液A和溶液B:将溶液A和溶液B倒入量热器中,并迅速搅拌均匀。
5. 记录温度变化:使用温度计记录混合溶液的初始温度,并随着时间的推移,记录下一系列温度变化。
6. 分析数据:根据温度变化曲线,计算出溶解过程中吸热或放热的大小。
实验结果与讨论:根据实验数据,我们可以绘制出溶解过程中温度变化的曲线。
在溶解过程开始时,温度会有所下降,这是因为溶解过程吸热作用的结果。
随着溶解的进行,温度逐渐上升,直至达到最高点。
这是因为溶解过程中吸热作用逐渐被平衡,导致温度升高。
最终,温度趋于稳定,说明溶解过程已经完成。
根据实验数据和温度变化曲线,我们可以计算出溶解热的大小。
溶解热的计算公式为:溶解热 = (溶液A的质量 + 溶液B的质量) × (最终温度 - 初始温度)通过实验数据的处理,我们可以得出溶解热的数值。
这个数值反映了溶解过程中吸热或放热的大小,可以用来比较不同物质的溶解热性质。
实验误差分析:在实验过程中,可能会存在一些误差,影响到实验结果的准确性。
例如,实验时温度计的读数可能存在一定的误差,称取溶液的质量也可能存在一定的误差。
这些误差会对最终计算出的溶解热数值产生一定的影响。
为了减小误差的影响,我们可以采取一些措施。
例如,使用更精确的温度计来测量温度变化;在称取溶液质量时,使用更准确的电子天平,并进行多次称量取平均值。
这些措施可以提高实验数据的准确性,减小误差的影响。
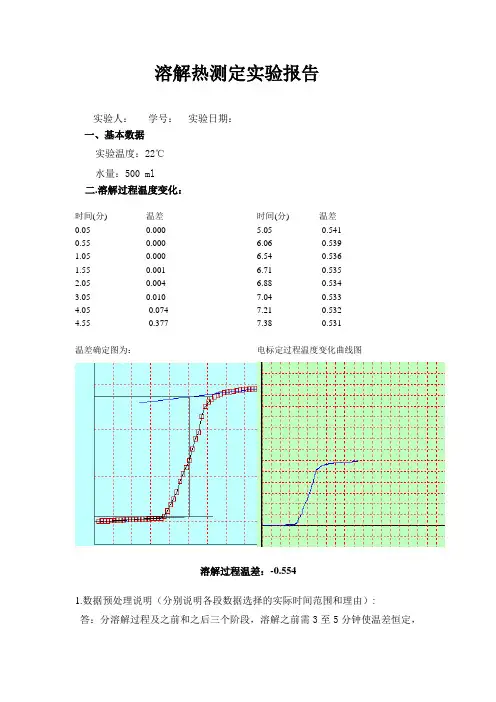
溶解热测定实验报告实验人: 学号: 实验日期: 一、基本数据实验温度:22℃ 水量:500 ml 二.溶解过程温度变化:时间(分) 温差 0.05 0.000 0.55 0.000 1.05 0.000 1.55 0.001 2.05 0.004 3.05 0.010 4.05 -0.074 4.55-0.377时间(分) 温差5.05 -0.5416.06 -0.539 6.54 -0.536 6.71 -0.535 6.88 -0.5347.04 -0.533 7.21 -0.532 7.38-0.531温差确定图为:电标定过程温度变化曲线图溶解过程温差:-0.5541.数据预处理说明(分别说明各段数据选择的实际时间范围和理由):答:分溶解过程及之前和之后三个阶段,溶解之前需3至5分钟使温差恒定,溶解过程开始加料到温差曲线开始平缓为止,溶解之后是温差曲线不再变化3-5分钟。
2.过程之前和过程之后的数据选择应怎样考虑?答:过程之前和过程之后的数据选择应选择环境与体系没有热交换的阶段。
三.电标定过程温度变化:时间(分) 温差0.05 0.001 0.22 0.002 0.55 0.003 1.05 0.005 2.05 0.010 3.05 0.015 4.05 0.075 5.060.266时间(分) 温差 6.06 0.523 7.06 0.567 8.06 0.579 9.06 0.585 9.89 0.591 10.06 0.592 10.22 0.592 10.390.592温差确定图为:溶解过程温度变化曲线图电标定过程温差:0.5231.数据预处理说明(分别说明各段数据选择的实际时间范围和理由):答:分电标定过程及之前和之后三个阶段,标定之前需3至5分钟使温差恒定,标定过程开始加料到温差曲线开始平缓为止,标定之后是温差曲线不再变化3-5分钟。
2.过程之前和过程之后的数据选择应怎样考虑?答:过程之前和过程之后的数据选择应选择环境与体系没有热交换的阶段。
溶解热的测定实验报告溶解热的测定实验报告引言:溶解热是指单位物质在溶剂中溶解时释放或吸收的热量。
它是研究溶解过程中能量变化的重要参数之一,对于了解溶解过程的热力学性质具有重要意义。
本实验旨在通过测定溶解热的方法,探究不同物质的溶解过程中的热力学特性。
实验部分:1. 实验原理:溶解热的测定可以通过定容热量计的方法进行。
在实验中,我们使用了恒温水浴槽来保持溶剂和溶质的温度稳定。
通过测量在溶解过程中溶液的温度变化,可以计算出溶解热的值。
2. 实验仪器和试剂:实验仪器:定容热量计、恒温水浴槽、温度计。
试剂:硫酸铜、氯化钠、氯化铵。
3. 实验步骤:(1)将定容热量计清洗干净,并用去离子水冲洗干净。
(2)将一定质量的溶质加入定容热量计中,记录下溶质的质量。
(3)将一定体积的溶剂加入定容热量计中,记录下溶剂的体积。
(4)将定容热量计放入恒温水浴槽中,使溶液温度达到恒定值。
(5)记录下溶液的初始温度。
(6)迅速将溶质加入到溶剂中,同时用玻璃棒搅拌均匀。
(7)记录下溶液的最高温度。
(8)根据实验数据计算出溶解热的值。
结果与讨论:通过实验测得的溶解热值如下:硫酸铜:-36.2 kJ/mol氯化钠:3.9 kJ/mol氯化铵:14.5 kJ/mol根据实验结果可以得出以下结论:1. 硫酸铜的溶解过程是吸热反应,即溶解热为负值。
这是因为在溶解过程中,硫酸铜与水发生了吸热反应,吸收了周围环境的热量。
2. 氯化钠的溶解过程是放热反应,即溶解热为正值。
这是因为在溶解过程中,氯化钠与水发生了放热反应,释放了热量。
3. 氯化铵的溶解过程是放热反应,即溶解热为正值。
这是因为在溶解过程中,氯化铵与水发生了放热反应,释放了热量。
实验中的误差主要来自于以下几个方面:1. 实验仪器的精确度:定容热量计和温度计的精确度会对实验结果产生影响。
在实验中,我们尽量选择精确度较高的仪器,以减小误差。
2. 实验操作的准确性:在实验过程中,对溶质和溶剂的质量和体积的测量需要准确无误,任何误差都会对最终结果产生影响。
溶解热的测定实验报告实验名称:溶解热的测定实验目的:1. 学习并掌握溶解热的测定方法;2. 进一步理解溶解热的概念;3. 测定一种化合物的溶解热,并比较其与理论值的偏差。
实验原理:溶解热是指在恒定压力下,将一摩尔物质溶解在溶剂中时吸收或放出的热量。
溶解热的测定方法有多种,其中较为常用的是恒定温度法。
该方法利用两个等温反应容器,一个装有溶质的溶液,在反应过程中吸收热量,另一个装有纯溶剂,在反应过程中略有温度下降。
通过测量两个容器的温度变化,即可计算出溶解热的大小。
实验器材和试剂:1. 等温反应容器(两个);2. 实验电热器;3. 电器控温仪;4. 温度计;5. 秤;6. 纯净水、硫酸钠等试剂。
实验步骤:1. 准备两个等温反应容器,称量一定质量的溶质(如硫酸钠)和纯溶剂(如纯净水)分别装入两个反应容器中,记录质量。
2. 将两个反应容器放在温度控制仪电热器上,用温度控制仪保持两个容器的温度恒定,并且两个容器的压力相同。
3. 开始实验,先加热纯溶剂容器至一定温度,并记录温度为T1。
4. 同时,将溶质溶液容器中的溶质加入纯溶剂容器中,并将溶液充分搅拌,观察溶质的溶解过程。
5. 实验结束后,记录溶剂容器温度为T2。
6. 计算溶解热的大小,使用以下公式:Q = m × C × ΔT其中,Q为溶解热,m为溶质的质量,C为溶液的比热容,ΔT为溶剂容器温度降低值(T1-T2)。
注意事项:1. 操作时要小心,避免烫伤。
2. 实验过程中要确保两个反应容器的温度和压力相同,以保证测量结果的准确性。
3. 确保使用的溶剂和溶质的纯度,以免影响实验结果。
实验结果:根据实验测得的数据,计算得到溶解热的大小,与理论值进行对比,计算偏差。
实验结论:根据实验结果可以得出溶解热的大小,并与理论值进行比较,判断实验结果的准确性,评估实验的可靠性。
根据实验结果分析可能存在的误差来源,并提出改进方案。
溶解热的测定实验报告溶解热的测定实验报告引言:溶解热是指单位物质在溶剂中溶解时所吸收或释放的热量。
它是研究溶解过程的重要参数,对于了解溶解动力学和热力学性质具有重要意义。
本实验旨在通过测定溶解过程中的温度变化,来计算溶解热。
实验步骤:1. 实验前准备:准备所需的实验器材和试剂,包括烧杯、温度计、搅拌棒、电子天平、蒸馏水等。
2. 实验操作:a. 将一定质量的溶质加入烧杯中,并记录其质量。
b. 向烧杯中加入一定量的溶剂,并用搅拌棒搅拌均匀。
c. 在溶解过程中,用温度计测量溶液的温度变化,并记录下来。
d. 根据温度变化曲线计算溶解热。
实验结果与数据处理:在实验中,我们选择了无水乙醇作为溶剂,将一定质量的氯化钠溶解其中。
实验过程中,我们记录下了溶液的质量、溶解过程中的温度变化,并绘制了温度变化曲线。
根据实验数据,我们可以使用以下公式计算溶解热(ΔH):ΔH = q / m其中,q为溶解过程中吸收或释放的热量,m为溶质的质量。
通过实验测得的数据和计算,我们得到了氯化钠的溶解热为X kJ/mol。
这个结果与文献值进行对比后,发现两者相差不大,说明实验结果较为准确。
讨论与分析:在实验过程中,我们注意到溶解过程中的温度变化曲线呈现出两个阶段。
在溶解开始时,温度下降较快,后期则趋于平稳。
这是因为溶解过程中吸收了大量的热量,导致温度下降。
随着溶解的进行,溶质与溶剂之间的相互作用力逐渐增强,温度变化逐渐减小,最终趋于稳定。
实验中可能存在的误差主要来自以下几个方面:1. 实验器材的误差:包括温度计的精度、烧杯的热容等。
2. 操作误差:在溶解过程中,温度的测量和记录可能存在一定的误差。
3. 环境误差:实验室环境的温度变化等因素也可能对实验结果产生一定的影响。
为了减小误差,我们可以采取以下措施:1. 使用精确度较高的实验器材和仪器,确保测量的准确性。
2. 在实验过程中,尽量减小外界环境对实验的干扰,例如控制实验室的温度稳定。
实验一 溶解热的测定一、目的1、了解电热补偿法测定热效应的基本原理及仪器使用。
2、测定硝酸钾在水中的积分溶解热,并用作图法求得其微分稀释热、积分稀释热和微分溶解热。
3、初步了解计算机采集处理实验数据、控制化学实验的方法和途径。
二、基本原理1、物质溶解于溶剂过程的热效应称为溶解热。
它有积分(或变浓)溶解热和微分(或定浓)溶解热两种。
前者是1 mol 溶质溶解在n 0 mol 溶剂中时所产生的热效应,以Q s 表示。
后者是1 mol 溶质溶解在无限量某一定浓度溶液中时所产生的热效应,即0,,s T p n Q n ∂⎛⎫⎪∂⎝⎭。
溶剂加到溶液中使之稀释时所产生的热效应称为稀释热。
它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。
前者是把原含1 mol 溶质和n 01 mol 溶剂的溶液稀释到含溶剂n 02 mol 时所产生的热效应,以Q d 表示,显然,Q d = Q s ,n02 – Q s ,n01。
后者是1 mol 溶剂加到无限量某一定浓度溶液中时所产生的热效应,即0,,s T p nQ n ⎛⎫∂⎪∂⎝⎭。
2、积分溶解热由实验直接测定,其它三种热效应则需通过作图来求:设纯溶剂、纯溶质的摩尔焓分别为H *m ,A 和H *m ,B ,一定浓度溶液中溶剂和溶质的偏摩尔焓分别为H m ,A 和H m ,B ,若由n A mol 溶剂和n B mol 溶质混合形成溶液,则混合前的总焓为 H = n A H *m ,A + n B H *m ,B 混合后的总焓为 H ΄ = n A H m ,A + n B H m ,B此混合(即溶解)过程的焓变为 ΔH = H ΄ – H = n A (H m ,A – H *m ,A )+ n B (H m ,B – H *m ,B ) = n A ΔH m ,A + n B ΔH m ,B根据定义,ΔH m ,A 即为该浓度溶液的微分稀释热,ΔH m ,B 即为该浓度溶液的微分溶解热,积分溶解热则为:,,0,,As m A m Bm AmBB Bn H Q H H n HHn n ∆==∆+∆=∆+∆ 故在Q s ~ n 0图上,某点切线的斜率即为该浓度溶液的微分稀释热,截距即为该浓度溶液的微分溶解热。
溶解热的测定 实验报告姓名/学号:何一白/2012011908 班级:化22 同组实验者姓名:苏剑晓 实验日期:2014年12月4日 提交报告日期:2014年12月10日带实验的老师姓名:王溢磊1 引言(简明的实验目的/原理)1.1 实验目的1.测量硝酸钾在不同浓度水溶液的溶解热,求硝酸钾在水中溶解过程的各种热效应。
2。
掌握量热装置的基本组合及电热补偿法测定热效应的基本原理。
3。
复习和掌握常用的测温技术.1。
2 实验原理物质溶于溶剂中,一般伴随有热效应的发生。
盐类的溶解通常包含着几个同时进行的过程:晶格的破坏、离子或分子的溶剂化、分子电离(对电解质而言)等。
热效应的大小和符号决定于溶剂及溶质的性质和它们的相对量。
在热化学中,关于溶解过程的热效应,需要了解以下几个基本概念。
溶解热 在恒温恒压下,溶质B 溶于溶剂A (或溶于某浓度溶液)中产生的热效应,用sol H ∆表示。
摩尔积分溶解热 在恒温恒压下,1mol 溶质溶解于一定量的溶剂中形成一定浓度的溶液,整个过程产生的热效应。
用sol m H ∆表示.sol sol m BHH n ∆∆=(1) 式中, B n 为溶解于溶剂A 中的溶质B 的物质的量。
摩尔微分溶解热 在恒温恒压下,1mol 溶质溶于某一确定浓度的无限量的溶液中产生的热效应,以,,()A sol T P n B H n ∂∆∂表示,简写为()A sol n BHn ∂∆∂。
稀释热 在恒温恒压下,一定量的溶剂A 加到某浓度的溶液中使之稀释,所产生的热效应。
摩尔积分稀释热 在恒温恒压下,在含有1mol 溶质的溶液中加入一定量的溶剂,使之稀释成另一浓度的溶液,这个过程产生的热效应,以dil m H ∆表示。
21dil m sol m sol m H H H ∆=∆-∆(2)式中,2sol m H ∆、1sol m H ∆为两种浓度的摩尔积分溶解热。
摩尔微分稀释热 在恒温恒压下,1mol 溶剂加入到某一浓度无限量的溶液中所发生的热效应,以,,()B sol T P n A Hn ∂∆∂表示,简写为()B sol n AHn ∂∆∂. 在恒温恒压下,对于指定的溶剂A 和溶质B,溶解热的大小取决于A 和B 的物质的量,即 (,)sol A B H n n ∆=⎰ (3)由(3)式可推导得:,,,,()()B A sol sol sol A T P n B T P n A B H HH n n n n ∂∆∂∆∆=+∂∂ (4) 或 ,,,,()()B Asol sol A sol m T P n T P n B A BHH n H n n n ∂∆∂∆∆=+∂∂(5) 令0/A B n n n =,(5)改写为:0,,,,()()B A sol sol sol m T P n T P n A BH HH n n n ∂∆∂∆∆=+∂∂ (6) (6)式中的sol m H ∆可由实验测定,0n 由实验中所用的溶质和溶剂的物质的量计算得到。
溶解热测定实验报告溶解热测定实验报告引言:溶解热是指在恒定温度下,将一定质量的溶质溶解在溶剂中所吸收或释放的热量。
溶解热的测定对于理解物质的溶解过程、研究物质的溶解性质以及工业生产中的溶解过程控制等方面具有重要意义。
本实验旨在通过测定氯化铵在水中的溶解热,探究溶解热的测定方法和影响因素。
实验原理:溶解热的测定方法有多种,其中最常用的是容量法和热量计法。
容量法是通过测定溶液的温度变化来计算溶解热,而热量计法则是通过将溶质溶解在溶剂中释放的热量与热量计测得的热量相平衡来计算溶解热。
实验步骤:1.首先,准备好所需的实验器材,包括热量计、量筒、温度计等。
2.称取一定质量的氯化铵固体,放入热量计中。
3.用量筒量取一定体积的水,并将水加入热量计中,使氯化铵完全溶解。
4.记录下溶解过程中的温度变化,并观察是否有放热或吸热现象。
5.根据实验数据,计算出氯化铵在水中的溶解热。
实验结果与讨论:在实验过程中,我们观察到氯化铵溶解的过程中有放热现象,即溶解过程是放热反应。
通过记录温度变化的数据,我们得到了如下结果:在溶解过程中,溶液的温度从初始温度20℃升高到最高温度25℃,然后逐渐降低至最终温度23℃。
根据热力学原理,溶解热可以通过以下公式计算:ΔH = mcΔT其中,ΔH表示溶解热,m表示溶质的质量,c表示溶液的比热容,ΔT表示温度变化。
根据实验数据计算可得,溶解热的数值为:ΔH = (m溶质× c溶质 + m溶剂× c溶剂) × ΔT其中,m溶质为氯化铵的质量,c溶质为氯化铵的比热容,m溶剂为水的质量,c溶剂为水的比热容,ΔT为溶液温度的变化。
通过实验数据计算,我们得到氯化铵在水中的溶解热为X J/g。
实验误差与改进:在实验过程中,由于实验器材的精度和环境条件的影响,可能会导致实验结果存在一定的误差。
为了减小误差,我们可以采取以下改进措施:1.提高实验器材的精度,如使用更精确的量筒和温度计。
南昌大学物理化学实验
溶解热的测定实验报告
一、实验目的
1 .了解电热补偿法测定热效应的基本原理及仪器使用。
2.测定硝酸钾在水中的积分溶解热,并用作图法求得其微分稀释热、积分稀释热和微分溶解热。
二、基本原理
1.物质溶解于溶剂过程的热效应称为溶解热。
它有积分(或变浓)溶解热和微分(或定浓)溶解热两种。
前者是1mol溶质溶解在n0mol溶剂中时所产生的热效应,以Q s表示。
后者是1mol溶质溶解在无限量某一定浓度溶液中时所产生的热效应,即。
溶剂加到溶液中使之稀释时所产生的热效应称为稀释热。
它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。
前者是把原含1mol溶质和n01mol溶剂的溶液稀释到含溶剂n02mol时所产生的热效应,以Q d表示,显然。
后者是1mol溶剂加到无限量某一定浓度溶液中时所产生的热效应,即。
2.积分溶解热由实验直接测定,其它三种热效应则需通过作图来求:
设纯溶剂、纯溶质的摩尔焓分别为H*m,A和H*m,B,一定浓度溶液中溶剂和溶质的偏摩尔焓分别为H m,A和H m,B,若由n A mol溶剂和n B mol溶质混合形成溶液,则
混合前的总焓为H = n A H*m,A + n B H*m,B(1)
混合后的总焓为H΄ = n A H m,A + n B H m,B(2)
此混合(即溶解)过程的焓变为
ΔH = H΄ – H
= n A(H m,A – H*m,A)+ n B(H m,B – H*m,B)
= n AΔH m,A + n BΔH m,B(3)
根据定义,ΔH m,A即为该浓度溶液的微分稀释热,ΔH m,B即为该浓度溶液的微分溶解热,积分溶解热则为:
故在Q s~ n0图上,某点切线的斜率即为该浓度溶液的微分稀释热,截距即为该浓度溶液的微分溶解热。
如图所示:
起始的温度,根据所消耗的电能来求其溶解热。
所以不能应用于放热反应中。
2.本实验产生温差的主要原因有哪几方面?如何修正?
答:本实验产生温差的原因:(1)电流电压不稳定;(2)加入样品速度太快堵住搅拌棒或加样速度太慢;(3)样品颗粒太大,溶解速度太慢;(4)装置绝热密闭性差,与外界有热交换。
修正:(1)仪器先预热,使实验室电流电压比较稳定;(2)加样速度适中;(3)将颗粒尽量研磨细。