物理化学实验报告-溶解热的测定
- 格式:docx
- 大小:32.23 KB
- 文档页数:6


溶解热的测定溶解热是指在恒定压力下,单位质量固体物质在溶液中完全溶解时所放出或吸收的热量。
它是化学热力学中的一项重要物理量,与溶解过程的热力学性质和反应机理密切相关。
溶解热的测定方法有很多种,我们这里介绍两种典型的实验方法:计算比热容法和测定热效应法。
一、计算比热容法比热容法是根据热平衡原理,在温度为T1的热源中将样品加热至温度为T2,测定样品的质量m、热容Cp、初始温度T1和终末温度T2,从而计算出溶解热ΔH。
其计算公式为:ΔH = (Q2 - Q1) / m = Cp × (T2 - T1)其中,Q1和Q2分别表示样品在T1和T2温度下吸收的热量,Cp是样品的比热容,m是样品质量,ΔH为溶解热。
此外,由于固体在溶液中溶解时通常伴随着熔化,因此在计算时应将熔化热考虑在内,即:其中,ΔHm为熔化热,通常可以参考文献或手册给出的数据进行修正。
比热容法的优点是测量精度高,操作简单,但需要较精确的温度测量和热量测量,且需要考虑熔化热的影响。
二、测定热效应法测定热效应法是通过测量溶解过程中反应热量的变化来计算溶解热。
通常是在恒定压力下将固体样品加入到溶液中,测定反应热量和样品的质量,从而计算出溶解热ΔH。
其计算公式为:ΔH = Q / m其中,Q为反应过程中放出或吸收的热量,m为样品质量,ΔH为溶解热。
测定热效应法有多种实验方法,比如热量计法、差热分析法、反应热法等,不同的方法适用于不同类型的样品和反应体系。
其中,热量计法是一种较为常用的测定方法,其基本原理是通过测量加热物体的能量变化量来计算反应热量。
它的优点是可应用于各种类型的样品和反应体系,能够直接测定反应过程的热量变化,但需要一定的操作技能和仪器支持。
总之,溶解热的测定是化学热力学中的一项重要实验。
通过计算比热容法和测定热效应法等方法,可以获得溶解过程的热力学性质和反应机理,为化学工艺控制和工业生产提供重要的参考数据。

物化实验报告溶解热的测定_KCl、KNO3实验报告:溶解热的测定——KCl、KNO3一、实验目的1.学习和掌握溶解热测定的原理和方法。
2.通过实验测定KCl和KNO3在水中溶解的热效应。
3.比较相同浓度下KCl和KNO3的溶解热效应差异。
二、实验原理溶解热是指物质在溶解过程中所伴随的热量变化。
当物质溶解时,其分子或离子会从固态或晶体状态分散到溶剂中,这一过程通常会吸收或释放热量。
溶解热的测定有助于了解物质溶解过程中的热力学性质。
溶解热的测定通常采用量热计进行。
量热计可以准确地测量溶液温度的变化,并以此来计算溶解热。
根据Arrhenius公式,溶解热与温度有关,因此,通过测量不同温度下的溶解热,可以评估温度对物质溶解热效应的影响。
三、实验步骤1.准备实验器材:500ml烧杯、电子天平、量筒、水浴锅、保温杯、恒温水浴、热量计等。
2.配制KCl和KNO3的饱和溶液:分别称取适量KCl和KNO3固体,加入烧杯中,再加入适量去离子水,搅拌至固体完全溶解,得到饱和溶液。
3.测量溶解热:将保温杯中的去离子水倒入量热计中,插入电子天平,记录初始温度T1。
分别将KCl和KNO3的饱和溶液倒入量热计中,记录溶解后的温度T2。
根据温度差和水的质量,计算溶解热。
4.重复测量:为了确保实验结果的准确性,可以重复以上步骤几次,每次测量不同的浓度。
5.数据处理和分析:整理实验数据,根据溶解热的计算公式,比较相同浓度下KCl和KNO3的溶解热效应差异。
四、实验结果与讨论1.实验数据:以下是实验测定的KCl和KNO3在水中溶解的热效应数据。
2.结果分析:从上表可以看出,相同浓度下,KCl的溶解热效应比KNO3高。
随着浓度的增加,两种物质的溶解热效应都逐渐增大。
这表明在溶解过程中,KCl分子或离子从固体分散到水中的吸热过程比KNO3更为显著。
此外,KCl和KNO3的溶解热效应与Arrhenius公式中的常数相关联,这意味着溶解热的温度依赖性较强。

物化实验报告-溶解热的测定一、实验目的本实验旨在通过科学的测定方法,准确地得到溶解热数据,进一步理解溶解热现象和物质溶解过程中的热力学性质。
二、实验原理溶解热是指一定温度下,一定量的溶剂中溶质溶解时所需的热量。
通过测量溶解热,可以了解溶质和溶剂之间的相互作用、溶解过程的动力学性质等。
溶解热的测定有助于我们深入理解溶解现象和溶液的热力学性质。
本实验采用综合量热法测定溶解热。
综合量热法是一种通过测量热量和温度变化来确定溶解热的实验方法。
在实验过程中,需要精确控制温度变化和溶液浓度等因素,以减小误差。
三、实验步骤1.准备实验器材:恒温水浴、量热计、搅拌器、称量纸、电子天平、保温杯、热水浴、计时器等。
2.配制一定浓度的溶质溶液:用称量纸称取一定质量的溶质,加入热水浴中搅拌均匀,冷却至室温。
3.将量热计和保温杯放入恒温水浴中,确保其处于稳定状态。
4.将配制好的溶质溶液倒入保温杯中,记录初始温度T1。
5.开启搅拌器,将保温杯置于恒温水浴中,记录最终温度T2。
6.测量此过程中溶液的体积变化ΔV,计算溶液的密度ρ=m/ΔV(m为溶质的质量)。
7.根据综合量热法公式计算溶解热ΔH:ΔH = cm(T2-T1) +mΔTc·ΔV/ΔV·m·c·ΔT (c为水的比热容,m为溶质的质量,ΔTc为溶液的密度变化)。
四、实验数据分析通过本次实验,我们得到了一系列溶质的溶解热数据。
从数据中可以看出,不同溶质具有不同的溶解热。
这些数据有助于我们深入理解溶解现象和物质溶解过程中的热力学性质。
溶解热在化学、物理、生物等许多领域都有重要应用,例如化学反应过程的动力学分析、生物大分子的溶液性质研究等。
本实验方法具有较高的精度和可靠性,为后续相关领域的研究提供了有价值的参考数据。

物化实验报告-溶解热的测定实验目的:1. 了解溶解现象的性质。
2. 学习测定物质溶解热的方法。
3. 熟悉热量计的使用方法。
实验原理:一般来说,增加溶液中溶质的质量会增加它的浓度,从而使得其解离程度增加。
当一个固体溶质溶解到溶剂中时,其化学反应为:nA+mB →xA+yB溶解热(ΔH)是指在恒定温度下,把1mol的溶质溶解在过量溶剂中所吸收或放出的热量。
根据定义,若1mol溶质在溶液中溶解时,吸收了Q焓,而在一定浓度下,1mol溶质所溶出的热量为ΔHmol。
ΔHmol为溶质消失时(如汲去溶液中净溶质得到一个非常稀的溶液),1mol溶质发生物理化学反应所释放或吸收的热量,可以通过溶解热计测定。
实验器材:1. 热量计(包括绝热箱、内垫热垫、外围水垫、内外盘、挡热器等)2. 量筒3. 试管4. 钳子实验步骤:1. 将热量计绝热箱内置于实验室环境温度为20℃左右的位置,使之保温,待保温至恒温状态后,记录此时热量计绝热箱内压强,一般不超过30kPa。
2. 在保温状态下,将量好的蒸馏水倒入热量计的内/外垫上,令水面与仪器保持同一水平线,测试初始温度T1。
3. 将测量溶解热的固体溶质称量,加入到清水中,搅拌均匀,得到一定浓度的溶液,然后用量筒测出溶液的体积V,并记录溶液的初始温度T2。
4. 将溶解好的溶液加入热量计内垫里的试管中,并令试管位于热量计绝热同心管上。
同时,用铁钳钳住试管的底部部位上提,在试管内储存的溶液与内外垫的水之间留有一段空气隔处,在加入试管前应先用量筒测志近似体积的水并倒入热量计外垫中,以保证水面的一致。
5. 发现热量计稳定在一定温度后,记录此时的温度T3。
6. 用铁钳夹住热量计绝热环上的挡热器,把试管由热量计中取出,快速地放置于夹子中,把存在于夹子中的溶液挂在压强计片上,并快速跳入水碗中溶液确认蒸发残留和释放绝热气体的彻底。
1. 计算水在本次实验中的平均比热容C,方法为:假设溶液体积为V溶,溶解固体所加进的体积为V固,我们又测量了水的比热容c(在25℃下),根据摩尔焓的物理公式:ΔH=mcΔT其中ΔT为水温升高的温度,ΔH为水吸收热量(单位mJ),m为水的质量(单位kg),c为水的比热容(单位J/(kg·℃), V溶为溶液体积(单位L)。

溶解热测定(物化试验得好好做)一、实验目的1、设计简单量热计测定某物质在水中的积分溶解焓。
2、复习和掌握常用的量热技术与测温方法。
3、由作图法求出该物质在水中的摩尔稀释焓、微分溶解焓、微分稀释焓。
二、实验原理溶解热,即为一定量的物质溶于一定量的溶剂中所产生的热效应。
溶解热除了与溶剂量及溶质量有关外,还与体系所处的温度及压力有关。
溶解热分为积分溶解热和微分溶解热。
积分溶解热即在等温等压条件下,1mol溶质溶解在一定量的溶剂中形成某指定浓度的溶液时的焓变。
也即为此溶解过程的热效应。
它是溶液组成的函数,若形成溶液的浓度趋近于零,积分溶解热也趋近于一定值,称为无限稀释积分溶解热。
积分溶解热是溶解时所产生的热量的总和,可由实验直接测定。
微分溶解热即在等温等压下,在大量给定浓度的溶液里加入一摩尔溶质时所产生的热效应,它可表示为(ЭΔsolH/ЭnB)T、P、nA ,因溶液的量很大,所以尽管加入一摩尔溶质,浓度仍可视为不变。
微分热难以直接测量,但可通过实验,用间接的方法求得。
溶解热的测量可通过绝热测温式量热计进行,它是在绝热恒压不作非体积功的条件下,通过测定量热系统的温度变化,而推算出该系统在等温等压下的热效应。
本实验采用标准物质法进行量热计能当量的标定。
利用1molKCl溶于200mol水中的积分溶解热数据进行量热计的标定。
当上述溶解过程在恒压绝热式量热计中进行时,可设计以下途径完成:上述途径中:△H = △H1+△H2 = 0 →△H2 = -△H1△H1 = [n1Cp,m (KCL,S)+ n2Cp,m(H2O,l)+ K ]×(T2- T1)△H2 = n1ΔsolHmK = -[n1Cp,m(KCL,S)+ n2Cp,m(H2O,l)+(n1ΔsolHm )/(T2- T1)]= -[m1Cp(KCL,S)+ m2Cp(H2O,l)+(m1ΔsolHm )/(M1 △T)]式中m1 、m2 分别为溶解过程加入的KCl(S)和H2O(l)的质量;Cp,m为物质的恒压比热容,既单位质量的物质的等压热容,Cp(KCl,S)=0.699 kJ/(kg·K),Cp(H2O,l)= 4.184 kJ/(kg·K);M1为KCl的摩尔质量,△T =(T2- T1)即为溶解前后系统温度的差值;ΔsolHm 为1molKCl溶解于200 molH2O的积分溶解热,其不同温度下的积分溶解热数值见附录。


实验八 溶解热的测定一、实验目的及要求1.掌握采用电热补偿法测定热效应的基本原理;2.用电热补偿法测定硝酸钾在水中的积分溶解热,并用作图法求出硝酸钾在水中的微分溶解热,积分稀释热和微分稀释热;3.掌握溶解热测定仪器的使用。
二、实验原理物质溶解过程所产生的热效应称为溶解热,可分为积分溶解热和微分溶解热两种。
积分溶解热是指定温定压下把1 mol 物质溶解在 n 0 mol 溶剂中时所产生的热效应。
由于在溶解过程中溶液浓度不断改变,因此又称为变浓溶解热,以Q s 表示。
微分溶解热是指在定温定压下把 1 mol 物质溶解在无限量某一定浓度溶液中所产生的热效应。
在溶解过程中浓度可视为不变,因此又称为定浓溶解热,以0,,n p T s n Q ⎪⎭⎫ ⎝⎛∂∂表示,即定温,定压,定溶剂状态下,由微小的溶质增量所引起的热量变化。
稀释热是指将溶剂添加到溶液中,使溶液稀释过程中的热效应,又称为冲淡热。
它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。
积分稀释热是指在定温定压下把原为含 1 mol 溶质和 n 01 mol 溶剂的溶液冲淡到含有 n 02 mol 溶剂时的热效应,它为两浓度的积分溶解热之差,以Q d 表示。
微分冲淡热是指将 1 mol 溶剂加到某一浓度的无限量溶液中所产生的热效应,以n p T s n Q ,,0⎪⎪⎭⎫ ⎝⎛∂∂表示,即定温,定压,定溶质状态下,由微小溶剂增量所引起的热量变化。
积分溶解热的大小与浓度有关,但不具有线性关系。
通过实验测定,可绘制出一条积分溶解热Q s 与相对于 1 mol 溶质的溶剂量 n 0 之间的关系曲线(如图8-1所示),其它三种热效应由Q s ~n 0曲线求得。
设纯溶剂、纯溶质的摩尔焓分别为H 1和H 2,溶液中溶剂和溶质的偏摩尔焓分别为H 1,m 和H 2,m ,对于由 n 1 摩尔溶剂和 n 2 摩尔溶质所组成的体系,在溶剂和溶质未混合前,体系总焓为: 2211H n H n H += (1) 将溶剂和溶质混合后,体系的总焓为:m m H n H n H ,22,11'+= (2) 因此,溶解过程的热效应为:22112,221,11)()('H n H n H H n H H n H H H m m ∆+∆=-+-=-=∆ (3) 在无限量溶液中加入 1 mol 溶质,(3)式中的第一项可认为不变,在此条件下所产生的热效应为(3)式第二项中的ΔH 2,即微分溶解热。


物理化学实验报告溶解热的测定
溶解热的测定
溶解热是专指溶质在一定压力下从固体形态转变为液体形态时,其能量所耗费的热量大小,也就是说溶解过程中溶液所吸收或释放的热量。
本次实验以NaCl为溶质,采用盐酸与碳酸钠溶液混合液体的方式,来测定它在溶解过程中的溶解热。
实验环境、设备及试剂
本实验室使用的温度测定设备为“风冷式热量卡尔托热量计”,溶质的试剂为氯化钠。
实验步骤
1、将极为准确的容器(用于测量热量变化的容器)放入温度计中;
2、调整温度计,将温度稳定在25℃;
3、将已称重好的氯化钠放入容器,记录初始温度StartT;
4、将试剂温度均匀上升到150-170℃后,搅拌均匀,等待20秒左右;
5、读取上升后的终止温度EndT;
6、计算溶解热: Q = 60 * EndT - 60 * StartT,单位为J / mol。
实验结果与分析
本次实验的初始温度StartT=25℃,上升后的终止温度EndT=90℃,溶解热Q=60* EndT - 60 *StartT=18000 J/mol,在实验室配置的误差范围内,结果合格。
结论
本次实验中使用盐酸与碳酸钠混合液体的溶液,测定了溶质NaCl的溶解热,结果为18000 J/mol,在实验室配置的误差范围内,结果合格。
物化实验报告溶解热的测定实验目的:1.了解溶解现象和溶解热的概念;2.学习利用物化实验的方法测定溶解热;3.熟悉实验仪器的使用方法;4.加深对物质溶解规律的理解。
实验原理:溶解热是指单位物质在溶液中完全溶解时所吸收或放出的热量。
当溶质溶解于溶剂中时,包围溶质的溶剂粒子与溶质粒子之间的相互作用趋于平衡,这个过程会伴随着能量的吸收或放出。
利用焓计或反应热计可以测定溶解热,其中反应热计是一种常用的测定溶解热的方法。
实验仪器与试剂:1.水浴锅2.比色计3.10mL量筒4.25mL烧杯5.高精密电子天平6.10g溶剂,水7.5g溶质实验步骤:1.准备试剂和仪器,将水浴锅加热至80℃。
2.称取5g溶质,记作m1,加入10mL量筒中,并称取10g溶剂,记作m23.将溶质和溶剂放在25mL烧杯中,立即将烧杯放入水浴锅中。
4.使用比色计记录实验开始时的温度,记作t15.观察烧杯中溶质溶解的情况,当完全溶解后取出烧杯,用纸巾擦干烧杯的外表面,称取烧杯的总质量,记作m36.使用比色计记录实验结束时的温度,记作t27.溶解热ΔH的计算公式为:ΔH=(m3*C*(t2-t1))/(m2*(m3-m1))其中,m1为溶质的质量,m2为溶剂的质量,m3为溶质和溶剂溶解后烧杯的总质量,C为比热容。
实验结果与分析:根据实际测量得到的数据,计算得到溶解热ΔH的数值。
在实验中,可以根据所使用的物质自身的特性进行比较。
实验注意事项:1.使用水浴锅或烧杯时要小心,避免烫伤。
2.在称取溶质和溶剂时要准确,避免误差。
3.搅拌烧杯中的溶液是为了加速溶解过程,但不要过度搅拌,可能引起误差。
4.注意比色计的使用方法,确保温度测量的准确性。
实验总结:通过本次实验,我们成功测定了溶解热,并成功掌握了物质溶解热的测定方法。
实验过程中需要注意准确性和实验安全,同时也需要合理地安排实验步骤和操作,以确保实验结果的准确性。
溶解热的测定一、实验目的1.用简单量热剂测定硝酸钾的溶解热。
2. 学习量热计热容的标定方法。
3.非绝热因素对实验的校正。
4.学习使用《计算机全过程管理系统》。
二、实验原理将杜瓦瓶看作绝热体系,当盐溶于水,有热平衡:△H溶解W/M=K△T1(1)进行电标定时,用电热器加热,又平衡:IVt=K△T2(2)由上两式得:△H溶解=M/W*IVt*△T1 /△T2(3)由于在此两个过程中,体系温度变化小,一般在1度左右。
必须使用贝克曼温度计或者精密温度仪,才能读到千分位,达到实验的要求。
三、仪器与试剂1.仪器:500ml杜瓦瓶,装配有加热电炉丝和固体试样加料漏斗电磁搅拌器直流稳定电源(0~30V,0~2A)500ml量筒记录仪2.试剂:硝酸钾(AR)四、主要实验步骤1.在杜瓦瓶中用量筒加入450ml蒸馏水,装好量热计,开启搅拌。
调节输出为0,开启记录仪记录体系稳定过程。
2. 分析天平称取碾成细粉的硝酸钾(约3.3g),在量热计温度稳定3~5分钟后,从加料漏斗加入,记录仪记录过程温度变化。
注意,漏斗加料前后应加盖,以减少体系与环境的热交换。
待温度没有明显变化后约3分钟停止记录。
3.电标定过程与上述溶解过程类似操作,即分为标定前,标定期和标定后期。
电标定时电压约6-8V,电流约为0.6-0.8A。
记录好通断电的加热时间,当体系升温幅度将近溶解降温幅度时,断开电源,继续记录,直到温度上升趋势与标定前期相似为止。
4.杜瓦瓶重新装水,再做一次实验。
五、数据处理与结果讨论1、有关数据溶质的质量(m):3.3113g 溶质摩尔质量(ML):101.102g/mol 接电时间:2:01 min 断电时间:6:13通电时间(t): 252s 电压(V): 5.75V电流(DI):1.10A2、温差溶解过程(DT1): 0.534 标定过程(DT2): 0.564 3、相关图形3.1、溶解过程图1溶解过程t-T图3.2、电标定过程图2电标定过程t-T图4、计算积分溶解热△H溶解=M/W*IVt*△T1 /△T2/1000=101.102/3.3113×1.10×5.75×252×0.534/0.564/1000=46.08KJ/mol理论溶解热计算:ΔH溶解=34.99-0.157(t-25)KJ/mol=34.99-0.157*(21.40-25)得ΔH溶解=35.55KJ/mol相对误差=(46.08-35.55)/35.5*100%=29.6%误差分析:可能是因为记录通电时间不准确和杜瓦瓶外壳因温度过高烧化而造成误差较大。
实验一 溶解热的测定一、目的1、了解电热补偿法测定热效应的基本原理及仪器使用。
2、测定硝酸钾在水中的积分溶解热,并用作图法求得其微分稀释热、积分稀释热和微分溶解热。
3、初步了解计算机采集处理实验数据、控制化学实验的方法和途径。
二、基本原理1、物质溶解于溶剂过程的热效应称为溶解热。
它有积分(或变浓)溶解热和微分(或定浓)溶解热两种。
前者是1 mol 溶质溶解在n 0 mol 溶剂中时所产生的热效应,以Q s 表示。
后者是1 mol 溶质溶解在无限量某一定浓度溶液中时所产生的热效应,即0,,s T p n Q n ∂⎛⎫⎪∂⎝⎭。
溶剂加到溶液中使之稀释时所产生的热效应称为稀释热。
它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。
前者是把原含1 mol 溶质和n 01 mol 溶剂的溶液稀释到含溶剂n 02 mol 时所产生的热效应,以Q d 表示,显然,Q d = Q s ,n02 – Q s ,n01。
后者是1 mol 溶剂加到无限量某一定浓度溶液中时所产生的热效应,即0,,s T p nQ n ⎛⎫∂⎪∂⎝⎭。
2、积分溶解热由实验直接测定,其它三种热效应则需通过作图来求:设纯溶剂、纯溶质的摩尔焓分别为H *m ,A 和H *m ,B ,一定浓度溶液中溶剂和溶质的偏摩尔焓分别为H m ,A 和H m ,B ,若由n A mol 溶剂和n B mol 溶质混合形成溶液,则混合前的总焓为 H = n A H *m ,A + n B H *m ,B 混合后的总焓为 H ΄ = n A H m ,A + n B H m ,B此混合(即溶解)过程的焓变为 ΔH = H ΄ – H = n A (H m ,A – H *m ,A )+ n B (H m ,B – H *m ,B ) = n A ΔH m ,A + n B ΔH m ,B根据定义,ΔH m ,A 即为该浓度溶液的微分稀释热,ΔH m ,B 即为该浓度溶液的微分溶解热,积分溶解热则为: ,,0,,As m A m Bm AmBB Bn H Q H H n HHn n ∆==∆+∆=∆+∆ 故在Q s ~ n 0图上,某点切线的斜率即为该浓度溶液的微分稀释热,截距即为该浓度溶液的微分溶解热。
实验四 溶解热的测定一 实验目的1. 了解测定溶解热的基本原理2. 掌握量热法的测量技术3. 测定KNO 3 二 实验原理的积分溶解热 物质溶于溶剂时,常伴随着热效应产生。
经研究表明,温度、压力以及溶质和溶剂的性质、用量都对热效应有影响。
物质溶解过程,常包括溶质晶格的破坏和分子或离子的溶剂化作用。
一般晶格的破坏为吸热过程,溶剂化作用为放热过程。
总的热效应由两个过程的热量相对大小决定。
溶解热分为积分溶解热和微分溶解热,积分溶解热是在标准压力和一定温度下,1摩尔溶质溶于一定量的溶剂中所产生的热效应。
微分溶解热是在标准压力和一定温度下,1摩尔溶质溶于大量某浓度的溶液中所产生的热效应。
本实验测定的是积分溶解热。
测定积分溶解热是在绝热的量热计(杜瓦瓶)中进行。
首先标定量热系统的热容(指量热计和溶液温度升高1开所吸收的热量,单位为J ·K -1)。
将某温度下已知积分溶解热的标准物质KCI 加入量热计中溶解,用贝克曼温度计测量溶解前后量热系统的温度,并用雷诺作图法求出真实温度差△T s ,若系统的绝热性能很好,而且搅拌热可忽略时,由热力学第一定律可得如下公式:ss M m ·θs H ∆+C·△T s ss s s T H M m C ∆∆⋅−=0=0 (4-1)(4-2) 式中s m 、s M 分别为标准物质即KCI 的质量和摩尔质量,θs H ∆为标准压力和一定温度下1摩尔KCI 溶于200摩尔水中的积分溶解热(不同温度下KCI 积分溶解热见附表)。
△T s MmT C H ⋅∆⋅−=∆0溶为KCI 溶解前后温度变化值。
其次测待测物质的积分溶解热.若待测物质的质量为m ,摩尔质量为M 。
溶解前后温度变化△T ,则由(4-2)式得待测物质积分溶解热:(4-3) 必须指出,上述计算中包含了水溶液的热容都相同的假设条件。
三 仪器与药品测温量热计(保温瓶、贝克曼温度计、电动搅拌机各一个) 1套 秒表 1块 台称和分析天平各 1台 放大镜 1 个 1000 ml 容量瓶 1个 分析纯 KCI 和KNO 1.实验前准备3 四 实验步骤⑴ 称量KCI :把KCI 研磨成细小颗粒,按1摩尔KCI 与200摩尔水的比例称量(准确到0.001克)。
物理化学实验报告
溶解热的测定
实验时间:2018年4月日
姓名:刘双
班级:
学号:
1.实验目的
(1)了解电热补偿法测量热效应的基本原理。
(2)用电热补偿法测定硝酸钾在水中的积分溶解热,通过计算或者作图求出硝酸钾在水中的微分溶解热、积分冲淡热和微分冲淡热。
(3)掌握微机采集数据、处理数据的实验方法和实验技术。
2.实验原理
物质溶解于溶剂过程的热效应称为溶解热,物质溶解过程包括晶体点阵的破坏、离子或分子的溶剂化、分子电离(对电解质而言)等过程,这些过程热效应的代数和就是溶解过程的热效应,溶解热包括积分(或变浓)溶解热和微分(或定浓)溶解热。
把溶剂加到溶液中使之稀释,其热效应称为冲淡热。
包括积分(或变浓)冲淡热和微分(或定浓)冲淡热。
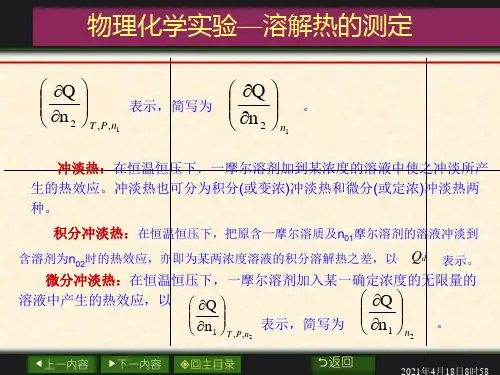
溶解热Q:在恒温、恒压下,物质的量为n2的溶质溶于物质的量为n1的溶剂(或溶于某浓度的溶液)中产生的热效应。
积分溶解热Qs:在恒温、恒压下,1mol溶质溶于物质的量为n1的溶剂中产生的热效应。
微分溶解热(ðQ
ðn2)n
1
:在恒温、恒压下,1mol溶质溶于某一确定浓度的无限量的溶液中
的热效应。
冲淡热:在恒温、恒压下,物质的量为n1的溶剂加入到某浓度的溶液中产生的热效应。
积分冲淡热Q d:在恒温、恒压下,把原含1mol溶质和n02mol溶剂的溶液冲淡到含溶剂为n01mol时的热效应,为某两浓度的积分溶解热之差。
微分冲淡热(ðQ
ðn1)
n2
或(ðQ S
ðn0
)
n2
:在恒温、恒压下,1mol溶剂加入到某一确定浓度的无限
量的溶液中产生的热效应。
它们之间的关系可表示为:
dQ=(ðQ
ðn1
)
n2
dn1+(
ðQ
ðn2
)
n1
dn2
上式在比值n1
n2
恒定下积分,得:
Q=(ðQ
ðn1)
n2
n1+(
ðQ
ðn2
)
n1
n2
Q n2=Q s,令:n1
n2
=n0,则有:
(
∂Q
∂n1
)=[
∂(n2Q s
∂(n2n0)
]=(
∂Q s
∂n0
)
Q d=(Q s)n01−(Q s)n02
其中积分溶解热Q s可以直接由实验测定,其他三种可以由Q s−n0曲线求得。
欲求溶解过程中的各种热效应,应先测量各种浓度下的的积分溶解热。
可采用累加的方法,先在纯溶剂中加入溶质,测出热效应,然后再这溶液中再加入溶质,测出热效应,根据先后加入的溶质的总量可计算出n0,而各次热效应总和即为该浓度下的溶解热。
本实验测量硝酸钾溶解在水中的溶解热,是一个溶解过程中温度随反应的进行而降低的吸热反应,故采用电热补偿法测定。
先测定体系的初始温度T,当反应进行后温度不断降低时,由电加热法使体系复原到起始温度,根据所耗电能求出热效应Q。
3.仪器和试剂
反应热测量数据采集接口装置:
NDRH-1型,温度测量范围0~40℃,温度测量分辨率0.001℃,电压测量范围0~20V,电压测量分辨率0.01V,电流测量范围0~2A,电流测量分辨率0.01A。
精密稳流电源:YP-2B型。
微机、打印机。
量热计(包括杜瓦瓶,搅拌器,加热器,搅拌子)。
称量瓶8只,毛笔,研钵。
硝酸钾(A.R.)
4.实验操作
(1)取8个称量瓶,分别编号。
(2)取KNO3于研钵中,研磨充分。
(3)分别称量约 2.5、1.5、2.5、3.0、3.5、4.0、4.0、4.5g 研磨后的硝酸钾,放入 8 个称量瓶中,并精确称量瓶子与药品的总质量。
记录下所称量的数据。
(4)使用0.1g精度的天平称量216.2g的去离子水,放入杜瓦瓶中,将杜瓦瓶放在磁力搅
拌器上。
(5)将温度传感器擦干并置于空气中一段时间,打开数据采集接口装置电源,预热3min。
(6)启动微机上的溶解热的测量软件。
并根据软件提示进行下一步实验。
(7)将稳流电源上的调节旋钮逆时针调到底,打开电源开关。
并打开磁力搅拌器,调节到合适的搅拌速度。
(8)根据软件的提示,温度传感器放入杜瓦瓶中,调节加热功率使其在2.0-2.4W之间。
此后不再调节稳流电源。
(9)当采样到水温比室温高出0.5摄氏度时,按程序提示加入第一份样品,之后操作相同,根据软件提示及时加入药品。
(10)当8份药品都已经加入后,软件提示溶解操作完成。
将软件退出到主界面。
(11)将8个称量瓶重新称重,从而计算出加入药品的量。
之后将算出的加入的药品的质量带入到软件中。
(12)整理实验仪器,并将原始数据拷贝。
5.实验数据及处理
本次实验采用的是A处理方法。
m(H2O)=216.3g n1 =12.017mol
所以首先需要算出每个溶解过程所消耗的电能也就是KNO3溶解过程中产生的热效应。
热效应的计算通过累加,并使用excel软件进行计算。
数据通过一阶指数拟合,QS-n0呈负相关,与基本n0-Qs关系不符,实验失败。
6.数据分析
数据处理完毕后,n0-Qs的关系呈负相关,计算得出的溶解热和稀释热值不合理,本次实验失败。
失败原因:
(1)主要原因
I、测定的室温不准确,在测定室温时,温度计示数未足够稳定,就确定了室温。
II、开始溶解时的水温测定不准确,实验操作时,待温度上升0.5℃时,先将温度传感器拿出,放入了第一份硝酸钾,再将温度传感器放入杜瓦瓶中,此时硝酸钾已经溶解了一部分,导致开始溶解时温度测定错误。
III、倒入第三份硝酸钾时由于操作不当,导致一部分硝酸钾洒出,而实际上并没有溶解那么多硝酸钾。
(2)其他原因
I、本次实验说使用的硝酸钾由于一些原因,已吸收了一点水。
II、实验时,系统与环境有一定的热交换,影响了热量的测定
III、实验时的温度与室温的是有一定差距的,从而使体系与环境的热交换较为剧烈,
影响了热量的测定。
IV、实验中,温度传感器和示数有一定延迟,所以可能两份硝酸钾的加入时机温差不一定为0.5℃。
V、实验时,加入硝酸钾过快,导致体系温度下降过快。
总结:本次实验,由于预习不到位,以及实验过程中的操作不当,导致实验失败,定当吸取经验教训。
7.思考题
(1)实验设计为什么在体系温度高于室温0.5摄氏度时加入第一份KNO3?
硝酸钾溶解为吸热过程,在溶解的过程中杜瓦瓶内温度会降低,如果瓶内温度与室温相差太大这样的话使得热传递比较剧烈,从而使得实验误差增大。
一开始在体系温度高于室温 0.5℃时加入第一份 KNO3,这样溶解是温度降低接近室温,实验误差更小。
(2)实验过程中如果加热功率有变化,会造成什么误差?如何解决这个问题?由于实验的基本原理是电热补偿法,所以计算消耗的电能是非常重要的,如果加热的功率总是起伏变化那么会使最终的消耗的电能值出现较大误差。
而本实验采用了计算机控制技术,精密稳流电源就是为了能够最大程度上的控制加热功率。
减小加热功率带来的误差。