氢原子光谱的规律性
- 格式:ppt
- 大小:801.50 KB
- 文档页数:51

氢原子光谱(spectrum of hydrogen atom )
氢原子光谱是最简单的光谱。
在可见光和近紫外部分,氢原子的光谱是由一个谱线系组成的,谱线波长间的间隔朝着短波的方向以一种有规律的方式递减。
这个规律首先由巴耳末用数学公式表达出来:
,4
2121-=n n B λ (1) 式中的56364.0,5,4,31==B n μm 。
(1)式就叫巴耳末公式,它所代表的谱线系叫巴耳末系。
巴尔末公式后来改写成
,121212⎪⎪⎭⎫ ⎝
⎛-=n R σ (2) 式中λσ1
=,是谱线的波数,B
R 4=叫里德伯常量,它的现代精确数值为 .m 104153373097.1-17⨯=R
如果把上述公式中的22换成2
2n ,令2n =1,3,4,5,……且对每个2n 值都取121+≥n n ,则可以得到另外一些线系的波数。
这些线系实际上已经被观察到。
2n =1的线系在远紫外区,被莱曼观察到,2n =3,4,5,6,……的线系,都在红外区,分别由帕邢、布喇开、普逢德(August Herman pfund,1879~1949)和哈姆泼雷斯(C·S·Humphreys )所发现。
因此,氢原子光谱的所有线系,可用一个公式来表示: 21
22n R n R -=σ (3) 这个公式叫里德伯公式,式中的1n 和2n ,都是整数,且1n >2n 。
对于某一线系来说,2n 是一常数。
当1n 递增时σ趋向一极限值22
n R =∞σ,这就是线系极限。
从理论上说,靠近线系极限处有无限多条谱线。
图1-23-18是氢原子的光谱图。

实验原理1、 氢、氘原子光谱(1) 氢原子光谱的规律氢光谱由许多谱线组成,其中巴耳末线系的规律可表示为)121(122nR H -=λ (1.1) 式中,λ为谱线波长,H R 为氢的里德伯常数,n=3,4,5,……巴耳末线系是本实验拍摄和研究的对象.对应于n =3,4,5,…的谱线分别称H α,H β,H γ……它们的波长间隔、谱线强度都随n 的增大而有规律地减小.(2) 氢、氘原子光谱的异同设氢核质量为M H ,同位素氘核质量为M D .它们的里德伯常数R H 和R D 分别为mM M R R H H H +=∞ (1.2) mM M R R D D D +=∞ 其中,m 为电子质量,R ∞是认为原子核质量无限大时的里德伯常数.以λH 和λD 代表对应于同一n 值的氢和氘谱线的波长,则巴耳末系可表示为)121(122n R H H-=λ )121(122n R D D -=λ (1.3) 由于M D ≠M H ,由式(1.2)知R D ≠R H ,则式由(1.3)可知,对同一n 值,λD ≠λH .可见,氢、氘原子光谱既有如式(1.3)所示的相同规律,对同一n 值,波长λH 和λD 又有差异.只是其差值一般都小于0.2nm .所以在谱片上氢、氘谱线总是靠得很近.(3) 关于M D /M H ,由式(1.2)知)/()/(m M M m M M R R H H D D H D ++= 从中解得mM R R R R M M H H D H D H D /)1/(1/--= (1.4) 由式(1.3)知,R D /R H =λH /λD ,故式(1.4)可化为mM M M H H D H D H D /)1/(1/--=λλλλ (1.5) 取M H /m =1836,对每一对氢氘谱线测得λH 和λD ,由式(1.5)即可求得M D /M H .2 测算波长波长无法直接测量,需要寻找一个与波长有关又能直接测量的量. (1) 光栅光谱的特点 光栅摄谱仪的色散率d λ/d l 几近常数.两谱线波长差和距离成正比.这一特点将谱线的波长和谱线的坐标联系在一起.谱线在谱片上的坐标正是一个与波长有关又能直接测量的量.由谱线坐标即可推算其波长.(2) 线性内插法图1.1为光栅摄谱仪拍得的三条谱线.其中左右两条的波长λ1,λ2为已知,且λ2>λ1,中间谱线的波长λ待求.若能测定三条谱线的坐标x 1、x 和x 2,根据光栅光谱的特点应有111212x x x x --=--λλλλ从中解出)(112121x x x x ---+=λλλλ (1.6)由式(1.6)知:在谱片上,对任何一条未知波长的谱线,只要在其周围找到两条波长λ1和λ2已知的谱线,并测定三者的坐标x 1,x 和x 2即可推算出未知波长λ.实验中,常将铁谱和待测谱线上下并排拍在一张谱片上,每条铁谱的波长都可由特制的光谱图查得.应用式(1.6)的条件是波长λ和坐标x 有线性关系.若二者只在很小的范围内接近线性关系,如棱镜摄谱仪拍得的谱片,则在|x 2-x 1|较小的条件下也可应用.此时应在待测谱线两侧适当小的范围内选取已知波长的谱线.这就是在光谱实验中经常用以计算波长的“线性内插法”.实 验 装 置平面光栅摄谱仪,交流电弧发生器,氢氘灯,铁电极,阿贝比长计,光谱投影仪和光谱图.(1) 光路原理一般平面光栅摄谱仪的光路如图1.2所示.图中,M 1,M 2是同一大凹球面反射镜的下、上两个不同框形部分.光源A 发出的光,经三透镜照明系统L 1,L 2,L 3后均匀照亮狭缝S ,通过S 的光经小平面反射镜N 反射转向π/2后射向M 1,因S 由N 所成的虚像正好处在M 1的焦面上,所以狭逢上一点S 发出的光经M 1反射后成了微微向上射出的平行光,并正好射到N 后上方的平面反射光栅G 上.G 把入射光向M 2方向衍射.M 2把来自不同刻纹的同一波长的平行衍射光会聚成一点S λ’, S λ’正好落在照相胶版B 上.G 相邻刻纹的衍射光传播到S λ’的程差δ=d (sin i +sin θ),图 1.1式中d是光栅常数,I,θ分别是入射光、衍射光相对于G的法线的夹角,sinθ取+号是因为θ,i在法线的同侧.显然,Sλ’要是个亮点,必须δ=kλ,于是得光栅方程d(sin i+sinθ)=kλ,式中λ是光波波长,k=0¸±1, ±2,…叫衍射级.除0外,对同一k,因i相同而λ不同则θ将不同,也就是不同波长的像点Sλ'将落在B的左右不同位置,成为一个单色像Sλ'.狭缝S是连续的点的集合,所以Sλ'是一条亮线.对同一k,A发出的所有波长所形成的所有单色像构成A的光谱,用胶版B就可以把它们拍摄下来.图 1.2(2)中心波长和光栅转角的关系.Sλ'落在B中心线附近的波长λB叫中心波长.显然,这时θ=i,对1级谱,光栅方程变为2d sin I=λ0,所以中心波长λ0和i有—一对应关系.光栅安装在一个金属齿盘上,盘底的轴插在机座的轴套上,盘边有一蜗杆和齿轮啮合,蜗杆用一连杆和机壳外的手柄联结;转动手柄就可以转动光栅,并在手柄边上可以读出光栅转角i.仪器色散能力较大,一次摄谱B只能容下相差约100nm的波长范围,所以拍摄不同波段的光谱时,必须把光栅转到相应的i角位置.(3)谱级分离.设B上某点δ=600nm,对λ1=600nm的光波,k=1,得到了加强;对λ2=300nm 的光波,k=2,也得到了加强.这样在B上δ=600nm处出现的谱线,就无法确定它是λ1还是λ2,这叫谱级重叠.但λ2是紫外光,它不能透过玻璃,在狭缝前放一无色玻璃作为滤色片,所有紫外光便都到不了B,从而简单地实现了1级可见光谱和2级紫外光谱的分离,滤色后在δ=600nm处出现的谱线一定是λ1.(4)拍摄比较光谱的操作原则.谱线是狭缝的单色像.让12mm高的狭缝全部露出来被光照亮,可得到12mm 高的一系列谱线;让上端6mm露出,就得到上端6mm高的谱;让下端6mm露出,就得到下端6 mm高的谱.设想用Na(钠)黄光照亮S,先让上端6 mm露出摄谱后,保持胶版B和光栅转角i都不动,再换为下端 6 mm摄谱.这样摄得的4条谱线,一定是后二条在前二条的延长线上,因为它们只是同一狭缝上、下二段成像先后不同而已.Na黄双线的波长大家都很熟悉,由此我们推想:把先摄下的二条谱线看成波长未知的被测谱线,后二条看成“波长标尺”上波长已知的二条刻度线,显然测得的结果非常准确.由此得出操作原则:拍摄互相比较的两列光谱时,不能移动胶版,不能转动色散元件,只能在换光源后换用狭缝的相邻部位摄谱.换用狭缝的不同部位很简单,狭缝前有一金属薄圆盘,叫哈特曼光栏盘,盘上不同位置开了不同高度的方孔,转动盘子让狭缝在所需的孔中露出就行了.“波长标尺”也现成,Fe(铁)的光谱线相当丰富,波长都已知,把Fe的光谱拍在被测光谱的旁边,也就相当于摆上了一把“波长标尺”.Fe光谱可以用电弧发生器激发.(5) 氢氘光谱灯.氢氘光谱灯(或放电管)内所充的纯净氢氘气体,在高压小电流放电时分解成原子并被激发到高能态,在跃迁到低能态的退激过程中发出原子光谱.。

第3节 氢原子光谱1.知道什么是光谱,能区别连续谱和线状谱,知道光谱分析的应用.2.知道氢原子光谱的实验规律. 3.知道经典电磁理论的困难在于无法解释原子的稳定性和光谱的分立特征.一、光谱1.定义:按照光的波长和强度分布展开排列的记录,即光谱.2.分类:有些光谱是一条条的亮线,这样的亮线叫谱线,这样的光谱叫线状谱.有的光谱不是一条条分立的谱线,而是连续在一起的光带,这样的光谱叫做连续谱.3.特征光谱:各种原子的发射光谱都是线状谱,说明原子只发射特定频率的光.不同原子发射的线状谱的亮线位置不同,说明不同原子发光频率是不一样的,因此这些亮线称为原子的特征谱线.4.光谱分析(1)定义:利用原子的特征谱线来鉴别物质和确定物质的组成成分,这种方法叫做光谱分析. (2)优点:灵敏度高.1.(1)各种原子的发射光谱都是连续谱.( ) (2)不同原子的发光频率是不一样的.( ) (3)线状谱和连续谱都可以用来鉴别物质.( ) 提示:(1)× (2)√ (3)× 二、氢原子光谱的实验规律1.许多情况下光是由原子内部电子的运动产生的,因此光谱研究是探索原子结构的重要途径. 2.巴耳末公式:1λ=R ⎝⎛⎭⎫122-1n 2(n =3、4、5…). 3.巴耳末公式的意义:以简洁的形式反映了氢原子的线状光谱,即辐射波长的分立特征.2.(1)光是由原子核内部的电子运动产生的,光谱研究是探索原子核内部结构的一条重要途径.( ) (2)稀薄气体的分子在强电场的作用下会变成导体并发光.( ) (3)巴耳末公式中的n 既可以取整数也可以取小数.( ) 提示:(1)× (2)√ (3)× 三、经典理论的困难1.核式结构模型的成就:正确地指出了原子核的存在,很好地解释了α粒子散射实验. 2.经典理论的困难:经典物理学既无法解释原子的稳定性,又无法解释原子光谱的分立特征.3.(1)经典物理学很好地解释原子的稳定性.( )(2)经典物理学无法解释原子光谱的分立特征.()(3)经典物理学可以很好地应用于宏观世界,也能解释原子世界的现象.()提示:(1)×(2)√(3)×知识点一光谱和光谱分析1.光谱的分类2.太阳光谱(1)特点:在连续谱的背景上出现一些不连续的暗线,是一种吸收光谱.(2)对太阳光谱的解释:阳光中含有各种颜色的光,但当阳光透过太阳的高层大气射向地球时,太阳高层大气中含有的元素会吸收它自己特征谱线的光,然后再向四面八方发射出去,到达地球的这些谱线看起来就暗了,这就形成了连续谱背景下的暗线.3.光谱分析(1)优点:灵敏度高,分析物质的最低量达10-10 g.(2)应用①应用光谱分析发现新元素;②鉴别物体的物质成分:研究太阳光谱时发现了太阳中存在钠、镁、铜、锌、镍等金属元素;③应用光谱分析鉴定食品优劣.(多选)下列关于光谱和光谱分析的说法中,正确的是()A.太阳光谱和白炽灯光谱都是线状谱B.煤气灯火焰中燃烧的钠蒸气或霓虹灯产生的光谱都是线状谱C.进行光谱分析时,可以用线状谱,不能用连续光谱D.我们能通过月球反射的日光分析鉴别月球的物质成分[解题探究] (1)光谱分析应当使用什么光谱线? (2)能否利用反射光分析反射物的物质组成?[解析] 太阳光谱中的暗线是太阳发出的连续谱经过太阳大气层时产生的吸收光谱,正是太阳发出的光谱被太阳大气层中存在的对应元素吸收所致,白炽灯发出的是连续谱,选项A 错误;月球本身不会发光,靠反射太阳光才能使我们看到它,所以不能通过光谱分析鉴别月球的物质成分,选项D 错误;光谱分析只能是线状谱和吸收光谱,连续谱是不能用来进行光谱分析的,所以选项C 正确;煤气灯火焰中燃烧的钠蒸气或霓虹灯产生的光谱都是线状谱,选项B 正确.[答案] BC(1)太阳光谱是吸收光谱,是阳光透过太阳的高层大气层时而形成的,不是地球大气造成的.(2)某种原子线状光谱中的亮线与其吸收光谱中的暗线是一一对应的,两者均可用来作光谱分析.(多选)关于光谱和光谱分析,下列说法正确的是( )A .发射光谱包括连续谱和线状谱B .太阳光谱是连续谱,氢光谱是线状谱C .线状谱和吸收光谱都可用作光谱分析D .光谱分析帮助人们发现了许多新元素解析:选ACD.线状谱和吸收光谱都是原子的特征光谱,都可用来进行光谱分析,太阳光谱是吸收光谱.A 、C 、D 选项正确.知识点二 氢原子光谱的实验规律及应用1.氢原子的光谱从氢气放电管可以获得氢原子光谱,如图所示.2.氢原子光谱的特点:在氢原子光谱图中的可见光区内,由右向左,相邻谱线间的距离越来越小,表现出明显的规律性.3.巴耳末公式(1)巴耳末对氢原子光谱的谱线进行研究得到了下面的公式:1λ=R ⎝⎛⎭⎫122-1n 2(n =3,4,5…),该公式称为巴耳末公式.(2)公式中只能取n ≥3的整数,不能连续取值,波长是分立的值.4.其他谱线:除了巴耳末系,氢原子光谱在红外和紫外光区的其他谱线,也都满足与巴耳末公式类似的关系式.对巴耳末公式的理解(多选)关于巴耳末公式1λ=R ⎝⎛⎭⎫122-1n 2的理解,正确的是( ) A .此公式是巴耳末在研究氢光谱特征时发现的 B .公式中n 可取任意值,故氢光谱是连续谱C .公式中n 只能取大于或等于3的整数值,故氢光谱是线状谱D .公式不但适用于氢光谱的分析,也适用于其他原子的光谱 [解题探究] 波长大小与n 的取值大小有何关系?[解析] 巴耳末公式是巴耳末在研究氢光谱特征时发现的,故A 选项正确;公式中的n 只能取大于或等于3的整数值,故氢光谱是线状谱,B 选项错误,C 选项正确;巴耳末公式只适用于氢光谱的分析,不适用于其他原子光谱的分析,D 选项错误.[答案] AC巴耳末公式的应用已知氢原子光谱中巴耳末系第一条谱线H α的波长为 nm(普朗克常量h =×10-34J ·s ,真空中的光速c =3×108 m ·s -1),求:(1)试推算里德伯常量的值;(2)利用巴耳末公式求其中第四条谱线的波长和对应光子的能量. [思路点拨] (1)n =1时,λ= nm ,利用巴耳末公式求R . (2)R 已求,n =4时利用巴耳末公式求λ. (3)h 、c 已知,利用E =h cλ求E .[解析] (1)巴耳末系中第一条谱线为n =3时,即1λ1=R ⎝⎛⎭⎫122-132 R =365λ1≈×107 m -1. (2)巴耳末系中第四条谱线对应n =6,则 1λ4=R ⎝⎛⎭⎫122-162 λ4=368××107 m ≈×10-7 m = nm ε=hν=h cλ4≈×10-19 J.[答案] (1)×107 m -1 (2)×10-7 m(或 nm) ×10-19J氢原子光谱的几种线系的表示公式莱曼系1λ=R ⎝⎛⎭⎫112-1n 2,n =2,3,4…(在紫外区) 巴耳末系1λ=R ⎝⎛⎭⎫122-1n 2,n =3,4,5…(在可见光区)帕邢系1λ=R ⎝⎛⎭⎫132-1n 2,n =4,5,6…(在红外区) 布喇开系1λ=R ⎝⎛⎭⎫142-1n 2,n =5,6,7…(在近红外区)[随堂达标]1.(多选)下列说法正确的是( ) A .发射光谱一定是连续谱B .线状谱和暗线谱都可以对物质成分进行分析C .霓虹灯发光形成的光谱是连续谱D .巴耳末公式只适用于氢原子发光 答案:BD2.(2023·南通高二检测)白炽灯发光产生的光谱是( ) A .连续光谱 B .明线光谱 C .原子光谱D .吸收光谱解析:选A.白炽灯发光属于炽热的固体发光,所以发出的是连续光谱. 3.(多选)下列说法中正确的是( )A .进行光谱分析,可以用线状谱,也可以用吸收光谱B .光谱分析的优点是非常灵敏而迅速C .使一种物质发出的白光通过另一种物质的低温蒸气,取得吸收光谱,就可以对前者的化学组成进行分析D .摄下月球的光谱,可以分析出月球是由哪些元素组成的解析:选AB.由于每种元素都有自己的特征谱线,因此,可以根据光谱来鉴别物质和确定它的化学组成.所以光谱分析可以用线状谱或者吸收光谱.月球的光谱是太阳的反射光谱,故不能分析月球是由哪些元素组成的.4.(多选)关于巴耳末公式,下列说法正确的是( ) A .巴耳末依据核式结构理论总结出巴耳末公式 B .巴耳末公式反映了氢原子发光的连续性 C .巴耳末依据氢光谱的分析总结出巴耳末公式D .巴耳末公式准确反映了氢原子发光的实际,其波长的分立值并不是人为规定的解析:选CD.由于巴耳末是利用当时已知的、在可见光区的4条谱线作了分析总结出的巴耳末公式,并不是依据核式结构理论总结出来的,巴耳末公式反映了氢原子发光的分立性,也就是氢原子实际只发出若干特定频率的光,由此可知,选项C 、D 正确.5.(选做题)(2023·常州高二检测)氢原子光谱巴耳末系最小波长与最大波长之比为( ) B .49解析:选A.由巴耳末公式1λ=R ⎝⎛⎭⎫122-1n 2,n =3,4,5,… 当n =∞时,最小波长1λ1=R 122①当n =3时,最大波长1λ2=R ⎝⎛⎭⎫122-132② 由①②得λ1λ2=59.[课时作业] [学生用书P90(独立成册)]一、单项选择题1.下列说法中正确的是( )A .炽热的固体、液体和高压气体发出的光形成连续光谱B .各种原子的明线光谱中的明线和它吸收光谱中的暗线必定一一对应C .气体发出的光只能产生明线光谱D .甲物体发出的白光通过乙物质的蒸气形成了甲物质的吸收光谱解析:选A.据连续光谱的产生知A 对;由于吸收光谱中的暗线和明线光谱中的明线相对应,但通常吸收光谱中看到的暗线要比明线光谱中的明线少,所以B 不对;气体发光也可以形成连续光谱,所以C 不对;甲物体发出的白光通过乙物质的蒸气形成了乙物质的吸收光谱,所以D 不对,应选A.2.关于光谱,下列说法正确的是( ) A .一切光源发出的光谱都是连续谱 B .一切光源发出的光谱都是线状谱 C .稀薄气体发出的光谱是线状谱D .作光谱分析时,利用连续谱和线状谱都可以鉴别物质和确定物质的化学组成解析:选C.不同光源发出的光谱有连续谱,也有线状谱,故A 、B 错误.稀薄气体发出的光谱是线状谱,C 正确.利用线状谱和吸收光谱都可以进行光谱分析,D 错误.3.太阳的光谱中有许多暗线,它们对应着某些元素的特征谱线.产生这些暗线是由于( ) A .太阳表面大气层中缺少相应的元素 B .太阳内部缺少相应的元素C .太阳表面大气层中存在着相应的元素D .太阳内部存在着相应的元素解析:选C.太阳光谱中的暗线是由于太阳内部发出的强光经过温度较低的太阳大气层时产生的,表明太阳大气层中含有与这些特征谱线相应的元素.4.(2023·南京高二检测)关于物质的吸收光谱和明线光谱之间的关系,下列说法中正确的是( ) A .吸收光谱和明线光谱的产生方法不同,它们的谱线互不相关 B .吸收光谱和明线光谱的产生方法相同,它们的谱线重合 C .明线光谱与吸收光谱都是原子光谱,它们的特征谱线相对应D.明线光谱与吸收光谱都可以用于光谱分析,以鉴别物质和确定化学组成解析:选D.吸收光谱和明线光谱的产生方法不同,同种物质吸收光谱中的暗线与它明线光谱中的明线相对应,A、B错误.明线光谱与吸收光谱都是原子的特征谱线,但是明线光谱是原子光谱,吸收光谱不是原子光谱,C错误.明线光谱和吸收光谱都可以进行光谱分析,D正确.5.对于巴耳末公式下列说法正确的是()A.所有氢原子光谱的波长都与巴耳末公式相对应B.巴耳末公式只确定了氢原子发光的可见光部分的光的波长C.巴耳末确定了氢原子发光的一个线系的波长,其中既有可见光,又有紫外光D.巴耳末公式确定了各种原子发光中的光的波长解析:选C.巴耳末公式只确定了氢原子发光中一个线系的波长,不能描述氢原子发出的各种波长,也不能描述其他原子的发光,故A、D错误;巴耳末公式是由当时已知的可见光中的部分谱线总结出来的,但它适用于整个巴耳末线系,该线系包括可见光和紫外光,故B错误,C正确.6.(2023·湛江高二检测)如图甲所示的a、b、c、d为四种元素的特征谱线,图乙是某矿物的线状谱,通过光谱分析可以确定该矿物中缺少的元素为()A.a元素B.b元素C.c元素D.d元素解析:选B.把矿物的线状谱与几种元素的特征谱线进行对照,b元素的谱线在该线状谱中不存在,故选项B 正确,与几个元素的特征谱线不对应的线说明该矿物中还有其他元素.二、多项选择题7.要得到钠元素的特征谱线,下列做法中正确的是()A.使固体钠在空气中燃烧B.将固体钠高温加热成稀薄钠蒸汽C.使炽热固体发出的白光通过低温钠蒸汽D.使炽热固体发出的白光通过高温钠蒸汽解析:选BC.炽热固体发出的是连续谱,燃烧固体钠不能得到特征谱线,A错误;稀薄气体发光产生线状谱,B正确;强烈的白光通过低温钠蒸汽时,某些波长的光被吸收产生钠的吸收光谱,C正确,D错误.8.(2023·哈尔滨高二检测)关于经典电磁理论与氢原子光谱之间的关系,下列说法正确的是()A.经典电磁理论很容易解释原子的稳定性B.根据经典电磁理论,电子绕原子核转动时,电子会不断释放能量,最后被吸附到原子核上C .根据经典电磁理论,原子光谱应该是连续的D .氢原子光谱彻底否定了经典电磁理论解析:选BC.根据经典电磁理论,电子绕原子核转动时,电子会不断释放能量,最后被吸附到原子核上,经典物理学无法解释原子的稳定性,并且原子光谱应该是连续的.氢原子光谱并没有完全否定经典电磁理论,而是要引入新的观念.故正确答案为B 、C.9.(2023·杭州高二检测)对原子光谱,下列说法正确的是( ) A .原子光谱是不连续的B .由于原子都是由原子核和电子组成的,所以各种原子的原子光谱是相同的C .由于各种原子的原子结构不同,所以各种原子的原子光谱也不相同D .分析物质发光的光谱,可以鉴别物质中含哪些元素解析:选ACD.原子光谱为线状谱;各种原子都有自己的特征谱线;据各种原子的特征谱线进行光谱分析可鉴别物质组成.由此知A 、C 、D 说法正确,B 说法错误.10.关于太阳光谱,下列说法正确的是( ) A .太阳光谱是吸收光谱B .太阳光谱中的暗线,是太阳光经过太阳大气层时某些特定频率的光被吸收后而产生的C .根据太阳光谱中的暗线,可以分析太阳的物质组成D .根据太阳光谱中的暗线,可以分析地球大气层中含有哪些元素解析:选AB.太阳是高温物体,它发出的白光通过温度较低的太阳大气层时,某些特定频率的光会被太阳大气层中的某些元素的原子吸收,从而使我们观察到的太阳光谱是吸收光谱,因此,选项A 、B 正确.分析太阳的吸收光谱,可知太阳大气层的物质组成,由于地球大气层的温度很低,太阳光通过地球大气层时不会被地球大气层中的物质原子吸收,故选项C 、D 错误.三、非选择题11.氢原子光谱的巴耳末系中波长最长的光波的光子能量为E 1,其次为E 2,则E 1E 2为多少?解析:由1λ=R ⎝⎛⎭⎫122-1n 2得:当n =3时,波长最长,1λ1=R ⎝⎛⎭⎫122-132,当n =4时,波长次之,1λ2=R ⎝⎛⎭⎫122-142,解得:λ1λ2=2720,由E =h c λ得:E 1E 2=λ2λ1=2027.答案:202712.氢原子光谱除了巴耳末系外,还有莱曼系、帕邢系等,其中帕邢系的公式为1λ=R ⎝⎛⎭⎫132-1n 2,n =4,5,6,…,R =×107 m -1.若已知帕邢系的氢原子光谱在红外线区域,试求:(1)n =6时,对应的波长;(2)帕邢系形成的谱线在真空中的波速为多少?n =6时,传播频率为多大?解析:(1)由帕邢系公式1λ=R ⎝⎛⎭⎫132-1n 2 当n =6时,λ=×10-6 m.(2)帕邢系形成的谱线在红外线区域,而红外线属于电磁波,在真空中以光速传播,故波速为光速c =3×108 m/s ,由v =λT =λν,得ν=v λ=c λ=3×108×10-6 Hz =×1014 Hz. 答案:(1)×10-6 m (2)3×108 m/s ×1014 Hz。


实验 氢原子光谱的研究氢原子的结构最简单,它的线光谱明显地具有规律,早就为人们所注意。
各种原子光谱线的规律性的研究正是首先在氢原子上得到突破的。
氢原子又是一种典型的最适合于进行理论与实验比较的原子,对氢原子光谱的种种研究在量子论的发展中多次起过重要作用。
1913年玻尔建立了半经典的氢原子理论,成功地解释了包括巴耳末线系在内的氢光谱的规律。
事实上氢的每一谱线都不是一条单独的线,换言之,都具有精细结构,不过用普通的光谱仪器难以分辨,因而被当作单独一条而已。
这一事实意味着氢原子的每一能级都具有精细结构。
1916年索末菲考虑到氢原子中电子的椭圆轨道上近日点的速度已经接近光速,他根据相对论性力学修正了玻尔的理论,得到了氢原子能级精细结构的精确公式。
但这仍是一个半经典理论的结果。
1925年薛定谔建立了波动力学(即量子学中的薛定谔方程),重新解释了玻尔理论所得到的氢原子能级。
不久海森伯和约丹(1926年)根据相对论性薛定谔方程推得一个比索末菲所得的在理论基础上更加坚实的结果,将这结果与托马斯(1926年)推得的电子自旋轨道相互作用的结果合并起来,也得到了精确的氢原子能级精细结构公式。
尽管如此,根据该公式所得巴耳末系第一条的(理论)精细结构与不断发展的精密测量中所得实验结果相比,仍有约百分之几的微小差异。
1947年蓝姆和李瑟福用射频波谱学方法,进一步肯定了氢原子第二能级中轨道角动量为零的一个能有确实比上述精确公式所预言的高出1057MHz (乘以普朗克常数即得相应的能量值),这就是有名的蓝姆移动。
直到1949年,利用量子电动力学理论将电子与电磁场的相互作用考虑在内。
这一事实才得到了解释,成为量子电动力学的一项重要实验根据。
[实验目的]1.学习识谱和一种测量谱线波长的方法。
2.通过测量氢光谱可见谱线的波长,验证巴耳末公式的正确性,从而对玻尔理论的实验基础有具体了解,力求准确测定氢的里德伯常数,对近代测量所达到的精度有一初步了解。




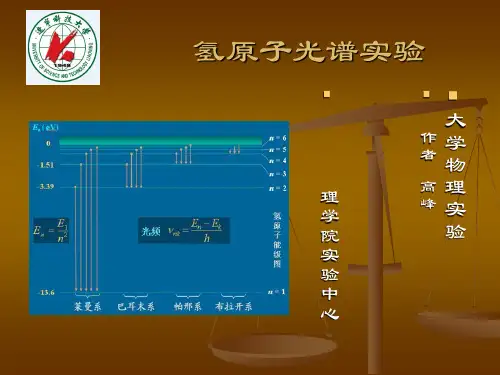
氢原子光谱实验⏹大学物理实验⏹作者高峰⏹理学院实验中心引言⏹氢原子光谱的谱线排列简单而且存在着规律性,它的线状谱线直接传达出了原子内部的信息,反映了原子能级结构。
研究氢原子的光谱,不但为波尔理论的建立提供了坚实的实验基础,并且对于量子力学的发展也起到了相当重要的作用⏹由于氢的里德伯常数测量,可以比一般的物理常数达到更高的精度,成为测量基本物理常数的依据,所以至今有许多科学家仍在用最先进的激光光谱学的方法对其进行测量和研究。
不断的减小了测量结果的不确定度,增加了结果的有效位数。
⏹传统的光谱分析,需要摄谱、暗室冲洗、测谱等阶段,实验周期较长。
组合式多功能光谱仪汲取了计算机和CCD 技术,一改传统摄谱仪用感光胶片的记录方法,使得光谱既可以在计算机屏幕上显示,又可以打印成谱图进行保存,大大缩短了实验的周期,增大了实验的精确程度。
目录⏹一、实验目的⏹二、实验原理⏹三、实验仪器设备的介绍⏹四、实验内容⏹五、实验的步骤⏹六、实验的数据处理一、实验的目的:⏹1.测量氢原子光谱中巴尔末线系的几条谱线的波长,并将在空气中的波长修正为真空中的波长。
⏹2.测量计算各谱线的里德伯常数R H ,并求其平均值或用线性拟和的方法求出R H 。
⏹3.学习多功能组合光谱仪的使用。
二、实验原理⏹1.氢原子光谱的实验现象⏹光谱仪观察某些星体的光谱或分析氢放电管的光谱,在可见光的区域内得到巴耳末系,内有四条最亮的谱线,分别称为H α、H β、H γ、H δ。
谱线H αH βH γH δ波长(n m )656.279486.133434.046410.173颜色红深绿青紫δλ(n m )0.1810.1360.1210.116αH βH γH δH ∞H2.巴耳末用经验公式1885年瑞士的巴耳末用经验公式表示出氢原子的前四条可见光谱:Λ,5,4,3,nm 256.364222=-=n n nλ422-=n nB λΛ,5,4,3=n B=364.56 为一经验常数.3.里德伯公式:里德伯将此式改写成用波数表示的形式.⎪⎭⎫ ⎝⎛-==22~1211n R H λν4.里兹并合原理:里德伯.里兹发现碱金属光谱有类似的规律.)()(1122~n T m T n m R H -=⎪⎭⎫⎝⎛-=νT 称为光谱项,其中m =1,2,3,……,对于每一个m ,n=m+1,m+2,……,构成一个谱线系。

实验氢-氘原子光谱原子光谱的测定与分析,为量子理论的建立提供了坚实的实验基础。
1885年巴尔末(J. J. Balmer )总结出了氢光谱线的经验公式。
1913年玻尔(N. Bohr ),1925年,海森伯(W.Heisenberg )建立起他们的理论都是建筑在原子光谱的测量基础之上的。
现在,无论在工业生产部门还是在科学研究领域,原子光谱的观察、测定和分析都是研究原子结构、物质分析的重要方法之一。
在物理学、化学化工、材料、生命科学领域内有广泛的实际应用。
一 实验目的1.掌握WPG-100型平面光栅摄谱仪的工作原理和使用方法,学习摄谱、识谱和谱线测量等光谱研究的基本技术。
2.通过所测得的氢(氘)原子光谱在可见和近紫外区的波长(误差小于0.5Å),验证巴耳末公式并准确测出氢(氘)的里德伯常数。
3.测量氢、氘同位素位移,求出质子与电子的质量比。
二 实验原理1.原子的激发与辐射原子内部的不同能量状态称为能级。
处于基态的原子可以吸收能量而跃迁到较高的能量状态,这个过程称为原子的激发。
原子也可以从较高的能级退到较低的能级或基态而放出能量,如果放出的能量取辐射形式,那么放出的能量就成为一个光子的能量hv ,这个过程称为原子的辐射。
要使原子发光必须先将它激发,原子激发的方式通常分为碰撞激发和光激发两种。
具有一定能量的电子、原子、分子与某原子相碰撞而使后者激发称为碰撞激发;原子吸收一个光子引起的激发称为光激发,即光的吸收过程。
本实验采用碰撞激发,它又分为热激发和电场引起的碰撞激发两种形式,前者指在高温下各原子有较大的运动速度,相互碰撞而产生激发,本实验的铁光谱就是这种方式产生的。
电场引起的碰撞激发是带电粒子在电场作用下加速运动,与原子发生非弹性碰撞使原子激发,氢(氘)光谱就是采用这种方式产生的。
2.氢原子光谱的实验规律早在原子理论建立以前人们就积累了有关原子光谱的大量实验数据,发现氢原子光谱可用一个普通的公式表示,即⎪⎭⎫ ⎝⎛-=2211~n mR v (1)其中:m 取1、2、3、4、5等正整数,每一个m 值对应一个光谱线系,如当m=2时便得到谱线在可见光和近紫外区的巴耳末线系;n 取m+1、m+2、m+3、…等正整数,每一个n 值对应一条谱线;R 称为里德伯常数。