第八章__配位平衡与滴定
- 格式:doc
- 大小:49.00 KB
- 文档页数:4


第八章 配位平衡与配位滴定法2、人们先后制得多种钴氨配合物,其中四种组成如下:(1)CoCl 3·6NH 3 (2)CoCl 3·5NH 3 (3)CoCl 3·4NH 3 (4)CoCl 3·3NH 3若用AgNO 3溶液沉淀上述配合物中的Cl -,所得沉淀的含氯量依次相当于总含氯量的0313233、、、,根据这一实验事实确定四种氨钴配合物的化学式?答:[Co(NH 3)6]Cl 3 [Co(NH 3)5Cl]Cl 2 [Co(NH 3)4Cl 2]Cl [Co(NH 3)3 Cl 3]4、在1.0L 氨水中溶解0.10molAgCl ,问氨水的最初浓度是多少?=2.16×10–3)mol.L (22.21002.21.01.01002.2)(Cl )])[Ag(NH ()(NH 1-33-1233=⨯⨯=⨯⋅=--+c c c 在溶解的过程中要消耗氨水的浓度为2×0.1=0.2mol·L -1,所以氨水的最初浓度为 2.22+0.2=2.42mol·L -15①AgI 不能溶于NH 3而能溶于KCN,因为溶解反应K ⊙=Ksp*K (稳),K(稳)Ag (CN )2>>K(稳)Ag (NH 3)2 ∴AgI 溶于KCN 的平衡常数很大而溶于NH 3的平衡常数很少②AgBr 能溶于KCN 而Ag 2S 不能,,∵K ⊙=Ksp*K (稳)Ag 2S 的Ksp<<AgBr 的Ksp ∴溶解反应的K 会很小]/)Ag ([])/(NH []/)Ag ([]/)Cl ([])/])([Ag(NH [])/(NH []/)Cl ([]/])Ag(NH [[θ2θ3θθθ232θ3θθ23c c c c c c c c c c c c c c c c K ++-+-+⋅⋅⋅=⋅=③Fe 与SCN -会生成血红色的配合物 ④略6、0. l0mol ∙L -1的AgNO 3溶液50mL ,加密度为0.932g ∙ mL -1含NH 3 18.24%的氨水30mL ,加水稀释到100mL ,求算这溶液中的Ag +浓度。


第八章配位化合物与配位滴定第八章配位化合物与配位滴定第一节配位化合物一、配位化合物的定义配位化合物(简称配合物,也称络合物)是指独立存在的稳定化合物进一步结合而成的复杂化合物。
例:[Cu(NH3)4]SO4是由一个Cu2+和四个NH3分子组成的独立基团。
特点:1.在结构中都包含有中心离子和一定数目的中性分子或阴离子相结合而成的结构单元,此结构单元表现出新的特征。
2.在配位化合物中中心离子或阴离子或中性分子通过形成配位共价键而结成独立的结构单元。
配位化合物的定义:由中心离子(或原子)和一定数目的中性分子或阴离子通过形成配位共价键相结合而成的复杂结构单元称配位单元,凡是由配位单元组成的化合物称配位化合物。
若配位单元带电荷称配离子,如[Ag(CN)2]-,配离子与带相反电荷的离子组成中性配合物。
若配位单元不带电荷,则配位单元本身就是配合物,如Fe(CO)5另外,必须指出有一类叫复盐的化合物,如KCl·MgCl2·6H2O、KAl(SO4)2·12H2O无复杂离子和复杂的配位单元,不是配合物。
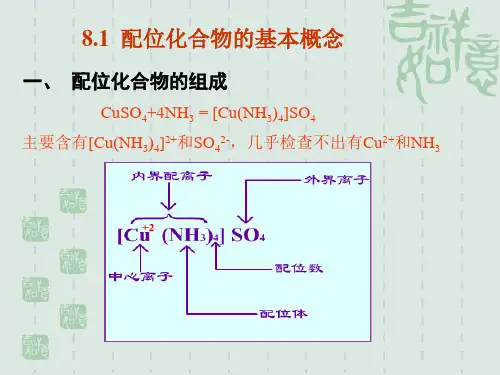
二、配合物的组成配合物在组成上一般包括内界和外界两部分。
中心体(离子或原子)内界配合物配体(单齿或多齿配体)外界现以[Cu(NH3)4]SO4为例说明配合物的组成。
内界外界[ Cu (NH3) 4 ]2+ SO42-中配配配外心位位位界离原体数离子子子组成:配合物的组成由外界离子、配体、中心离子(或原子)构成。
1.中心离子(或原子)也叫形成体,它位于配合物的中心,一般是金属离子,以过渡态金属离子最常见,也有中性原子或高氧化态的非金属元素。
如:Fe(CO)5中的Fe为形成体,是原子。
[PF6]-中的P是形成体,非金属元素。
作为中心离子的条件是:必须具有空的价电子轨道,可以接受配体所给予的孤对电子。
周期表中绝大多数元素可作为中心离子,常见的一些过渡元素如铁、铜、银、金、锌、汞、铂等元素的离子或原子,它们具有(n-1)d、ns、np、nd等的空的价电子轨道,都是强的形成体。

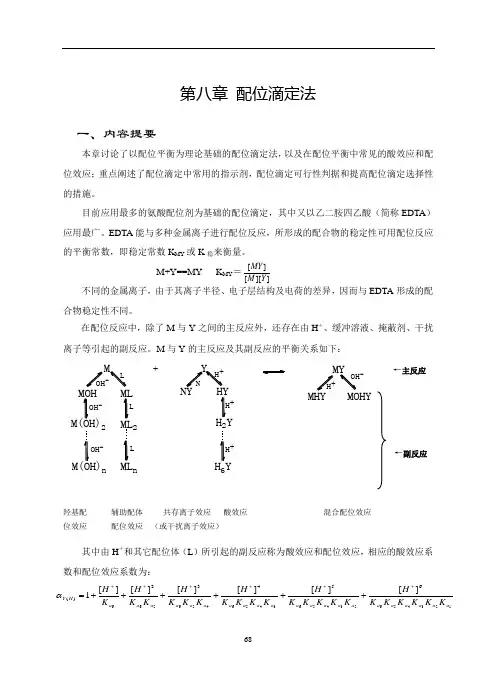
第八章 配位滴定法一、内容提要本章讨论了以配位平衡为理论基础的配位滴定法,以及在配位平衡中常见的酸效应和配位效应;重点阐述了配位滴定中常用的指示剂,配位滴定可行性判据和提高配位滴定选择性的措施。
目前应用最多的氨酸配位剂为基础的配位滴定,其中又以乙二胺四乙酸(简称EDTA )应用最广。
EDTA 能与多种金属离子进行配位反应,所形成的配合物的稳定性可用配位反应的平衡常数,即稳定常数K MY 或K 稳来衡量。
M+Y==MY K MY = 不同的金属离子,由于其离子半径、电子层结构及电荷的差异,因而与EDTA 形成的配合物稳定性不同。
在配位反应中,除了M 与Y 之间的主反应外,还存在由H +、缓冲溶液、掩蔽剂、干扰离子等引起的副反应。
M 与Y 的主反应及其副反应的平衡关系如下: ←主反应←副反应羟基配 辅助配体 共存离子效应 酸效应 混合配位效应位效应 配位效应 (或干扰离子效应)其中由H +和其它配位体(L )所引起的副反应称为酸效应和配位效应,相应的酸效应系数和配位效应系数为:6++--L2n2n -]][[][Y M MY 12345623456345645656665432)(][][][][][][1a a a a a a a a a a a a a a a a a a a a a H Y K K K K K K H K K K K K H K K K K H K K K H K K H K H ++++++++++++=α考虑了酸效应和配位效应影响后得到的稳定常数称为条件稳定常数,它与稳定常数的关系为: 在配位滴定中,一般根据lgC M ·'MY K ≥6来判断金属离子能否准确滴定,根据准确滴定时对'MY K 的要求,可以确定滴定的最高允许酸度。
直接滴定时的最低允许酸度主要取决于金属离子的水解酸度。
对于混合金属离子的滴定,可根据具体情况采用控制酸度及加掩蔽剂等方法来达到分别滴定的目的。


第八章配位滴定法1. 用于配位滴定的配位剂EDTA属于下列哪种配位剂()A “OO型”B “NO型”C “NN型”D “SO型”2. EDTA能与许多种金属离子进行配位反应。
在其多种存在形式中,以何种形式与金属离子形成的配合物最稳定()A H2Y2-B H3Y‾C H4YD Y4-3. 配位滴定法中配制滴定液使用的是()A EDTAB EDTA二钠盐C EDTA六元酸D EDTA负四价离子4. 有关EDTA叙述正确的是()A 在水溶液中EDTA一共有5级电离平衡B EDTA是一个二元有机弱酸C EDTA在溶液中总共有7种形式存在D EDTA不溶于碱性溶液5. 金属离子与EDTA形成稳定配合物的主要原因是()A 不分级配位B 配位比简单C 形成环状螯合物D 配合物的颜色较深6. EDTA与金属离子形成螯合物时,其螯合比一般为()A 1:1B 1:2C 1:4D 1:67. 关于稳定常数的概念错误的是()A 又称绝对稳定常数B 其倒数称为不稳定常数C 稳定常数与温度无关D 稳定常数越大,配合物越稳定8. 影响EDTA配合物稳定性的因素之一是酸效应。
酸效应是指()A 加入酸使溶液酸度增加的现象B 酸能使配位体配位能力降低的现象C 酸能使金属离子配位能力降低的现象D 酸能抑制金屑离子水解的现象9. 在下列叙述EDTA溶液中Y4-的分布系数为δ时,说法正确的是()A δ随pH增大而减小B δ随酸度减小而减小C δ随酸度减小而增大D δ与pH变化无关10. 下列叙述条件稳定常数K’MY的概念中,说法正确的是()A 随酸度减小而减小B K’MY随pH增大而减小C K’MY与pH变化无关D K’MY随酸度减小而增大11. 在EDTA配位滴定中,下列有关酸效应系数的叙述,正确的是()A 酸效应系数越小,越利于滴定B 酸效应系数越大,越利于滴定C pH越大,酸效应系数愈大D 酸度越低,酸效应系数愈大12. 浓度为1.0×10-3mol/L配位剂L滴定1.0×10-3mol/L金属离子M,设配合物ML的稳定常数为K ML=1014.0,在何种pH条件下可以准确滴定?()A pH=2.0,logαL(H)=14.0B pH=8.0,logαL(H)=3.0C pH=6.0,logαL(H)=5.5D pH=4.0,logαL(H)=10.013. EDTA滴定金属离子M时,能使滴定反应的平衡常数增加的效应是()A EDTA酸效应B M的水解反应C MY的副反应D M 的其他配位效应14. 配位滴定法的直接法终点所呈现的颜色是指()A 游离的金属指示剂的颜色B 被测金属离子与EDTA形成配合物的颜色C 游离的金属离子的颜色D 金属指示剂与被测金属离子形成配合物的颜色15. 金属指示剂一般为有机弱酸或弱碱,它具有酸碱指示剂的性质,同时它也是()A 有颜色的金属离子B 无颜色的金属离子C 金属离子的配位剂D 金属离子的氧化剂16. 用EDTA法测定自来水的硬度,已知水中含有少量Fe3+,某同学用NH3-NH4Cl调pH=9.6,选络黑T为指示剂,用EDTA标准溶液滴定,但溶液一直是红色找不到终点,其原因是()A pH太高B Fe3+封闭了指示剂C pH太低D 指示剂失效17. 配位滴定中,使用铬黑T作指示剂,用来调节溶液酸度的缓冲溶液是()A 硝酸B 盐酸C 氨-氯化铵缓冲液D 醋酸-醋酸钠缓冲液18. 用EDTA单独滴定Ca2+时,选用钙指示剂,适宜pH范围是()A pH<6B pH6~12C pH=12D pH=1019. 当溶液中有两种金属离子共存时,若要求滴定误差小于0.1%,则∆(lgcK)应大于()A 7B 4C 6D 520. 采用EDTA滴定法测定Al3+时,宜采用的滴定方式为()A 置换滴定法B 返滴定法C 直接滴定法D 间接滴定法21. EDTA测定水的总硬度时,选择适宜的指示剂为()A 钙指示剂B 铬黑TC PAND 二甲酚橙22. EDTA滴定测定Al3+时,下列金属离子标准溶液中适用于返滴定过量EDTA的是()A Mg2+B Ag2+C Ca2+D Zn2+23. 在Ca2+、Mg2+共存时,可不加掩蔽剂用 EDTA滴定Ca2+的pH条件是()A pH5B pH10C pH12D pH224. 以EDTA为滴定剂,以铬黑T为指示剂,不会出现封闭现象的离子是()A Fe3+B Mg2+C Al3+D Cu2+25. EDTA滴定Ca2+、Mg2+时,可用下列掩蔽剂掩蔽Fe3+是()A KCN或抗坏血酸B 乙酰丙酮或三乙醇胺C 乙酰丙酮或抗坏血酸D 三乙醇胺或KCN参考答案: BDBCC ACBCD ABCAC BCCCB BDCBD。
第八章 配位化合物与配位滴定习题1:配位化合物部分1 无水CrCl 3和氨作用能形成两种配合物A 和B ,组成分别为CrCl 3·6NH 3和CrCl 3·5NH 3。
加入AgNO 3,A 溶液中几乎全部氯沉淀为AgCl ,而B 溶液中只有2/3的氯沉淀出来。
加入NaOH 并加热,两种溶液均无氨味。
试写出这两种配合物的化学式并命名。
解:因加入AgNO 3,A 溶液中几乎全部氯沉淀为AgCl ,可知A 中的三个Cl -全部为外界离子,B 溶液中只有2/3的氯沉淀出来,说明B 中有两个Cl -为外界,一个Cl -属内界。
加入NaOH ,两种溶液无氨味,可知氨为内界。
因此A 、B 的化学式和命名应为,A :[Cr(NH 3)6]Cl 3 三氯化六氨合铬(Ⅲ) B :[Cr(NH 3)5Cl]Cl 2 二氯化一氯五氨合铬(Ⅲ)2 指出下列配合物的中心离子、配体、配位数、配离子电荷数和配合物名称。
解:3 试用价键理论说明下列配离子的类型、空间构型和磁性。
解:(1)CoF 63-和Co(CN)63-CoF 63-为外轨型,空间构型为正八面体,顺磁性,磁矩=B μ90.4)24(4=+。
Co(CN)63-为内轨型,空间构型为正八面体,抗磁性,磁矩为零。
(2)Ni(NH 3)42+和Ni(CN)42-Ni(NH 3)42+为外轨型,正四面体型,顺磁性,磁矩=B μ83.2)22(2=+。
Ni(CN)42-为内轨型,平面正方型,抗磁性,磁矩为零。
4 将0.1mol·L -1ZnCl 2溶液与1.0 mol·L -1NH 3溶液等体积混合,求此溶液中Zn(NH 3)42+和Zn 2+的浓度。
解:等体积混合后,ZnCl 2和NH 3各自的浓度减半,生成的Zn(NH 3)42+的浓度为0.05 mol·L -1,剩余的NH 3的浓度为0.3 mol·L -1,设Zn 2+的浓度为x mol·L -1。
习 题八一、选择题(将正确答案的序号填在括号内) 1.下列配合物中心离子的配位数有错误的是( )a.[Co(NO 2)3(NH 3)3];b.K 2[Fe(CN)5NO];c.[CoCl 2(NH 2)2(en)2];d.[Co(NH 3)4Cl 2]Cl 。
2.关于配合物,下列说法错误的是( )a.配体是一种可以给出孤对电子或π健电子的离子或分子;b.配位数是指直接同中心离子相连的配体总数;c.广义地讲,所有金属离子都可能生成配合物;d.配离子既可以存在于晶体中,也可以存在于溶液中。
3.关于外轨型与内转型配合物的区别,下列说法不正确的是( )a.外轨型配合物中配位原子的电负性比内轨型配合物中配位原子的电负性大;b.中心离子轨道杂化方式在外轨型配合物是ns 、np 、nd 轨道杂化,内轨型配合物是(n-1)d 、ns 、np 轨道杂化;c.一般外轨型配合物比内轨型配合物键能小;d.通常外轨型配合物比内轨型配合物磁矩小。
4.当下列配离子浓度及配体浓度均相等时,体系中Zn 2+离子浓度最小的是( )a.()+243NH Zn ; b.()+22en Zn ;c. ()-24CN Zn d.()-24OH Zn。
5.Fe(Ⅲ)形成配位数为6的外轨型配合物中,Fe 3+离子接受孤对电子的空轨道是( )a.d 2sp 3;b.sp 3d 2;c.p 3d 3d.sd 5 6.下列配离子能在强酸性介质中稳定存在的是( )a.()-3232O S Ag ; b.()+243NH Ni ; c.()-3342O C Fe ; d.-24HgCl 。
7.测得()+363NH Co 的磁矩µ=0.0B· M,可知Co 3+离子采取的杂化类型为( )a.d 2sp 3;b.sp 3d 2;c.sp 3 ;d.dsp 2 8.下列物质具有顺磁性的是( )a.()+23NH Ag ; b.()-46CN Fe ; c.()+243NH Cu ; d.()-24CN Zn9.下列物质中,能作为螯合剂的为( )a.HO-OH ;b.H 2N-NH 2;c.(CH 32)2N-NH 2;d.H 2N-CH 2-CH 2-NH 2。
第八章配位平衡与配位滴定法
一、选择题
1. 关于配合物,下列说法错误的是()
A. 配体是一种可以给出孤对电子或π键电子的离子或分子
B .配位数是指直接同中心离子相结合的配体总数
C. 广义地讲,所有金属离子都可能生成配合物
D. 配离子既可以存在于晶体中,也可以存在于溶液中
2. 关于外轨型与内轨型配合物的区别,下列说法不正确的是()
A. 外轨型配合物中配位原子的电负性比内轨型配合物中配位原子的电负性大
B. 中心离子轨道杂化方式在外轨型配合物是ns、np、nd轨道杂化,内轨型配合物是(n-1)d、ns、np轨道杂化
C. 一般外轨型配合物比内轨型配合物键能小
D. 通常外轨型配合物比内轨型配合物磁矩小
3. 当下列配离子浓度及配体浓度均相等时,体系中Zn2+离浓度最小的是()
A.Zn(NH3)42+ B. Zn(en)22+
C. Zn(CN)42-
D. Zn(OH)42-
4. Fe(Ⅲ)形成配位数为6的外轨型配合物中,Fe3+离子接受孤对电子的空轨道是()
A. d2sp3
B. sp3d2
C. p3d3
D. sd5
5.下列配离子能在强酸性介质中稳定存在的是()
A.Ag(S2O3)23-B.Ni(NH3)42+C.Fe(C2O4)33-D.HgCl42-
6. 测得Co(NH3)63+的磁矩μ=0B.M,可知Co3+离子采取的杂化类型为( )
A.d2sp3
B.sp3d2
C.sp3
D. dsp2
7.下列物质具有顺磁性的是()
A.Ag(NH3) +B.Fe(CN)64-C.Cu(NH3)42+D.Zn(CN)42-
8.下列物质中,能作为螯合剂的为( )
A. HO-OH
B. H2N-NH2
C. (CH3)2N-NH2
D. H2N-CH2-CH2-NH2
9. 在[RhBr2(NH3)4]+中,Rh的氧化数和配位数分别是()
A.+2和4
B.+3和6
C. +2和6
D. +3和4
10.Cu(en)22+的稳定性比Cu(NH3)42+大得多,主要原因是前者()
A. 配体比后者大
B.具有螯合效应
C. 配位数比后者小
D. en的相对分子质量比NH3大
11.下列离子中,形成配合物的能力最强的是()
A. Cu2+
B. Ca2+
C. Zn2+
D. Mg2+
12.下列配体中,配合能力最强的是()
A. NH3
B. H2O
C. Cl-
D. CN-
13.下列物质中,难溶于Na2S2O3溶液,而易溶于KCN溶液的是()
A. AgCl
B. AgI
C. AgBr
D. Ag2S
14.向含有Ag(NH3)2+配离子的溶液中分别加入下列物质时,平衡不向Ag(NH3)2 +离解方向移动的是()
A. 稀HNO3
B. NH3·H2O
C. Na2S
D. KI
15.下列各组盐溶液中加入浓氨水产生沉淀不溶解的是()
A. ZnCl2和AgCl
B. CuSO4和CoSO4
C. Mg(NO3)2和FeCl3
D. Ni(NO3)2和AgCl
16. EDTA与金属离子形成螯合物时,其螯合比一般为
A. 1:1
B. 1:2
C. 1:4
D. 1:6
17. EDTA与金属离子配位时,一分子的EDTA可提供的配位原子个数为
A. 2
B. 4
C. 6
D. 8
18. 在非缓冲溶液中用EDTA滴定金属离子时,溶液的pH将
A. 升高
B. 降低
C. 不变
D. 与金属离子价态有关
19. 下列叙述α[Y(H)]正确的是
A. α[Y(H)]随酸度减小而增大
B. α[Y(H)]随pH增大而减小
C. α[Y(H)]随酸度增大而减小
D. α[Y(H)]与pH变化无关
20. 以铬黑T为指示剂,用EDTA溶液滴定Ca2+、Mg2+总量, 可选择的缓冲溶液为
A. KHC8H4O4-HCl
B. KH2PO4-Na2HPO4
C. NH4Cl-NH3·H2O
D. NaAc-HAc
21. 用EDTA直接滴定有色金属离子,终点时所呈现的颜色是
A. 游离指示剂In的颜色
B. MY的颜色
C. MIn的颜色
D. A和B的混合颜色
22. Fe3+、Al3+对铬黑T有
A.僵化作用
B.氧化作用
C.沉淀作用
D.封闭作用
23. 在配位滴定中,用返滴定法测Al 3+时,以某金属离子标准溶液滴定过量的EDTA ,最适合的金属离子标准溶液是 ( )
A. Mg 2+
B. Zn 2+
C. Ag +
D. Bi 3+
24. 某溶液含Ca 2+、Mg 2+及少量Fe 3+、Al 3+,现加入三乙醇胺,调至pH=10,以铬黑T 为指示剂,用EDTA 滴定,此时测定的是 ( )
A. Mg 2+含量
B. Ca 2+含量
C. Ca 2+、Mg 2+总量
D. Ca 2+、Mg 2+、Fe 3+ 、Al 3+总量
25. 在配位滴定中,金属离子与EDTA 形成的配合物越稳定,K(MY)越大,在滴定时允许pH (仅考虑酸效应)
A. 越低
B. 越高
C. 中性
D. 无法确定
26. 在pH=5.0时,下列0.01 mol·L -1金属离子溶液中,可用EDTA 标准溶液直接准确滴定的是 ( )
A. Mg 2+
B. Mn 2+
C. Ca 2+
D. Zn 2+
27. Co(Ⅲ)的八面体配合物CoClm·nNH 3, 若1mol 配合物与AgNO 3作用生成1molAgCl 沉淀, 则m 和n 的值是 ( )
A. m=1, n=5
B. m=3, n=4
C. m=5, n=1
D. m=4, n=5
二、填充题
1.下列几种配离子:Ag(CN)2-、FeF 63-、Fe(CN)64-、Ni(NH 3)42+属于内轨型的是 。
2.在CuSO 4溶液中加入少量氨水,则溶液中有 色沉淀生成,若加入过量氨水,则沉淀溶解,生成 色 配离子。
3.根据下列配合物的名称,写出它们的化学式。
(1)二(硫代硫酸)合银(Ⅰ)酸钠 。
(2)二氯·一草酸根·一(乙二胺)合铁(Ⅲ) 。
(3)四氯合铂(Ⅱ)酸六氨合铂(Ⅱ) 。
(4)四(异硫氰根)·二氨合钴(Ⅲ)酸铵 。
4.根据Kj θ值,判断标态时下列反应进行的方向。
(1) 2--244[HgCl ] + 4I []4j HgI Cl K θ--
+= (2) 22223434()()j
C u N H Z n Z n N H C u K θ++++++=
5. 在无色溶液A中加入NaCl溶液得到白色沉淀B;B沉淀加氨水得溶液C;C 中加入KBr溶液得淡黄色沉淀D;D溶于Na2S2O3溶液得溶液E; D溶于KCN溶
6. [CoCl2(en)2]的名称是,中心离子是,配体是,配位数是。
7. 在含有酒石酸和KCN的氨性溶液中,用EDTA滴定Pb2+、Zn2+混合溶液中的Pb2+,加入KCN的作用是。
8. Ni(NH3)42+具有顺磁性,则它的几何构型为,杂化类型为;Ni(CN)42-具有反磁性,则它的几何构型为,杂化类型为。