第八章配位平衡与滴定
- 格式:doc
- 大小:49.00 KB
- 文档页数:4


(完整版)配位化合物与配位滴定法第⼋章配位化合物与配位滴定法【知识导航】本章知识在《中国药典》(2010年版)中主要应⽤于含⾦属离⼦药物的含量测定,以配位反应为基础的滴定分析法。
⽬前多⽤氨羧配位剂为滴定液,其中以⼄⼆胺四醋酸(EDTA)应⽤最⼴。
《中国药典》中使⽤直接滴定法对葡萄糖酸钙、葡萄糖酸钙⼝服液、葡萄糖酸钙含⽚、葡萄糖酸钙注射剂、葡萄糖酸钙颗粒、葡萄糖酸锌、葡萄糖酸锌⼝服液、葡萄糖酸锌⽚、葡萄糖酸锌颗粒进⾏含量测定;使⽤间接滴定法对氢氧化铝、氢氧化铝⽚、氢氧化铝凝胶进⾏含量测定。
在历年执业药师考试中也有相关考题出现。
学好本章内容有利于掌握配位滴定法的原理、配位滴定法在药物分析中的应⽤以及备战执业药师考试。
【重难点】1.配位化合物(coordination compound)简称配合物,以具有接受电⼦对的空轨道的原⼦和离⼦为中⼼(中⼼离⼦),与⼀定数量的可以给出电⼦对的离⼦或分⼦(配体)按⼀定的组成和空间构型形成的化合物。
配位键的形成:中⼼离⼦(原⼦)提供空轨道,配位体上的配位原⼦提供孤对电⼦。
例如:[Cu(NH3)4]SO4、K3[Fe(NCS)6]等。
这些化合物与简单的化合物区别在于分⼦中含有配位单元,⽽简单化合物中没有这些配位单元。
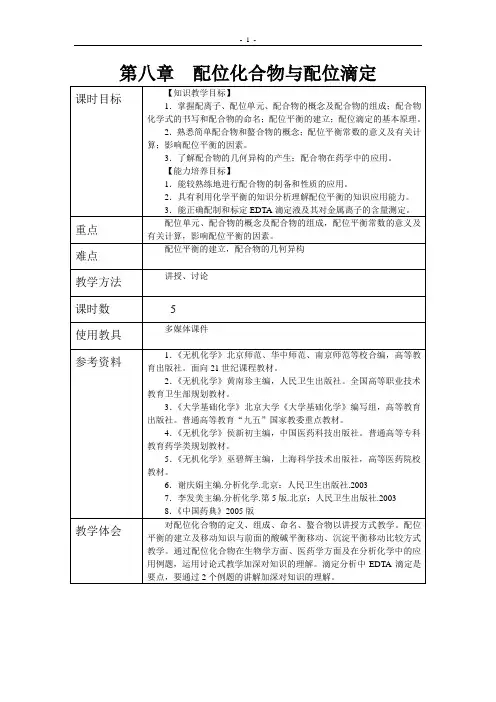
以[Cu(NH3)4]SO4为例:[Cu (NH3)4 ] SO4↓↓↓内界配体外界配位体中提供孤电⼦对的,与中⼼离⼦以配位键结合的原⼦称为配位原⼦。
⼀般常见的配位原⼦是电负性较⼤的⾮⾦属原⼦。
常见配位原⼦有C、N、O、P及卤素原⼦。
由于不同的配位体含有的配位原⼦不⼀定相同,根据⼀个配位体所提供的配位原⼦的数......⽬.,可将配位体分为单齿配位体(unidentate ligand)和多齿配位体(multidentate ligand)。
只含有⼀个配位原⼦配位体称单齿配位体如H2O、NH3、卤素等。
有两个或两个以上的配位原⼦配位体称多齿配位体,如⼄⼆胺NH2⼀CH2⼀CH2⼀NH2(简写为en),草酸根C2O42-(简写为ox)、⼄⼆胺四醋酸根(简称EDTA)等。

配位平衡与配位滴定法第八章配位平衡与配位滴定法(Coordination Equilibrium and Complexometic Titration)本章目标1.掌握配位化合物的定义、组成、命名和分类。
2掌握配位平衡和配位平衡常数的意义及其有关计算,理解配位平衡的移动及与其他平衡的关系。
3.了解螯合物及其特点。
4.了解EDTA与金属离子配合物的特点及其稳定性5.理解配位滴定的基本原理,配位滴定所允许的最低pH值和酸效应曲线,6.了解金属指示剂作用原理及应用7.掌握配位滴定的应用配位化合物(coordination compound)简称配合物,是组成复杂、应用广泛的一类化合物。
最早报道的配合物是1704年由德国涂料工人迪士巴赫在研制美术涂料时合成的,叫普鲁士蓝KFe[Fe(CN)6]。
19世纪上半叶,又陆续发现一些重要的配合物,由于当时还不能确定结构,这些物质通常以发现者的名字命名。
直到19世纪90年代,瑞典化学家Werner提出了配位理论,才对配合物的结构和某些性质给予了满意的解释,从而奠定了配位化合物的基础。
20世纪60年代以来,配合物的研究发展很快,已形成独立的学科。
配位反应已渗透到生物化学、有机化学、分析化学、催化动力学、生命科学等领域中去。
在生产实践、分析科学、功能材料和药物制造等方面有重要的实用价值和理论基础。
本章从配合物的基本概念出发,介绍其组成、结构、在溶液中的平衡和在滴定分析中的应用。
8.1 配合物的组成与命名8.1.1 配合物的定义通常把由一个简单正离子(或原子)和一定数目的阴离子或中性分子以配位键相结合形成的复杂离子(或分子)称为配位单元,含有配位单元的复杂化合物称为配合物。
这些化合物与简单的化合物区别在于分子中含有配位单元。
例如将Cu(NH3)4]SO4晶体溶于水中,溶液中除了含有[Cu (NH3)4]2+和SO42-,几乎检查不出有Cu2+和NH3的存在。
分析其结构,在[Cu(NH3)4]2+中,每个氨分子中的氮原子,提供一对孤对电子,填入Cu2+的空轨道,形成四个配位键。
第八章配位化合物与配位滴定第八章配位化合物与配位滴定第一节配位化合物一、配位化合物的定义配位化合物(简称配合物,也称络合物)是指独立存在的稳定化合物进一步结合而成的复杂化合物。
例:[Cu(NH3)4]SO4是由一个Cu2+和四个NH3分子组成的独立基团。
特点:1.在结构中都包含有中心离子和一定数目的中性分子或阴离子相结合而成的结构单元,此结构单元表现出新的特征。
2.在配位化合物中中心离子或阴离子或中性分子通过形成配位共价键而结成独立的结构单元。
配位化合物的定义:由中心离子(或原子)和一定数目的中性分子或阴离子通过形成配位共价键相结合而成的复杂结构单元称配位单元,凡是由配位单元组成的化合物称配位化合物。
若配位单元带电荷称配离子,如[Ag(CN)2]-,配离子与带相反电荷的离子组成中性配合物。
若配位单元不带电荷,则配位单元本身就是配合物,如Fe(CO)5另外,必须指出有一类叫复盐的化合物,如KCl·MgCl2·6H2O、KAl(SO4)2·12H2O无复杂离子和复杂的配位单元,不是配合物。
二、配合物的组成配合物在组成上一般包括内界和外界两部分。
中心体(离子或原子)内界配合物配体(单齿或多齿配体)外界现以[Cu(NH3)4]SO4为例说明配合物的组成。
内界外界[ Cu (NH3) 4 ]2+ SO42-中配配配外心位位位界离原体数离子子子组成:配合物的组成由外界离子、配体、中心离子(或原子)构成。
1.中心离子(或原子)也叫形成体,它位于配合物的中心,一般是金属离子,以过渡态金属离子最常见,也有中性原子或高氧化态的非金属元素。
如:Fe(CO)5中的Fe为形成体,是原子。
[PF6]-中的P是形成体,非金属元素。
作为中心离子的条件是:必须具有空的价电子轨道,可以接受配体所给予的孤对电子。
周期表中绝大多数元素可作为中心离子,常见的一些过渡元素如铁、铜、银、金、锌、汞、铂等元素的离子或原子,它们具有(n-1)d、ns、np、nd等的空的价电子轨道,都是强的形成体。


第9章配位平衡与配位滴定法—教学案例案例9.1:铜氨纤维具有会呼吸、清爽、抗静电、悬垂性佳四大功能,其最吸引人的特性为具吸湿、放湿性,属呼吸、清爽的纤维。
铜氨纤维产品的性能近似于丝绸,极具悬垂感。
作为面料它手感柔软,光泽柔和,符合环保服饰潮流,特别适用于与羊毛、合成纤维混纺或纯纺,做高档针织物。
利用铜氨溶液具有溶解纤维的能力,将棉纤维溶解在铜氨溶液中,配成纺丝液,然后从很细的喷丝嘴中将纺丝液喷注于稀酸中,纤维素则以细长且具有蚕丝光泽的细丝从稀酸中沉淀出来,再进行染色、调图等,便得到质地高档、色泽艳丽的铜氨纤维。
问题:(1) 铜氨溶液的主要化学成分是什么?如何制备?(2) 工业上制造人造丝是利用了铜氨溶液的什么性质?案例9.1分析:向硫酸铜溶液中加入过量的氨水,得到的不是氢氧化铜沉淀,而是浅蓝色的碱式硫酸铜沉淀:2CuSO4 + 2NH3ꞏH2O=Cu2(OH)2SO4↓+ (NH4)2SO4若继续加入氨水,碱式硫酸铜沉淀就会溶解,得到亮蓝色的四氨合铜配离子:Cu2(OH)2SO4 + 8NH3=2[Cu(NH3)4]2+ + SO42− + 2OH−铜氨溶液具有溶解纤维的性能,在所得的纤维溶液中再加酸时,纤维又可以沉淀析出。
案例9.2:配位化学是无机化学中发展最快的一个分支,也是众多学科的交叉点,在元素分离和提取、催化领域、工业水处理、染料工业、医药工业、食品工业等有广泛的应用。
顺铂(Cisplatin)是1965年美国科学家罗森伯格(Rosenborg)等人首次发现的,是第一个具有抗癌活性的金属配合物。
顺铂可抑制癌细胞的DNA复制过程,并损伤其细胞膜结构,有较强的广谱抗癌作用。
临床用于卵巢癌、前列腺癌、睾丸癌、肺癌、鼻咽癌、食道癌、恶性淋巴瘤、乳腺癌、头颈部鳞癌、甲状腺癌及成骨肉瘤等多种实体肿瘤,均能显示疗效。
它具有抗癌谱广、作用强、与多种抗肿瘤药有协同作用、且无交叉耐药等特点,为当前联合化疗中最常用的药物之一。
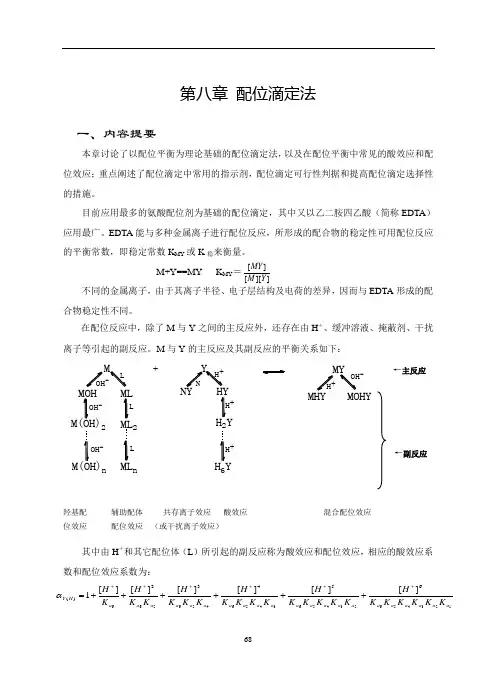
第八章 配位滴定法一、内容提要本章讨论了以配位平衡为理论基础的配位滴定法,以及在配位平衡中常见的酸效应和配位效应;重点阐述了配位滴定中常用的指示剂,配位滴定可行性判据和提高配位滴定选择性的措施。
目前应用最多的氨酸配位剂为基础的配位滴定,其中又以乙二胺四乙酸(简称EDTA )应用最广。
EDTA 能与多种金属离子进行配位反应,所形成的配合物的稳定性可用配位反应的平衡常数,即稳定常数K MY 或K 稳来衡量。
M+Y==MY K MY = 不同的金属离子,由于其离子半径、电子层结构及电荷的差异,因而与EDTA 形成的配合物稳定性不同。
在配位反应中,除了M 与Y 之间的主反应外,还存在由H +、缓冲溶液、掩蔽剂、干扰离子等引起的副反应。
M 与Y 的主反应及其副反应的平衡关系如下: ←主反应←副反应羟基配 辅助配体 共存离子效应 酸效应 混合配位效应位效应 配位效应 (或干扰离子效应)其中由H +和其它配位体(L )所引起的副反应称为酸效应和配位效应,相应的酸效应系数和配位效应系数为:6++--L2n2n -]][[][Y M MY 12345623456345645656665432)(][][][][][][1a a a a a a a a a a a a a a a a a a a a a H Y K K K K K K H K K K K K H K K K K H K K K H K K H K H ++++++++++++=α考虑了酸效应和配位效应影响后得到的稳定常数称为条件稳定常数,它与稳定常数的关系为: 在配位滴定中,一般根据lgC M ·'MY K ≥6来判断金属离子能否准确滴定,根据准确滴定时对'MY K 的要求,可以确定滴定的最高允许酸度。
直接滴定时的最低允许酸度主要取决于金属离子的水解酸度。
对于混合金属离子的滴定,可根据具体情况采用控制酸度及加掩蔽剂等方法来达到分别滴定的目的。



第八章配位滴定法1. 用于配位滴定的配位剂EDTA属于下列哪种配位剂()A “OO型”B “NO型”C “NN型”D “SO型”2. EDTA能与许多种金属离子进行配位反应。
在其多种存在形式中,以何种形式与金属离子形成的配合物最稳定()A H2Y2-B H3Y‾C H4YD Y4-3. 配位滴定法中配制滴定液使用的是()A EDTAB EDTA二钠盐C EDTA六元酸D EDTA负四价离子4. 有关EDTA叙述正确的是()A 在水溶液中EDTA一共有5级电离平衡B EDTA是一个二元有机弱酸C EDTA在溶液中总共有7种形式存在D EDTA不溶于碱性溶液5. 金属离子与EDTA形成稳定配合物的主要原因是()A 不分级配位B 配位比简单C 形成环状螯合物D 配合物的颜色较深6. EDTA与金属离子形成螯合物时,其螯合比一般为()A 1:1B 1:2C 1:4D 1:67. 关于稳定常数的概念错误的是()A 又称绝对稳定常数B 其倒数称为不稳定常数C 稳定常数与温度无关D 稳定常数越大,配合物越稳定8. 影响EDTA配合物稳定性的因素之一是酸效应。
酸效应是指()A 加入酸使溶液酸度增加的现象B 酸能使配位体配位能力降低的现象C 酸能使金属离子配位能力降低的现象D 酸能抑制金屑离子水解的现象9. 在下列叙述EDTA溶液中Y4-的分布系数为δ时,说法正确的是()A δ随pH增大而减小B δ随酸度减小而减小C δ随酸度减小而增大D δ与pH变化无关10. 下列叙述条件稳定常数K’MY的概念中,说法正确的是()A 随酸度减小而减小B K’MY随pH增大而减小C K’MY与pH变化无关D K’MY随酸度减小而增大11. 在EDTA配位滴定中,下列有关酸效应系数的叙述,正确的是()A 酸效应系数越小,越利于滴定B 酸效应系数越大,越利于滴定C pH越大,酸效应系数愈大D 酸度越低,酸效应系数愈大12. 浓度为1.0×10-3mol/L配位剂L滴定1.0×10-3mol/L金属离子M,设配合物ML的稳定常数为K ML=1014.0,在何种pH条件下可以准确滴定?()A pH=2.0,logαL(H)=14.0B pH=8.0,logαL(H)=3.0C pH=6.0,logαL(H)=5.5D pH=4.0,logαL(H)=10.013. EDTA滴定金属离子M时,能使滴定反应的平衡常数增加的效应是()A EDTA酸效应B M的水解反应C MY的副反应D M 的其他配位效应14. 配位滴定法的直接法终点所呈现的颜色是指()A 游离的金属指示剂的颜色B 被测金属离子与EDTA形成配合物的颜色C 游离的金属离子的颜色D 金属指示剂与被测金属离子形成配合物的颜色15. 金属指示剂一般为有机弱酸或弱碱,它具有酸碱指示剂的性质,同时它也是()A 有颜色的金属离子B 无颜色的金属离子C 金属离子的配位剂D 金属离子的氧化剂16. 用EDTA法测定自来水的硬度,已知水中含有少量Fe3+,某同学用NH3-NH4Cl调pH=9.6,选络黑T为指示剂,用EDTA标准溶液滴定,但溶液一直是红色找不到终点,其原因是()A pH太高B Fe3+封闭了指示剂C pH太低D 指示剂失效17. 配位滴定中,使用铬黑T作指示剂,用来调节溶液酸度的缓冲溶液是()A 硝酸B 盐酸C 氨-氯化铵缓冲液D 醋酸-醋酸钠缓冲液18. 用EDTA单独滴定Ca2+时,选用钙指示剂,适宜pH范围是()A pH<6B pH6~12C pH=12D pH=1019. 当溶液中有两种金属离子共存时,若要求滴定误差小于0.1%,则∆(lgcK)应大于()A 7B 4C 6D 520. 采用EDTA滴定法测定Al3+时,宜采用的滴定方式为()A 置换滴定法B 返滴定法C 直接滴定法D 间接滴定法21. EDTA测定水的总硬度时,选择适宜的指示剂为()A 钙指示剂B 铬黑TC PAND 二甲酚橙22. EDTA滴定测定Al3+时,下列金属离子标准溶液中适用于返滴定过量EDTA的是()A Mg2+B Ag2+C Ca2+D Zn2+23. 在Ca2+、Mg2+共存时,可不加掩蔽剂用 EDTA滴定Ca2+的pH条件是()A pH5B pH10C pH12D pH224. 以EDTA为滴定剂,以铬黑T为指示剂,不会出现封闭现象的离子是()A Fe3+B Mg2+C Al3+D Cu2+25. EDTA滴定Ca2+、Mg2+时,可用下列掩蔽剂掩蔽Fe3+是()A KCN或抗坏血酸B 乙酰丙酮或三乙醇胺C 乙酰丙酮或抗坏血酸D 三乙醇胺或KCN参考答案: BDBCC ACBCD ABCAC BCCCB BDCBD。
第八章 配位化合物与配位滴定习题1:配位化合物部分1 无水CrCl 3和氨作用能形成两种配合物A 和B ,组成分别为CrCl 3·6NH 3和CrCl 3·5NH 3。
加入AgNO 3,A 溶液中几乎全部氯沉淀为AgCl ,而B 溶液中只有2/3的氯沉淀出来。
加入NaOH 并加热,两种溶液均无氨味。
试写出这两种配合物的化学式并命名。
解:因加入AgNO 3,A 溶液中几乎全部氯沉淀为AgCl ,可知A 中的三个Cl -全部为外界离子,B 溶液中只有2/3的氯沉淀出来,说明B 中有两个Cl -为外界,一个Cl -属内界。
加入NaOH ,两种溶液无氨味,可知氨为内界。
因此A 、B 的化学式和命名应为,A :[Cr(NH 3)6]Cl 3 三氯化六氨合铬(Ⅲ) B :[Cr(NH 3)5Cl]Cl 2 二氯化一氯五氨合铬(Ⅲ)2 指出下列配合物的中心离子、配体、配位数、配离子电荷数和配合物名称。
解:3 试用价键理论说明下列配离子的类型、空间构型和磁性。
解:(1)CoF 63-和Co(CN)63-CoF 63-为外轨型,空间构型为正八面体,顺磁性,磁矩=B μ90.4)24(4=+。
Co(CN)63-为内轨型,空间构型为正八面体,抗磁性,磁矩为零。
(2)Ni(NH 3)42+和Ni(CN)42-Ni(NH 3)42+为外轨型,正四面体型,顺磁性,磁矩=B μ83.2)22(2=+。
Ni(CN)42-为内轨型,平面正方型,抗磁性,磁矩为零。
4 将0.1mol·L -1ZnCl 2溶液与1.0 mol·L -1NH 3溶液等体积混合,求此溶液中Zn(NH 3)42+和Zn 2+的浓度。
解:等体积混合后,ZnCl 2和NH 3各自的浓度减半,生成的Zn(NH 3)42+的浓度为0.05 mol·L -1,剩余的NH 3的浓度为0.3 mol·L -1,设Zn 2+的浓度为x mol·L -1。
习 题八一、选择题(将正确答案的序号填在括号内) 1.下列配合物中心离子的配位数有错误的是( )a.[Co(NO 2)3(NH 3)3];b.K 2[Fe(CN)5NO];c.[CoCl 2(NH 2)2(en)2];d.[Co(NH 3)4Cl 2]Cl 。
2.关于配合物,下列说法错误的是( )a.配体是一种可以给出孤对电子或π健电子的离子或分子;b.配位数是指直接同中心离子相连的配体总数;c.广义地讲,所有金属离子都可能生成配合物;d.配离子既可以存在于晶体中,也可以存在于溶液中。
3.关于外轨型与内转型配合物的区别,下列说法不正确的是( )a.外轨型配合物中配位原子的电负性比内轨型配合物中配位原子的电负性大;b.中心离子轨道杂化方式在外轨型配合物是ns 、np 、nd 轨道杂化,内轨型配合物是(n-1)d 、ns 、np 轨道杂化;c.一般外轨型配合物比内轨型配合物键能小;d.通常外轨型配合物比内轨型配合物磁矩小。
4.当下列配离子浓度及配体浓度均相等时,体系中Zn 2+离子浓度最小的是( )a.()+243NH Zn ; b.()+22en Zn ;c. ()-24CN Zn d.()-24OH Zn。
5.Fe(Ⅲ)形成配位数为6的外轨型配合物中,Fe 3+离子接受孤对电子的空轨道是( )a.d 2sp 3;b.sp 3d 2;c.p 3d 3d.sd 5 6.下列配离子能在强酸性介质中稳定存在的是( )a.()-3232O S Ag ; b.()+243NH Ni ; c.()-3342O C Fe ; d.-24HgCl 。
7.测得()+363NH Co 的磁矩µ=0.0B· M,可知Co 3+离子采取的杂化类型为( )a.d 2sp 3;b.sp 3d 2;c.sp 3 ;d.dsp 2 8.下列物质具有顺磁性的是( )a.()+23NH Ag ; b.()-46CN Fe ; c.()+243NH Cu ; d.()-24CN Zn9.下列物质中,能作为螯合剂的为( )a.HO-OH ;b.H 2N-NH 2;c.(CH 32)2N-NH 2;d.H 2N-CH 2-CH 2-NH 2。
思考题1. 根据酸碱质子理论,什么是酸?什么是碱?酸碱反应的实质是什么?【答】酸碱质子理论:凡能放出质子(氢离子)的分子或离子都是酸,凡能与质子(氢离子)结合的分子或离子都是碱。
酸碱反应的实质是质子转移反应。
2. 根据酸碱电子理论,什么是酸?什么是碱?酸碱反应的实质是什么?【答】酸碱的电子理论:凡是能给出电子对的分子、离子或原子团都叫做碱,也叫做路易斯碱;凡是能接受电子对的分子、离子或原子团都叫做酸,也叫做路易斯酸。
酸碱反应的实质是配位键的形成并生成酸碱配合物。
3. 说明下列名词的意义:(1) 酸碱共轭对;(2) 两性物质;(3) 溶剂的质子自递反应;(4) 拉平效应和区分效应;(5) 酸的强度和酸度;(6) 稀释定律;(7) 分析浓度和平衡浓度;(8) 分布系数;(9) 质子平衡条件;(10) 同离子效应和盐效应;(11) 化学计量点和滴定终点;(12) 酸碱滴定突跃范围。
【答】(1) 质子酸失去一个质子变为质子碱,质子碱得到一个质子转为酸。
因一个质子的得失而相互转变的每一对酸碱就称为共轭酸碱对(2) 有些酸碱物质,在不同的酸碱共轭酸碱对中,有时是质子酸,有时是质子碱,把这类物质称为酸碱的两性物质。
如:HPO42-、H2PO4-、HS-、H2O等。
(3) 仅仅在溶剂分子之间发生的质子传递作用称为溶剂的质子自递反应,反应的平衡常数称为溶剂的质子自递常数。
(4) 拉平效应:在某溶剂中,不能区分酸性强弱的现象。
区分效应:在某溶剂中,能区分酸性强弱的现象。
(5) 酸的强度:表示给出质子的能力。
酸度:表示溶液中[H+]浓度或[OH-]浓度的大小。
通常以pH 或pOH表示。
(6) 弱电解质的解离度是随着浓度的减小而增大,这一规律就称为稀释定律。
(7) 在酸(或碱)的解离反应式中,当共轭酸碱对处于平衡状态时,溶液中存在着多种酸碱组分,这些组分的浓度称为平衡浓度,以[ ]表示;各组分平衡浓度之和称为分析浓度(或总浓度),通常以c表示。
第八章配位平衡与配位滴定法
一、选择题
1. 关于配合物,下列说法错误的是()
A. 配体是一种可以给出孤对电子或π键电子的离子或分子
B .配位数是指直接同中心离子相结合的配体总数
C. 广义地讲,所有金属离子都可能生成配合物
D. 配离子既可以存在于晶体中,也可以存在于溶液中
2. 关于外轨型与内轨型配合物的区别,下列说法不正确的是()
A. 外轨型配合物中配位原子的电负性比内轨型配合物中配位原子的电负性大
B. 中心离子轨道杂化方式在外轨型配合物是ns、np、nd轨道杂化,内轨型配合物是(n-1)d、ns、np轨道杂化
C. 一般外轨型配合物比内轨型配合物键能小
D. 通常外轨型配合物比内轨型配合物磁矩小
3. 当下列配离子浓度及配体浓度均相等时,体系中Zn2+离浓度最小的是()
A.Zn(NH3)42+ B. Zn(en)22+
C. Zn(CN)42-
D. Zn(OH)42-
4. Fe(Ⅲ)形成配位数为6的外轨型配合物中,Fe3+离子接受孤对电子的空轨道是()
A. d2sp3
B. sp3d2
C. p3d3
D. sd5
5.下列配离子能在强酸性介质中稳定存在的是()
A.Ag(S2O3)23-B.Ni(NH3)42+C.Fe(C2O4)33-D.HgCl42-
6. 测得Co(NH3)63+的磁矩μ=0B.M,可知Co3+离子采取的杂化类型为( )
A.d2sp3
B.sp3d2
C.sp3
D. dsp2
7.下列物质具有顺磁性的是()
A.Ag(NH3) +B.Fe(CN)64-C.Cu(NH3)42+D.Zn(CN)42-
8.下列物质中,能作为螯合剂的为( )
A. HO-OH
B. H2N-NH2
C. (CH3)2N-NH2
D. H2N-CH2-CH2-NH2
9. 在[RhBr2(NH3)4]+中,Rh的氧化数和配位数分别是()
A.+2和4
B.+3和6
C. +2和6
D. +3和4
10.Cu(en)22+的稳定性比Cu(NH3)42+大得多,主要原因是前者()
A. 配体比后者大
B.具有螯合效应
C. 配位数比后者小
D. en的相对分子质量比NH3大
11.下列离子中,形成配合物的能力最强的是()
A. Cu2+
B. Ca2+
C. Zn2+
D. Mg2+
12.下列配体中,配合能力最强的是()
A. NH3
B. H2O
C. Cl-
D. CN-
13.下列物质中,难溶于Na2S2O3溶液,而易溶于KCN溶液的是()
A. AgCl
B. AgI
C. AgBr
D. Ag2S
14.向含有Ag(NH3)2+配离子的溶液中分别加入下列物质时,平衡不向Ag(NH3)2 +离解方向移动的是()
A. 稀HNO3
B. NH3·H2O
C. Na2S
D. KI
15.下列各组盐溶液中加入浓氨水产生沉淀不溶解的是()
A. ZnCl2和AgCl
B. CuSO4和CoSO4
C. Mg(NO3)2和FeCl3
D. Ni(NO3)2和AgCl
16. EDTA与金属离子形成螯合物时,其螯合比一般为
A. 1:1
B. 1:2
C. 1:4
D. 1:6
17. EDTA与金属离子配位时,一分子的EDTA可提供的配位原子个数为
A. 2
B. 4
C. 6
D. 8
18. 在非缓冲溶液中用EDTA滴定金属离子时,溶液的pH将
A. 升高
B. 降低
C. 不变
D. 与金属离子价态有关
19. 下列叙述α[Y(H)]正确的是
A. α[Y(H)]随酸度减小而增大
B. α[Y(H)]随pH增大而减小
C. α[Y(H)]随酸度增大而减小
D. α[Y(H)]与pH变化无关
20. 以铬黑T为指示剂,用EDTA溶液滴定Ca2+、Mg2+总量, 可选择的缓冲溶液为
A. KHC8H4O4-HCl
B. KH2PO4-Na2HPO4
C. NH4Cl-NH3·H2O
D. NaAc-HAc
21. 用EDTA直接滴定有色金属离子,终点时所呈现的颜色是
A. 游离指示剂In的颜色
B. MY的颜色
C. MIn的颜色
D. A和B的混合颜色
22. Fe3+、Al3+对铬黑T有
A.僵化作用
B.氧化作用
C.沉淀作用
D.封闭作用
23. 在配位滴定中,用返滴定法测Al 3+时,以某金属离子标准溶液滴定过量的EDTA ,最适合的金属离子标准溶液是 ( )
A. Mg 2+
B. Zn 2+
C. Ag +
D. Bi 3+
24. 某溶液含Ca 2+、Mg 2+及少量Fe 3+、Al 3+,现加入三乙醇胺,调至pH=10,以铬黑T 为指示剂,用EDTA 滴定,此时测定的是 ( )
A. Mg 2+含量
B. Ca 2+含量
C. Ca 2+、Mg 2+总量
D. Ca 2+、Mg 2+、Fe 3+ 、Al 3+总量
25. 在配位滴定中,金属离子与EDTA 形成的配合物越稳定,K(MY)越大,在滴定时允许pH (仅考虑酸效应)
A. 越低
B. 越高
C. 中性
D. 无法确定
26. 在pH=5.0时,下列0.01 mol·L -1金属离子溶液中,可用EDTA 标准溶液直接准确滴定的是 ( )
A. Mg 2+
B. Mn 2+
C. Ca 2+
D. Zn 2+
27. Co(Ⅲ)的八面体配合物CoClm·nNH 3, 若1mol 配合物与AgNO 3作用生成1molAgCl 沉淀, 则m 和n 的值是 ( )
A. m=1, n=5
B. m=3, n=4
C. m=5, n=1
D. m=4, n=5
二、填充题
1.下列几种配离子:Ag(CN)2-、FeF 63-、Fe(CN)64-、Ni(NH 3)42+属于内轨型的是 。
2.在CuSO 4溶液中加入少量氨水,则溶液中有 色沉淀生成,若加入过量氨水,则沉淀溶解,生成 色 配离子。
3.根据下列配合物的名称,写出它们的化学式。
(1)二(硫代硫酸)合银(Ⅰ)酸钠 。
(2)二氯·一草酸根·一(乙二胺)合铁(Ⅲ) 。
(3)四氯合铂(Ⅱ)酸六氨合铂(Ⅱ) 。
(4)四(异硫氰根)·二氨合钴(Ⅲ)酸铵 。
4.根据Kj θ值,判断标态时下列反应进行的方向。
(1) 2--
244[HgCl ] + 4I []4j HgI Cl K θ--+= (2) 22223434()()j
C u N H Z n Z n N H C u K θ++++++=
5. 在无色溶液A中加入NaCl溶液得到白色沉淀B;B沉淀加氨水得溶液C;C 中加入KBr溶液得淡黄色沉淀D;D溶于Na2S2O3溶液得溶液E; D溶于KCN溶
6. [CoCl2(en)2]的名称是,中心离子是,配体是,配位数是。
7. 在含有酒石酸和KCN的氨性溶液中,用EDTA滴定Pb2+、Zn2+混合溶液中的Pb2+,加入KCN的作用是。
8. Ni(NH3)42+具有顺磁性,则它的几何构型为,杂化类型为;Ni(CN)42-具有反磁性,则它的几何构型为,杂化类型为。