配位平衡和配位滴定法
- 格式:ppt
- 大小:5.07 MB
- 文档页数:42




第9章配位平衡与配位滴定法1.无水CrC13和氨作用能形成两种配合物A和B,组成份别为CrC13·6NH3和CrC13·5NH3。
加入AgNO3,A溶液中几乎全数的氯沉淀为AgC1,而B溶液中只有三分之二的氯沉淀出来。
加入NaOH并加热,两种溶液均无氨味。
试写出这两种配合物的化学式并命名。
解:A [Cr(NH3)6]Cl3三氯化六氨合铬(Ⅲ)B [Cr Cl (NH3)5]Cl2二氯化一氯·五氨合铬(Ⅲ)2.指出下列配合的的中心离子、配体、配位数、配离子电荷数和配合物名称。
K2[HgI4] [CrC12(H2O)4]C1 [Co(NH3)2(en)2](NO3)2Fe3[Fe(CN)6]2K[Co(NO2)4(NH3)2] Fe(CO)5解:3.试用价键理论说明下列配离子的类型、空间构型和磁性。
(1)[CoF6]3-和[Co(CN)6 ]3- (2)[Ni(NH3)4]2+和[Ni(CN)4]2-解:4.将·L-1ZnC12溶液与·L-1NH3溶液等体积混合,求此溶液中[Zn(NH3)4]2+和Zn2+的浓度。
解: Zn 2+ + 4NH 3 = [Zn(NH 3)4]2+ 平衡浓度/mol·L -1 x ×+4x ≈ ≈94342243109230050⨯=⋅==++..x .)NH (c )Zn (c ))NH (Zn (c K f θx =c(Zn 2+)=×10-9mol·L -15.在·L -1[Ag(NH 3)2]+溶液中加入1mL 1mol·L -1NaC1溶液,溶液中NH 3的浓度至少需多大才能阻止AgC1沉淀生成?解: [Ag(NH 3)2]++Cl - = AgCl + 2NH 3 平衡浓度/mol·L -1 c(NH 3)107233210771101111-+-⨯⨯⨯===..K K ))NH (Ag (c )Cl (c )NH (c K sp f j 11073510107711011010050--⋅=⨯⨯⨯⨯=Lmol .....)NH (c6.计算AgC1在·L -1氨水中的溶解度。

第六章 配位滴定法第一节 概 述配位滴定法是以形成配位化合物反应为基础的滴定分析方法。
常用的配位滴定是EDTA 滴定。
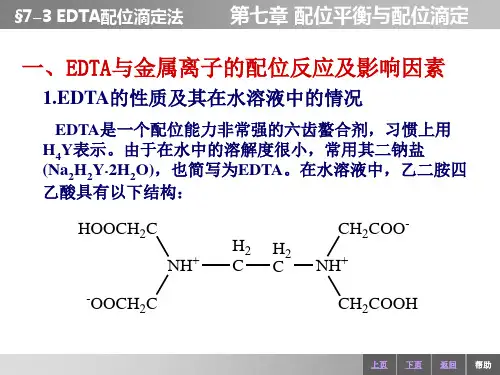
EDTA 全称为乙二胺四乙酸,常用H 4Y 表示,其结构式为H O OCCH 2 CH 2CO O HN -CH 2- CH 2-NH O OCCH 2 CH 2CO O HEDTA 与金属离子能形成螯合物,配位比为1:1。
第二节 基本原理一、配位平衡1. 稳定常数与累积稳定常数金属离子与EDTA 的反应通式为:M + Y = MY K MY = ]][[][Y M MY …… 稳定常数金属与EDTA 配合物的lg K 稳值见表6-1。
金属离子与其他配位剂L 的逐级反应:M + L = ML k 1 = ]][[][L M ML …… 第一级稳定常数ML + L = ML 2 k 2 = ]][[][2L ML ML …… 第二级稳定常数┊ML n -1 + L =ML n k n = ]][[][1L ML ML n n - …… 第n 级稳定常数将逐级稳定常数依次相乘,得各级累积稳定常数ββ1 = k 1 = ]][[][L M ML β2 = k 1⋅ k 2 = 22]][[][L M ML …… βn = k 1⋅ k 2 …… k n =n n L M ML ]][[][ [ML n ] = βn [M] [L]n2. 副反应系数 主反应 M + Y = MYL OH H N H OHML NY M(OH)YML 2 M(OH)2 H 2Y副反应 ┊ ┊ ┊ML n M(OH)n H 6Y配位效应 酸效应 共存离子效应1) 配位剂Y 的副反应系数α Y(1) 酸效应系数α Y(H)在水溶液中,EDTA 有H 6Y 2+、H 5Y +、H 4Y 、H 3Y -、H 2Y 2-、HY 3-和Y 4-等七种存在型体,真正能与金属离子配位的是Y 4-离子。
设[Y]为Y 4-的浓度,[Y ']为未与M 配位的EDTA 各种存在型体的总浓度:α Y(H) = [Y '] / [Y]= ][][][][][][][][4265432234-++----++++++Y Y H Y H Y H Y H Y H HY Y= 3456445635626][][][][1K K K K H K K K H K K H K H ++++++++ 1234566234565][][K K K K K K H K K K K K H ++++α Y(H)为配位剂与H +的副反应系数,由于α Y(H)是 [H +]的函数,故又称为酸效应系数。

第八章 配位平衡与配位滴定法§8-1 配合物教学目的及要求:1.掌握配合物及其组成。
2.掌握配合物命名。
教学重点:配合物命名。
教学难点:配合物命名。
一、配合物及其组成1.中心离子中心离子绝大多数为金属离子特别是过渡金属离子。
2.配体和配位原子配合物中同中心离子直接结合的阴离子或中性分子叫配体,配体中具有孤电子对并与中心离子形成配位键的原子称为配位原子(单基(齿)配体,多基(齿)配体) 3.配位数配合物中直接同中心离子形成配位键的配位原子的总数目称为该中心离子的配位数 配位数=配位体数×齿数 4.配离子的电荷数配离子的电荷等于中心离子和配体电荷的代数和。
[Cu (NH 3)4] SO 4 K 3[Fe(CN)6]↑↑↑↑↑↑↑↑中心离子中心离子配体配体配位数配位数外界内界外界内界配合物配合物二、配合物的命名配离子按下列顺序依次命名:阴离子配体→中性分子配体→“合”→中心离子(用罗马数字标明氧化数)。
氧化数无变化的中心离子可不注明氧化数。
若有几种阴离子配体,命名顺序是:简单离子→复杂离子→有机酸根离子;若有几种中性分子配体,命名顺序是:NH 3→H 2O →有机分子。
各配体的个数用数字一、二、三……写在该种配体名称的前面。
对整个配合物的命名与一般无机化合物的命名相同,称为某化某、某酸某和某某酸等。
由于配离子的组成较复杂,有其特定的命名原则,搞清楚配离子的名称后,再按一般无机酸、碱和盐的命名方法写出配合物的名称。
举例:K 4[Fe(CN)6] 六氰合铁(Ⅱ)酸钾 H[AuCl 4] 四氯合金(Ⅲ)酸[CoCl 2(NH 3)3(H 2O)]Cl 氯化二氯三氨一水合钴(Ⅲ) [PtCl(NO 2)(NH 3)4]CO 3 碳酸一氯一硝基四氨合铂(Ⅳ) [Ni(CO)4] 四羰基合镍§8-2 配离子的配位离解平衡教学目的及要求:1.理解配位平衡常数。
2.掌握配位平衡的移动。

第9章配位平衡与配位滴定法—教学案例案例9.1:铜氨纤维具有会呼吸、清爽、抗静电、悬垂性佳四大功能,其最吸引人的特性为具吸湿、放湿性,属呼吸、清爽的纤维。
铜氨纤维产品的性能近似于丝绸,极具悬垂感。
作为面料它手感柔软,光泽柔和,符合环保服饰潮流,特别适用于与羊毛、合成纤维混纺或纯纺,做高档针织物。
利用铜氨溶液具有溶解纤维的能力,将棉纤维溶解在铜氨溶液中,配成纺丝液,然后从很细的喷丝嘴中将纺丝液喷注于稀酸中,纤维素则以细长且具有蚕丝光泽的细丝从稀酸中沉淀出来,再进行染色、调图等,便得到质地高档、色泽艳丽的铜氨纤维。
问题:(1) 铜氨溶液的主要化学成分是什么?如何制备?(2) 工业上制造人造丝是利用了铜氨溶液的什么性质?案例9.1分析:向硫酸铜溶液中加入过量的氨水,得到的不是氢氧化铜沉淀,而是浅蓝色的碱式硫酸铜沉淀:2CuSO4 + 2NH3ꞏH2O=Cu2(OH)2SO4↓+ (NH4)2SO4若继续加入氨水,碱式硫酸铜沉淀就会溶解,得到亮蓝色的四氨合铜配离子:Cu2(OH)2SO4 + 8NH3=2[Cu(NH3)4]2+ + SO42− + 2OH−铜氨溶液具有溶解纤维的性能,在所得的纤维溶液中再加酸时,纤维又可以沉淀析出。
案例9.2:配位化学是无机化学中发展最快的一个分支,也是众多学科的交叉点,在元素分离和提取、催化领域、工业水处理、染料工业、医药工业、食品工业等有广泛的应用。
顺铂(Cisplatin)是1965年美国科学家罗森伯格(Rosenborg)等人首次发现的,是第一个具有抗癌活性的金属配合物。
顺铂可抑制癌细胞的DNA复制过程,并损伤其细胞膜结构,有较强的广谱抗癌作用。
临床用于卵巢癌、前列腺癌、睾丸癌、肺癌、鼻咽癌、食道癌、恶性淋巴瘤、乳腺癌、头颈部鳞癌、甲状腺癌及成骨肉瘤等多种实体肿瘤,均能显示疗效。
它具有抗癌谱广、作用强、与多种抗肿瘤药有协同作用、且无交叉耐药等特点,为当前联合化疗中最常用的药物之一。

习 题八一、选择题(将正确答案的序号填在括号内) 1.下列配合物中心离子的配位数有错误的是( )a.[Co(NO 2)3(NH 3)3];b.K 2[Fe(CN)5NO];c.[CoCl 2(NH 2)2(en)2];d.[Co(NH 3)4Cl 2]Cl 。
2.关于配合物,下列说法错误的是( )a.配体是一种可以给出孤对电子或π健电子的离子或分子;b.配位数是指直接同中心离子相连的配体总数;c.广义地讲,所有金属离子都可能生成配合物;d.配离子既可以存在于晶体中,也可以存在于溶液中。
3.关于外轨型与内转型配合物的区别,下列说法不正确的是( )a.外轨型配合物中配位原子的电负性比内轨型配合物中配位原子的电负性大;b.中心离子轨道杂化方式在外轨型配合物是ns 、np 、nd 轨道杂化,内轨型配合物是(n-1)d 、ns 、np 轨道杂化;c.一般外轨型配合物比内轨型配合物键能小;d.通常外轨型配合物比内轨型配合物磁矩小。
4.当下列配离子浓度及配体浓度均相等时,体系中Zn 2+离子浓度最小的是( )a.()+243NH Zn ; b.()+22en Zn ;c. ()-24CN Zn d.()-24OH Zn。
5.Fe(Ⅲ)形成配位数为6的外轨型配合物中,Fe 3+离子接受孤对电子的空轨道是( )a.d 2sp 3;b.sp 3d 2;c.p 3d 3d.sd 5 6.下列配离子能在强酸性介质中稳定存在的是( )a.()-3232O S Ag ; b.()+243NH Ni ; c.()-3342O C Fe ; d.-24HgCl 。
7.测得()+363NH Co 的磁矩µ=0.0B· M,可知Co 3+离子采取的杂化类型为( )a.d 2sp 3;b.sp 3d 2;c.sp 3 ;d.dsp 2 8.下列物质具有顺磁性的是( )a.()+23NH Ag ; b.()-46CN Fe ; c.()+243NH Cu ; d.()-24CN Zn9.下列物质中,能作为螯合剂的为( )a.HO-OH ;b.H 2N-NH 2;c.(CH 32)2N-NH 2;d.H 2N-CH 2-CH 2-NH 2。
化学滴定法
滴定分析法,作为一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度,滴定分析可算是实验室中最最常用的定量方法啦!
1、酸碱滴定法
滴定分析法中,酸碱滴定最基本。
中心问题:“酸碱平衡”,本质是酸碱之间的质子传递。
2、配位滴定法
主要是:EDTA的结构、性质、配位平衡、稳定常数、滴定曲线、指示剂的选择及消除干扰的方法。
重点:配位平衡。
在配位滴定中,除主反应外,还有各种副反应干扰主反应的进行,反应条件对配位平衡有很大的影响。
3、氧化还原滴定法
氧化还原滴定法的核心仍然是平衡,是以电子转移为依据的平衡,反应条件对平衡的影响很大。
4、沉淀滴定法
沉淀滴定法的核心是沉淀平衡。
重点是银量法,根据确定终点的方法不同,可分为摩尔法、福尔哈德法、吸附指示剂法。
酸碱、配位、氧化还原、沉淀滴定之联系与区别:
滴定分析的共同特点是在滴定过程中,被测离子浓度呈现出规律性变化。
只要重点掌握酸碱滴定过程中pH值计算,其它几种滴定方法可依相同的思路加以解决。