垂体泌乳素(PRL)测定试剂盒(化学发光免疫分析法)产品技术要求mairui
- 格式:docx
- 大小:16.01 KB
- 文档页数:3

催乳素(PRL)ELISA试剂盒,大鼠ELISA试剂盒催乳素(PRL)ELISA试剂盒,大鼠ELISA试剂盒供应商:上海樊克生物有限公司本试剂仅供研究使用标本:全血催乳素(PRL)ELISA试剂盒,大鼠ELISA试剂盒样品收集、处理及保存方法1、血清-----操作过程中避免任何细胞刺激。
使用不含热原和内毒素的试管。
收集血液后,1000×g离心10分钟将血清和红细胞迅速小心地分离。
2、血浆-----EDTA、柠檬酸盐、肝素血浆可用于。
1000×g离心30分钟去除颗粒。
3、细胞上清液---1000×g离心10分钟去除颗粒和聚合物。
4、保存------如果样品不立即使用,应将其分成小部分-70 ℃保存,避免反复冷冻。
尽可能的不要使用溶血或高血脂血。
如果血清中大量颗粒,前先离心或过滤。
人白细胞抗原ELISA试剂盒技术支持不要在37℃或更高的温度加热解冻。
应在室温下解冻并确保样品均匀地充分解冻。
试剂的准备标准品:标准品的系列稀释应在实验时准备,不能储存。
稀释前将标准品振荡混匀。
2.洗涤缓冲液,50×的稀释:蒸馏水50倍稀释。
操作步骤1.使用前,将所有试剂充分混匀。
不要使液体产生大量的泡沫,以免加样时加入大量的气泡,产生加样上的误差。
2.根据待测样品数量加上标准品的数量决定所需的板条数。
每个标准品和空白孔建议做复孔。
每个样品根据自己的数量来定,能使用复孔的尽量做复孔。
3.加入稀释好后的标准品50ul于反应孔、加入待测样品50ul于反应孔内。
立即加入50ul的生物素标记的抗体。
盖上膜板,轻轻振荡混匀,37℃温育1小时。
4.甩去孔内液体,每孔加满洗涤液,振荡30秒,甩去洗涤液,用吸水纸拍干。
重复此操作3次。
如果用洗板机洗涤,洗涤次数增加一次。
5.每孔加入80ul的亲和链酶素-HRP,轻轻振荡混匀,37℃温育30分钟。
6.甩去孔内液体,每孔加满洗涤液,振荡30秒,甩去洗涤液,用吸水纸拍干。
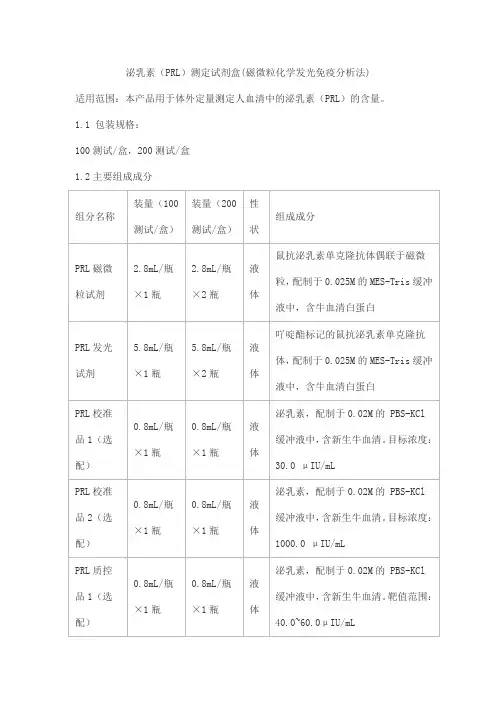
泌乳素(PRL)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:本产品用于体外定量测定人血清中的泌乳素(PRL)的含量。
1.1 包装规格:100测试/盒,200测试/盒1.2主要组成成分注:1.不同批号试剂盒中各组分不可以互换使用。
2. 校准品和质控品具有批特异性,具体浓度见瓶签。
2.1外观试剂盒各组分应齐全、完整,液体无渗漏;磁微粒试剂摇匀后为棕色含固体微粒的均匀悬浊液,无明显凝集;其他液体组分应澄清,无沉淀或絮状物;包装标签应清晰、易识别。
2.2装量各组分装量应不得低于标示体积。
2.3溯源性根据GB/T21415-2008及有关规定,提供试剂盒内校准品的来源、赋值过程以及测量不确定度等内容,溯源至国际标准品(编号:83/573)。
2.4线性在[15.0,3000.0 ]μIU/mL范围内,相关系数r应不低于0.9900。
2.5空白限应不高于7.5 μIU/mL。
2.6准确度在试剂盒规定的剂量-反应曲线范围内检测泌乳素国家或国际标准品(编号:83/573),其测量结果的相对偏差应在±10.0%范围内。
2.7精密度2.7.1 批内精密度在试剂盒的剂量-反应曲线范围内,设置2个不同浓度的质控品,测定结果的变异系数(CV)应不高于8.0%。
2.7.2 批间精密度在三个批次产品之间,在试剂盒的剂量-反应曲线范围内,设置2个不同浓度的质控品,测定结果的变异系数(CV)应不高于15.0%。
2.8质控品的测定值均应在规定的质控范围内。
2.9特异性测定浓度为250 ng/mL的人生长激素(GH)样本,其测定结果应不高于7.5 μIU/mL。
2.10稳定性试剂盒在2~8℃保存,有效期为12个月,有效期结束的前后两个月内,检测试剂盒的外观、装量、线性、空白限、准确度、批内精密度、质控品的测定值,应符合相应的规定。

化学发光免疫类体外诊断试剂(盒)产品技术审评规范(2017版)本规范旨在指导注册申请人对化学发光免疫类体外诊断试剂(盒)产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对化学发光免疫类体外诊断试剂(盒)产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围本规范适用于利用化学发光免疫分析技术对被测物质进行定量检测的第二类体外诊断试剂(包括以微孔板、管、磁颗粒、微珠和塑料珠等为载体的酶促及非酶促化学发光免疫分析测定试剂)的注册技术审查。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号)化学发光免疫类体外诊断试剂(盒)产品分类代号为6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求。
(二)主要原材料研究资料(如需提供)主要原材料(例如各种天然抗原、重组抗原、单克隆抗体、多克隆抗体以及多肽类、激素类等生物原科,辣根过氧化物酶、碱性磷酸酶等标记用酶、磁微粒及其他主要原料)的选择、制备、质量标准及实验验证研究资料;校准品、质控品的原料选择、制备、赋值过程及试验资料;校准品的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。

2. 性能指标
2.1 外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;试剂盒内组分(磁性微球除外)应为澄清的液体,无沉淀、无悬浮物、无絮状物。
2.2 批内精密度
批内变异系数(CV)应≤8%。
2.3 批间精密度
批间变异系数(CV)应≤15%。
2.4 准确度
回收率应在(90.0%~110.0%)范围内。
2.5 空白限
空白限应≤0.020 ng/mL。
2.6 线性
在(0.100~25.0)ng/mL浓度区间内,线性相关性系数(r)绝对值应≥0.9900。
2.7 校准品均一性
校准品均一性(CV)应≤8%。
2.8 质控品测量准确度
质控品1测定结果应在[2.80~5.20] ng/mL范围内,质控品2测定结果应在[11.2~20.8]ng/mL范围内。
2.9 质控品均一性
质控品均一性(CV)应≤8%。
2.10 溯源性
本试剂盒校准品可以溯源至企业内部校准品。
第1页共1页。
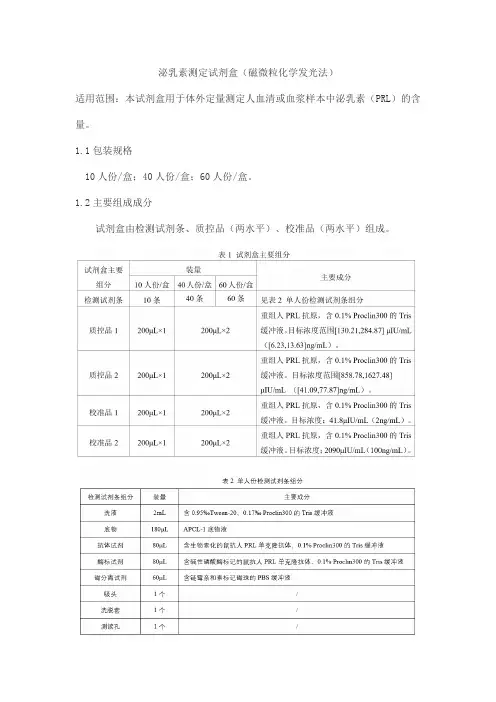
泌乳素测定试剂盒(磁微粒化学发光法)适用范围:本试剂盒用于体外定量测定人血清或血浆样本中泌乳素(PRL)的含量。
1.1包装规格10人份/盒;40人份/盒;60人份/盒。
1.2主要组成成分试剂盒由检测试剂条、质控品(两水平)、校准品(两水平)组成。
2.1外观试剂盒组分应齐全、完整;检测试剂条应无漏液、无破损、无污染;中文包装标签应清晰,易识别。
2.2 校准品溯源性根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至国际标准品98/580。
2.3准确度在试剂盒规定的剂量反应曲线范围内检测泌乳素国家(或国际)标准品98/580,其测量结果的相对偏差应±10%范围内。
2.4空白限:应不高于5.225μIU/mL(0.25ng/mL)。
2.5线性在[10.45,4180] μIU/mL([0.5,200] ng/mL)的线性区间内,相关系数(r)应不低于0.990。
2.6精密度2.6.1批内精密度CV≤8.0%。
2.6.2批间精密度CV≤15.0%。
2.7质控品赋值有效性同一套质控品的测定结果应在本试剂盒规定的范围内。
2.8 特异性测定浓度为200ng/mL的人生长激素(GH)样本,其测定结果应不高于20μIU/mL(0.96ng/mL)。
2.9校准品和质控品瓶间差校准品瓶间差CV≤10%。
质控品瓶间差CV≤10%。
2.10稳定性2.10.1效期稳定性试剂盒2~8℃条件下保存至效期末,检验结果应符合2.1、2.3、2.4、2.5、2.6.1、2.7的要求。
2.10.2 质控品开瓶稳定性质控品开瓶后,在2℃~8℃密封避光保存,在7天后检测质控品批内精密度和质控品测定值,应符合2.6.1和2.7的要求。
2.10.3 校准品开瓶稳定性校准品开瓶后,在2℃~8℃密封避光保存,在7天后检测准确度和线性,应符合2.3和2.5的要求。
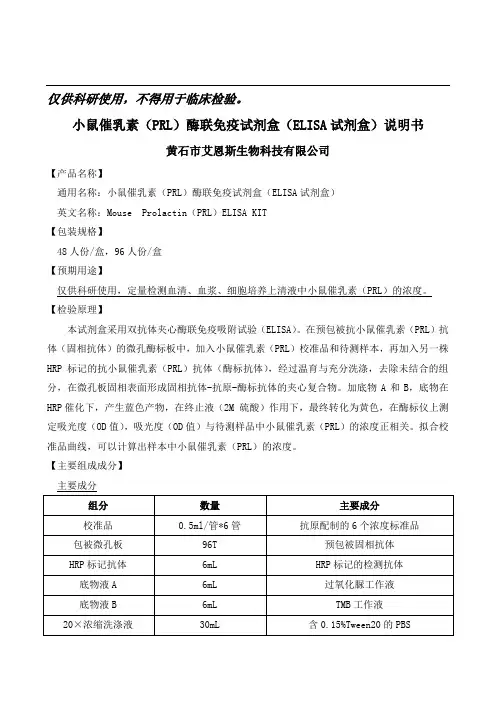
仅供科研使用,不得用于临床检验。
小鼠催乳素(PRL)酶联免疫试剂盒(ELISA试剂盒)说明书黄石市艾恩斯生物科技有限公司【产品名称】通用名称:小鼠催乳素(PRL)酶联免疫试剂盒(ELISA试剂盒)英文名称:Mouse Prolactin(PRL)ELISA KIT【包装规格】48人份/盒,96人份/盒【预期用途】仅供科研使用,定量检测血清、血浆、细胞培养上清液中小鼠催乳素(PRL)的浓度。
【检验原理】本试剂盒采用双抗体夹心酶联免疫吸附试验(ELISA)。
在预包被抗小鼠催乳素(PRL)抗体(固相抗体)的微孔酶标板中,加入小鼠催乳素(PRL)校准品和待测样本,再加入另一株HRP标记的抗小鼠催乳素(PRL)抗体(酶标抗体),经过温育与充分洗涤,去除未结合的组分,在微孔板固相表面形成固相抗体-抗原-酶标抗体的夹心复合物。
加底物A和B,底物在HRP催化下,产生蓝色产物,在终止液(2M 硫酸)作用下,最终转化为黄色,在酶标仪上测定吸光度(OD值),吸光度(OD值)与待测样品中小鼠催乳素(PRL)的浓度正相关。
拟合校准品曲线,可以计算出样本中小鼠催乳素(PRL)的浓度。
【主要组成成分】主要成分校准品检测范围:0.156-10ng/ml。
校准品已经通过测试,结果表明HBs抗原阴性,HIV1、HIV2和HCV抗体阴性,由于不存在一种试验方法能够完全保证没有这些物质,本品必须按照具有潜在的感染性进行处理,处理过程应当遵循通用的安全措施。
需要但未提供的材料及耗材1、酶标仪2、精密移液器及一次性吸头3、蒸馏水4、洗瓶或者自动洗板机5、37℃水浴锅或恒温箱6、500ml量筒7、无粉一次性乳胶手套【储存条件及有效期】1、2-8℃保存,切勿冷冻,有效期6个月。
2、开封使用后,包被微孔板放入带有干燥剂的自封袋中,密闭自封袋,并将全部试剂放回2-8℃冰箱。
3、开封后,按照建议的条件保存,校准品、包被微孔板和HRP标记抗体,有效期为14天,其他成分在标签标明的有效期内是稳定的。
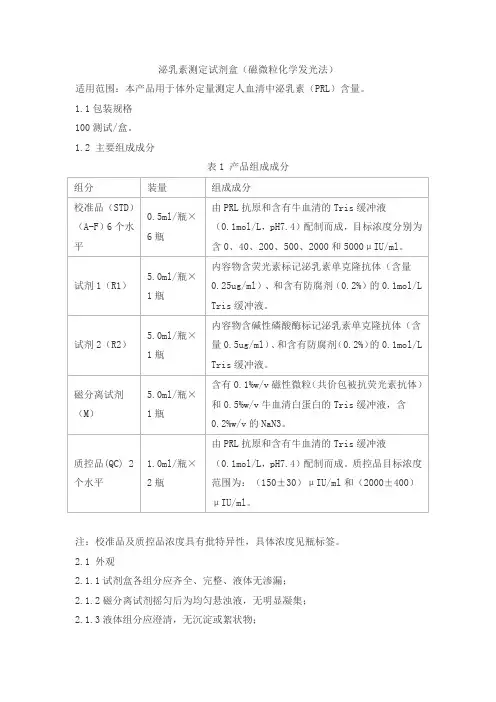
泌乳素测定试剂盒(磁微粒化学发光法)适用范围:本产品用于体外定量测定人血清中泌乳素(PRL)含量。
1.1包装规格100测试/盒。
1.2 主要组成成分表1 产品组成成分注:校准品及质控品浓度具有批特异性,具体浓度见瓶标签。
2.1 外观2.1.1试剂盒各组分应齐全、完整、液体无渗漏;2.1.2磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.1.3液体组分应澄清,无沉淀或絮状物;2.1.4包装标签应清晰,易识别。
2.2净含量不得低于标示体积。
2.3 特异性(交叉反应)试剂盒与表2中有关潜在交叉反应物应无显著的交叉反应。
表2 交叉反应2.4准确度用国际标准品(NIBSC,编号84/500)作为样本进行检测,其测量结果的相对偏差应在±10%范围内。
2.5空白限应不大于5μIU/ml。
2.6线性在[5,5000]μIU/ml的测量范围内,试剂盒的相关系数r应≥0.990。
2.7重复性用(150±30)μIU/ml和(2000±400)μIU/ml的样本各重复检测10次,其变异系数(CV)应不大于10%。
2.8 质控品的赋值有效性试剂盒对质控品的测量值应在质控范围内。
2.9批间差用三个批号试剂盒检测同一份样本,每一批试剂重复检测样本10次,其变异系数(CV)应不大于15%。
2.10效期稳定性该试剂盒有效期为12个月,在有效期满后一个月内的任一天检测试剂盒的准确度,空白限,线性和重复性,应符合2.4~2.7的要求。
2.11 溯源性根据GB/21415-及有关规定提供校准品的来源、赋值过程以及不确定度等内容,校准品溯源至国际标准品(NIBSC,编号84/500)。

2性能指标
2.1外观
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;Ra 组分应为棕色含固体微粒的液体,无板结、无絮状物。
Rb 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2装量
应不少于试剂瓶的标示装量值。
2.3准确度
对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10% 范围内。
2.4最低检测限
应不大于1 pg/mL。
2.5线性
试剂盒在1 pg/mL~2000 pg/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 6%。
2.7批间差
变异系数CV 应≤ 10%。

小鼠催乳素(PRL)酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用检测范围:0.312ng/ml-20ng/ml最低检测限:0.08ng/ml特异性:本试剂盒可同时检测天然或重组的小鼠PRL,且与其他相关蛋白无交叉反应。
有效期:6个月预期应用:ELISA法定量测定小鼠血清、血浆或其它相关生物液体中PRL含量。
说明1.试剂盒保存:-20℃(较长时间不用时);2-8℃(频繁使用时)。
2.浓洗涤液低温保存会有盐析出,稀释时可在水浴中加温助溶。
3.中、英文说明书可能会有不一致之处,请以英文说明书为准。
4.刚开启的酶联板孔中可能会含有少许水样物质,此为正常现象,不会对实验结果造成任何影响。
概述实验原理用纯化的抗体包被微孔板,制成固相载体,往包被抗PRL抗体的微孔中依次加入标本或标准品、生物素化的抗PRL抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。
TMB 在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的PRL呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
试剂盒组成及试剂配制1.酶联板(Assay plate):一块(96孔)。
2.标准品(Standard):2瓶(冻干品)。
3.样品稀释液(Sample Diluent):1×20ml/瓶。
4.生物素标记抗体稀释液(Biotin-antibody Diluent):1×10ml/瓶。
5.辣根过氧化物酶标记亲和素稀释液(HRP-avidin Diluent):1×10ml/瓶。
6.生物素标记抗体(Biotin-antibody):1×120μl/瓶(1:100)7.辣根过氧化物酶标记亲和素(HRP-avidin):1×120μl/瓶(1:100)8.底物溶液(TMB Substrate):1×10ml/瓶。
9.浓洗涤液(Wash Buffer):1×20ml/瓶,使用时每瓶用蒸馏水稀释25倍。


催乳素(PRL)测定试剂盒(化学发光免疫分析法)适用范围:用于体外定量测定人血清中催乳素(PRL)的含量。
1.1 名称及规格
包装规格为96人份/盒。
主要组成成分见表1:
表1 组成
2.1物理性能
试剂盒的各液体组分应澄明,无沉淀或絮状物;
包被抗体微孔板的铝箔袋,应无破损现象。
2.2 准确度
回收率应在90%—110%之间。
2.3 线性
在企业线性范围内[20,1500]mIU/L,线性相关系数应不低于0.9900。
2.4 重复性
分别检测高值和低值两个样本,重复性(CV%)应不高于10.0%.
2.5 批间差
在多个不同批次产品之间,样本测定结果的变异系数(CV)应不高于15.0%。
2.6 空白检测限
试剂盒的空白检测限应不高于10 mIU/L。
2.7 特异性
表2 与LH、FSH、TSH的交叉反应
2.8 稳定性
2℃-8℃保存,有效期12个月,效期后分别检测2.1~2.4、2.6项,其结果应符合各项要求。
2.9溯源性
应根据GB/T 21415-2008提供所用PRL校准品溯源性资料,并溯源企业工作校准品与罗氏PRL试剂盒比对赋值。
2性能指标
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;Ra 组分应为棕色含固体微粒的液体,无板结、无絮状物。
Rb 和Rc 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2装量
应不少于试剂瓶的标示装量值。
2.3准确度
1.3.1将HCG 国家标准品配成两个浓度水平的样品,用待检试剂盒进行检测,其检测结果与标定靶值的相对偏差在±10%范围内。
1.3.2对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10% 范围内。
2.4最低检测限
应不大于0.5 mIU/mL。
2.5线性
试剂盒在0.5 mIU/mL~5000 mIU/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 5%。
2.7批间差
变异系数CV 应≤ 10%。
2.8特异性
测定浓度200 mIU/mL 的LH,测定结果应不高于本试剂盒的最低检测限;
测定浓度200 mIU/mL 的FSH,测定结果应不高于本试剂盒的最低检测限;
测定浓度200 μIU/mL 的TSH,测定结果应不高于本试剂盒的最低检测限。
2.9稳定性
2~8℃避光保存,试剂盒有效期为365 天。
到有效期后90 天内的试剂盒应符合2.1、2.3、2.4、2.5、2.6 的要求。
泌乳素(PRL)测定试剂盒(化学发光免疫分析法)适用范围:用于体外定量测定人血清中泌乳素的浓度。
1.产品型号/规格及其划分说明1.1包装规格96人份/盒、48人份/盒。
1.2产品主要组成成分注:校准品S0~S5靶值:0μIU/mL,50μIU/mL,200μIU/mL,500μIU/mL,1000μIU/mL,2500μIU/mL。
2.性能指标2.1外观所有液体组分应齐全、澄清,无沉淀或絮状物;包被抗体微孔板的真空袋,应无破损漏气现象;包装完好,液体无渗漏;中文包装标签清晰,无磨损。
2.2准确度用国家标准品(编号:150532)为样本检测,其结果相对偏差在±10%。
2.3最低检测限最低检测限应不大于20µIU/mL。
2.4线性在[50,2500]µIU/mL浓度范围内,相关系数(r)绝对值应不小于0.990。
2.5重复性用高低两个浓度的样本,各重复检测10次,变异系数(CV)应不大于12.0%。
2.6批间差用三个批号试剂盒检测同一样本,则三个批号试剂盒之间的批间变异系数(CV)应不大于15.0%。
2.7特异性特异性应符合如下要求:a)含浓度不低于10000mIU/mL的人绒毛膜促性腺激素(HCG)的零浓度PRL样本,检测结果不高于30µIU/mL;b)含浓度不低于200mIU/mL的促卵泡生成激素(FSH)的零浓度PRL样本,检测结果不高于30µIU/mL;c)含浓度不低于200mIU/mL的促黄体生成激素(LH)的零浓度PRL样本,检测结果不高于30µIU/mL;d)含浓度不低于100µIU/mL的促甲状腺激素(TSH)的零浓度PRL样本,检测结果不高于30µIU/mL。
2.8稳定性2℃~8℃放置8个月后,测定结果应符合2.1~2.5各项要求。
2.9校准品溯源性本产品校准品依照GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求进行溯源,可溯源至国家标准品(编号:150532)。
泌乳素(PRL)测定试剂盒(光激化学发光法)适用范围:本试剂盒用于体外定量测定人血清中泌乳素(PRL)的含量。
1.1 规格说明:1. 校准品靶值批特异,详见定值单。
2. 质控品质控范围批特异,详见定值单。
2.1 外观PRL试剂盒组分齐全,内外包装均完整,标签清晰,液体试剂无渗漏。
2.2 空白限试剂盒的空白限应不高于0.94ng/mL(20μIU/mL)。
2.3 线性在[1.42,200]ng/mL([30,4240]μIU/mL)区间内,线性相关系数(r)应不小于0.9900。
2.4 准确度在试剂盒规定的剂量-反应曲线范围内检测泌乳素WHO标准品84/500,其测量结果的相对偏差应在±10.0%范围内。
2.5 精密度2.5.1 批内精密度试剂盒质控品测定结果的变异系数(CV)应不大于8.0%。
2.5.2 批间精密度在3批产品之间,质控品测定结果的变异系数(CV)应不大于15.0%。
2.6 质控品测定值同一套质控品的测定结果应在试剂盒规定的范围内。
2.7 特异性浓度为200ng/mL的人生长激素GH,在本试剂盒上的测定结果应不高于0.94ng/mL (20.0μIU/mL)2.8 稳定性试剂盒在2℃~8℃保存至效期末后3个月内,检验结果应符合2.1、2.2、2.3、2.4、2.5.1、2.6的规定。
2.9 溯源性依据GB/T 21415-2008及有关规定提供所用校准品的来源、赋值过程以及测量不确定度等内容,校准品溯源至WHO国际标准物质(WHO International Standard Prolactin,Human)84/500。
大鼠催乳素(PRL)酶联免疫吸附测定试剂盒使用说明书本试剂盒仅供体外研究使用、不用于临床诊断!预期应用ELISA法定量测定大鼠血清、血浆或其它相关生物液体中催乳素含量。
实验原理用纯化的催乳素抗体包被微孔板,制成固相载体,往微孔中依次加入标本或标准品、生物素化的催乳素抗体、HRP标记的亲和素,经过彻底洗涤后用底物(TMB)显色。
TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的催乳素呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
试剂盒组成及试剂配制1、酶标板:一块(96孔)2、标准品(冻干品):2瓶,请临用前15分钟内配制。
每瓶以样品稀释液稀释至1ml,盖好后室温静置大约10分钟,同时反复颠倒/搓动以助溶解,其浓度为10ng/ml,然后做系列倍比稀释(注:不要直接在板中进行倍比稀释),分别配制成10ng/ml,5ng/ml,2.5ng/ml,1.25ng/ml,0.625ng/ml,0.312ng/ml,0.156ng/ml,样品稀释液直接作为空白孔0ng/ml。
如配制5ng/ml标准品:取0.5ml(不要少于0.5ml)10ng/ml的上述标准品加入含有0.5ml 样品稀释液的Eppendorf管中,混匀即可,其余浓度以此类推。
3、样品稀释液:1×20ml。
4、检测稀释液A:1×10ml。
5、检测稀释液B:1×10ml。
6、检测溶液A:1×120/瓶(1:100)。
临用前以检测稀释液A1:100稀释(如:10检测溶液A/990检测稀释液A),充分混匀,稀释前根据预先计算好的每次实验所需的总量配制(100/孔),实际配制时应多配制0.1-0.2ml。
7、检测溶液B:1×120/瓶(1:100)。
临用前以检测稀释液B1:100稀释。
稀释方法同检测溶液A。
8、底物溶液:1×10ml/瓶。
泌乳素检测试剂(盒)注册技术审查指导原则(征求意见稿)本指导原则旨在指导注册申请人对泌乳素检测试剂(盒)注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则是对泌乳素检测试剂(盒)的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供申请人和审查人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围泌乳素检测试剂(盒)用于体外定量测定人血清或血浆样本中泌乳素(Prolactin,PRL)的浓度。
本指导原则适用于以抗原-抗体反应为基本原理对泌乳素进行定量检测的体外诊断试剂,如化学发光法、酶免疫法或荧光免疫法等,不适用于用胶体金或其他方法标记的半定量测定泌乳素试剂(如试纸条等)。
根据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)和《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号), 泌乳素检测试剂(盒)管理类别为Ⅱ类,分类代号为6840。
本指导原则适用于进行首次注册申报和相关许可事项变更的产品。
二、注册申报材料要求(一)综述资料综述资料主要包括产品预期用途、产品描述、有关生物安全性方面说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《体外诊断试剂注册管理办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求。
相关描述应至少包含如下内容:1.产品预期用途及预期用途相关的临床适应症背景情况泌乳素(PRL)由垂体嗜酸性细胞分泌,由198个氨基酸残基组成,分子量约为22000。
性能指标
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;中文包装标签应清晰,准确、牢固;Ra 试剂应为棕色含固体微粒的液体,无板结、无絮状物;Rb试剂应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2净含量
应符合表2的要求。
表2净含量误差要求
用产品配套的2个浓度的定值校准品作为样本进行检测,检测结果与标定浓度的相对偏差应在
±10%范围内。
2.4最低检测限
应不大于0.47 ng/mLo
2.5线性
试剂盒在0.94 ng/mL-200 ng/mL范围内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV应<10%o
2.7批间差
变异系数CV应<10%0
2.8分析特异性
当样品中甘油三酯浓度<1800mg/dL,胆红素浓度<10mg/dL,血红蛋白浓度<500mg/dL,总蛋白浓度< 10g/dL时测试结果的干扰偏差应在±10%范围内。
当样品中生长激素(GH)浓度<2mlU/mL,总人绒毛膜促性腺激素(HCG )浓度V1000 mIU/mL,促卵泡生成素(FSH )浓度<200 mIU/mL,促甲状腺激素(TSH)浓度M00卩IU/mL, 人胎盘催乳素(PL)浓度<10 pg/mL,促黄体生成素(LH)浓度<200 mIU/mL时,测试结果应工2.0 ng/mLo。