第三章 氧化还原反应 电化学.
- 格式:doc
- 大小:38.50 KB
- 文档页数:6

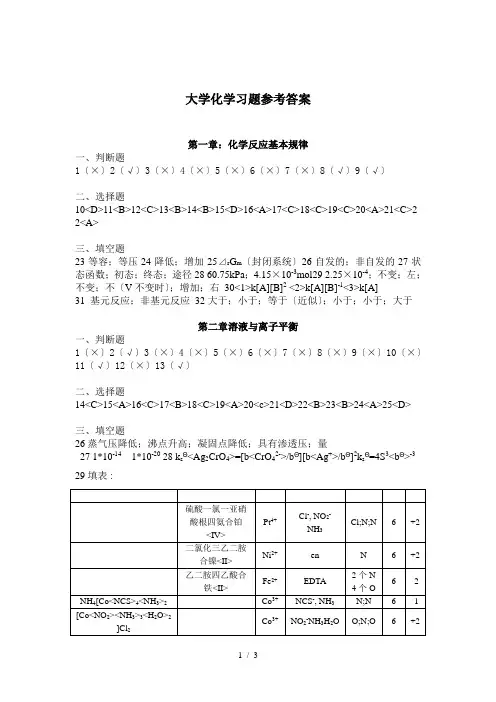
大学化学习题参考答案第一章:化学反应基本规律一、判断题1〔×〕2〔√〕3〔×〕4〔×〕5〔×〕6〔×〕7〔×〕8〔√〕9〔√〕二、选择题10<D>11<B>12<C>13<B>14<B>15<D>16<A>17<C>18<C>19<C>20<A>21<C>2 2<A>三、填空题23等容;等压24降低;增加25⊿r G m〔封闭系统〕26自发的;非自发的27状态函数;初态;终态;途径28 60.75kPa;4.15×10-3mol29 2.25×10-4;不变;左;不变;不〔V不变时〕;增加;右30<1>k[A][B]2 <2>k[A][B]-1<3>k[A]31 基元反应;非基元反应32大于;小于;等于〔近似〕;小于;小于;大于第二章溶液与离子平衡一、判断题1〔×〕2〔√〕3〔×〕4〔×〕5〔×〕6〔×〕7〔×〕8〔×〕9〔×〕10〔×〕11〔√〕12〔×〕13〔√〕二、选择题14<C>15<A>16<C>17<B>18<C>19<A>20<c>21<D>22<B>23<B>24<A>25<D>三、填空题26蒸气压降低;沸点升高;凝固点降低;具有渗透压;量27 1*10-141*10-20 28 k sΘ<Ag2CrO4>=[b<CrO42->/bΘ][b<Ag+>/bΘ]2k sΘ=4S3<bΘ>-3 29填表:30 底浓度往高浓度31. 形成难解离的配离子32HPO42-; HO-; SO42-; [Fe<OH><H2O>5]2+33=<1.0×10-14>/<1.76×10-5>=5.68×10-1034 NH4+、H3PO4、H2S为酸;PO43-、CO32-、CN-、OH-、NO2-为碱;[Fe<OH><H2O>5]2+、HSO3-、HS-、H2PO4-、HPO42-、H2O为两性物质第三章氧化还原反应电化学一、判断题1〔×〕2〔√〕3〔×〕4〔×〕5〔×〕6〔×〕7〔×〕二、选择题8 <A>9<B>10<C>11<A>12<D>13<C>14<B>15<D>16<C>17<C>18<A>三、填空题19 CrO72-; Sn2+20 自发;电子的转移或偏移21 正极的电极电势大于负极的电极电势22 负极23〔-〕Pt Fe3+<b1>,Fe2+<b2> Cl-<b3> Cl2<p> Pt<+> 24 0.797V25 降低;升高26 0.0034V;-2×96485×0.0034=656.098 j mol-1;ln kΘ=<2×96485×0.0034>/<8.314×298.15>=0.2647 kΘ=1.3030 27 Cu-2e=Cu2+; Cu2+ +2e=Cu;4OH- -4e=O2+2H2O; Cu2+ +2e=Cu; Cu-2e=Cu2+; Cu2+ +2e=Cu;29〔注:第四空可能不严密,该电池的负极为Ag涂布AgCl插入Cl-〔如NaCl〕中;正极为Pt涂布I2插入I-〔如NaI〕,根据电极反应,电池反应可以写成I2+2Ag+2Cl-= 2I-+2AgCl,但I-可以借助盐桥进入负极区<Na+也可进入正极区>,因此AgCl将发生沉淀的转化形成AgI,因此最终电池反应应为2Ag+I2 = 2AgI。

氧化还原反应和电化学氧化还原反应和电化学是化学领域中重要的研究方向,它们在生产、能源、环境保护等各个领域都具有重要的应用价值。
本文将从氧化还原反应的基础知识入手,介绍氧化还原反应的定义、特征以及电化学的相关概念和应用。
一、氧化还原反应的基本概念和特征1.1 氧化还原反应的定义氧化还原反应是指化学反应中,电子从一种物质转移到另一种物质的过程。
在氧化还原反应中,发生氧化的物质失去电子,而发生还原的物质则获得电子。
整个过程涉及到电子的转移和能量的释放。
1.2 氧化还原反应的特征氧化还原反应的特征可以总结为以下几个方面:1)电子的转移:氧化还原反应中,电子从一个物质转移到另一个物质,导致物质的氧化或还原。
2)氧化和还原:氧化是指物质失去电子,还原是指物质获得电子。
3)氧化剂和还原剂:氧化剂是指能接受电子的物质,还原剂是指能提供电子的物质。
4)氧化态和还原态:在氧化还原反应中,物质的氧化态和还原态发生变化。
二、电化学的基本概念和应用2.1 电化学的基本概念电化学是研究电能与化学能之间相互转化的学科。
它涉及到电解、电池等重要概念。
2.2 电化学的应用电化学在许多领域都有广泛的应用。
以下是电化学的几个应用方面:1)电解:通过电解,可以将化合物分解为原子或离子,使得某些实验或工业过程得以实现。
2)电池:电化学电池是将化学能转化为电能的装置,广泛应用于电子产品、交通工具等领域。
3)腐蚀和防腐:电化学腐蚀是指金属在电解质中发生的一种化学腐蚀过程,而电化学防腐则是通过电化学方法来保护金属材料。
4)电解池:电解池是用于电解过程的装置,广泛应用于化学实验、电镀、电解精炼等领域。
三、氧化还原反应与电化学的关系氧化还原反应和电化学有着密切的关系。
氧化还原反应中的电子转移过程是电化学研究的基础。
通过电化学的方法,我们可以控制和利用氧化还原反应,实现能量的转化和化学反应的控制。
例如,电化学电池就是通过氧化还原反应来产生电能的装置。

氧化还原反应与电化学氧化还原反应是一种在化学反应中非常重要的类型,它涉及物质的电荷转移和电子流动。
与氧化还原反应密切相关的是电化学,电化学则是研究电荷转移和电流在化学反应中的应用。
本文将探讨氧化还原反应与电化学之间的联系以及它们在现实生活中的应用。
一、氧化还原反应氧化还原反应(简称氧化反应和还原反应)是指物质中原子氧化态和还原态发生变化的过程。
在氧化反应中,物质失去电子并增加氧化态;而在还原反应中,物质获得电子并减少氧化态。
氧化还原反应是一种相互联系的电子流动过程,其中一个物质被氧化,同时另一个物质被还原。
氧化还原反应具有普遍性和广泛性。
它们在自然界和工业生产中都起着非常重要的作用。
例如,许多金属的氧化反应会导致它们产生锈蚀,损失金属的本来特性和价值。
此外,许多生化反应,如呼吸和新陈代谢中产生的能量,也是通过氧化还原反应进行的。
二、电化学基础电化学是研究电荷转移与电流在化学反应中的应用的科学学科。
它探究了氧化还原反应如何与电流和电势相关,并通过控制电流和电势来实现对化学反应的控制和调节。
电化学中的两个重要概念是电解和电池。
电解是一种利用外加电流引起氧化还原反应的过程。
在电解中,阳极发生氧化反应,阴极发生还原反应。
电池是一种将化学能转化为电能的装置,其中氧化还原反应是产生电流的基础。
三、氧化还原反应在电化学中的应用氧化还原反应在电化学中有许多实际应用。
以下是几个常见的例子:1. 腐蚀防护:通过将金属制品镀上一层不易被氧化的物质,例如使用电镀技术将锌镀在铁上,可以防止金属产生氧化反应,减缓腐蚀的速度。
2. 电解水制氢:电解水是一种将水分解为氢气和氧气的反应。
通过将电流通过含水溶液中的两个电极,可以将水分解为氢气和氧气,从而产生可用于能源和化学反应的氢气。
3. 电池技术:电池是一种将化学能转化为电能的设备。
它基于氧化还原反应,通过控制金属离子和氧化物之间的电子传递来产生电流。
电池在我们日常生活中被广泛使用,例如干电池、锂电池和燃料电池。

氧化还原反应的电化学工作原理氧化还原反应是化学中非常重要的一类反应,也被称为电化学反应。
本文将介绍氧化还原反应的电化学工作原理,并探讨其在实践中的应用。
一、电化学反应的基本概念电化学反应是指通过电子的转移,使化学物质发生氧化还原反应的过程。
在电化学反应中,通常涉及两种基本反应:氧化反应和还原反应。
氧化反应是指物质失去电子或氢原子的过程,而还原反应则是物质获得电子或氢原子的过程。
二、氧化还原反应的电极过程电化学反应发生在电化学电池中,其中包括两个电极:阳极和阴极。
阳极通常是氧化反应的发生地,而阴极则是还原反应的发生地。
当外部电源施加到电化学电池上时,电子将从阴极流向阳极,完成氧化还原反应。
三、氧化还原反应的电化学能量转化在氧化还原反应中,电化学能量发生转化。
当反应进行时,化学能转化为电能。
这种转化是通过电流的生成来实现的,电流是由电子的流动产生的。
电化学能量转化也可以反过来进行,即通过外部电源施加电流,使电能转化为化学能。
四、氧化还原反应的应用氧化还原反应在很多领域都有广泛的应用。
以下是一些例子:1. 电镀电镀是一种利用氧化还原反应将金属镀在物体表面的工艺。
通过在电解质溶液中适当选择金属离子和电极材料,可以实现金属的沉积,从而达到防锈、美化或增加导电性能的目的。
2. 燃料电池燃料电池是利用氧化还原反应将化学能转化为电能的装置。
其中最常见的燃料电池是氢燃料电池,其阴极反应是氧气还原为水,阳极反应是氢气氧化为水。
燃料电池具有高效能源转换和无污染排放的特点,被广泛研究和应用于汽车和能源系统。
3. 锂离子电池锂离子电池是一种通过氧化还原反应将化学能转化为电能的储能设备。
锂离子电池广泛应用于手机、笔记本电脑、电动汽车等领域。
在锂离子电池中,锂离子从阴极材料中脱嵌,进入正极材料进行还原反应,同时电子从阴极流向正极,完成电化学反应。
4. 腐蚀防护腐蚀是氧化还原反应的一种负面应用。
金属在潮湿的环境中容易发生氧化反应(腐蚀),导致金属的破坏和失效。

氧化还原反应与电化学氧化还原反应和电化学是化学学科中两个重要的概念。
氧化还原反应是指化学物质之间电子的转移过程,是化学反应的一种基本类型。
而电化学研究的是电能与化学能之间的相互转化关系,通过电化学实验可以对化学反应进行研究和控制。
本文将详细介绍氧化还原反应和电化学的基本概念、原理与应用。
一、氧化还原反应氧化还原反应是电子转移过程的化学反应。
在氧化还原反应中,物质可以失去电子(被氧化)或者获得电子(被还原)。
氧化还原反应可以用电子的流动来描述,在反应过程中产生电流。
氧化还原反应的关键参数是氧化剂和还原剂。
氧化剂是指可以接受电子的物质,它在反应中发生还原。
还原剂是指可以给予电子的物质,它在反应中发生氧化。
氧化还原反应的基本表达式是:氧化剂 + 还原剂→ 还原剂 + 氧化剂氧化还原反应对于生命的存在和能量交换起着重要作用。
例如,细胞呼吸过程中发生的有机物的氧化就是一个氧化还原反应。
此外,氧化还原反应还广泛应用于电池、金属腐蚀以及化学合成等领域。
二、电化学的基本概念与原理电化学研究的是电能和化学能之间的相互转化关系。
它研究了电解过程、电池的工作原理、电化学平衡等内容。
电化学反应是指利用电流来引发的化学反应。
电解池是进行电化学反应的装置,它由阳极、阴极和电解质溶液组成。
在电解过程中,阳极发生氧化反应,阴极发生还原反应。
电化学反应的基本原理是法拉第定律和电极电势。
法拉第定律描述了通过电解质溶液的电流与产生的化学反应之间的关系。
电极电势是反应进行的动力学参数,它可以通过电位差和电子传递速率来描述。
电化学还包括电化学平衡和电化学动力学。
电化学平衡是指电解过程中正反应和逆反应达到动态平衡的状态。
电化学动力学研究的是电化学反应速率与外部电势、浓度和温度等因素之间的关系。
三、氧化还原反应与电化学的应用氧化还原反应和电化学在生活和工业中有广泛的应用价值。
其中最常见的应用是电池。
电池是将化学能转化为电能的装置,包括干电池、蓄电池和燃料电池等。

电化学中的氧化还原氧化还原反应是电化学中的重要概念,也是许多电化学过程的基础。
在电化学中,氧化还原反应是指物质失去电子的过程称为氧化,而物质获得电子的过程称为还原。
这种反应涉及电子的转移,因此也被称为电子转移反应。
氧化还原反应在电化学中具有广泛的应用,包括电池、电解、电镀等领域。
本文将介绍电化学中的氧化还原反应的基本概念、原理和应用。
1. 氧化还原反应的基本概念氧化还原反应是指物质中电子的转移过程。
在氧化还原反应中,发生氧化的物质失去电子,而发生还原的物质获得电子。
氧化还原反应可以用化学方程式表示,其中氧化反应和还原反应分别写在方程式的左右两侧,通过电子的转移实现物质的氧化和还原。
在氧化还原反应中,氧化剂是指能够接受电子的物质,而还原剂是指能够给出电子的物质。
氧化还原反应中的电子转移过程是通过电子传导体实现的。
在电化学中,常用的电子传导体包括金属导体、电解质溶液和离子传导体等。
通过这些电子传导体,氧化还原反应中的电子可以在物质之间传递,实现物质的氧化和还原。
2. 氧化还原反应的原理氧化还原反应的原理基于物质中电子的转移过程。
在氧化还原反应中,发生氧化的物质失去电子,而发生还原的物质获得电子。
这种电子的转移过程导致物质的化学性质发生变化,从而实现氧化还原反应。
在氧化还原反应中,氧化剂接受电子,而还原剂给出电子,通过这种电子的转移实现物质的氧化和还原。
氧化还原反应的原理还涉及电子传导体的作用。
在氧化还原反应中,电子传导体起着至关重要的作用,它们提供了电子传递的通道,使得氧化还原反应能够顺利进行。
不同的电子传导体对氧化还原反应的速率和效率都会产生影响,因此在设计和优化氧化还原反应过程时需要考虑电子传导体的选择和性能。
3. 氧化还原反应的应用氧化还原反应在电化学中具有广泛的应用。
其中最常见的应用之一是电池。
电池是利用氧化还原反应产生电能的装置,通过氧化剂和还原剂之间的氧化还原反应释放出电子,从而产生电流。

第3章氧化还原反应电化学3.1 本章小结3.1.1. 基本要求(包括重点和难点)第一节氧化数的概念第二节电极反应、电池符号、电极类型电动势、电极电势(平衡电势)、标准电极电势能斯特方程、离子浓度及介质酸碱性改变对电极电势的影响及计算原电池电动势与吉布斯函数变的关系利用电极电势判断原电池的正负极、计算电动势、比较氧化剂与还原剂的相对强弱氧化还原反应方向的判据计算氧化还原反应的平衡常数并判断氧化还原反应进行的程度第三节分解电压(理论分解电压、实际分解电压、超电压)电解产物(盐类水溶液电解产物)第四节金属的腐蚀:化学腐蚀、电化学腐蚀(析氢腐蚀、吸氧腐蚀)金属腐蚀的防止3.1.2. 基本概念第一节氧化与还原: 对于一个氧化还原反应,得到电子的物质叫做氧化剂,失去电子的物质叫做还原剂。
氧化剂从还原剂中获得电子,使自身氧化数降低,这个过程叫做还原;还原剂由于给出电子而使自身氧化数升高,这个过程叫做氧化。
还原剂失去电子后呈现的元素的高价态称为氧化态,氧化剂获得电子后呈现的元素的低价态称为还原态。
氧化数: 指化合物分子中某元素的形式荷电数,可假设把每个键中的电子指定给电负性较大的原子而求得。
氧化数的计算遵循以下规律:(1)单质氧化数为0(2)简单离子的氧化数等于该离子所带的电荷数(3)碱金属和碱土金属在化合物中的氧化数分别为+1、+2(4) 氢在化合物中氧化数一般为+1,在活泼金属氢化物中的氧化数为-1。
(5) 化合物中氧的氧化数一般为-2,但在过氧化物中,其氧化数为-1,在超氧化物中为-21,在氧的氟化物OF 2和O 2F 2中氧化数分别为+2和+1。
(6) 在所有的氟化物中,氟的氧化数为-1(7) 在多原子分子中,各元素氧化数的代数和为0,多原子离子中,各元素的氧化数的代数和等于离子所带的电荷数;在配离子中,各元素氧化数的代数和等于该配离子的电荷第二节原电池(电池符号) 利用氧化还原反应产生电流,使化学能转变为电能的装置叫做原电池。

氧化还原反应中的电化学氧化还原反应是化学反应中非常重要的一类反应,其中电化学是研究和应用氧化还原反应的重要分支。
本文将重点探讨氧化还原反应中的电化学原理、应用以及相关实验技术。
一、电化学基础电化学是研究电荷传递和电流的性质与变化的学科,它与化学反应密切相关。
氧化还原反应中的电化学可以通过观察和控制电子的转移和离子的迁移来实现。
在电化学中,通过两个电极之间的电子流和离子流来实现电荷转移。
在氧化还原反应中,氧化剂接受电子并发生还原,而还原剂失去电子并发生氧化。
这个过程中,氧化剂和还原剂通过电子的转移,来传递电荷并发生化学反应。
这一过程可以通过电池或电解槽实现。
二、电化学反应类型根据氧化还原反应的不同特点,电化学反应可以分为两种类型:电解和电池。
1. 电解反应电解是通过外加电流来促使非自发性反应发生的过程。
在电解过程中,通过外部电源提供电流,使得化学反应在电解槽中发生。
这种电化学反应对于一些化学分析、合成和电镀等领域非常重要。
2. 电池反应电池是将化学反应中释放的化学能转化为电能的装置。
电池反应是自发性的反应,可以通过将氧化剂和还原剂分离并通过导线连接来产生电流。
根据电池反应类型的不同,电池可以分为原电池和电解池。
原电池内部的反应是自发的,产生电能;而电解池通过外部电源来推动非自发的电化学反应。
三、电化学实验技术在研究和应用氧化还原反应中的电化学,各种实验技术被广泛应用。
1. 极化曲线极化曲线是评估电化学电极性能的重要实验技术。
通过测量电极在不同电位下的电流和电势,可以得到极化曲线。
这些曲线提供了有关于电极在特定条件下的电流传输和反应速率等信息。
2. 循环伏安技术循环伏安技术是一种用于研究电化学反应和材料表征的常用实验方法。
通过变化电极电位来研究反应机理、动力学和电化学性能等方面的信息。
3. 电动势测量电动势测量是用于评估电化学反应的重要实验技术。
电动势测量可以帮助我们了解反应的热力学特征,包括电动势的大小和反应的方向。

氧化还原反应与电化学氧化还原反应(简称氧化反应或还原反应)是化学反应的一种重要类型,也是电化学研究的基础。
电化学研究了物质在电场和电流的作用下的性质和变化规律,将电能与化学变化联系起来。
本文将着重介绍氧化还原反应与电化学之间的关系,探讨电流与氧化还原反应的本质联系,以及电化学在实际应用中的重要性。
1. 氧化还原反应的基本概念和原理氧化还原反应是指物质中的原子、离子或分子失去电子的过程为氧化反应,而得到电子的过程称为还原反应。
在氧化还原反应中,存在着氧化剂和还原剂两个参与物质,氧化剂接受电子,还原剂失去电子。
这一过程可以用化学方程式表示,例如:2Na + Cl2 → 2NaCl。
在这个反应中,钠(Na)失去了电子,发生了氧化反应;氯气(Cl2)接受了钠的电子,发生了还原反应。
2. 电流与氧化还原反应的联系氧化还原反应离不开电流的存在。
电流是指电荷在单位时间内通过导体横截面的量,其方向由正电荷流动的方向确定。
在氧化还原反应中,氧化剂接受电子,必须有电子从还原剂中流向氧化剂,才能维持反应的进行。
这个电子的流动过程形成了电流。
因此,可以说氧化还原反应是电流流动的结果,电流的存在促使了氧化还原反应的进行。
3. 电化学的研究内容电化学研究了物质在电场和电流的作用下的性质和变化规律。
其研究内容主要包括三个方面:电解学、电池学和电化学分析。
(1)电解学:电解学研究了物质在电解过程中的行为和特性。
电解是指将电能转化为化学能的过程,通过电解可以将化合物分解成对应的离子,或将离子还原为相应的化合物。
例如,通过电解水可以将水分解为氢气和氧气。
(2)电池学:电池学研究了电化学电池的工作原理和特性。
电化学电池是指利用氧化还原反应转化化学能为电能的装置。
电池由正极、负极和电解质组成,正极发生氧化反应,负极发生还原反应,通过电路和外部载荷与电解质之间的电子流动将化学能转化为电能。
(3)电化学分析:电化学分析是利用氧化还原反应进行分析的一种方法。

氧化还原反应和电化学氧化还原反应(简称“氧化还原反应”)是化学反应中一种非常重要的类型。
在氧化还原反应中,物质的电荷状态发生变化,原子失去或获得电子,从而形成离子,以完成化学反应。
电化学则是研究电能与化学能之间转化的学科。
一、氧化还原反应1. 概念和基本原理氧化还原反应是指在化学反应中,原子、离子或分子中的电子的互相转移过程。
氧化是指物质失去电子,而还原则是指物质获得电子。
在氧化还原反应中,存在着氧化剂和还原剂的概念。
氧化剂接受电子,自身被还原,而还原剂则失去电子,自身被氧化。
2. 氧化还原反应的应用氧化还原反应广泛应用于生活和工业领域。
例如,在电池中,氧化还原反应产生电能;在腐蚀过程中,金属发生氧化还原反应,导致金属的破坏;在生物体内,呼吸作用中的氧化还原反应产生能量。
二、电化学1. 电化学基本概念电化学是研究电能与化学能之间相互转化的学科。
它涉及到电解、电极反应、电池和电解质溶液等概念。
电化学通常分为两个分支:电解学和电池学。
2. 电化学实验电化学实验是研究电化学现象的重要手段。
在实验中,常见的电化学装置包括电解槽、电极、电解质溶液等。
通过实验可以观察到电流的流动和电极上发生的反应,从而揭示电化学过程的本质。
三、氧化还原反应与电化学的联系氧化还原反应与电化学紧密相关。
在电池中,氧化还原反应产生电能,而在电解槽中,电能则用于促使氧化还原反应发生。
此外,电极反应是电化学研究的重点之一,它涉及到氧化还原反应中电子的转移过程。
结论氧化还原反应是化学反应中重要的类型,通过氧化和还原的相互转化,实现能量的转化。
电化学则是研究电能与化学能之间相互转化的学科,它与氧化还原反应密切相关。
两者的研究和应用对于能源、环保等领域具有重要意义。
通过深入理解氧化还原反应和电化学,我们可以更好地应用于实际生活和工业中,促进科学技术的发展和进步。
这篇文章介绍了氧化还原反应和电化学的基本概念、原理和应用,并强调了两者之间的联系。
氧化还原反应和电化学氧化还原反应是化学反应中常见的一种反应类型,也是电化学研究的基础。
它涉及到物质的电子转移过程,包括氧化和还原两个半反应。
在氧化还原反应中,物质会失去或者获得电子,产生不同的氧化态。
本文将介绍氧化还原反应的基本概念及其在电化学中的应用。
一、氧化还原反应的概念氧化还原反应是指物质中的原子或离子发生电子转移的过程。
在氧化还原反应中,一个物质被氧化,失去电子,而另一个物质被还原,获得电子。
氧化还原反应的关键是电子的转移,可以通过半反应来描述。
在一个氧化还原反应中,通常会有氧化剂和还原剂。
氧化剂是指能够接受电子的物质,它在反应中被还原。
还原剂是指能够捐赠电子的物质,它在反应中被氧化。
氧化还原反应中,物质的氧化态会发生改变。
原子或离子失去电子后,氧化态变大;反之,获得电子后,氧化态变小。
氧化态的改变可以通过氧化数的变化来表示。
二、电化学中的氧化还原反应电化学是研究电与化学反应相互关系的学科。
氧化还原反应在电化学中具有重要的意义,电解和电池就是基于氧化还原反应而发展起来的。
1. 电解电解是指在外加电势的作用下,使溶液中发生氧化还原反应的过程。
在电解中,通过外加电势提供能量,促使物质发生电子转移。
正极受电子,发生还原反应;负极释放电子,发生氧化反应。
电解可以将电能转化为化学能,促使化学反应进行。
电解的应用十分广泛,例如铜的电镀、水的电解等。
2. 电池电池是将化学能转换为电能的装置,它利用氧化还原反应来产生电流。
电池由两个半电池组成,分别是氧化半反应和还原半反应。
在电池中,氧化半反应发生在负极(阴极),还原半反应发生在正极(阳极)。
通过电解质溶液或离子传导体,电子会从负极流向正极,形成电流。
电池的种类有很多,例如干电池、蓄电池、燃料电池等。
它们都利用氧化还原反应的电子转移特性来产生电流,满足人们对电能的需求。
三、电化学的应用电化学在生活和工业中有着广泛的应用,涉及到电解、电池、电镀等领域。
1. 电解用于金属提取和电解制氢电解在金属提取中起着重要的作用,例如铝的电解、锌的电解等。
氧化还原反应与电化学反应氧化还原反应(简称氧化反应或还原反应)和电化学反应是化学领域中重要的两个概念。
尽管它们在某些方面存在联系,但实际上是两个独立的概念,具有不同的定义和特点。
本文将探讨氧化还原反应和电化学反应的概念、区别以及在实际应用中的重要性。
一、氧化还原反应氧化还原反应是指化学反应中物质的氧化态和还原态之间的转变。
在氧化还原反应中,某一物质被氧化,即失去电子,同时另一物质被还原,即获得电子。
典型的氧化还原反应可以表示为以下形式:氧化剂 + 还原剂→ 氧化产物 + 还原产物其中,氧化剂是指能够接受电子的物质,而还原剂是指能够提供电子的物质。
氧化剂在反应中被还原,还原剂在反应中被氧化。
这种电子的转移过程是氧化还原反应的核心。
例如,常见的金属与酸反应产生金属盐和氢气的反应就是典型的氧化还原反应。
在这个反应中,金属被酸氧化失去电子,而酸则被金属还原获得电子。
这种反应过程不仅仅发生在化学实验室中,还存在于自然界的许多过程中,如腐蚀、燃烧等。
二、电化学反应电化学反应是指化学反应中涉及电子转移的反应。
与氧化还原反应类似,电化学反应也涉及物质的氧化态和还原态的转变。
然而,电化学反应更加注重反应过程中的电流和电势差。
电化学反应可以通过电解或电池(包括电解池和电池)进行。
在电解中,外加电势通过电解质中的离子传递,导致氧化还原反应发生。
在电池中,氧化还原反应会产生电流,从而进行能量转换和电化学合成。
电化学反应在许多实际应用中发挥着重要作用。
例如,电解法是一种常用的工业制备金属的方法。
充电电池则是一种广泛使用的能量储存设备。
在电化学反应中,电流和电势差是关键参数,影响反应速率和反应的方向。
三、氧化还原反应与电化学反应的区别尽管氧化还原反应和电化学反应都涉及到物质的氧化态和还原态的转变,但它们在定义、特点和应用方面存在着一些区别。
首先,氧化还原反应是一个广义的概念,而电化学反应则是其中的一种特殊情况。
氧化还原反应可以发生在气相、液相或固相中,而电化学反应通常发生在电解质溶液中。
化学氧化还原反应与电化学反应化学氧化还原反应与电化学反应是化学领域中两个重要的研究方向。
两者都涉及原子或分子的电子转移过程,但相应的反应机制和应用领域有所不同。
本文将从基本概念、反应机制和应用领域等方面对这两种反应进行分析和比较。
一、基本概念1.化学氧化还原反应化学氧化还原反应是指物质中的原子或分子通过转移电子而产生的化学反应。
在氧化还原反应中,发生氧化反应的物质叫做还原剂,接受电子的物质叫做氧化剂。
氧化还原反应可以通过氧化态的变化来判断。
还原剂的氧化态在反应前较高,在反应后较低;氧化剂的氧化态在反应前较低,在反应后较高。
2.电化学反应电化学反应是指以电解质溶液或电解质固体为介质,通过电流传递来引起的化学反应。
在电化学反应中,正极吸收电子,发生氧化反应,称为氧化反应;负极放出电子,发生还原反应,称为还原反应。
电化学反应可以分为两类,即电解反应和电池反应。
电解反应是通过外加电压将化学物质分解成离子,而电池反应则是通过电催化反应产生电流。
二、反应机制1.化学氧化还原反应机制化学氧化还原反应的机制与反应物之间的电子转移有关。
还原剂从反应物中吸收电子,氧化剂则释放电子给反应物。
在反应过程中,发生氧化反应的物质将电子从其他物质转移给自身,形成较低的氧化态;而发生还原反应的物质则将电子给予其他物质,形成较高的氧化态。
2.电化学反应机制电化学反应的机制与电解质溶液中离子的运动和电子的传递有关。
正极的氧化反应是在电流作用下离子接受电子的过程,负极的还原反应是在电流作用下离子失去电子的过程。
当两极之间的电压足够大时,离子会从正极移动到负极,而在此过程中发生氧化还原反应。
三、应用领域1.化学氧化还原反应的应用化学氧化还原反应在许多化学领域中广泛应用。
例如,在有机合成中,氧化还原反应可以用于生成新的化合物或改变化合物的结构;在环境保护中,氧化还原反应可以用于废水处理和空气净化;在能源领域,氧化还原反应可以用于燃料电池和太阳能电池的电化学反应。
氧化还原反应与电化学氧化还原反应是化学反应中最为重要的一类反应,广泛应用于能源转换、电化学储能、化学合成等各个领域。
同时,了解和掌握氧化还原反应的原理和机制,对于深入理解和应用化学知识也至关重要。
本文将探讨氧化还原反应与电化学的关系,为读者提供相关的知识和应用实例。
一、氧化还原反应的基本概念氧化还原反应是指在化学反应中,电子从一种物质转移给另一种物质的过程。
其中,电子的失去被称为氧化反应,而电子的获得则被称为还原反应。
以氧元素为例,当氧元素接受电子时,它发生了还原反应;当氧元素失去电子时,它发生了氧化反应。
氧化还原反应中,电子在物质间的传递起到了关键的作用。
二、氧化还原反应的主要类型1. 单质氧化还原反应单质氧化还原反应是指单质物质发生氧化还原反应,如金属与非金属的反应。
例如,铁与氧发生氧化反应生成铁的氧化物。
2. 非金属元素与金属元素的氧化还原反应非金属元素与金属元素之间的氧化还原反应在生活中经常发生,比如酸与碱的中和反应。
例如,盐酸与氢氧化钠反应生成氯化钠和水。
3. 氧化剂与还原剂的氧化还原反应氧化剂是指能够与其他物质发生氧化反应的物质,它们能够接受电子。
相反,还原剂则是指能够与其他物质发生还原反应的物质,它们能够失去电子。
三、电化学的基本原理电化学是研究电能与化学反应之间相互转化的科学。
在电化学中,氧化还原反应是不可或缺的一部分。
电化学反应可以分为两类:电解和电池。
电解是指利用外加电源的电能将化学反应进行反向的反应,而电池则是将化学反应能量转化为电能的装置。
四、氧化还原反应与电化学的关系1. 电化学储能电化学储能是指将化学能转化为电能并进行储存的过程。
常见的储能装置包括电池和超级电容器。
在电池中,氧化还原反应是通过将化学能转化为电能的方式进行的。
例如,锌-铜电池中,锌发生氧化反应,铜离子接受电子发生还原反应,电能通过外部电路传递。
2. 电解过程电解是指利用外加电源的电能将化学反应进行反向的反应。
第三章 氧化还原反应 电化学1. 下列属于电极的是( )A 、H +/H 2B 、H 2|H +C 、Pt|Fe 3+,Fe 2+D 、Pt | Cl 2|Cl -||Zn 2+|Zn 中的Zn 和Pt2.将氧化还原反应 Fe + Hg 2Cl 2 = FeCl 2 + 2Hg 装配成原电池写出其 电池符号: ( )。
3.测量KMnO 4水溶液在碱性,中性,酸性介质中的氧化能力以在 酸 性介质中( ),因为在酸性介质中的电极电势( )。
4.下列表达式中正确的是( )。
A 、Ln K θ= V zE 0592.0θB 、lg K θ=V zE 0592.0 C 、lg K θ= V zE 0592.0θ D 、Ln K θ=V zE 0592.05. 由公式lgK Ө= 可见,溶液中氧化还原反应的平衡常数 K Ө( )。
A 、与浓度无关B 、与浓度有关C 、与反应书写有关D 、与反应书写无关6.已知 E Ө(I 2/I -)=0.53V , E Ө(Fe 3+/Fe 2+)=0.77V反应 I -+Fe 3+→1I 2+Fe 2+ 的E Ө及反应方向为( )。
A 、0.24V 正向B 、0.24V 逆向C 、1.30V 正向D 、-1.30V 逆向7.金属与水反应时,金属的E Ө值须小于 ( )。
A :-0.83V ;B :-0.413V ;C :0 V ;8.金属与碱反应的必要条件有 ( )A 、E Ө[M(OH)n /M]<-0.83V;B 、 E Ө(M n+/M) <-0.413VC 、金属具有两性;D 、E Ө(M n+/M) < 0 V9.O 2+2H 2O+4e→4OH -, 其E Ө=0.401V ;1O 2+H 2O+2e→2OH - E Ө= 0.401V ,相同。
这是因为E Ө是由物质的( )决定的,( )而变化。
VzE 0592.0θ10.对反应4Al+3O2+6H2O=4Al(OH)3来说,Δr GӨ=- z EӨF中的z应等于()。
第三章氧化还原反应电化学
1. 下列属于电极的是()
A、H+/H2
B、H2|H+
C、Pt|Fe3+,Fe2+
D、Pt | Cl
2
|Cl-||Zn2+|Zn中的Zn和Pt 2.将氧化还原反应Fe+ Hg2Cl2= FeCl2+ 2Hg装配成原电池写出其电池符号: ()。
3.测量KMnO4水溶液在碱性,中性,酸性介质中的氧化能力以在酸性介质中(),因为在酸性介质中的电极电势()。
4.下列表达式中正确的是()。
A、Ln Kθ=
V zE 0592
.0θ
B、lg Kθ=
V
zE
0592
.0
C、lg Kθ=
V
zE
0592
.0
θ
D、Ln Kθ=
V
zE
0592
.0
5.由公式lgKӨ= 可见,溶液中氧化还原反应的平衡常数KӨ()。
A、与浓度无关
B、与浓度有关
C、与反应书写有关
D、与反应书写无关
6.已知 E Ө(I2/I-)=0.53V,EӨ(Fe3+/Fe2+)=0.77V
反应I-+Fe3+→1I2+Fe2+ 的EӨ及反应方向为()。
A、0.24V正向
B、0.24V逆向
C、1.30V正向
D、-1.30V逆向
7.金属与水反应时,金属的EӨ值须小于()。
A:-0.83V;B:-0.413V;C:0 V;
8.金属与碱反应的必要条件有( )
A、EӨ[M(OH)n/M]<-0.83V;
B、EӨ(M n+/M) <-0.413V
C、金属具有两性;
D、EӨ(M n+/M) < 0 V
9.O2+2H2O+4e→4OH-,其EӨ=0.401V;
1O
2+H
2
O+2e→2OH-EӨ= 0.401V,
相同。
这是因为EӨ是由物质的()决定的,()而变化。
10.对反应4Al+3O2+6H2O=4Al(OH)3来说,Δr GӨ=- z EӨF中的z应等于()。
A、 3
B、12
C、
6 D、24
11.已知下列反应均按正反应方向进行。
2FeCl
3 + SnCl
2
= SnCl
4
+ 2FeCl
2
2KMnO
4+10FeSO
4
+8H
2
SO
4
= 2MnSO
4
+5Fe
2
(SO
4
)
3
+K
2
SO
4
+8H
2
O
上述两个反应中几个氧化还原电对的电极电势的相对大小从大到小的排列顺序是()
A、EӨ(MnO4-/Mn2+)> EӨ(Fe3+/Fe2+) > EӨ(Sn4+/Sn2+)
B、EӨ(Fe3+/Fe2+) > EӨ(MnO4-/Mn2+)> EӨ(Sn4+/Sn2+)
C、EӨ(Sn4+/Sn2+) > EӨ(MnO4-/Mn2+)> EӨ(Fe3+/Fe2+)
12.改变电极反应式中计量数的倍数后,其电极电势的数值也将随之改变,正确与否?( )。
13.Zn的浓差电池符号为
(-)Zn|Zn2+(1.0mol.kg-1)|| Zn2+(0.001mol.kg-1) |Zn (+)
判断正确与否?( ) 。
14.金属表面因氧气分布不均匀而被腐蚀,这种腐蚀称为差异充气腐蚀,此时金属溶解处是()
A、在氧气浓度较大的部位;
B、在氧气浓度较小的部位
C、在凡有氧气的部位。
15.Zn片上滴加几滴NaCl溶液,过一段时间后,再滴加酚酞,则会出现NaCl溶液周围变红,溶液内部产生白色沉淀。
利用电化学腐蚀原理解释这一现象。
16.插入泥土中的铁棒作腐蚀电极的()。
17.在KMnO4溶液中加入稀H2SO4,振荡后,再加入Na2SO3溶液,充分振荡后,溶液的颜色变为(),其离子方程式:
18.铁棒在稀HCl中加入缓蚀剂后,其腐蚀速率有时比不加缓蚀剂还快,这可能是由于加入缓蚀剂量不足所致。
判断对错。
( )
19.析氢腐蚀和吸氧腐蚀的主要不同点在于阴极反应不同。
析氢的阴极反应:
吸氧的阴极反应:
20.金属防腐方法中采用外加电流法时,被保护的金属应直接与电源的
( )相连。
21.在O2分子中氧的氧化数和共价数均为2。
判断对错()。
22.当金属和周围介质接触时,由于发生()或()而引起的材料性能的(),叫做金属的腐蚀。
23. 阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池反应为
2H2 +O22H2O,介质为75%的KOH溶液,则该电池的正极反
应为,负极反应为。
24. 在Re2Cl92-中Re的氧化数是_____。
在HS3O10中S的氧化数是___。
25. 已知:Ag+ + e- = Ag EӨ= 0.799 V
Ag
2C
2
O
4
+ 2e- = 2Ag +C
2
O
4
2-EӨ= 0.49 V
当b(Ag+) = 0.10 mol·kg-1,b(C2O42-) = 1.00 mol·kg-1时,由Ag+/Ag和Ag2C2O4/Ag两个半电池组成原电池。
(1) 写出该原电池的电池符号及电池反应方程式,并计算电池的
电动势。
(2) 计算Ag2C2O4的溶度积常数。
答案:
1、C
2、(-)Fe| Fe2+||Cl-| Hg2Cl2 | Hg | Pt(+)
3、最强、最大
4、C
5、C 和A
6、A
7、B
8、A
9、本性、不随反应书写形式
10、B
11、A
12、错
13、对
14、B
15、内部氧浓度小, 电极电势低,氧化成Zn2+,外部氧浓度相对
高还原为OH -,遇酚酞变红。
Zn2++ 2OH -= Zn(OH)2 (白色沉淀)
16、负极
17、紫色褪去、2Mn04- + 6H+ +5SO32- = 2Mn2+ +3H2O+5SO42- &nb。