基因敲除2
- 格式:ppt
- 大小:1.10 MB
- 文档页数:76

基因敲除技术是一种基因编辑技术,通过这种技术,研究人员可以删除或改变特定的DNA 序列,以研究基因的功能和作用机制。
基因敲除技术的原理:
1. 基因敲除可以通过同源重组的方法实现。
具体来说,研究人员将一个含有同源序列的筛选标记基因插入到待编辑的基因的3'端,然后加入四环素抗性基因的启动子和终止序列,通过筛选标记基因的表达,选择含有同源序列的细胞,再通过同源序列的识别和同源重组将待编辑的基因删除。
2. 另一种基因敲除方法是随机突变。
研究人员将含有同源序列的筛选标记基因插入到待编辑的基因的3'端,然后加入四环素抗性基因的启动子和终止序列,通过筛选标记基因的表达,选择含有同源序列的细胞,再通过随机突变的方法产生突变体。
基因敲除技术的应用:
1. 研究基因的功能和作用机制。
通过基因敲除技术,研究人员可以删除或改变特定的DNA 序列,以研究该基因的作用和影响。
2. 疾病治疗。
基因敲除技术也可以用于治疗某些疾病,如遗传性疾病、癌症等。
3. 药物开发。
研究人员可以通过基因敲除技术来研究药物的作用机制和效果,以开发新的药物。

同源重组基因敲除原理
同源重组基因敲除是一种基因编辑技术,用于通过删除特定基因的方法来研究该基因的功能。
该技术依赖于同源重组(homologous recombination)的原理,即通过引入一个与目标基因相似但存在缺陷的DNA片段,使其与目标基因发生交换,从而使目标基因的序列被“剪除”。
同源重组基因敲除的过程可以简单概括为以下几个步骤:
1. 构建敲除基因载体:首先,需要构建一种含有目标基因的缺陷的 DNA 片段的敲除基因载体。
这个载体通常包括两个关键
部分:一个能够与目标基因进行同源重组的“同源臂”,以及一个“筛选标记”以区分带有敲除基因的细胞。
2. 转染细胞:将敲除基因载体导入目标细胞中。
这可以通过多种方法实现,如基因枪、电穿孔或病毒介导等。
3. 同源重组:在目标细胞内,敲除基因载体中的同源臂与目标基因的相应部分发生同源重组,并在此过程中将缺陷的片段插入到目标基因的位置。
4. 筛选转基因细胞:为了筛选那些已经发生同源重组的细胞,通常会在敲除基因载体中加入一个筛选标记,如抗生素的抗性基因。
只有那些发生重组的细胞才能生存下来,因为它们可以在含有相应抗生素的培养基上生长。
通过同源重组基因敲除技术,可以实现有针对性地敲除特定基
因的目的。
这种方法广泛应用于功能基因组学研究,为我们理解基因的功能和相互作用提供了重要的工具。



基因敲除基因敲除和基因嵌入技术该技术是上个世纪90年代出现的最新外源DNA导入技术。
基因敲除是基因打靶技术的一种,类似于基因的同源重组。
指外源DNA与受体细胞基因组中序列相同或相近的基因发生同源重组,从而代替受体细胞基因组中的相同/相似的基因序列,整合入受体细胞的基因组中。
此法可产生精确的基因突变,也可正确纠正机体的基因突变。
基因嵌入又称基因置换,它是利用内源基因序列两侧或外面的断裂点,用同源序列的目的基因整个置换内源基因。
目前用于基因敲除和基因嵌入的技术有Cre/Lox P 系统、FLPI系统等。
[编辑本段]基因敲除(knock-out)基因敲除技术是20世纪80年代发展起来的,是建立在基因同源重组技术基础以及胚胎干细胞技术基础上的一种新分子生物学技术。
所谓胚胎干细胞(EmbryonicStem cell,ES)是从着床前胚胎(孕3—5天)分离出的内细胞团(Inner cellmass,ICM)细胞,它具有向各种组织细胞分化的多分化潜能,能在体外培养并保留发育的全能性。
在体外进行遗传操作后,将它重新植回小鼠胚胎,它能发育成胚胎的各种组织。
而基因同源重组是指当外源DNA片段大且与宿主基因片段同源性强者并互补结合时,结合区的任何部分都有与宿主的相应片段发生交换(即重组)的可能,这种重组称为同源重组。
基因敲除就是通过同源重组将外源基因定点整合入靶细胞基因组上某一确定的位点,以达到定点修饰改造染色体上某一基因的目的的一种技术。
它克服了随机整合的盲目性和偶然性,是一种理想的修饰、改造生物遗传物质的方法。
这项技术的诞生可以说是分子生物学技术上继转基因技术后的又一革命。
尤其是条件性、诱导性基因打靶系统的建立,使得对基因靶位时间和空间上的操作更加明确、效果更加精确、可靠,它的发展将为发育生物学、分子遗传学、免疫学及医学等学科提供了一个全新的、强有力的研究、治疗手段,具有广泛的应用前景和商业价值。
现在基因敲除技术主要应用于动物模型的建立,而最成熟的实验动物是小鼠,对于大型哺乳动物的基因敲除模型还处于探索阶段。

分子生物学中的基因敲除技术基因是生物体内控制遗传信息传递和表达的基本单位。
基因拥有编码DNA序列,其不同的组合与排列方式决定了生物体的生理和形态特征。
基因突变会导致基因功能的改变,从而引起各种疾病。
因此,人们对于基因的研究一直是分子生物学领域的重点之一。
近年来,基因敲除技术的发展为基因功能的研究带来了革命性的变化。
本文将对分子生物学中的基因敲除技术进行介绍。
一、基因敲除技术的概述基因敲除技术又称基因敲除或基因敲除法,是指通过人工干预的方法,使其中一个或多个基因失去功能的一种技术手段。
它的主要思路是选取某些与目标基因相关的DNA片段进行改造,然后将这些片段通过基因修饰技术导入细胞中,从而抑制目标基因的表达,并从中研究基因功能。
在基因敲除技术的发展史上,一共经历了三个阶段。
第一阶段是限制酶切割技术阶段,该技术主要利用酶切割技术,即利用特定限制酶切割目标基因的特定区域,破坏基因的完整性以达到抑制基因表达的目的。
第二阶段是RNAi技术阶段,该技术利用速度和精度等优势,有效地抑制目标基因的表达。
最新阶段是CRISPR/Cas9基因编辑技术阶段,该技术可以直接在基因组中精确定位和切割目标,其准确性高、效果显著。
二、限制酶切法限制酶切法是利用限制酶断裂DNA,粘性末端互相结合形成重组、重组与质粒互相连接,经过再次引入宿主细胞,利用靶向位点引起相应基因抑制或丧失功能的方法。
具体方法如下:首先选择一个用于酶切靶基因的限制酶;然后,设计基于该酶作用的引物,并用聚合酶链式反应(PCR)扩增目的基因的片段;接下来,利用限制酶切割PCR产物,得到一段粘性端的DNA片段,然后再将其引入宿主细胞中并与目标基因的序列进行重组。
通过该方法,就可以抑制或消除目标基因的表达,对基因功能进行研究。
不过,限制酶切法也具有一些局限性。
例如,它不能实现基因的全局敲除,因为在粘性端重组的过程中,有一定概率发生错误的重组,造成基因复制,而复制后的多个基因片段均可导致基因的表达。

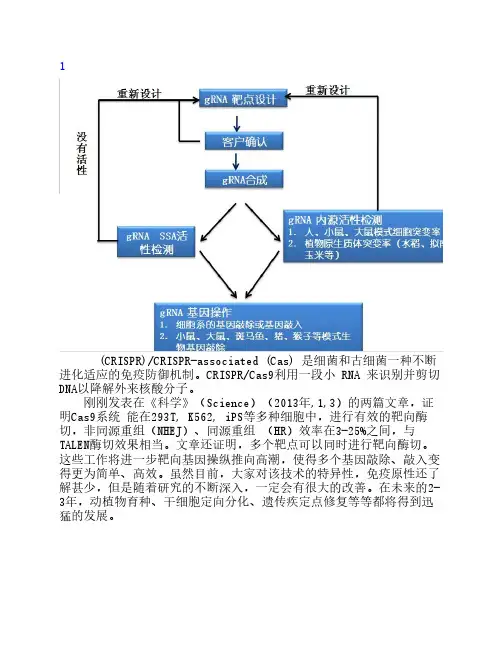
1(CRISPR)/CRISPR-associated (Cas) 是细菌和古细菌一种不断进化适应的免疫防御机制。
CRISPR/Cas9利用一段小 RNA 来识别并剪切DNA以降解外来核酸分子。
刚刚发表在《科学》(Science)(2013年,1,3)的两篇文章,证明Cas9系统 能在293T, K562, iPS等多种细胞中,进行有效的靶向酶切,非同源重组(NHEJ)、同源重组 (HR)效率在3-25%之间,与TALEN酶切效果相当。
文章还证明,多个靶点可以同时进行靶向酶切。
这些工作将进一步靶向基因操纵推向高潮,使得多个基因敲除、敲入变得更为简单、高效。
虽然目前,大家对该技术的特异性,免疫原性还了解甚少,但是随着研究的不断深入,一定会有很大的改善。
在未来的2-3年,动植物育种、干细胞定向分化、遗传疾定点修复等等都将得到迅猛的发展。
图1. RNA指导的CRISPR/Cas9基因剪切系统唯尚立德已经利用CRISPR/Cas9在斑马鱼,哺乳动物细胞上成功实现基因敲除和基因敲入,现推出如下技术服务:1. 应用CRISPR /Cas9提供稳定细胞系靶向基因敲除、敲入技术服务;2. 应用CRISPR /Cas9提供模式生物靶向基因技术服务,包括小鼠,大鼠,斑马鱼等;近几十年来,随着全基因组测序技术的不断成熟,我们在各种细菌和古细菌(archaea)中也陆续发现了很多成簇的、规律间隔的短回文重复序列(clustered regularly interspaced short palindromic repeat sequences,即CRISPR序列,这就是二十多年前日本科学家发现的那个序列)和CRISPR相关基因(CRISPR-associated genes, Cas gene)。
研究发现,这些CRISPR序列与很多病毒或者质粒的DNA序列是互补的,说明这套CRISPR–Cas系统很有可能是生物体抵御病毒等外来入侵者的一套特异性防御机制,就好像是另外一套适应性免疫反应系统(adaptive immune system)。

2017年第4期87农业科技自1987年Capecchi等采用小鼠胚胎干细胞成功介导定向基因转移(也叫做基因打靶),使小鼠体内的特定基因丧失功能以来,基因敲除已成为一种精确地人工修饰基因组的途径,并首先在模式生物小鼠中建立。
基因敲除技术不仅可以研究基因功能、创造有特定经济价值的动物,而且可以指导对人类基因的研究,在阐明人类疾病地说发生机理、开发更为有效的治疗手段及药物中具有重要价值。
1、基因敲除技术的基本原理基因打靶是在同源重组和ES细胞成功分离的基础之上实现的[1-2]。
基因敲除技术应用DNA同源重组原理,利用一段人工修饰的同源片段代替靶基因片段,使外源基因引入基因组DNA的特定片段上,随基因组DNA的复制而稳定复制,从而达到基因敲除的目的。
在基因敲除中,实现基因定点整合的唯一途径就是利用遗传物质的同源重组机制。
2、基因敲除技术的必要条件2.1、打靶载体的构建。
一般来说,打靶载体包含与基因座上相应的DNA序列完全同源的2~10kb序列、经过修改后的目标基因序列和标记基因,为方便从转化细胞中挑选发生同源整合的细胞。
常用的打靶载体有两类—插入型和置换型。
插入型载体通常是由某些逆转录病毒介导的[3],其断裂位点通常位于同源序列内,选择基因与同源目的序列紧紧相连,载体DNA上的同源序列与染色体靶位点发生一次同源重组,从而将整个载体整合到染色体靶位点上[4]。
而置换型载体转化受体细胞,载体含有两段与基因组靶序列同源的DNA片段,中间插入正筛选标记,一般使用的是细菌氨基糖苷磷酸转移酶基因(neo),可以用G418筛选稳定整合载体DNA的细胞。
负筛选标记是单纯疱疹病毒胸腺嘧啶激酶基因(HSV-tk),用GANC筛选除去随机整合了载体DNA的细胞。
以上两种载体的区别在于,载体与靶基因组同源序列双链断裂位点的不同。
2.2、细胞培养和转化。
基因靶向整合在动物细胞中非常困难,以小鼠胚胎干细胞为受体细胞的有关研究显示,外源DNA的平均转化率是5%~10%,其中发生染色体整合的细胞仅有1%~10%,而在这些整合外源DNA的细胞中,同源重组的比例是10-3,由于动物原代细胞的存活期有限,所以有效的细胞培养技术和DNA导入技术是基因敲除实验的关键。

基因敲除技术与转基因技术的比较研究生物技术的发展和应用为人类带来了巨大的利益。
然而,与此同时,也不可避免地带来了一些争议。
在生物技术领域,基因敲除技术和转基因技术是两个热门话题,它们的利用在不同领域具有巨大的应用前景。
本文旨在比较基因敲除技术与转基因技术,帮助读者更好地了解它们的区别和优劣之处。
一、基因敲除技术基因敲除技术是一种通过DNA重组实现基因灭活或剔除的方法。
它通常通过利用重组酶切,将合成的DNA序列植入到细胞中,可以导致目标基因在细胞内被敲除或被靶向沉默。
基因敲除技术的优势在于可以准确地控制目标基因,从而促进基因治疗的发展。
此外,它还可以为疾病基因的研究提供新的平台。
基因敲除技术在基础研究、药物研发、细胞修饰和癌症研究等领域有着广泛的应用。
例如,通过敲除恶性肿瘤细胞中的抑癌基因,可以阻止恶性肿瘤的发展;在研发新的药物时,可以通过基因敲除来验证药物的靶点,从而确定药物的作用机理;以及通过基因敲除来研究不同基因在特定生物过程中的作用,例如神经发育和心肌细胞的分化。
二、转基因技术与基因敲除技术不同,转基因技术针对的是在植物和动物等有机体中插入外来基因的技术。
转基因技术常用的几种方法包括随机插入、受控插入、基因扩增和胚胎基因修饰。
转基因技术可以实现“设计”生物体,也就是人为地改变其生物特性。
转基因技术在食品生产、医疗和工业生产等领域有着广泛的应用。
例如,经过转基因技术改造后的植物可以抵抗病虫害,提高产量和质量,从而为食品生产提供了可能;在医疗领域,转基因技术可以用于生产抗体和蛋白质药物,或者用于治疗癌症、糖尿病和多发性硬化等疾病。
此外,转基因技术还可以用于工业制造,例如用转基因植物生产生物燃料、革命纤维和生物塑料等。
三、基因敲除技术与转基因技术的比较基因敲除技术和转基因技术虽然都是生物技术领域的重要发展方向,但二者还是有所不同的。
基因敲除技术致力于通过切断DNA序列来消除不必要的基因,而转基因技术则是通过插入新的基因来增强或改变生物体的功能。

《基因敲除的原理》基因敲除可以说是基因组学、细胞分离培养以及转基因技术的组合。
那么基因敲除的原理是什么呢?基因敲除的方法有哪些呢?在此,做个小结,以供大家学习。
一.概述:基因敲除是自80年代末以来发展起来的一种新型分子生物学技术,是通过一定的途径使机体特定的基因失活或缺失的技术。
通常意义上的基因敲除主要是应用DNA 同源重组原理,用设计的同源片段替代靶基因片段,从而达到基因敲除的目的。
随着基因敲除技术的发展,除了同源重组外,新的原理和技术也逐渐被应用,比较成功的有基因的插入突变和iRNA ,它们同样可以达到基因敲除的目的。
二.实现基因敲除的多种原理和方法:1.利用基因同源重组进行基因敲除基因敲除是80年代后半期应用DNA 同源重组原理发展起来的。
80年代初,胚胎干细胞(ES细胞)分离和体外培养的成功奠定了基因敲除的技术基础。
1985年,**证实的哺乳动物细胞中同源重组的存在奠定了基因敲除的理论基础。
到1987年,Thompsson**建立了完整的ES细胞基因敲除的小鼠模型[1]。
直到现在,运用基因同源重组进行基因敲除依然是构建基因敲除动物模型中*普遍的使用方法。
(1)利用同源重组构建基因敲除动物模型的基本步骤:①. 基因载体的构建:把目的基因和与细胞内靶基因特异片段同源的DNA 分子都重组到带有标记基因(如neo 基因,TK 基因等)的载体上,成为重组载体。
基因敲除是为了使某一基因失去其生理功能,所以一般设计为替换型载体。
②.ES 细胞的获得:现在基因敲除一般采用是胚胎干细胞,*常用的是鼠,而兔,猪,鸡等的胚胎干细胞也有使用。
常用的鼠的种系是129及其杂合体,因为这类小鼠具有自发突变形成畸胎瘤和畸胎肉瘤的倾向,是基因敲除的理想实验动物。
而其他遗传背景的胚胎干细胞系也逐渐被发展应用。
③.同源重组:将重组载体通过一定的方式(电穿孔法或显微注射)导入同源的胚胎干细胞(ES cell)中,使外源DNA 与胚胎干细胞基因组中相应部分发生同源重组,将重组载体中的DNA 序列整合到内源基因组中,从而得以表达。
植物基因敲除技术步骤植物基因敲除是一个复杂的过程,涉及精确地去除或改变特定基因的序列,从而阻断该基因的表达。
这一技术在植物研究和农业生物技术中非常重要,用于研究基因功能、改善作物性状等。
以下是基本的植物基因敲除技术步骤:1.目标基因的选择和设计:●首先,研究人员需要确定要敲除的目标基因。
●设计特定于该基因的导向序列,通常利用RNA指导的核酸酶(如CRISPR-Cas9系统)实现特定位点的切割。
2.构建敲除载体:●制备包含所需敲除序列的载体,这可能包括导向RNA(gRNA)和Cas9或其他核酸酶的编码序列。
●将这些构建克隆到合适的载体中,用于植物转化。
3.植物细胞的转化:●使用农杆菌介导转化、基因枪或其他方法将构建的载体转移到植物细胞中。
●在细胞内,导向RNA将核酸酶引导至目标基因的特定位置,导致DNA双链断裂。
4.筛选和培养转化植物:●筛选含有敲除构建的植物细胞。
●使用组织培养技术促进这些细胞的生长和分化,形成完整的植物。
5.分析和验证基因敲除:●对转化植物进行分子水平的分析,确认目标基因已被敲除或改变。
●这通常涉及PCR、序列测定和/或基因表达分析。
6.表型分析:●观察和记录敲除目标基因后植物的表型变化。
●这有助于理解该基因在植物发育或代谢中的作用。
7.进一步的研究和应用:●基于敲除结果,进行进一步的功能验证实验。
●在农业或生物技术中应用敲除技术,例如开发抗病或高产的作物品种。
植物基因敲除是一个高度技术化的过程,需要精确的设计和细致的实验操作。
随着基因编辑技术(如CRISPR-Cas9)的发展,这一过程变得更加高效和精确。
基因敲除流程基因敲除是一种常用的遗传工程技术,它通过改变生物体内特定基因的DNA序列,从而使得该基因失去功能。
基因敲除技术在生物学研究和生物医学领域具有重要的应用价值,可以帮助科学家们研究基因在生物体内的功能和作用机制,也为疾病治疗和基因治疗提供了新的思路和方法。
基因敲除流程主要包括以下几个步骤:1. 选择目标基因,首先,需要确定要敲除的目标基因。
在选择目标基因时,需要充分考虑该基因在生物体内的功能和作用,以及敲除后可能带来的生理和生化效应。
2. 构建敲除载体,接下来,需要构建含有目标基因敲除所需的DNA片段的敲除载体。
敲除载体通常包括选择标记基因和敲除目标基因的DNA片段,通过重组技术将其连接在一起,并导入到宿主细胞内。
3. 寻找敲除细胞系,将构建好的敲除载体导入到细胞内后,需要筛选出含有目标基因敲除的细胞系。
这一步通常需要利用选择标记基因对细胞进行筛选,以获得含有目标基因敲除的细胞系。
4. 验证敲除效果,一旦获得含有目标基因敲除的细胞系,就需要对敲除效果进行验证。
通常可以利用PCR、Western blot等技术对细胞内的DNA和蛋白进行检测,以确认目标基因已经被成功敲除。
5. 稳定传代,最后,需要将含有目标基因敲除的细胞系进行稳定传代,以确保目标基因的敲除效果可以在细胞的后代中得到稳定传递。
总的来说,基因敲除流程包括目标基因选择、敲除载体构建、敲除细胞系筛选、敲除效果验证和稳定传代等几个关键步骤。
通过这些步骤,科学家们可以成功地实现对目标基因的敲除,为进一步的基因功能研究和生物医学应用奠定了基础。
基因敲除技术的不断发展和完善,为生物学和医学领域的研究提供了强大的工具和支持。
相信随着技术的进步和应用的拓展,基因敲除技术将在未来发挥更加重要的作用,为人类健康和生命科学的发展带来更多的希望和可能。