海水中的二氧化碳系统
- 格式:doc
- 大小:26.00 KB
- 文档页数:2

co2的海—气交换1.引言1.1 概述随着人类活动日益增加,大气中的CO2浓度不断升高,进而引发了全球气候变化的问题。
CO2的海-气交换是指海洋与大气之间的二氧化碳气体的交换过程。
海洋是地球上最大的碳储库之一,同时也是全球CO2循环的重要组成部分。
在海洋中,CO2以多种形式存在,其中包括溶解态CO2、碳酸盐离子和有机碳。
这些形式的CO2通过海水与大气中的CO2进行反应和交换。
海洋的表面积广阔,能够吸收大量的CO2,起到缓解大气中CO2浓度升高的作用。
另一方面,海洋通过呼吸作用释放CO2到大气中。
然而,气候变化对海洋CO2交换产生了重要影响。
温度升高会导致海洋表层水温上升,促使海洋释放更多的CO2到大气中。
与此同时,大气中的CO2浓度升高也加剧了海洋的酸化程度,导致海洋生态系统受到威胁,进一步影响了海洋中CO2的交换过程。
因此,了解和研究海洋中CO2的海-气交换对于理解全球碳循环和气候变化具有重要意义。
通过深入研究海洋对CO2的吸收和释放过程,可以为我们提供更准确的气候模型,并为应对全球气候变化提供科学依据。
本文将着重探讨海洋中CO2循环的机制以及气候变化对海洋CO2交换的影响。
通过总结目前的研究成果,为未来的研究提供展望,以期为气候变化的应对和全球碳管理提供科学支持。
文章结构部分的内容旨在介绍文章的组织框架和主要内容,以便读者能够清晰地了解文章的结构和逻辑顺序。
文章结构如下:1. 引言1.1 概述本部分将简要介绍文章要讨论的主题——CO2的海-气交换以及其重要性。
强调海洋在全球碳循环中的作用,引起读者的兴趣和关注。
1.2 文章结构本部分将详细介绍文章的结构和内容安排。
主要分为引言、正文和结论三个部分。
通过明确的结构指导读者,让他们能够更好地理解整篇文章的完整性和逻辑性。
1.3 目的本部分将阐述文章的目的和意义。
主要目的是研究和探讨气候变化对海洋CO2交换的影响,并对未来进行展望。
通过深入研究,为应对气候变化提供科学依据,并为未来保护海洋生态环境提供可行建议。

海上二氧化碳高效碳捕集技术海上二氧化碳高效碳捕集技术是指利用海洋作为碳捕集地点,采用高效的技术将大气中的二氧化碳吸收并储存起来的环保技术。
随着全球温室气体排放量的不断增加,海上二氧化碳高效碳捕集技术成为人们关注的焦点之一。
本文将从该技术的原理、优势以及应用前景等方面进行介绍。
一、原理海上二氧化碳高效碳捕集技术主要依靠人工建造的碳捕集设施,将海水中的二氧化碳吸收并转化为固态的碳酸盐,然后将其储存于海底。
这一过程大致可以分为三个步骤:吸收、转化和储存。
通过设计合理的设备,将含有二氧化碳的气体与海水接触,利用化学反应将二氧化碳吸收至海水中。
随后,通过调节反应条件,使二氧化碳与海水中的离子发生反应,转化为碳酸盐。
最后,将转化后的碳酸盐储存于海底,利用海洋的巨大容量来储存这些二氧化碳。
二、优势海上二氧化碳高效碳捕集技术相较于传统的陆地碳捕集技术具有以下几个优势:1.海洋的巨大容量:地球表面的70%被海洋覆盖,海洋拥有巨大的容量来储存二氧化碳,远远超过陆地。
因此,海上碳捕集技术可以大规模地吸收和储存二氧化碳,为减少大气中的温室气体提供了更大的空间。
2.碳酸盐的稳定性:海洋中的碳酸盐具有较高的稳定性,不易释放出二氧化碳。
相比之下,陆地上的碳酸盐储存容易受到地震、地下水流等因素的影响,导致二氧化碳重新释放到大气中。
海上碳捕集技术可以有效地避免这一问题,确保储存的稳定性。
3.生态环境的保护:海洋生态系统对于人类的生存和发展至关重要。
海上碳捕集技术可以避免在陆地上占用大量的土地资源,减少对生态环境的破坏。
同时,在碳捕集过程中,也可以利用海洋生态系统中的生物来帮助吸收二氧化碳,促进生态平衡的保持。
三、应用前景海上二氧化碳高效碳捕集技术在应对气候变化和减少温室气体排放方面具有巨大的潜力。
通过吸收和储存大量的二氧化碳,可以有效地减少大气中的温室气体浓度,降低全球气温上升的速度。
海上碳捕集技术还可以与其他能源技术相结合,实现碳中和的目标。


海洋中的碳循环及其影响因素海洋是地球上最大的碳库之一,承载着大量的碳元素。
海洋中的碳循环是地球碳循环的重要组成部分,对地球气候和生态系统起着至关重要的调节作用。
本文将深入探讨海洋中的碳循环过程,以及影响海洋碳循环的因素。
### 1. 海洋中的碳循环过程海洋中的碳循环主要包括碳的吸收、储存和释放三个过程。
首先,大气中的二氧化碳会溶解到海水中,形成碳酸根离子等化学物质。
这些溶解在海水中的碳元素会被海洋生物吸收,进入海洋生态系统。
海洋生物通过光合作用吸收二氧化碳,将其转化为有机碳,形成有机物。
有机碳在海洋中不断循环,一部分被沉积到海底,形成海底沉积物,长期储存碳元素。
另一部分有机碳通过食物链传递,最终进入海洋生物的体内。
海洋中的碳循环还包括海水与大气之间的气体交换过程。
海水中的二氧化碳浓度受温度、盐度等因素的影响,会发生季节性变化。
海水中的二氧化碳可以通过气体交换作用释放到大气中,也可以从大气中吸收二氧化碳。
这种气体交换过程在海洋表层特别活跃,对全球碳平衡起着重要作用。
### 2. 影响海洋碳循环的因素海洋中的碳循环受到多种因素的影响,包括生物、物理和化学因素等。
以下是一些主要的影响因素:#### 2.1 海洋生物海洋生物是海洋碳循环的重要参与者,它们通过光合作用和呼吸作用影响海水中的碳浓度。
浮游植物是海洋中最主要的光合生物,它们吸收二氧化碳进行光合作用,将碳固定为有机物。
海洋中的浮游动物通过摄食浮游植物,间接参与有机碳的循环。
海洋生物的死亡和沉积也会影响海洋碳循环的速率。
#### 2.2 海洋物理条件海洋的物理条件如温度、盐度、海洋流等也会对海洋碳循环产生影响。
温度的变化会影响海水的溶解氧和二氧化碳浓度,从而影响海洋生物的生长和代谢。
盐度的变化也会改变海水的密度和流动性,进而影响海水中的碳分布。
海洋流会将碳元素输送到不同区域,影响碳的储存和释放过程。
#### 2.3 化学因素海洋中的化学物质如碳酸根离子、钙离子等也对海洋碳循环起着重要作用。

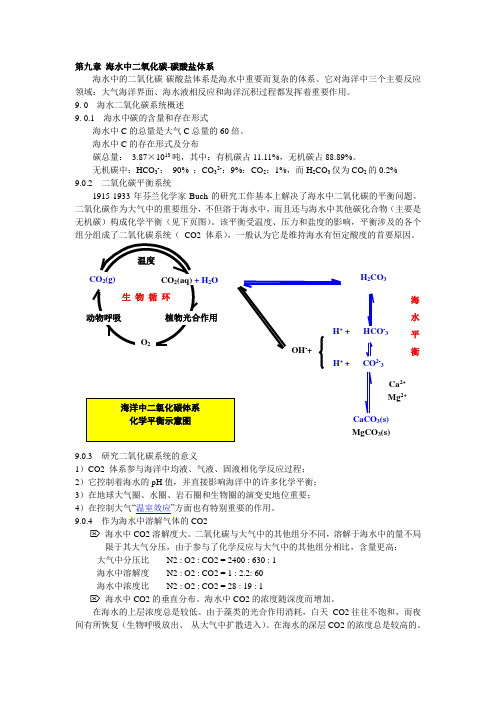
第九章 海水中二氧化碳-碳酸盐体系海水中的二氧化碳-碳酸盐体系是海水中重要而复杂的体系。
它对海洋中三个主要反应领域:大气海洋界面、海水液相反应和海洋沉积过程都发挥着重要作用。
9. 0 海水二氧化碳系统概述9. 0.1 海水中碳的含量和存在形式海水中C 的总量是大气C 总量的60倍。
海水中C 的存在形式及分布碳总量: 3.87×1013吨,其中:有机碳占11.11%,无机碳占88.89%。
无机碳中:HCO 3-: 90% ;CO 32-:9%;CO 2:1%,而H 2CO 3仅为CO 2的0.2% 9.0.2 二氧化碳平衡系统1915-1933年芬兰化学家Buch 的研究工作基本上解决了海水中二氧化碳的平衡问题。
二氧化碳作为大气中的重要组分,不但溶于海水中,而且还与海水中其他碳化合物(主要是无机碳)构成化学平衡(见下页图)。
该平衡受温度、压力和盐度的影响,平衡涉及的各个组分组成了二氧化碳系统( CO2 体系),一般认为它是维持海水有恒定酸度的首要原因。
9.0.3 研究二氧化碳系统的意义1)CO2 体系参与海洋中均液、气液、固液相化学反应过程; 2)它控制着海水的pH 值,并直接影响海洋中的许多化学平衡; 3)在地球大气圈、水圈、岩石圈和生物圈的演变史地位重要; 4)在控制大气―温室效应‖方面也有特别重要的作用。
9.0.4 作为海水中溶解气体的CO2⌦ 海水中CO2溶解度大。
二氧化碳与大气中的其他组分不同,溶解于海水中的量不局限于其大气分压,由于参与了化学反应与大气中的其他组分相比,含量更高:大气中分压比 N2 : O2 : CO2 = 2400 : 630 : 1 海水中溶解度 N2 : O2 : CO2 = 1 : 2.2: 60 海水中浓度比 N2 : O2 : CO2 = 28 : 19 : 1⌦ 海水中CO2的垂直分布。
海水中CO2的浓度随深度而增加。
在海水的上层浓度总是较低。
海水二氧化碳系统 - 海水二氧化碳系统海水二氧化碳系统 - 正文包括溶解在海水中的二氧化碳、碳酸、碳酸氢根离子和碳酸根离子的平衡物系。
这些成分之间的化学反应和平衡关系,二氧化碳在大气和海洋之间的交换,悬浮颗粒中的碳酸盐与海水二氧化碳系统之间的化学平衡,海洋生物的生长繁殖与二氧化碳的循环,海水中二氧化碳含量的分布及其变化,都是这方面的主要研究内容。
海水二氧化碳系统的研究工作,虽然在18世纪就已经开始,但直到1915年,K.布赫才首次研究海水二氧化碳系统中各种成分之间的平衡理论。
20世纪30年代初,根据国际海洋考察理事会(ICES)的建议,由K.布赫、H.W.哈维、H.瓦滕贝格和S.格里彭贝格组成的专业小组,测定了不同温度和不同盐度下碳酸的第一级和第二级表观解离常数。
50年代以后,各国学者分别测定此解离常数。
由于测定的方法和所依据的标准不同,所得的结果就不一致。
为此,J.M.吉斯克于1978年在“海洋表和标准”联合专家小组(JPOTS)的会议上,建议对测定标准和有关常数进行统一。
总二氧化碳二氧化碳在海水中有如下的化学反应和平衡关系:CO2(溶解态)+H2O匑H2CO3H2CO3匑H+HCO婣HCO婣匑H++CO2-3在溶解态的二氧化碳与碳酸的平衡中,后者的量与前者相比甚小。
通常把这两者的浓度之和表示为【CO2】T,【CO2】T=【CO2】+【H2CO3】以表示海水中二氧化碳系统各成分的总浓度,称为总二氧化碳。
考虑碳酸在海水中的一级解离和二级解离时,通常以氢离子的活度αH+代替浓度【H+】,二氧化碳各分量用浓度,并称所得解离常数为表观解离常数K′。
因此,碳酸的一级和二级表观解离常数为它们是海水的温度、盐度和压力的函数。
海水中二氧化碳的含量,与海洋生物的分布、大陆径流、海-气交换、固体悬浮物质和海洋沉积物等有密切的关系,因而有明显的区域分布和垂直分布。
二氧化碳的海-气交换海洋表层水和大气之间的二氧化碳交换,处于动态平衡。
海洋对co2吸收的机制
海洋吸收二氧化碳主要有两种途径:
一是二氧化碳可以溶于水(大概比例是1体积水溶解1体积二氧化碳),来“储存”二氧化碳.
二是海洋生物(主要是藻类)光合作用吸收二氧化碳,这种海洋生物吸收效果是很大的,因为藻类光合作用吸收的二氧化碳是全球植物吸收二氧化碳最多的.
水可以和二氧化碳反应,从而吸收二氧化碳.
反应式为:H2O+CO2=H2CO3
2.海水中存在着大量的绿色单细胞或多细胞的植物,他们的光合作用消耗二氧化碳。
吸收二氧化碳做光合作用的原料.
反应式为:6CO2+12H2O==C6H12O6+6H2O+6O2
3.海水中含有的部分化合物会和二氧化碳反应,从而吸收二氧化碳.
海水吸收CO2,跟海水呈弱碱性有直接关系CO2+H2O=H2CO3;2NaOH+CO2=Na2CO3+H2O;
Na2CO3+CO2+H2O=2NaHCO3;2CO2+2H2O+CaCl2=2HCl+Ca(HCO3)2;(属恶性反应)Mg~+CO2=MgCO2....(因海水含有大量化合物,这里不多提了,以上是主要的反应,尤其是与水的结合)
CO2在生物过程中起重要作用,藻类光合作用消耗CO2,产生有机物和氧气。
海水中的二氧化碳系统
水中溶解有大量的碳化合物,其中无机物的主要形式有HCO3-、CO32-、H2CO3和CO2。
溶解CO2可以与大气中的CO2进行交换,这个过程起着调节大气CO2浓度的作用。
工业革命以来,由于大量使用矿物燃料,排放大量CO2,使大气CO2浓度上升,形成所谓“温室效应”,影响了全球气候变化(图4—6)。
因此近年来对大气与海洋的CO2交换过程十分重视,开展了广泛的国际合作,进行了大量研究工作。
CO2海气交换的研究是JGOFS(全球海洋通量研究计划)的重要组成部分。
早期的化学海洋学研究就已经知道海水的二氧化碳系统是维持海水有恒定酸度的重要原因,这是由于在海水中存在下列平衡:
这个平衡过程控制着海水的pH,使海水具有缓冲溶液的特性。
增加大气的CO2也增加了海水中的无机碳总量,同时增加海水的缓冲容量,引起海水酸度增加,不利于更多的CO2进入海水。
海水的pH值
海水的pH值约为8.1,其值变化很小,因此有利于海洋生物的生长;海水的弱碱性有利于海洋生物利用CaCO3组成介壳;海水的CO2含量足以满足海洋生物光合作用的需要,因此海洋成为生命的摇篮。
一般气体在海水中的溶解量与其在大气中的分压成正比,但CO2是个例外。
CO2与水有反应,因此提高了它在海水中的浓度。
CO2在生物过程中起重要作用,藻类光合作用消耗CO2,产生有机物和氧气。
因此,大部分地区的海水表层CO2是不饱和的,深层水由于下沉有机物的分解含有较多的CO2。
赤道海域环流和美洲大陆西岸上升流把CO2带入表层水。
海水从大气中吸收CO2的能力很大,而且最初它所能吸收的CO2是现今的几倍。
要准确估计海水吸收CO2的能力是较为困难的,因为整个体系处于动态之中。
CO2与水生成碳酸,碳酸离解得到碳酸氢根和碳酸根,这是海水中溶解碳的主要化学形式。
CO2浓度随深度增加,因为藻类光合作用消耗CO2而在呼吸中放出CO2,另一个原因是CO2的溶解度随压力增加而增加。
天然的碳有三种同位素:12C,13C和14C。
其中14C是放射性同位素。
大气中的14C有两种来源,一是宇宙射线与大气中的N2发生核反应产生的;另一种是由于核爆炸产生的。
14C 进入海洋后,随着海水的运动减低浓度,因此可以用来研究CO2的气体交换速率和水团的年龄等。
海水中的二氧化碳含量约为2.2mmol/kg。
CO
2的各种形式随pH的变化
影响海水pH的因素
海水的pH一般在7.5~8.2的范围变化,主要取决于二氧化碳的平衡。
在温度、压力、盐度一定的情况下,海水的pH主要取决于H2CO3各种离解形式的比值。
反过来,当海水pH值测定后也可以推算出碳酸的浓度。
温度校正可用下式
pH t1(现场)=pH t1(测定)+0.0113(t2-t1) (4-14)
由于深度改变引起的压力校正可以通过查表得到。
海水的缓冲容量
海水具有一定的缓冲能力,这种缓冲能力主要是受二氧化碳系统控制的。
缓冲能力可以
用数值表示,称为缓冲容量。
定义为使pH变化一个单位所需加入的酸或碱的量:
海水的pH在6~9之间时缓冲容量最大。
大洋水的pH变化主要是由CO2的增加或减少引起的。
海水的缓冲容量除与CO2有关外,还与H3BO3有关。
由于离子对的影响,海水的缓冲容量比淡水和NaCl溶液都要大。