物化下册期末复习全解
- 格式:ppt
- 大小:1.39 MB
- 文档页数:54

第八章电解质溶液第九章1.可逆电极有哪些主要类型?每种类型试举一例,并写出该电极的还原反应。
对于气体电极和氧化还原电极在书写电极表示式时应注意什么问题?答:可逆电极有三种类型:(1)金属气体电极如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s)(2)金属难溶盐和金属难溶氧化物电极如Ag(s)|AgCl(s)|Cl-(m), AgCl(s)+ e- = Ag(s)+Cl-(m)(3)氧化还原电极如:Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2)对于气体电极和氧化还原电极,在书写时要标明电极反应所依附的惰性金属。
2.什么叫电池的电动势?用伏特表侧得的电池的端电压与电池的电动势是否相同?为何在测电动势时要用对消法?答:正、负两端的电势差叫电动势。
不同。
当把伏特计与电池接通后,必须有适量的电流通过才能使伏特计显示,这样电池中发生化学反应,溶液浓度发生改变,同时电池有内阻,也会有电压降,所以只能在没有电流通过的情况下才能测量电池的电动势。
3.为什么Weslon标准电池的负极采用含有Cd的质量分数约为0.04~0.12的Cd一Hg齐时,标准电池都有稳定的电动势值?试用Cd一Hg的二元相图说明。
标准电池的电动势会随温度而变化吗?答:在Cd一Hg的二元相图上,Cd的质量分数约为0.04~0.12的Cd一Hg齐落在与Cd一Hg固溶体的两相平衡区,在一定温度下Cd一Hg齐的活度有定值。
因为标准电池的电动势在定温下只与Cd一Hg齐的活度有关,所以电动势也有定值,但电动势会随温度而改变。
4.用书面表示电池时有哪些通用符号?为什么电极电势有正、有负?用实验能测到负的电动势吗?答:用“|”表示不同界面,用“||”表示盐桥。
电极电势有正有负是相对于标准氢电极而言的。
不能测到负电势。
5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst方程计算电极的还原电势?5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst 方程计算电极的还原电势?答:电极电势不是电极表面与电解质溶液之间的电势差。


物理化学下册复习资料物理化学下册复习资料一、电化学1、18 ℃时, NaCl, NaOH和 NH4Cl的无限稀释摩尔电导率分别为129.8×10-4,217.2×10-4和108.6×10-4 S.m2/mol. 0.1 mol/dm3 NH4OH水溶液的摩尔电导率为3.09×10-4 S.m2/mol, 试求:18 ℃时 0.1 mol.dm-3 NH4OH的离解度及离解平衡常数K.解:NH4OH= NH4Cl+NaOH -NaClΛo(NH4OH) = Λo(NH4Cl) + Λo(NaOH) - Λo(NaCl)=(108.6+217.2-129.8)×10-4=196×10-4 S.m2.mol-1 α = Λ(NH4OH)/Λo(NH4OH) = 3.09×10-4/(196×10-4) = 0.01577K = Cα/ (1-α) = 0.1×0.01577/(1-0.01577)= 2.53×10-52、测得饱和BaSO4溶液的电导率是3.48×10-4 S/m, 而配制溶液所用纯水的电导率是0.5×10-4 S/m, 试计算 BaSO4的溶度积。
已知: Λm∞(1/2 Ba2+) =63.64×10-4 S.m2/molΛm∞(1/2 SO42-)=79.8×10-4 S.m2/molKey:) = κ(溶液) - κ(水)κ(BaSO4= (3.48-0.5)×10-4= 2.98×10-4 S/m Λ≈Λo = 2[Λo(1/2 Ba2+) + Λo(1/2 SO)]4= 2(63.64×10-4+ 79.8×10-4 )= 286.88×10-4 S.m2/molC = κ/Λ = 0.01039 mol/m2 = 1.039×10-5 mol/dm3Ksp = C2= 1.08×10-103. 反应 Cu2+( a1) → Cu2+( a2), a1> a2可构成两种电池:(1) Cu|Cu2+( a2)||Cu2+( a1)|Cu(2) Pt|Cu2+( a2),Cu+(a')||Cu2+( a1),Cu+(a’)|Pt(a)分别写出这两种电池的电极反应;(b)试计算两种电池的电动势 E1, E2之间的关系;(c)说明为什么两种电池的电池反应始、终态相同,但E1和E2不同.4、电池: Ag(s),AgCl(s)|Cl-(a)|Cl(g,pθ)|Pt(s)2(1)写出此电池的电极反应及电池反应;(2)如果要测定该电池反应的平衡常数Kθ, ΔG及ΔH需设计什么样的实验 ? 测定哪些数据 ?解:(1) (-) Ag(s) + Cl-(a) -e→ AgCl(s)(g,p○) + e → Cl-(a)(+) 1/2 Cl2(g,p○) = AgCl(s) 电池: Ag(s) + 1/2 Cl2(2)要测K○需测E○,为此安排 a = 1 下测定电池电动势E○.要测△G需测该温度下的E○.要测△H需测一系列温度下的 E,得到 (dE/dT)p,由 E 及(dE/dT)p可计算△H.5、电池:Hg(l),Hg2Br2(s)|KBr(0.1mol/kg)||KCl(0.1mol/kg)|Hg2Cl2(s)| Hg(l)在 5 ~50 ℃范围内的电动势可按下式计算:E/V = 0.1318 -1.88×10-4t/℃ (t为摄氏温度)(1) 写出电极反应及电池反应;(2) 计算25 ℃下Z=2电极反应的ΔG,ΔS,ΔH, Q 。

物理化学物理化学((下册下册))期末考试大纲第八章:第八章:电化学、原电池、电化学、原电池、电解池、正负极、阴阳极等基本概念和电解定理;电解池、正负极、阴阳极等基本概念和电解定理;电解池、正负极、阴阳极等基本概念和电解定理;电导、电导率、电导、电导率、摩尔电导率的意义及其与溶液浓度的关系;离子独立移动定律及电导测定的应用;电解质的离子平均活度、平均活度因子及其计算方法;离子强度的计算,德拜-休克尔极限公式公式. .第九章:第九章:可逆电池可逆电池,,电池的书面写法电池的书面写法,,电极反应和电池反应电极反应和电池反应,,可逆电池的热力学可逆电池的热力学((桥梁公式、E q与K qa 的关系的关系),),),用用Nernst 公式计算电极电势和电池电动势公式计算电极电势和电池电动势,,电动势测定的应用电动势测定的应用((计算平均活度因子、解离平衡常数和pH 值).第十章:第十章:极化现象极化现象,,超电势超电势,,极化对电解电压和原电池电动势的影响,电解过程中电极电势的计算及反应顺序的判断计算及反应顺序的判断,,金属的电化学腐蚀与防护金属的电化学腐蚀与防护,,化学电源的类型化学电源的类型. .第十一章:第十一章:反应速率表示法反应速率表示法,,基元反应基元反应,,反应机理反应机理,,反应级数反应级数,,反应分子数反应分子数,,简单级数反应的速率方程(推导和计算)及特点及特点((反应速率常数的量纲、反应速率常数的量纲、半衰期半衰期半衰期),),),典型复杂反应典型复杂反应典型复杂反应((对峙、平行、连续连续))的特点的特点,,对峙、平行反应速率方程的推导平行反应速率方程的推导,,温度对反应速率的影响温度对反应速率的影响,,阿仑尼乌斯公式的含义及由它求活化能的含义及由它求活化能,,链反应的特点链反应的特点,,用稳态近似、平衡假设、速控步等近似方法推导速率方程速率方程. .第十二章:第十二章:碰撞理论、过渡状态理论的要点过渡状态理论的要点,,离子强度对反应速率的影响离子强度对反应速率的影响,,光化学反应的基本定律,光化学反应与热反应的差别光化学反应与热反应的差别,,量子产率量子产率,,催化作用原理催化作用原理,,催化剂催化剂,,酶催化酶催化. .第十三章:第十三章:表面吉布斯自由能和表面张力的含义表面吉布斯自由能和表面张力的含义,,表面张力与温度的关系表面张力与温度的关系,,弯曲液面上的附加压力压力,,杨-拉普拉斯公式杨-拉普拉斯公式,,开尔文公式开尔文公式,,液-固界面现象液-固界面现象((铺展、润湿、接触角、毛细管液面高度面高度),),),表面活性剂的作用表面活性剂的作用表面活性剂的作用,,表面活性物质在溶液中的分布表面活性物质在溶液中的分布,,物理吸附、化学吸附的特点化学吸附的特点,,朗格缪尔等温吸附模型朗格缪尔等温吸附模型. .第十四章:第十四章:分散系统分散系统,,胶体胶体,,胶体的结构表示式胶体的结构表示式,,胶体的丁铎尔效应胶体的丁铎尔效应,,电动现象电动现象((电泳、电渗电泳、电渗),),),电电动电位动电位,,胶体的稳定性及一些因素对它的影响胶体的稳定性及一些因素对它的影响,,大分子溶液与胶体的异同大分子溶液与胶体的异同,,大分子物质平均摩尔质量的种类均摩尔质量的种类,,唐南平衡唐南平衡. .A16.附加压力: : 由于界面张力的作用由于界面张力的作用由于界面张力的作用,,在弯曲液面内外产生的压力差在弯曲液面内外产生的压力差. . 2's p R g=17.吸附: : 在相界面上在相界面上在相界面上,,某种物质的浓度不同于体相浓度的现象某种物质的浓度不同于体相浓度的现象. . 18.物理吸附: : 由于范德华力的作用而产生的吸附由于范德华力的作用而产生的吸附由于范德华力的作用而产生的吸附. .19.化学吸附: : 由于生成化学键而发生电子的转移与原子重排的吸附由于生成化学键而发生电子的转移与原子重排的吸附由于生成化学键而发生电子的转移与原子重排的吸附. . 20.吸附质: : 被吸附剂吸附的物质被吸附剂吸附的物质被吸附剂吸附的物质. . 21.吸附剂: : 具有吸附能力的物质具有吸附能力的物质具有吸附能力的物质..通常都是固体通常都是固体. . 22.表面过剩/表面吸附量: : 在单位面积的表面层中在单位面积的表面层中在单位面积的表面层中,,所含溶质的物质的量与同量溶剂在溶液本体中所含溶质的物质的量的差值溶液本体中所含溶质的物质的量的差值. . 22da drRT a A n S ×-==G s23.表面活性剂: : 能使溶液表面张力降低的物质能使溶液表面张力降低的物质能使溶液表面张力降低的物质. . . 习惯上只把那些溶入少量就能显著降习惯上只把那些溶入少量就能显著降低溶液表面张力的物质称为表面活性剂低溶液表面张力的物质称为表面活性剂. .24.临界胶束浓度: : 形成一定形状的胶束所需的表面活性物质的最低浓度形成一定形状的胶束所需的表面活性物质的最低浓度形成一定形状的胶束所需的表面活性物质的最低浓度. . 25.速率方程: : 表示化学反应的反应速率与浓度等参数间的关系式表示化学反应的反应速率与浓度等参数间的关系式, , 或浓度与时间等参或浓度与时间等参数间的关系式数间的关系式..也称动力学方程. 26.转化速率: : 单位时间内发生的反应进度单位时间内发生的反应进度单位时间内发生的反应进度. .27.反应速率: : 单位时间单位体积内发生的化学反应的反应进度单位时间单位体积内发生的化学反应的反应进度单位时间单位体积内发生的化学反应的反应进度 或 单位体积内单位体积内,,反应进度随时间的变化率进度随时间的变化率. . dtdc v dt d V r jj ×=×=11x (恒容恒容) )28.反应机理: : 表示一个总包表示一个总包表示一个总包((复杂复杂))反应所经历的具体途径的若干基元反应的有序集合反应所经历的具体途径的若干基元反应的有序集合..也称反应历程.29.基元反应: : 反应物粒子在碰撞中相互作用直接转化为产物的反应反应物粒子在碰撞中相互作用直接转化为产物的反应反应物粒子在碰撞中相互作用直接转化为产物的反应. . 30.简单反应: : 只包含一个基元反应的总包反应只包含一个基元反应的总包反应只包含一个基元反应的总包反应. .31.复合反应: : 由两个或两个以上基元反应组成的总包反应由两个或两个以上基元反应组成的总包反应由两个或两个以上基元反应组成的总包反应. . . 也称也称复杂反应 32.具有简单级数的反应具有简单级数的反应//简单级数反应: : 反应速率只与反应物浓度的简单方次反应速率只与反应物浓度的简单方次(0或正整数)有关的反应有关的反应..可以是基元反应、简单反应简单反应,,也可是复合反应也可是复合反应,,但必须具有简单级数但必须具有简单级数. . 33.质量作用定律: : 反应的反应速率与以计量系数的绝对值为指数的反应物浓度的乘积反应的反应速率与以计量系数的绝对值为指数的反应物浓度的乘积成正比成正比..只适用于基元反应只适用于基元反应. .34.反应级数: : 速率方程中各浓度项的指数和速率方程中各浓度项的指数和速率方程中各浓度项的指数和..若速率方程中有加减运算若速率方程中有加减运算,,则无级数可言则无级数可言 35.零级反应零级反应//一级反应一级反应//二级反应二级反应//三级反应: : 反应速率与反应物浓度的反应速率与反应物浓度的0/1/2/3次方成正比的一类反应正比的一类反应. .36.反应分子数: : 引发一个基元反应所必需的反应物相互作用的最少微观粒子引发一个基元反应所必需的反应物相互作用的最少微观粒子(分子、原子、离子、自由基等子、离子、自由基等))数. . 即基元反应中的反应物分子个数之和即基元反应中的反应物分子个数之和即基元反应中的反应物分子个数之和. .37.半衰期: : 反应物浓度降低到其初始浓度的一半所需的时间反应物浓度降低到其初始浓度的一半所需的时间1/2t . 38.分数寿期: : 消耗掉反应初始浓度的某一分数消耗掉反应初始浓度的某一分数a 所需的时间a t .分数衰期: : 反应物浓度降低到其初始浓度的某一分数反应物浓度降低到其初始浓度的某一分数b 所需的时间b t .若b a -=1,则b tt a =. . 如如: : 某一级反应某一级反应四分之三寿期3/4t =60min,60min,而其而其四分之一衰期1/4t =60min39.初始速率: : 反应刚开始进行的一瞬间的反应速率反应刚开始进行的一瞬间的反应速率反应刚开始进行的一瞬间的反应速率..可以认为反应物没有消耗可以认为反应物没有消耗. .40.范特霍夫规则: : 对同一化学反应对同一化学反应对同一化学反应,,反应的温度每升高1010℃℃(K),(K),反应速率约增加反应速率约增加1~3倍.4~210»+TT k k 41.对峙反应: : 正向和逆向同时进行的反应正向和逆向同时进行的反应正向和逆向同时进行的反应..也称可逆反应. 42.平行反应: : 反应物能同时进行几种不同的反应反应物能同时进行几种不同的反应反应物能同时进行几种不同的反应. .43.连串反应: : 反应所产生的物质能继续起反应而产生其它物质的一类反应反应所产生的物质能继续起反应而产生其它物质的一类反应反应所产生的物质能继续起反应而产生其它物质的一类反应..也称连续反应.44.稳态近似法: : 在一系列的连串反应中在一系列的连串反应中在一系列的连串反应中,,若生成高活性的中间产物粒子若生成高活性的中间产物粒子((如原子、离子、自由基等自由基等),),),因其能量高、因其能量高、活性大、反应能力强反应能力强,,一旦生成就立即发生反应一旦生成就立即发生反应,,当反应达到稳定状态后到稳定状态后,,其净的反应速率可视为零的一种近似处理方法其净的反应速率可视为零的一种近似处理方法. . 45.链反应: : 用光、热、辐射或其它方法使反应引发用光、热、辐射或其它方法使反应引发,通过活性组份通过活性组份((自由基或原子自由基或原子))的不断再生断再生,,使反应得以自动发展下去的一类连续反应使反应得以自动发展下去的一类连续反应..又称连锁反应. 46.直链反应: : 由一个自由基或原子与饱和分子反应由一个自由基或原子与饱和分子反应由一个自由基或原子与饱和分子反应,,只生成一个新自由基或原子的链反应反应. . . 也称为也称为单链反应.47.支链反应: : 由一个活性粒子由一个活性粒子由一个活性粒子((自由基或原子自由基或原子))与饱和分子反应生成两个及两个以上新活性粒子活性粒子((自由基或原子自由基或原子))的反应的反应. . 48.原盐效应: : 在稀溶液中在稀溶液中在稀溶液中,,离子强度对离子反应的反应速率的影响离子强度对离子反应的反应速率的影响. . 49.光化反应: : 在光的作用下进行的化学反应在光的作用下进行的化学反应在光的作用下进行的化学反应. . 50.光化学定律: (1).(1).只有被物质吸收的光只有被物质吸收的光只有被物质吸收的光,,才能引发光化学反应才能引发光化学反应.(2)..(2)..(2).在初级过程中在初级过程中在初级过程中,,一个分子个分子((或原子或原子))吸收一个光子而活化吸收一个光子而活化. .51.光敏剂: : 能把所吸收的光能传递给对光不敏感的物质并使其活化乃至发生反应而加能把所吸收的光能传递给对光不敏感的物质并使其活化乃至发生反应而加入的一类物质入的一类物质. .52.催化剂: : 加入少量就可以显著改变反应的速率加入少量就可以显著改变反应的速率加入少量就可以显著改变反应的速率,,而本身在反应前后没有数量和化学性质变化的一类物质性质变化的一类物质. . 53.催化作用: : 化学反应速率由于催化剂的加入而发生变化的这种作用化学反应速率由于催化剂的加入而发生变化的这种作用化学反应速率由于催化剂的加入而发生变化的这种作用. . 54.自催化作用: : 反应产物对反应本身具有加速反应的作用反应产物对反应本身具有加速反应的作用反应产物对反应本身具有加速反应的作用. . 55.55.催化反应的催化反应的选择性: : 转化为目标产物的原料量与发生转化的原料总量之比转化为目标产物的原料量与发生转化的原料总量之比转化为目标产物的原料量与发生转化的原料总量之比. . 56.分散体系分散体系((系统系统)): : 把一种或几种物质分散在另一种物质中所构成的体系把一种或几种物质分散在另一种物质中所构成的体系(系统系统). ). 57.分散相: : 被分散在分散介质中的物质被分散在分散介质中的物质被分散在分散介质中的物质 或 被分散介质所分散的物质被分散介质所分散的物质. . 58.分散介质: : 呈连续分布的、起分散作用的物质呈连续分布的、起分散作用的物质呈连续分布的、起分散作用的物质. . 59.分子分散体系分子分散体系((系统系统)):以分子、原子或离子状态均匀分散在分散介质中形成的体系(系统系统).).).又称又称真溶液,简称溶液. 60.胶体分散体系: : 被分散在分散介质中的粒子半径在被分散在分散介质中的粒子半径在1~100nm(100nm(即即9710~10m --,傅版傅版))或1~1000nm(1000nm(即即m 6910~10--,天大版天大版))之间的分散体系之间的分散体系((系统系统). ). 61.扩散: : 有浓度梯度时有浓度梯度时有浓度梯度时,,物质粒子因热运动物质粒子因热运动((布朗运动布朗运动))而发生宏观上的定向迁移现象而发生宏观上的定向迁移现象..其推动力是浓度梯度其推动力是浓度梯度,,扩散过程是不可逆的扩散过程是不可逆的. .d d d d s n cD A t x=-×× 62.憎液溶胶: : 由难溶物分散在分散介质中所形成的胶体分散体系由难溶物分散在分散介质中所形成的胶体分散体系由难溶物分散在分散介质中所形成的胶体分散体系..简称溶胶.63.沉降: : 多相分散系统中的粒子多相分散系统中的粒子多相分散系统中的粒子,,因受重力作用而下沉的过程因受重力作用而下沉的过程. .64.电泳: : 在外电场的作用下在外电场的作用下在外电场的作用下,,胶体粒子在分散介质中定向迁移的现象胶体粒子在分散介质中定向迁移的现象. . 65.电渗: : 在多孔膜在多孔膜在多孔膜((或毛细管或毛细管))两端施加一定电压两端施加一定电压,,液体通过多孔膜而定向流动的现象液体通过多孔膜而定向流动的现象. . 66.流动电势: : 在外力的作用下在外力的作用下在外力的作用下,,迫使液体通过多孔隔膜迫使液体通过多孔隔膜((或抟细管或抟细管))定向流动时定向流动时,,在多孔膜两边所产生的电势差膜两边所产生的电势差. .67.沉降电势: : 分散相粒子在重力场或离心力场的作用下迅速移动时分散相粒子在重力场或离心力场的作用下迅速移动时分散相粒子在重力场或离心力场的作用下迅速移动时,,在移动方向的两端所产生的电势差端所产生的电势差. .68.聚沉值: : 使一定量溶胶在一定时间内完全聚沉所需电解质的最小浓度使一定量溶胶在一定时间内完全聚沉所需电解质的最小浓度使一定量溶胶在一定时间内完全聚沉所需电解质的最小浓度. . . 聚沉值越小聚沉值越小聚沉能力越强聚沉能力越强. . 69.感胶离子序: : 将带有相同电荷的离子按聚沉能力从大到小排列的顺序将带有相同电荷的离子按聚沉能力从大到小排列的顺序将带有相同电荷的离子按聚沉能力从大到小排列的顺序. . 70.悬浮液: : 将不溶性固体粒子分散在液体中所形成的粗分散体系将不溶性固体粒子分散在液体中所形成的粗分散体系(系统系统). ). 71.乳状液: : 由两种不互溶或部分互溶的液体所形成的粗分散体系由两种不互溶或部分互溶的液体所形成的粗分散体系(系统系统). ). 72.唐南平衡: : 若用半透膜将小分子电解质水溶液与大分子电解质水溶液隔开若用半透膜将小分子电解质水溶液与大分子电解质水溶液隔开若用半透膜将小分子电解质水溶液与大分子电解质水溶液隔开,,由于大分子电解质离子不能透过半透膜分子电解质离子不能透过半透膜,,而小分子电解质离子可以透过半透膜而小分子电解质离子可以透过半透膜,,当膜两边达成渗透平衡时达成渗透平衡时,,小分子电解质在膜两边的分布不同小分子电解质在膜两边的分布不同. .1.1.已知在已知在300K 时,某一级反应的半衰期为s 50,且反应温度升高1010℃反应速率增加℃反应速率增加1倍.若指前因子1710979.2-´=s A 且与温度关系不大且与温度关系不大,,试求试求: : (1).300K 时,反应的转化率达到87.5%87.5%所需的时间所需的时间所需的时间. . (2).(2).使反应转化率在使反应转化率在s 50内达到75%75%所需的温度所需的温度所需的温度. . 解:(1).(1).因一级反应有因一级反应有因一级反应有: : k t 2ln 2/1= , ,和和 kt y=-11ln (或k a t a )1ln(--=) 所以所以: : )(01386.0502ln 2ln 12/1-===s t k )(15001386.0%)5.871ln(11ln 1s y k t =--=-= [ [或或)(15001386.0)871ln(8/7s t t =--==] (2).(2).据题由据题由据题由: : )11(ln 2112T T R Ea k k -=得:)(60532ln 31458300310300310ln 1121212-×=´´-´=×-=mol kJ k k R T T T T Ea将阿仑尼乌斯公式代入积分方程得将阿仑尼乌斯公式代入积分方程得::t Ae y RTEa /11ln -=-,即: RT Ea t A y -=×--)1ln(ln 所以所以: : )(3105010979.2)75.01ln(ln 3145.81060.53)1ln(ln 73K t A y R EaT =´´--´-=×---=(也可先据kt y =-11ln 求出)(02773.0)1ln(1-=--=s t y k ,再由RT Ea A k -=ln ln 求T)2. 2.反应反应P B A k¾®¾+的动力学实验数据如下的动力学实验数据如下:: [A 0]/[mol/dm -3] 1.0 2.0 3.01.0 1.0 [B 0]/[mol/dm -3] 1.0 1.0 1.02.03.0 r 0/[mol/dm -3/s] 0.15 0.300.45 0.15 0.15若该反应的速率方程为b a ][][B A k r =,求b a 和.解: : 据题有据题有据题有: : b a 000][][B A k r =, , 故可得故可得故可得: : b a ba1,01,02,02,01,02,0][][][][B A B A r r = 将第1,2两级数据代入上式得两级数据代入上式得: :a÷÷øöççèæ=1,02,01,02,0][][A A r r 即: 0.10.10.2ln 15030.0ln][][lnln1,02,01,02,0===A A r r a 同理同理,,将第1,4组数据代入则可得组数据代入则可得::b÷÷øöççèæ=1,02,01,02,0][][B B r r 亦即亦即::00.10.2ln 15.015.0ln][][lnln 1,02,01,02,0===B B r r b3.3.今在今在473.2K 时研究反应D C B A k+¾®¾+22,其速率方程可写成yx B A k r ][][=.现经实验1得当A 、B 的初始浓度分别为0.013-×dm mol 和0.023-×dm mol 时,测得反应物B 在不同时刻的浓度数据如下表在不同时刻的浓度数据如下表: :t/min 0 5395 13025[B]/( 3-×dm mol )0.020 0.010 0.0050 试求试求: (1).: (1).: (1).该反应的总级数该反应的总级数该反应的总级数 (2).(2).实验实验2: 2: 当当A 、B 的初始浓度均为0.023-×dm mol 时,测得初始反应速率仅为实验1的初始速率的1.414倍,求A 、B 的反应级数y x 和的值的值. .(3).(3).求算求算k 值.解:(1).(1).由实验由实验1数据可知数据可知,,min 53952/1=t ,min130254/3=t.因此时有因此时有::000][2][1][A BA ==,故原方程可写成ny x y y x y yx A k A k x A k B A k r]['][2)]([2][][0=××=-××==++,即此条件下即此条件下,,反应速率与简单n 级反应相同级反应相同. .利用简单n 级反应的分数寿期公式k C n a t n n a 101)1(1)1(-----=可得可得::1212/14/3+=-n t t 亦即亦即: : 50.12ln )1539513025ln(12ln )1ln(12/14/3=-+=-+=t tn (2).(2).由实验由实验2知:yxy xB A k B A k 1,01,02,02,0][][4.1][][=002ln 2ln c c c c 2352382350238cc 112(-)(.)('12253510845-´-T T Ea ln 1´+--+---一、选择题(一、选择题(2222分)1.强电解质CaCl 2的摩尔电导率与其离子的摩尔电导率的关系是 ( )A.)()()(22-¥+¥¥+=L Cl Ca CaCl m m m l l B.)()(5.0)(22-¥+¥¥+=L Cl Ca CaCl m m m l l C.)(2)()(22-¥+¥¥+=L Cl Ca CaCl m m m l l D.)]()([2)(22-¥+¥¥+=L Cl Ca CaCl m m m l l 2.强电解质CaCl 2的水溶液,其离子平均活度±a 与电解质活度B a 之间的关系为之间的关系为( ) A. B a a =± B. 3B a a =± C. 2/1B a a =± D. 3/1B a a =± 3.在不可逆电极过程中,随着电流密度的增大 ( )A.阴极电势变低,阳极电势变高阴极电势变低,阳极电势变高B. 电池的电动势降低电池的电动势降低C.电解池耗电能增加电解池耗电能增加D. 以上说法都对以上说法都对 4.某电池反应为-++=++OH Hg l O H g O l Hg 42)(2)()(2222,当电池反应达平衡时,电池的电动势E 必然是必然是 ( )A. 0>EB. J E E =C. 0<ED. 0=E 5.下列说法中正确的是:.下列说法中正确的是: ( )A. 反应级数等于反应分子数反应级数等于反应分子数B. 具有简单级数的反应是基元反应具有简单级数的反应是基元反应C. 不同反应若具有相同的级数形式,一定具有相同的反应机理D. 反应级数不一定是简单正整数反应级数不一定是简单正整数6.某化学反应的方程式为B A ®2,在动力学研究中表明该反应为,在动力学研究中表明该反应为( ) A. 二级反应二级反应 B. 基元反应基元反应 C. 双分子反应双分子反应 D. 以上都无法确定以上都无法确定7.设理想气体反应体系P A ®的速率方程为A c c c k r =,若用分压表示浓度,速率方程可写为A P P P k r =,式中c k 与P k 的关系为的关系为 ( )A. P c k k =B. RT k k P c ×=C. RT k k c P ×=D. P c k k /1= 8.催化剂能极大地改变反应速率,下列说法错误的是 ( )A. 催化剂改变了反应历程催化剂改变了反应历程B. 催化剂降低了反应活化能催化剂降低了反应活化能C. 催化剂改变了反应平衡,提高了转化率D. 催化剂同时加快正向与逆向反应催化剂同时加快正向与逆向反应9.一定温度、压力下,将1克液体水分散成半径为10 -9米的小水滴,经过此变化后,以下性质保持不变的是以下性质保持不变的是 ( )A. 总表面能总表面能B. 表面张力表面张力C. 比表面积比表面积D. 液面下的附加压力液面下的附加压力10.硅胶吸水后其表面吉布斯自由能将.硅胶吸水后其表面吉布斯自由能将 ( )A. 降低降低B. 升高升高C. 不变不变D. 无法确定无法确定 11.在水中加入肥皂液后,将发生.在水中加入肥皂液后,将发生 ( )A. 0/<a g d d 正吸附正吸附B. 0/<a g d d 负吸附负吸附C. 0/>a g d d 正吸附正吸附D. 0/>a g d d 负吸附负吸附 12.将少量的KI 溶液加入AgNO 3溶液中制得AgI 溶胶,下列电解质聚沉能力最强的是( )A. NaCl B. FeCl 3 C. MgSO 4 D. K 3PO 413.下列各分散体系中丁铎尔(Tyndall )效应最强的是)效应最强的是 ( )A. 食盐水溶液食盐水溶液B. 大分子溶液大分子溶液C. 空气空气D. Fe(OH)3溶胶溶胶14.下列电池中能测定AgCl 的)(AgCl G mfJ D 的是的是 ( )A. Ag(s)|AgCl(s)|KCl(aq)|Cl 2(p J),Pt B. Ag(s)|Ag +||Cl -|Cl 2(g),Pt C. Ag(s)|Ag +||Cl -| AgCl(s)| Ag(s) D. Ag(s)|AgCl(s)| Cl -|| Ag +| Ag(s) 15.乳状液属于.乳状液属于 ( )A. 分子分散体系分子分散体系B. 胶体分散体系胶体分散体系C. 粗分散体系粗分散体系D. 憎液溶胶憎液溶胶 16.兰缪尔(Langmuir)吸附理论中最重要的基本假设是吸附理论中最重要的基本假设是 ( ) A. 气体处于低压下气体处于低压下 B. 固体表面的不均匀性固体表面的不均匀性 C. 吸附是单分子层的吸附是单分子层的 D. 吸附是放热的吸附是放热的17.电池在恒温、恒压下可逆放电1F 与以一定的电压放电1F ,二者相比不同的是二者相比不同的是 ( ) A. 电池反应的m r U D B. 电池反应的m r H D C. 与环境交换的热Q D. 电池反应的m r G D 18.一定T 、P 下可以发生D G >0的反应是的反应是 ( )A. 原电池中的反应原电池中的反应B. 光化学反应光化学反应C. 催化反应催化反应D. 溶液中的反应溶液中的反应 19.胶体体系能够保持相对稳定的最重要因素是 ( )A. 布朗运动布朗运动B. 胶粒表面的扩散双电层胶粒表面的扩散双电层C. 溶剂化层的作用溶剂化层的作用D. 胶体为微多相体系胶体为微多相体系 20.某光化学反应A + h n ®n® A*, 其速率与其速率与 ( ) A. A 的浓度有关的浓度有关 B. A 的浓度无关的浓度无关 C. A 的浓度和h n 有关有关 D. 不确定不确定。

第八章电解质溶液1・Faraday电解定律的基本内容是什么?这定律在电化学中有何用处? 答:法拉第电解定律的基本内容是:通电于电解质溶液之后,(1)在电极上(两相界面),发生化学变化的物质的量与通入电荷成正比・(2〉若将几个电解池串联,通入一定的电荷量后,在各个电解池的电极上发生化学变化的物质的量都相等.Q(E)=Z+eL=z^F根据Faraday定律,通过分析电解过程中反应物在电极上物质的量的变化,就可求岀电荷量的数值,在电化学的定量研究和电解工业上有重要的应用.2.电池中正极、负极、阴极、阳极的定义分别是什么?为什么在原电池中负极是阳极而正极是阴极?答:给出电子到外电路的电极叫做电池的负极,在外电路中电势低.从外电路接受电子的电极叫做电池的正极,在外电路中电势较高.发生氧化作用的电极称为阳极,发生还原作用的一极称为阴极•原电池的阳极发生氧化作用•阴极发生还原作用,内电路的电子由阳极运动到阴极•所以原电池的阴极是正极,阳极是负极.3・电解质溶液的电导率和摩尔电导率与电解质溶液浓度的关系有何不同?为什么?答:强电解质溶液的电导率随着浓度的增大而升高(导电粒子数目增多),但大到一定程度以后,由于正、负离子之间的相互作用增大,因而使离子的运动速率降低,电导率反而下降•弱电解质的电导率随浓度的变化不显著,浓度增加电离度减少,离子数目变化不大•摩尔电导率随浓度的变化与电导率不同,浓度降低,粒子之间相互作用减弱,正、负离子的运动速率因而增加,故摩尔电导率增加.4.怎样分别求强电解质和弱电解质的无限稀释摩尔电导率?为什么要用不同的方法?答:在低浓度下,强电解溶液的摩尔电导率与乞成线性关系.在一定温度下,一定电解质溶液来说,0是定值,通过作图,直线与纵坐标的交点即为无限稀释时溶液的摩尔电导率人箒•即外推法.弱电解质的无限稀释摩尔电导率A益,根据离子独立移动定律,可由强电解质溶液的无限稀释摩尔电导率A 益设计求算,不能由外推法求岀,由于弱电解质的稀溶液在很低浓度下与坨不呈直线关系•并且浓度的变化对4m 的值影响很大,实验的误差很大,由实验值直接求弱电解质的A益很困难.5.离子的摩尔电导率、离子的迁移速率、离子的电迁移率和离子迁移数之间有哪些定量关系式?答:定量关系式:厂+ = “+ dE/ dZ r- = u- dE/ dl厂+ •厂-离产迁移速率山+ 4一离子的电迁移率.饥I4 7一厂++~・"乍=耳=母卯正离子迁移数艺= 1无限稀释强电解质溶液銘=益4 +銘・-盈=(屛+“GF・6.在某电解质溶液中,若有i种离子存在,则溶液的总电导应该用下列哪个公式表示: 答:对电解质溶液来说电导G是其导电的能力,以1一1型电解质溶液为例.⑴G=^+舟+ ・・・;(2)G = 爭?为什么?G=K AJ I K =A H \ • c稀电解质溶液A m =Ai +Am ・•・〃=(△: +Am >C = Am ・ c+Am ・ c «+ =Am • c 则 G+ =/c> A/2・•・G 总=G++G —=盒+古…=工盒・7. 电解质与非电解质的化学势表示形式有何不同?活度因子的表示式有何不同? 答:非电解质的化学势的表示形式:活度因子表示式:非电解质a m ^ = Vm^ —电解质 QB=a 甘• a^r =a±・&为什么要引进离子强度的概念?离子强度对电解质的平均活度因子有什么影响?答:在稀溶液中,影响离子平均活度因子7士的主要因素是离子的浓度和价数,并且离子价数比浓度影 响还要更大一些•且价型愈高,影响愈大,因此而提出离子强度的概念.I = *另加必对平均活度因子的影响lg/+=—常数/!9. 用DebyeHuckel 极限公式计算平均活度因子时有何限制条件?在什么时候要用修正的Debys Hiickel 公式? 答:限制条件为:① 离子在静电引力下的分布遵从Boltzmann 分布公式,并且电荷密度与电势之间的关系遵从静电学中的Poisson (泊松)公式.I② 离子是带电荷的圆球,离子电场是球形对称的,离子不极化•在极稀溶液中可看成点电荷.③ 离子之间的作用力只存在库仑引力,其相互吸引而产生的吸引能小于它的热运动的能量.④ 在稀溶液中,溶液的介电常数与溶剂的介电常数相差不大,可以忽略加入电解质后的介电常数的变 化.若不把离子看作点电荷,考虑到离子的直径,极限公式修正为:—A\z+z- 1/7lgy 士随着离子半径的增大而增大•所以溶液中离子溶度增加,迁移速率亦将增加.12. 影响难溶盐的溶解度主要有哪些因素?试讨论AgCl 在下列电解质溶液中的溶解度大小,按由小 到大的次序排列出来(除水外,所有的电解质的浓度都是0・1 mol ・dm'3).(l) NaNQ (2)NaCl (3)H 2O (4)CuSC)4 (5)NaBr阿=阴(T) +RTlnZn.B 今=炖(丁) +RTlnoni ・B电解质 /zB=/^(T)+RTlnaB=〃g(T) + RTlna# • cf-7M Blgz±= 1+辆I ・10. 不论是离子的电迁移率不是摩尔电导率,氢离子和氢氧根离子都比其他与之带相同电荷的离子要 大得多,试解释这是为什么?答:在水溶液中,屮和OH-离子的电迁移率和摩尔电导率特别大,说明 屮和OH —在电场力作用下 运动速率特别快,这是因为水溶液具有氢键质子可以在水分子间转换,电流很快沿着氢键被传导.11. 在水溶液中带有相同电荷数的离子,如Li 十,Na 十,K + ,Rb +,…,它们的离子半径依次增大,而迁移 速率也相应增大,这是为什么?答:IF ,Na+ ,K+ ,Rb 〒等离子带有相同的电荷,离子半径依次增大,根据修正的Debye-Huckel 公式:答:影响难溶盐的溶解度的主要因素有:①共同离子影响,如AgBr在NaBr中的溶解度远小于水中的溶解度.②其它电解质的影响,其它电解质的存在通过影响离子强度,影响难溶盐的活度系数,从而影响溶解度.溶解度顺序为:(2)<(3)<(1)<(4)«5).13.用Pt电极电解一定浓度的CuSQ溶液,试分析阴极部、中部和阳极部溶液的颜色在电解过程中有何变化?若都改用Cu电极,三部溶液颜色变化又将如何?答:Pt是惰性电极,阴极部溶液中C£+被还原生成Cu,溶液中Ci?+的浓度变小,颜色变淡,阳极部溶液中+向中部迁移,颜色变淡,中部的颜色在短时间内基本保持不变.用Cu做电极时,阴极部的颜色变淡,中部基本不变,阳极部颜色变深.14.什么叫离子氛?Debye-Hiickel-()nsager电导理论说明了什么问题?苔:溶液中每一个离子都被电荷符号相反的离子所包围,由于离子间的相互作用使得离子分布不均匀, 从而形成离子氛.Deby^Huckel-Oisager电导理论说明,电解质溶液的摩尔电导率与离子间相互作用、离子的性质、离子本身结构和溶剂能力以及介质的介电常数都有关系.第九章1.可逆电极有哪些主要类型?每种类型试举一例,并写出该电极的还原反应。
物化期末知识点总结一、物质与能量1. 物质的分类:纯物质和混合物,纯物质又分为单质和化合物。
2. 物质的性质:物质的物理性质和化学性质。
物理性质包括颜色、味道、密度等,化学性质包括燃烧性、稳定性等。
3. 物质的变化:物质的物理变化和化学变化。
物理变化包括相变和形态变化,化学变化指物质的化学反应。
4. 能量的分类:能源和能量转化,能源包括化学能、热能、光能等。
能量转化的方式包括热能转化、化学能转化、机械能转化等。
二、原子结构与元素周期表1. 原子的组成:原子由质子、中子和电子组成,质子和中子存在于原子核中,电子绕核运动。
2. 在原子核中,质子和中子的质量分别为1和1.008,而电子的质量很小可以忽略。
3. 原子的电荷平衡:原子中质子和电子的数目相等,因此原子没有净电荷。
4. 元素周期表:元素周期表按照一定的规律排列,周期表的主体是元素的原子核中质子的数目,以及元素的电子排布规律。
三、电子排布和化学键1. 电子排布规律:电子在原子中的排布遵循泡利不相容原理、能量最低原理和阻塞原理。
2. 电子层级:一个原子中的电子分布在不同的能级上,电子层级从内到外依次是K层、L 层、M层等。
3. 电子云模型:电子在原子中的运动可以形成一个电子云模型,其中最外层的电子称为价电子。
4. 化学键:化学键是原子之间的相互作用力,包括离子键、共价键和金属键。
离子键是由正负离子之间的相互引力产生的,共价键是由共享电子对形成的。
四、物质的量和化学方程式1. 物质的量:物质的量是用摩尔(mol)来表示的,1摩尔物质的质量等于该物质相对分子质量(相对原子质量)的数值(g)。
2. 摩尔质量和摩尔体积:摩尔质量指的是1摩尔物质的质量,摩尔体积指的是1摩尔气体在标准状况下的体积。
3. 化学方程式:化学方程式是用化学符号表示化学反应过程的方程式,由反应物、生成物和反应条件组成。
五、化学反应的速率和平衡1. 反应速率:反应速率是指化学反应中反应物浓度变化的快慢程度。
物理化学下册复习物理化学下册的知识体系较为复杂,涵盖了诸多重要的概念和原理。
为了更好地掌握这部分内容,进行系统的复习是必不可少的。
首先,我们来回顾一下化学动力学这一重要章节。
化学动力学主要研究化学反应的速率和反应机制。
反应速率的定义是单位时间内反应物或生成物浓度的变化量。
影响反应速率的因素众多,包括反应物的浓度、温度、催化剂等。
浓度对反应速率的影响可以用速率方程来描述,比如对于简单的反应 aA +bB → cC + dD,其速率方程可能表示为 r = kA^mB^n ,其中 k 是反应速率常数,m 和 n 则是反应物 A 和 B 的反应级数。
温度对反应速率的影响通常用阿仑尼乌斯公式来表达,即 k = A e^(Ea/RT) ,其中 A 是指前因子,Ea 是反应的活化能,R 是气体常数,T 是热力学温度。
活化能的概念非常关键,它反映了反应物分子要发生反应所需克服的能垒。
催化剂能够显著改变反应速率,但它在反应前后自身的化学性质和质量并不发生变化。
催化剂通过改变反应的路径,降低反应的活化能,从而加速反应的进行。
接下来是电化学部分。
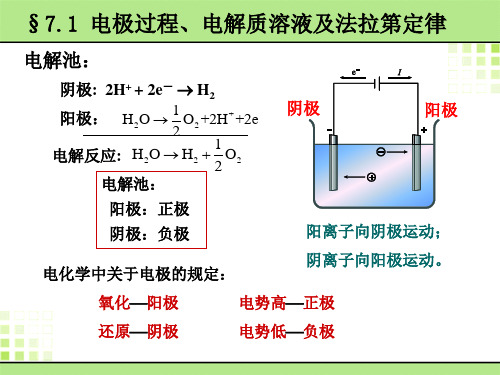
电化学研究的是电能和化学能之间的相互转换以及相关的规律。
原电池和电解池是电化学中的两个重要概念。
原电池是将化学能转化为电能的装置,而电解池则是将电能转化为化学能。
能斯特方程在电化学中具有重要地位,它用于计算电极的电极电势。
对于氧化还原反应 aA + bB = cC + dD ,其能斯特方程可以表示为φ =φ° +(RT/nF)ln(C^cD^d/A^aB^b) 。
通过能斯特方程,我们可以了解浓度、温度等因素对电极电势的影响。
在电解质溶液方面,需要了解强电解质和弱电解质的区别,以及电导、电导率、摩尔电导率等概念。
离子迁移数也是一个重要的知识点,它表示某种离子所传输的电量在总电量中所占的比例。
表面化学这一章节同样不容忽视。
表面张力是表面化学中的核心概念,它是指增加单位表面积时所需要的功。
第八章电解质溶液第九章1.可逆电极有哪些主要类型?每种类型试举一例,并写出该电极的还原反应。
对于气体电极和氧化还原电极在书写电极表示式时应注意什么问题?答:可逆电极有三种类型:(1)金属气体电极如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s)(2)金属难溶盐和金属难溶氧化物电极如Ag(s)|AgCl(s)|Cl-(m), AgCl(s)+ e- = Ag(s)+Cl-(m)(3)氧化还原电极如:Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2)对于气体电极和氧化还原电极,在书写时要标明电极反应所依附的惰性金属。
2.什么叫电池的电动势?用伏特表侧得的电池的端电压与电池的电动势是否相同?为何在测电动势时要用对消法?答:正、负两端的电势差叫电动势。
不同。
当把伏特计与电池接通后,必须有适量的电流通过才能使伏特计显示,这样电池中发生化学反应,溶液浓度发生改变,同时电池有内阻,也会有电压降,所以只能在没有电流通过的情况下才能测量电池的电动势。
3.为什么Weslon标准电池的负极采用含有Cd的质量分数约为0.04~0.12的Cd一Hg齐时,标准电池都有稳定的电动势值?试用Cd一Hg的二元相图说明。
标准电池的电动势会随温度而变化吗?答:在Cd一Hg的二元相图上,Cd的质量分数约为0.04~0.12的Cd一Hg齐落在与Cd一Hg固溶体的两相平衡区,在一定温度下Cd一Hg齐的活度有定值。
因为标准电池的电动势在定温下只与Cd一Hg齐的活度有关,所以电动势也有定值,但电动势会随温度而改变。
4.用书面表示电池时有哪些通用符号?为什么电极电势有正、有负?用实验能测到负的电动势吗?答:用“|”表示不同界面,用“||”表示盐桥。
电极电势有正有负是相对于标准氢电极而言的。
不能测到负电势。
5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst方程计算电极的还原电势?5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst 方程计算电极的还原电势?答:电极电势不是电极表面与电解质溶液之间的电势差。