高中化学常见无机物的用途
- 格式:doc
- 大小:20.50 KB
- 文档页数:2

第三部分常见无机物及其应用第一章常见的金属元素第一节金属概述和碱金属【双基在线】一、金属的性质:1.物理性质:大多数是不透明具有金属光泽的晶体,是电和热的良导体,有延展性。
2.化学性质:(1)能与活泼的非金属单质化合成相对应的二元化合物。
(2)与水(或与酸)反应。
(3)金属间的置换反应。
Fe + CuSO4 = FeSO4 + Cu(4)特殊性质与重要反应:a. 2Mg + CO2 = 2MgO + Cb. 8Al + 3Fe3O4 = 9Fe + 4Al2O3c. Fe + 2FeCl3 = 3FeCl2d. 2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2 ↑4.合金:两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质叫合金。
合金比它的成分金属具有许多良好的物理的、化学的或机械的等方面的性能,一般地说,合金的熔点比其各成分金属的熔点低,强度和硬度都大于其各成分的金属。
二、金属钠:1.物理性质:银白色金属光泽,硬度小、比水轻、熔点低,易导电、传热。
2.化学性质:(1)与O2反应(常温)4Na + O2 = 2Na2O ;(点燃)2Na + O2 = Na2O2(2)与水反应(水中滴有酚酞):2Na + 2H2O = 2NaOH + H2↑现象:浮、熔、游、响、红(有声有色:现象要联系到性质)3.钠的存在与保存:(1)只以化合态存在;(2)密封保存,通常保存在煤油中。
4.用途:制取过氧化钠等化合物,钠钾合金作原子反应堆的导热剂(热流体),还原金属,用于电光源。
5.钠的制法:2 ↑四、碱金属元素性质的相似性和递变性:碱金属包括锂、钠、钾、铷、铯和钫六种(其中钫为放射性元素)元素符号分别为:Li 、【要点点拨】1.探究金属活动性的规律:(1)金属与水或酸反应越剧烈,该金属越活泼。
(2)金属对应的氢氧化物的碱性越强,该金属越活泼。
(3)一种金属能从另一种金属的盐溶液中将其转换出来,则该金属活泼性比另一种金属强。

高中化学常见物质及应用高中化学常见物质及其应用:一、无机化合物:1. 水(H2O):水是一种无机化合物,常见于生活中。
它有很多应用,包括饮用、煮饭、清洗、浇灌植物等。
此外,水也是化学反应中的重要参与物,许多反应都需要水作为溶剂。
2. 氧气(O2):氧气是一种气体,在空气中占据很大比例。
它可以用于人类呼吸、火的燃烧和细胞呼吸等生物过程中。
此外,氧气还可以用于氧疗、高效燃烧和氧化反应等许多实验和工业应用中。
3. 二氧化碳(CO2):二氧化碳在大气中也很常见,是一种重要的温室气体。
它还可以用于饮料制作中的注气、灭火装置、气泡发生器等应用。
4. 氯化钠(NaCl):氯化钠是食盐的化学名。
它是一种普遍使用的调味品,用于食品的烹饪和保存。
此外,氯化钠还可以用于净水、制氯和防腐剂等。
5. 重要金属:铁、铜、锌等金属常见于生活中,具有广泛的应用。
铁可用于建筑、制造机械和生产钢铁。
铜可用于电气导线、水管和制作乐器等。
锌可用于镀锌、蓄电池和合金制造等。
6. 硫酸(H2SO4):硫酸是一种强酸,广泛用于实验室和工业领域。
它可用于制作化肥、染料、肥皂和清洗剂等。
7. 氨气(NH3):氨气是一种具有刺激性气味的无色气体。
它可用于制作氮肥、清洗剂、合成纤维等。
8. 氧化铜(CuO):氧化铜是一种黑色固体,可用于制作铜盐、颜料、导电材料等。
二、有机化合物:1. 葡萄糖(C6H12O6):葡萄糖是一种常见的单糖,是人类和其他生物的重要能量来源。
它还用于食品加工、饮料制作和制药工业。
2. 乙醇(C2H5OH):乙醇是一种无色液体,广泛应用于食品饮料、消毒剂、溶剂等。
3. 甘油(C3H8O3):甘油是一种可溶于水的有机液体,主要用于制造肥皂和面霜等化妆品。
4. 丙酮(C3H6O):丙酮是一种无色液体,具有良好的溶剂性,可用于涂料、塑料和胶水的制造。
5. 苯(C6H6):苯是一种无色液体,具有特殊的芳香气味。
它是合成塑料、橡胶、染料和药物的重要原料。

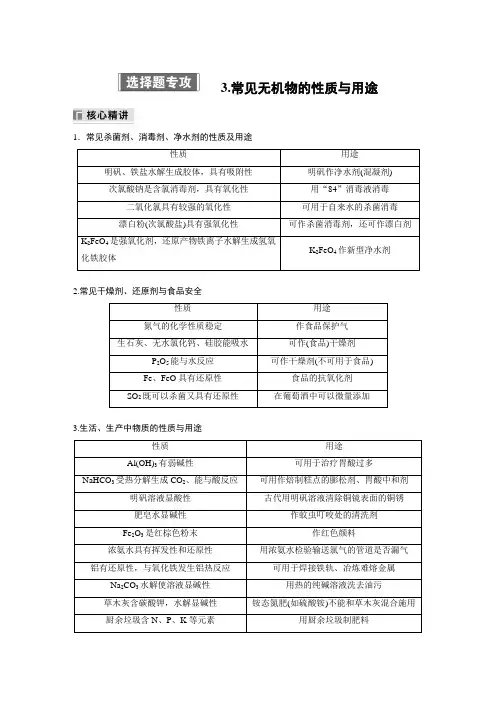
3.常见无机物的性质与用途1.常见杀菌剂、消毒剂、净水剂的性质及用途性质用途明矾、铁盐水解生成胶体,具有吸附性明矾作净水剂(混凝剂)次氯酸钠是含氯消毒剂,具有氧化性用“84”消毒液消毒二氧化氯具有较强的氧化性可用于自来水的杀菌消毒漂白粉(次氯酸盐)具有强氧化性可作杀菌消毒剂,还可作漂白剂K2FeO4是强氧化剂,还原产物铁离子水解生成氢氧K2FeO4作新型净水剂化铁胶体2.常见干燥剂、还原剂与食品安全性质用途氮气的化学性质稳定作食品保护气生石灰、无水氯化钙、硅胶能吸水可作(食品)干燥剂P2O5能与水反应可作干燥剂(不可用于食品)Fe、FeO具有还原性食品的抗氧化剂SO2既可以杀菌又具有还原性在葡萄酒中可以微量添加3.生活、生产中物质的性质与用途性质用途Al(OH)3有弱碱性可用于治疗胃酸过多NaHCO3受热分解生成CO2、能与酸反应可用作焙制糕点的膨松剂、胃酸中和剂明矾溶液显酸性古代用明矾溶液清除铜镜表面的铜锈肥皂水显碱性作蚊虫叮咬处的清洗剂Fe2O3是红棕色粉末作红色颜料浓氨水具有挥发性和还原性用浓氨水检验输送氯气的管道是否漏气铝有还原性,与氧化铁发生铝热反应可用于焊接铁轨、冶炼难熔金属Na2CO3水解使溶液显碱性用热的纯碱溶液洗去油污草木灰含碳酸钾,水解显碱性铵态氮肥(如硫酸铵)不能和草木灰混合施用厨余垃圾含N、P、K等元素用厨余垃圾制肥料硅是常用的半导体材料可作太阳能电池板、电脑芯片二氧化硅导光能力强可作光导纤维4HF+SiO2===2H2O+SiF4↑用HF刻蚀玻璃Al具有良好的延展性和抗腐蚀性常用铝箔包装物品MgO、Al2O3的熔点很高作耐高温材料镁铝合金质量轻、强度大可用作高铁车厢材料水玻璃(硅酸钠)不燃不爆可用作耐火材料、防腐剂等锂质量轻、比能量大可用作电池负极材料锌的活泼性大于铁在海轮外壳上装若干锌块以减缓船体腐蚀1.(2023·广东,3)建设美丽乡村,守护中华家园,衣食住行皆化学。

【高考化学】模块一常见无机物的性质与用途一、常见无机物1、混合物2、纯净物二、无机物质的特征性质1、常见物质的颜色全部颜色分类O3红棕色;Fe(OH)3红褐色;[Fe(SCN)]2+红色(或血红色);Cu2O红色(或砖红色);被氧化的苯2酚(即苯醌)粉红色;石蕊在pH<5的溶液中呈红色;酚酞在pH8~10的溶液中呈浅红色;NO2红棕色;红磷暗红色;Br2深棕红色;品红溶液红色;充氦气、氖气的灯管红色;Cu紫红色;*甲基橙在pH<3.1的溶液中显红色。
-紫红色;[Fe(C6H5O)6]3—紫色;I2紫黑色;I2蒸汽紫色;I2的CCl4或苯或汽油等溶液紫红色4(碘酒褐色);充氩气的灯管蓝紫色;石蕊在pH5~8的溶液中呈紫色。
*甲基橙在pH3.3~4.4的溶液中呈橙色。
Fe(OH)2变成Fe(OH)3的中间产物灰绿色。
晶体棕黄色;FeCl3晶体棕红色。
2、AgI、Ag3PO4、Fe3+、不纯硝基苯黄色;Na2O2、三硝基甲苯、AgBr、F2、硝化甘油、NaNO2黄色;*甲基橙在pH>4.4的溶液中呈黄色。
2+、Cu(OH)2、CuSO4·5H2O;石蕊在pH>8的溶液中呈蓝色;I2遇淀粉变蓝色;液态、固态的氧气淡蓝色;MnO2、CuO、CuS、Cu2S、PbS、Ag2S、FeS、FeO、Fe3O4黑色;Si 灰黑色;石油黑色或深棕色;煤焦油黑褐色。
绿色:Fe2+浅绿色;Cl2淡黄绿色;CuCl2浓溶液绿色(很浓黄绿色、稀则蓝色);碱式碳酸铜绿色。
O褐色;溶解了溴的溴苯褐色;碘酒褐色。
22、物质的状态:常温下为液体的单质:Br2、Hg常温下的常见的无色液体:H2O H2O2常见的气体单质:H2、N2、O2、F2、Cl2、NH3、HF、HCl(HX)、H2S、CO、CO2、NO、NO2、SO2)[注:有机物中的气态烃CxHy(x≤4);有机化学中有许多液态物质,但是含氧有机化合物中只有HCHO常温下是气态]常见的固体单质:I2、At、S、P、C、Si、金属单质;白色胶状沉淀(Al(OH)3、H4SiO4)3、物质的气味:有臭鸡蛋气味的气体:H2S有刺激性气味的气体:Cl2、SO2、NO2、HX、NH3有刺激性气味的液体:浓盐酸、浓硝酸、浓氨水、氯水、溴水4、物质的毒性:非金属单质有毒的:Cl2、Br2、I2、F2、S、P4常见的有毒气体化合物:CO、NO、NO2、SO2、H2S、能与血红蛋白结合的是CO和NO5、物质的溶解性:极易溶于水的气体:HX、NH3常见的难溶于水的气体:H2、N2、NO、CO、CH4、C2H4、C2H2S和P4不溶于水,微溶于酒精,易溶于二硫化碳。

无机化合物种类性质与应用概述无机化合物是由非碳元素与碳元素形成的化合物,具有多种多样的种类、性质和应用。
本文将对无机化合物的不同种类、性质以及各个领域中的应用进行概述。
一、无机盐类无机盐类是无机化合物中最常见的一类。
它们一般由金属离子和非金属离子组成,具有晶体结构和良好的溶解性。
无机盐类的性质多样,如氯化钠具有辛辣的味道,硫酸铁可起到催化作用等。
无机盐类广泛应用于农业、医药、化工等领域,例如氯化钠被用作食盐,硫酸铝在净水处理中起着重要作用。
二、氧化物氧化物是由金属与氧元素形成的化合物,它们通常具有高的熔点和热稳定性。
氧化物的性质与氧化态和金属离子的电荷密切相关。
例如二氧化碳是一种无色气体,具有酸性。
氧化物广泛应用于陶瓷、电子器件、涂料等领域。
氧化铝是一种重要的陶瓷材料,被广泛用于制作陶瓷、电子器件等。
三、酸酸是一类能够释放出H+离子的化合物,具有酸性的性质。
酸可分为无机酸和有机酸两类。
无机酸如硫酸、盐酸等在化工制剂、冶金等领域得到广泛应用。
有机酸如乙酸、柠檬酸则常用于食品添加剂、制药等行业。
四、金属硫化物金属硫化物是由金属和硫元素形成的化合物,具有高熔点和良好的电导性。
金属硫化物在化学反应和电子器件中具有重要应用。
例如二硫化钼被广泛应用于润滑剂、电子器件等领域。
五、配合物配合物是由金属离子和配体形成的化合物。
配合物的性质与金属离子的性质以及配体的种类密切相关。
配合物在催化剂、药物、染料等领域都有广泛应用。
例如铁氰化钾是一种常见的配位化合物,在印染和药物制备中有重要作用。
总结:无机化合物种类繁多,拥有多样的性质和广泛的应用。
从无机盐类到氧化物、酸、金属硫化物再到配合物,每一类都具有各自的特点和用途。
通过深入了解无机化合物的性质和应用,我们可以更好地利用它们来满足人们的需求,并推动科学技术的发展。
无机化合物的研究和应用也将继续在各个领域中发挥重要作用。

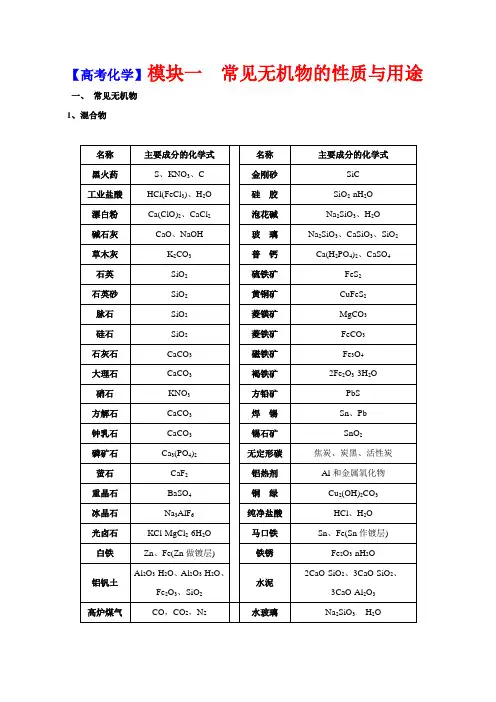
【高考化学】模块一常见无机物的性质与用途一、常见无机物1、混合物2、纯净物二、无机物质的特征性质1、常见物质的颜色全部颜色分类O3红棕色;Fe(OH)3红褐色;[Fe(SCN)]2+红色(或血红色);Cu2O红色(或砖红色);被氧化的苯2酚(即苯醌)粉红色;石蕊在pH<5的溶液中呈红色;酚酞在pH8~10的溶液中呈浅红色;NO2红棕色;红磷暗红色;Br2深棕红色;品红溶液红色;充氦气、氖气的灯管红色;Cu紫红色;*甲基橙在pH<3.1的溶液中显红色。
-紫红色;[Fe(C6H5O)6]3—紫色;I2紫黑色;I2蒸汽紫色;I2的CCl4或苯或汽油等溶液紫红色4(碘酒褐色);充氩气的灯管蓝紫色;石蕊在pH5~8的溶液中呈紫色。
*甲基橙在pH3.3~4.4的溶液中呈橙色。
Fe(OH)2变成Fe(OH)3的中间产物灰绿色。
晶体棕黄色;FeCl3晶体棕红色。
2、AgI、Ag3PO4、Fe3+、不纯硝基苯黄色;Na2O2、三硝基甲苯、AgBr、F2、硝化甘油、NaNO2黄色;*甲基橙在pH>4.4的溶液中呈黄色。
2+、Cu(OH)2、CuSO4·5H2O;石蕊在pH>8的溶液中呈蓝色;I2遇淀粉变蓝色;液态、固态的氧气淡蓝色;MnO2、CuO、CuS、Cu2S、PbS、Ag2S、FeS、FeO、Fe3O4黑色;Si 灰黑色;石油黑色或深棕色;煤焦油黑褐色。
绿色:Fe2+浅绿色;Cl2淡黄绿色;CuCl2浓溶液绿色(很浓黄绿色、稀则蓝色);碱式碳酸铜绿色。
O褐色;溶解了溴的溴苯褐色;碘酒褐色。
22、物质的状态:常温下为液体的单质:Br2、Hg常温下的常见的无色液体:H2O H2O2常见的气体单质:H2、N2、O2、F2、Cl2、NH3、HF、HCl(HX)、H2S、CO、CO2、NO、NO2、SO2)[注:有机物中的气态烃CxHy(x≤4);有机化学中有许多液态物质,但是含氧有机化合物中只有HCHO常温下是气态]常见的固体单质:I2、At、S、P、C、Si、金属单质;白色胶状沉淀(Al(OH)3、H4SiO4)3、物质的气味:有臭鸡蛋气味的气体:H2S有刺激性气味的气体:Cl2、SO2、NO2、HX、NH3有刺激性气味的液体:浓盐酸、浓硝酸、浓氨水、氯水、溴水4、物质的毒性:非金属单质有毒的:Cl2、Br2、I2、F2、S、P4常见的有毒气体化合物:CO、NO、NO2、SO2、H2S、能与血红蛋白结合的是CO和NO5、物质的溶解性:极易溶于水的气体:HX、NH3常见的难溶于水的气体:H2、N2、NO、CO、CH4、C2H4、C2H2S和P4不溶于水,微溶于酒精,易溶于二硫化碳。

1.N2:合成氨,填充灯泡(与氩气),保存粮食2.稀有气体—保护气,霓虹灯,激光3.H2探空气球,氢氧焰,冶金,合成氨,高能无害燃料;4.CO2灭火剂,制纯碱,制尿素,人工降雨(干冰)5.C. 金刚石:制钻头石墨:制电极,坩埚,铅笔芯,高温润滑剂木炭制黑火药; 焦炭冶金; 炭黑制油黑、颜料、橡胶耐磨添加剂6.CaCO3:建筑石料,混凝土,炼铁熔剂,制水泥,制玻璃,制石灰7.Cl2:自来水消毒,制盐酸,制漂白粉,制氯仿8.HF:雕刻玻璃,提炼铀,制氟化钠农药9.AgBr:感光材料;AgI:人工降雨;NaF:杀灭地下害虫10.S:制硫酸,硫化橡胶,制黑火药,制农药石硫合剂,制硫磺软膏治疗皮肤病11.P:白磷制高纯度磷酸,红磷制农药,制火柴,制烟幕弹12.Si:制合金,制半导体。
13.SiO2:制光导纤维,石英玻璃,普通玻璃14.Mg、Al制合金,铝导线,铝热剂15.MgO、Al2O3:耐火材料,Al2O3用于制金属铝16.明矾:净水剂;17.CuSO4:制波尔多液;PCl3:制敌百虫18.漂白剂:氯气、漂白粉(实质是HClO);SO2(或H2SO3);Na2O2;H2O2;O319.消毒杀菌:氯气,漂白粉(水消毒);高锰酸钾(稀溶液皮肤消毒),酒精(皮肤,75%)碘酒;苯酚(粗品用于环境消毒,制洗剂,软膏用于皮肤消);甲醛(福尔马林环境消毒)20.石膏:医疗绷带,水泥硬化速度调节21.皓矾:医疗收敛剂,木材防腐剂,媒染剂,制颜料;22.BaSO4:制其它钡盐;医疗“钡餐”23.制半导体:硒,硅,锗Ge,镓Ga24.K、Na合金,原子能反应堆导热剂;锂制热核材料,铷、铯制光电管25.芒硝:医疗缓泻剂;小苏打,治疗胃酸过多症26.磷酸钙:工业制磷酸,制过磷酸钙等磷肥;27.水玻璃:矿物胶用于建筑粘合剂,耐火材料28.MgCl2制金属镁(电解),Al2O3制金属铝(电解),NaCl制金属钠(电解)29.果实催熟剂—乙烯,30.气焊、气割有氧炔焰,氢氧焰31.乙二醇用于内燃机抗冻32.甘油用于制硝化甘油,溶剂,润滑油。

物质的用途(无机)HCLO:杀菌消毒,漂白织物氯气:自来水的消毒,制造盐酸,漂粉精制造多种农药,制造氯仿chcl3等有机溶剂,是重要的化工原料SO2:制造硫酸,杀菌消毒,做实物和干果的防腐剂,漂白纸浆、毛、丝、草帽亚铁离子有还原性,可与氯水同时使用做净水剂、杀菌消毒剂KAL(SO4)2·12H2O(明矾):净水剂硫酸钙:做石膏绷带,调节水泥凝结时间硫酸钡(天然重晶石):做X射线的内服药剂,钡餐SO2:大气主要的污染物,使人发生呼吸道疾病,会使植物枯死,形成酸雨氮气:合成氨,制硝酸,制氮肥,炸药作保护气:焊接金属,填充灯泡,保存食品医学上,液氮做冷冻剂,在冷冻麻醉下手术高科技领域:用液氮制造低温环境,有些超导材料获得超导性能NO:对环境污染和对人类的影响——包括破坏臭氧层,形成酸雨,与体内血红蛋白结合中毒,影响氧气的携带与输送(氮的氧化物都是大气污染物,其中NO2是造成光化学污染的主要因素)白磷:制高纯度磷酸,制燃烧弹,烟雾弹红磷:制高纯度磷酸,制农药,安全火柴氨气:制铵盐,硝酸,尿素,制医用稀氨水,制纯碱,制制冷剂硝酸:制王水,造炸药,染料,塑料,医药,硝酸盐;溶有二氧化氮的浓硝酸可作火箭中的助燃剂。
溶有在实验它是一种重要的化学试剂,也是一种重要的化工产品锂:冶金,医疗钠及其化合物:制玻璃,制皂,造纸,纺织,化工,制药,发酵粉,灭火器(干粉灭火器NaHCO3固体;泡沫灭火器Al2(SO4)3和NaHCO3溶液)钾钠元素是人体不可缺少的常量元素,NA-K合金做原子反应堆导热剂钾的化合物用于制造液态肥皂和玻璃,钾盐是重要的化肥铷铯在普通光的照射下能放出电子,可用于制造光电管钠:制取过氧化钠等化合物NA-K合金做原子反应堆导热剂做强还原剂制取稀有金属应用于灯光源,制高压钠灯过氧化钠:供氧剂(呼吸面具及潜水艇)漂白剂(永久性漂白)氢氧化钠:是重要的化工原料,在造纸,制皂,纺织,印染,精炼石油等工业上都有广泛的应用镁:制合金(结构材料)强还原性——冶炼金属信号弹,燃烧弹,照明弹,烟花礼花弹用于制造各种轻合金:镁和铝,铜,锡,锰,钛等金属形成的多种合金(约含镁80%),密度只有1.8g/cm3左右,是制造飞机火箭快艇车辆的重要材料铝:银白色光泽——制作涂料,银漆密度较小——制航空用合金导电性好——做导线,电缆反射性好——制高质量反射镜导热性好——各种热交换器,炊具延展性好——包装香烟,糖果铝热剂:冶炼难溶的金属(V,Cr,Mn),焊接钢材,铁轨氧化镁:熔点高,是优良的耐火材料,用来制造耐火砖,耐火管和坩埚氯化镁:制金属镁MgCO3(菱镁矿,滑石粉):很强的稀释能力,牙膏中的摩擦剂,橡胶制品中的填充剂MgSO4(泻盐):医治便秘和驱除蛔虫Al2O3(天然产的是刚玉,铝土矿(矾土)):冶炼铝的原料和耐火材料,用来制耐火坩埚,耐火管,耐高温的实验仪器。

高中化学无机物高中化学教学中,无机物是一个重要的知识点,它包括无机酸、碱、盐和氧化物等多种物质。
无机物是指由金属元素、非金属元素或金属元素与非金属元素组成的化合物,其结构稳定,不易发生化学变化。
本文将重点探讨高中化学无机物的性质、分类及应用。
一、性质1. 无机酸:无机酸是一类含有H+离子的化合物,具有酸性,能与碱发生中和反应。
常见的无机酸有硫酸、盐酸、硝酸等。
无机酸的酸性大小与其离子解离的程度有关,离子解离度越高,酸性越强。
2. 碱:碱是一类含有OH-离子的化合物,具有碱性,能与酸发生中和反应。
常见的碱有氢氧化钠、氢氧化钾等。
碱的碱性大小与其提供的氢氧离子的数量有关,提供的氢氧离子越多,碱性越强。
3. 盐:盐是由金属离子与非金属离子或者两种非金属离子组成的化合物,具有各种不同的性质。
常见的盐有氯化钠、硫酸钠、硫酸铜等。
盐的性质取决于其组成离子的种类和数量。
4. 氧化物:氧化物是一类含有氧元素的化合物,与其他物质发生氧化还原反应。
常见的氧化物有氧化铁、氧化铝、氧化钙等。
氧化物的性质与其中金属元素的氧化态有关,氧化态越高,氧化性越强。
二、分类无机物可以根据其成分和性质进行分类,主要分为无机盐、弱酸、强酸、弱碱、强碱等几种类型。
其中,无机盐是最常见和广泛应用的一类无机物,广泛应用于生活和工业生产中。
1. 无机盐:无机盐是由金属离子和非金属离子或者两种非金属离子组成的化合物,其具有各种不同的性质。
常见的无机盐有氯化钠、硫酸钠、硫酸铜等。
无机盐在农业、医药、化工等领域有着重要的应用价值。
2. 弱酸:弱酸是指离子解离程度较低,酸性较弱的无机酸。
常见的弱酸有碳酸、硼酸等。
弱酸通常在实验室中用于制备其他化合物或作为试剂使用。
3. 强酸:强酸是指离子解离程度较高,酸性较强的无机酸。
常见的强酸有硫酸、盐酸、硝酸等。
强酸在工业生产中有着广泛的应用,如用于废水处理、金属清洗等。
4. 弱碱:弱碱是指提供氢氧离子较少,碱性较弱的化合物。
第三章常见无机物及其应用3.1 常见金属元素及其化合物3.1.1 钠及其化合物单质钠的性质和用途金属钠是一种柔软,银白色、有金属光泽的金属,是热和电的良导体;它的密度为0.97g /cm3,比水的密度小,比煤油的密度大,熔点为97.81℃、沸点为882.9℃。
新切开的钠的光亮的表面很快变暗。
用酒精灯加热:钠先熔成闪亮的小球,然后剧烈燃烧,发出黄色的火焰,生成一种淡黄色色固体。
钠原子最外层只有一个电子,在化学反应中钠原子容易失去最外层的一个电子,具有很强的还原性,是一种活泼的金属元素。
(1)跟非金属反应:①金属钠放置在空气中,会迅速被氧化而生成氧化钠:4Na+O2=2Na2O,(空气中钠的切面变暗)②在空气(或氧气)中燃烧:2Na+O2Na2O2(黄色火焰),以上反应说明Na2O2比Na2O稳定。
可见,与O2反应时因条件不同而产物不同。
③在氯气中燃烧:2Na+Cl2NaCl(白烟)(2)钠与水反应:2Na+2H2O =2NaOH +H2↑现象:①浮:钠投入水中并浮在水面上②声:钠立即跟水反应,并放出热量,发出嘶嘶响声,产生气体。
③游:同时钠熔成一个闪亮的小球并在水面上向各方迅速游动最后消失④红:反应后的水溶液使酚酞变红。
(3)钠与酸反应:钠与酸的反应比水反应更激烈,极易爆炸。
(4)钠与盐溶液反应:先考虑钠与水反应生成NaOH,再考虑NaOH是否与盐反应。
例如:①钠与CuSO4溶液反应 2Na+2H2O=NaOH+H2↑ CuSO4+2NaOH=Na2SO4+Cu(OH)2合并:2Na+2H2O+CuSO4=Na2SO4 +Cu(OH)2↓+H2↑②钠与FeCl3溶液反应:6Na+6H2O+2FeCl3=6NaCl+2Fe(OH)3↓+3H2↑由于金属钠的化学性质非常活泼,易与空气中的O2、H2O等反应,所以少量金属钠可保存在煤油里,大量的金属钠则存在铁筒中用石蜡密封。
取用时一般先用镊子把钠从煤油中夹出来,并用滤纸把表面的煤油吸干,然后用小刀切下绿豆大小的一块再做有关实验。
高中化学教案:常见无机化合物的性质与应用一、常见无机化合物的性质1. 硫酸的性质硫酸(H2SO4)是一种无色、无臭的液体,具有强烈的腐蚀性。
它是一种二元强酸,可以与碱反应产生相应的盐和水。
硫酸的稀溶液呈酸性,可以与金属反应产生气体,如与锌反应生成氢气。
此外,硫酸还可被加热使其脱水,生成浓硫酸。
硫酸可用作工业上制造肥料、工艺品、塑料等的原料。
2. 氯化钠的性质氯化钠(NaCl)是一种无色结晶体,易溶于水,味咸。
在室温下是一种稳定的化合物,在高温下能够熔化形成热稳定的液态。
氯化钠可以通过电解氯化钠溶液得到金属钠和氯气的产物。
氯化钠还是一种重要的食盐,被广泛用于食品加工和调味。
3. 碳酸氢钠的性质碳酸氢钠(NaHCO3),也称为小苏打,在常温下为无色结晶体。
碳酸氢钠溶于水具有碱性,能与酸反应产生盐和二氧化碳气体。
这种化合物在酸洗、清洁剂以及烘焙食品中被广泛应用。
4. 氧化铁的性质氧化铁(Fe2O3)是一种固体,常见的有红色和黑色两种结构。
它是一种不溶于水的物质,在高温下与还原剂反应生成金属铁。
氧化铁的红色种类是一种重要的颜料,被用于颜料、涂料和陶瓷制造中。
二、常见无机化合物的应用1. 硫酸的应用硫酸广泛应用于工业、农业和日常生活中。
在工业界,硫酸被用作制造肥料、塑料、橡胶和合成材料等原料。
在农业领域,硫酸用作土壤调理剂,能够调节土壤的酸碱性,并提供植物所需的硫元素。
此外,硫酸还被用作清洗和脱色剂,在纺织工业和皮革加工中被广泛使用。
2. 氯化钠的应用氯化钠是一种重要的化学物质,被广泛应用于食品加工、医药制造、皮革加工和冶金工业等领域。
在食品加工中,氯化钠被用作调味剂和食盐。
在医药制造中,氯化钠被用作药物制剂的辅助成分以及一些治疗用途,如静脉注射盐水。
此外,氯化钠还可以用于皮革加工中的脱毛剂和金属冶金中的电解。
3. 碳酸氢钠的应用碳酸氢钠在日常生活中有广泛的应用。
它被用作一种食品添加剂,可在烘焙食品过程中产生二氧化碳,起到发酵和膨松的作用。
高中化学常见物质的用途高中化学是一门重要的科学学科,它研究了许多化学物质及其性质、结构与变化规律。
这些常见物质在日常生活中起着重要的作用,被广泛应用于不同的领域。
本文将介绍几种常见的高中化学物质及其主要用途。
1. 二氧化碳(CO2)二氧化碳是一种常见的化合物,在自然界中普遍存在,并参与了一系列重要的化学反应。
二氧化碳被广泛应用于工业生产、气候调节和食品加工等领域。
例如,二氧化碳被用作冷却剂和灭火剂,广泛应用于制冷设备和消防系统。
此外,二氧化碳还被用作使面团膨胀的脱氧剂,用于制作面包和蛋糕等食品。
2. 盐酸(HCl)盐酸是一种强酸,具有强烈的腐蚀性。
在实验室中,盐酸经常用于调节酸碱度和清洁设备。
此外,盐酸还被广泛用作工业生产中的原料和试剂。
例如,盐酸可以用于生产氯化铁、氯化铜等化学物质。
盐酸还被用作钢铁生产中的酸洗剂,去除金属表面的氧化物和污垢,提高金属的质量和外观。
3. 硫酸(H2SO4)硫酸是一种常见的无机酸,在化工、冶金和制药等行业中有广泛的应用。
硫酸是一种强酸,具有强烈的腐蚀性和氧化性。
它可以用作脱水剂、催化剂和溶剂等。
例如,硫酸可以用于冶炼铜、锌等金属,促进金属的氧化反应。
硫酸也被用作制药工业中的溶剂和催化剂,帮助合成药物和化学物质。
4. 氧气(O2)氧气是一种常见的气体,是生物体进行呼吸和能量代谢的必需物质。
氧气广泛应用于医疗、工业和燃料等领域。
在医疗领域,氧气被用作治疗呼吸系统疾病、提供急救和手术等用途。
在工业领域,氧气被用于燃烧和氧化反应,如钢铁冶炼、煤矿安全等。
此外,氧气还被用作火箭和喷射器的燃料,提供动力。
5. 碳酸钠(Na2CO3)碳酸钠,俗称苏打粉,是一种常见的无机化合物。
碳酸钠在日常生活中有许多用途,如清洁剂、食品添加剂和玻璃制造等。
碳酸钠可以与酸反应产生二氧化碳,用于烘焙食品时使面团发酵膨胀。
此外,碳酸钠还可以用作清洁剂,用于除去油渍和污垢。
在玻璃制造过程中,碳酸钠被用作玻璃的主要原料,调节玻璃的化学性质和抗碱性能。
⾼考化学常见⽆机物的性质与应⽤常见⽆机物及其应⽤⼀、⽐较元素⾦属性强弱的依据⾦属性——⾦属原⼦在⽓态时失去电⼦能⼒强弱(需要吸收能量)的性质⾦属活动性——⾦属原⼦在⽔溶液中失去电⼦能⼒强弱的性质1.在⼀定条件下⾦属单质与⽔反应的难易程度和剧烈程度。
⼀般情况下,与⽔反应越容易、越剧烈,其⾦属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。
⼀般情况下,与酸反应越容易、越剧烈,其⾦属性越强。
3.依据最⾼价氧化物的⽔化物碱性的强弱。
碱性越强,其元素的⾦属性越强。
4.依据⾦属单质与盐溶液之间的置换反应。
⼀般是活泼⾦属置换不活泼⾦属。
但是ⅠA族和ⅡA族的⾦属在与盐溶液反应时,通常是先与⽔反应⽣成对应的强碱和氢⽓,然后强碱再可能与盐发⽣复分解反应。
5.依据⾦属活动性顺序表(极少数例外)。
6.依据元素周期表。
同周期中,从左向右,随着核电荷数的增加,⾦属性逐渐减弱;同主族中,由上⽽下,随着核电荷数的增加,⾦属性逐渐增强。
7.依据原电池中的电极名称。
做负极材料的⾦属性强于做正极材料的⾦属性。
8.依据电解池中阳离⼦的放电(得电⼦,氧化性)顺序。
优先放电的阳离⼦,其元素的⾦属性弱。
9.⽓态⾦属原⼦在失去电⼦变成稳定结构时所消耗的能量越少,其⾦属性越强。
⼆、⽐较元素⾮⾦属性强弱的依据1.依据⾮⾦属单质与H2反应的难易程度、剧烈程度和⽣成⽓态氢化物的稳定性。
与氢⽓反应越容易、越剧烈,⽓态氢化物越稳定,其⾮⾦属性越强。
2.依据最⾼价氧化物的⽔化物酸性的强弱。
酸性越强,其元素的⾮⾦属性越强。
3.依据元素周期表。
同周期中,从左向右,随着核电荷数的增加,⾮⾦属性逐渐增强;同主族中,由上⽽下,随着核电荷数的增加,⾮⾦属性逐渐减弱。
4.⾮⾦属单质与盐溶液中简单阴离⼦之间的置换反应。
⾮⾦属性强的置换⾮⾦属性弱的。
5.⾮⾦属单质与具有可变价⾦属的反应。
能⽣成⾼价⾦属化合物的,其⾮⾦属性强。
6.⽓态⾮⾦属原⼦在得到电⼦变成稳定结构时所释放的能量越多,其⾮⾦属性越强。
高中化学教案:常见无机化合物的性质与应用一级标题:常见无机化合物的性质与应用引言:在高中化学教学中,常见的无机化合物是我们学习和掌握的基础知识之一。
了解无机化合物的性质和应用,能够帮助我们理解它们在日常生活和工业生产中的重要角色。
本文将介绍几种常见无机化合物的性质及其各自的应用。
二级标题1:氯化钠(NaCl)氯化钠是一种晶体固体,在常温下呈白色颗粒状。
它具有一些重要的性质和应用。
1. 性质:氯化钠是具有离子结构的结晶固体,其中包含正离子钠(Na⁺)和负离子氯(Cl⁻)。
由于正负电荷相互吸引,氯化钠具有很高的熔点和沸点。
此外,氯化钠也是可溶于水的,在水中形成易于流动的离子溶液。
2. 应用:氯化钠广泛用作调味剂,在食品加工过程中起到增强味道、保鲜和消毒清洁等作用。
此外,氯化钠还被用作工业生产中的电解质,电镀以及液压润滑剂等领域。
二级标题2:碳酸钠(Na2CO3)碳酸钠也是一种常见的无机化合物,在我们的日常生活中有着重要的应用。
1. 性质:碳酸钠是一种白色结晶固体,可溶于水。
它在加热时会分解,释放出二氧化碳气体。
其溶液具有碱性,并可与酸反应产生相应盐。
2. 应用:碳酸钠被广泛应用于玻璃制造、洗涤剂、纸张和肥料等行业。
在玻璃制造过程中,碳酸钠作为助熔剂能降低玻璃熔点并提高透明度。
此外,在家庭清洁产品中,碳酸钠作为重要成分之一能够去除油垢和污渍。
二级标题3:硫酸铜(CuSO4)硫酸铜是一种具有多种性质和应用的无机化合物,尤其在农业和医学领域发挥着重要作用。
1. 性质:硫酸铜是一种蓝色结晶固体,可溶于水。
在空气中易吸湿和发生颜色变化。
它的溶液呈现深蓝色。
2. 应用:硫酸铜可用作农业领域的杀真菌剂,能够防治作物病害,并在植物营养补充中起到重要作用。
在医学上,硫酸铜被用作眼药水,可以治疗眼部感染和炎症。
此外,硫酸铜还可以作为催化剂和试剂在实验室中使用。
二级标题4:氧化铁(Fe2O3)氧化铁是一种常见的无机陶瓷材料,在工业、建筑以及美容等领域具有广泛应用。
新高一生物无机物知识点一、无机物的概念与分类无机物是指没有碳-碳化合物键(C-C)的化合物,包括无机酸、无机盐和无机气体等。
在自然界中,无机物广泛存在于地壳、海洋和大气中。
二、常见无机物的性质与应用1. 无机酸:无机酸是指以氢作为阳离子的酸,如硫酸、盐酸等。
它们具有电离性和腐蚀性,常用于实验室化学分析、工业生产和草坪施肥等领域。
2. 无机盐:无机盐是由阳离子和阴离子组成的化合物,如氯化钠、硫酸钠等。
无机盐在生活中广泛应用于食品调味、肥料施用、医药制剂和水处理等方面。
3. 无机气体:无机气体指没有碳-碳键的气体,如氧气、氮气等。
这些气体在自然界中十分重要,氧气参与呼吸过程,氮气是生物体和植物的重要营养元素。
三、水和无机物的关系水是一种无机化合物,是地球上最常见的无机物质。
它具有许多独特的性质和重要的生物学意义。
1. 水的溶解性:水是一种极好的溶剂,对无机物和有机物均有良好的溶解性。
这一特性使得水成为生物体内许多化学反应的基础。
2. 水的凝固与沸腾:水的凝固点为0℃,沸腾点为100℃,这一范围是地球上生物体生活的温度范围。
水的凝固与沸腾对维持地球生态系统的平衡至关重要。
3. 水的表面张力:水具有较大的表面张力,这使得一些生物在水面上能够行走或滑行,如昆虫的水面行走和水滴在叶片上的滑落。
四、常见无机物的循环与生态意义1. 碳循环:碳是生物体构成有机物的基本元素,其循环过程包括生物体的呼吸、光合作用和分解等。
碳循环对维持生物体的能量供应和生态平衡起着重要作用。
2. 氮循环:氮是组成蛋白质和核酸的重要元素,其循环包括氮的固定、氮的脱氮和氮的释放等过程。
氮循环对植物的生长发育和土壤的肥力具有重要影响。
3. 氧循环:氧是许多生物体进行呼吸的必需气体,通过水和气体的相互转换,氧可以在大气、海洋和生物体之间循环。
五、无机物对环境的影响1. 酸雨:大气中的氮氧化物和硫氧化物在空气中与水蒸气反应生成不溶于水的硫酸和硝酸,从而形成酸雨。
常见无机物的用途
Cl
2
:氯气是一种重要的化工原料,在生活和生产中的应用十分广泛。
自来水的消毒、农药的生产、药物的合成等都需要用到氯气。
ClO
2
:二氧化氯的应用十分广泛,除用于一般的杀菌、消毒外,还广泛地用于环保、灭藻、漂白、保鲜、除臭等方面。
Br
2
:溴可用于生产多种药剂,如熏蒸剂、杀虫剂、抗爆剂等。
AgBr:溴化银是一种重要的感光材料,是胶卷中必不可少的成分。
I
2
:碘是一种重要的药用元素,含碘食品的生产也需要碘元素。
AgI:碘化银可用于人工降雨。
Na
2O
2
:过氧化钠可用作漂白剂和呼吸面具中的供氧剂。
Na:钠除了可用来制取一些钠的化合物外,还可用于从钛、锆、铌、钽等金属的氯化物中置换出金属单质。
充有钠蒸气的高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明。
Na、K:钠和钾的合金在常温下是液体,可用于快中子反应堆作热交换剂。
Na
2CO
3
:碳酸钠的水溶液呈碱性,因而被称为“纯碱”。
热的纯碱溶液可以
去除物品表面的油污。
纯碱是一种非常重要的化工原料,在玻璃、肥皂、合成洗涤剂、造纸、纺织、石油、冶金、食品等工业中有着广泛的应用。
NaHCO
3
:碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一;在医疗上,它是治疗胃酸过多的一种药剂。
Mg:镁能与铜、铝、锡、锰、钛等形成许多合金,镁合金的密度较小,但硬度和强度都较大,因此被大量用于制造火箭、导弹和飞机的部件等。
由于镁燃烧会发出耀眼的白光,因此常用来制造信号弹和焰火。
MgO:氧化镁的熔点高达2800℃,是优质的耐高温材料。
FeCl
3
:在制作印刷电路板的过程中常利用铜与氯化铁溶液的反应。
FeCl
3、FeSO
4
:氯化铁、硫酸亚铁是优良的净水剂。
(说明:Fe2+、Fe2+可水解
生成胶体)
Fe
2O
3
:氧化铁红颜料跟某些油料混合,可以制成防锈油漆。
Fe:磁性材料大多数是含铁的化合物。
人体中的铁元素大部分存在于血红蛋白内,血红蛋白起着运输氧气、二氧化碳的作用。
铁的化合物还在人体内发生的
氧化还原反应中起传递电子的作用。
人体缺铁会引起贫血等疾病。
Cu2+:由于铜盐能杀死某些细菌,并能抑制藻类生长,因此游泳场馆常用硫酸铜作池水消毒剂。
稀的硫酸铜溶液还可用于杀灭鱼体上的寄生虫,治疗鱼类皮肤病和鳃病等。
Na
2SiO
3
:硅酸钠是极少数可溶于水的硅酸盐中的一种,硅酸钠的水溶液俗称
“水玻璃”,是建筑行业经常使用的一种黏合剂。
人们也经常把具有特殊用途的木材、纺织品等用水玻璃浸泡,这样加工的产品既耐腐蚀又不易着火。
分子筛(说明:具有多孔结构的硅酸盐):常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等。
SiO
2
:二氧化硅除可用于制作光学镜片、石英坩埚外,还可用于制造光导纤维。
光导纤维非常细,导光能力很强,一条光缆由上万条光导纤维组成,因此利用光缆通讯能同时传输大量的信息。
Si:硅晶体的导电性介于导体和绝缘体之间,是一种重要的半导体材料,广泛应用于电子工业的各个领域。
SO
2
:在工业上,二氧化硫可用于漂白纸浆以及草帽等编织物。
H 2SO
4
:硫酸在生产中具有广泛的应用。
化肥、医药、农药的生产,金属矿石
的处理,金属材料的表面清洗等都要用到硫酸。
CaSO
4
:利用石膏的这一性质,人们常用它制作各种模型和医疗上用的石膏绷带。
在水泥生产中,可用石膏调节水泥的凝结时间。
在石膏资源丰富的地方也可以用它来制硫酸。
BaSO
4
:硫酸钡不容易被X射线透过,在医疗上可用作检查肠胃的内服药剂,俗称“钡餐”。
硫酸钡还可用作白色颜料,并可作高档油漆、油墨、造纸、塑料、橡胶的原料及填充剂。
FeSO
4
:在医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂,在工业上硫
酸亚铁还是生产铁系列净水剂和颜料氧化铁红(主要成分为Fe
2O
3
)的原料
书上记载的真挺详细的。