复旦大学无机化学之卤素
- 格式:pptx
- 大小:294.84 KB
- 文档页数:27





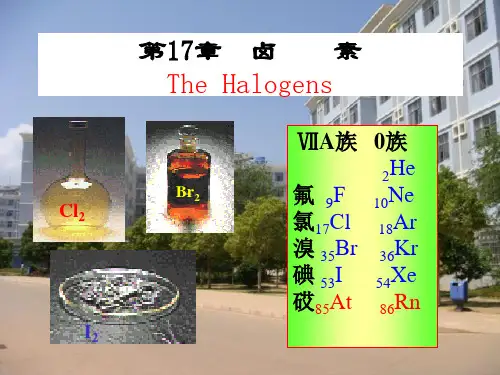
化学竞赛无机化学绝密课件卤素一、卤素简介卤素,又称卤族元素,是元素周期表中第VIIA族元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
卤素元素在自然界中大多以无机盐形式存在,具有独特的化学性质和广泛的应用领域。
本课件旨在为化学竞赛选手提供卤素元素的系统性知识,帮助选手在竞赛中取得优异成绩。
二、卤素的物理性质1.氟:氟是卤素元素中最轻的一种,具有浅黄绿色,在常温常压下为气态,具有刺激性气味。
氟的熔点为-219.67℃,沸点为-188.1℃,密度约为0.0017g/cm³。
2.氯:氯是一种黄绿色气体,具有刺激性气味。
氯的熔点为-101.5℃,沸点为-34.04℃,密度约为3.21g/L。
3.溴:溴在常温常压下为液态,具有红棕色,具有刺激性气味。
溴的熔点为-7.2℃,沸点为58.78℃,密度约为3.12g/cm³。
4.碘:碘在常温常压下为固态,具有紫黑色,具有刺激性气味。
碘的熔点为113.7℃,沸点为184.3℃,密度约为4.93g/cm³。
5.砹:砹是一种放射性元素,具有多种同位素,其中^210At的半衰期最长,约为8.1小时。
砹的物理性质尚不明确,但一般认为其熔点、沸点较高,密度较大。
三、卤素的化学性质1.氧化性:卤素元素具有较强的氧化性,能与大多数金属和非金属发生反应。
氟的氧化性最强,可以与水反应氧气。
2.电子亲和能:卤素元素的电子亲和能较大,容易接受电子,形成负离子。
3.电负性:卤素元素的电负性较高,与碳、氢等元素形成的化合物中,卤素元素表现出较强的亲电子性。
4.反应符合性:卤素元素与氢、卤化氢、金属卤化物等化合物发生反应时,遵循相应的反应规律,如氟化反应、氯化反应、溴化反应、碘化反应等。
5.卤素互化反应:氟、氯、溴、碘之间可以发生互化反应,相应的卤化物。
四、卤素化合物卤素元素与金属、非金属、有机物等均可形成多种化合物,下面列举一些常见的卤素化合物:1.卤化氢:卤素元素与氢气反应,卤化氢(HX,X代表卤素元素)。

无机化学卤素和氧族元素无机化学是研究无机物质的性质、结构和变化规律的科学。
而卤素和氧族元素是无机化学中非常重要的两个元素家族。
本文将从两个方面分别对卤素和氧族元素进行探讨。
卤素是指元素周期表中第17族的元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
这些元素具有许多共同的性质。
首先,卤素是非金属元素,所以它们一般都是气体、液体或固体。
其次,卤素的化学性质活泼,容易与其他元素发生化学反应。
例如,卤素与金属反应会产生相应的卤化物,如氯化铁(FeCl2)。
再次,卤素具有较高的电负性,所以它们往往以阴离子的形式存在。
最后,卤素的原子半径随着周期增加而增加,电子亲和能随周期增加而减小。
卤素的重要性体现在许多方面。
首先,卤素广泛应用于化学和医药工业。
例如,氯被广泛用于消毒水和漂白剂中,碘被用于制备碘酒和碘盐以防止碘缺乏病。
其次,卤素化合物在有机合成中起着重要的作用。
例如,氯化亚砜(DMSO)被用作溶解剂和氧化剂,溴代反应是有机合成中常用的反应之一、此外,卤素在光电子学和材料学中也具有重要的应用。
例如,氟可以增强材料的抗腐蚀性能,氯和溴可以增加材料的阻燃性能。
接下来,我们来介绍一下氧族元素。
氧族元素是指元素周期表中第16族的元素,包括氧(O)、硫(S)、硒(Se)、碲(Te)和钋(Po)。
氧族元素的特点是具有六个价电子,所以它们往往以阴离子的形式存在。
此外,氧族元素也是非金属元素,它们的电负性较高,化学性质也比较活泼。
例如,氧为广泛存在于地壳中的元素,它与大多数金属反应会生成相应的金属氧化物。
此外,硫化物在地质学和有机化学中也具有重要的地位。
氧族元素的应用也非常广泛。
首先,氧族元素广泛应用于能源领域。
例如,硫被广泛用于制备硫铵磺酸铵炸药,在电池中的铅酸和锂硫电池中也有重要应用。
其次,氧族元素也在制药和化妆品中发挥着重要作用。
例如,硫化物被用于制备抗生素和眼药水,硒化物被用于制备护肤品和化妆品。




非金属元素•卤素、•氧族元素•氮和磷•碳和硅第1节卤素•1.卤素(halogen)通性–氟(fluorine) 1810-1886 莫瓦桑–氯(chlorine) 舍勒,1774-1810戴维–溴(bromine) 1824 巴拉尔–碘(Iodine) 1813年库特瓦–砹(Astatine)•卤素基本性质(见表1)溴(Br)碘(I)3553价电子组态2s22p53s23p54s24p55s25p5114133酸性溶液中,氯元素的电势图:氯溴碘聚集状态气气液固黄绿红棕紫黑化学性质• 1. 与单质作用•与金属作用•与非金属作用•与氢作用2.卤素之间的置换反应:•氧化能力:F 2> Cl 2 > Br 2 > I 2•还原能力:I -> Br -> Cl -> F-–按F-Cl-Br-I 的次序,前面的卤素单质可以将后面的卤素从其卤化物中置换出来Cl222222=222222I Br I Br I Cl I Cl Br Cl Br Cl +=++++=+−−−−−−222222222222I Br I Br I Cl I Cl Br Cl Br Cl +=++=++=+−−−−−−•对水的氧化作用1-OX+•卤素在水中的歧化HXO X H O H X ++=+-+22HBrHI卤化氢的化学性质•热稳定性:卤化氢受热分解成单质的反应进行的难易•热稳定性按HF-HCl-HBr-HI依次减弱•还原性:卤化氢或氢卤酸的还原性是指HX失去电子的能力•还原性按HF-HCl-HBr-HI依次增强•酸性:除HF外,皆为强酸,•按HCl-HBr-HI依次增强– a.离子型:沸点高于673K,•碱金属(Li除外)、碱土金属(Be除外)同一金属不同卤素的卤化物,其熔点、沸点由氟NaBr NaI高价态的卤化物共价性PbCl2PbCl4(二)卤化物的水解反应HFBrO H O H BrF HCl PO H O H PCl HCl SiO H O H SiCl HF BO H O H BF 553344334325332344243323+=++=++=++=+(三) 氟化物的特殊性•溶解性特殊:AgF溶于水,CaF2难溶于水•易形成最高配位数的化合物•毒性大一.卤素的含氧酸及其盐•次卤酸(HXO )、亚卤酸(HXO 2)、卤酸(HXO 3)和高卤酸(HXO 4)•含氧酸根离子结构的卤素原子采用sp 3杂化,–次卤酸根为直线形,–亚卤酸根为V 字形,–卤酸根为三角锥形–高卤酸根为四面体形。