X-
(ns2np6 )
2、形成+1,+3,+5,+7氧化数的或共共价化用合一物对。 电子
氯、溴、碘的成对ns2np5电子可以依次被拆开或作为配位电子对而进行成 键作用,因而可以有多种氧化态,如:
HC+lO1 、HClO2、+3HClO3、ClO+4-5、IF7、IF5+、7ICl3
+7
3、可以提供电子对形成配键。
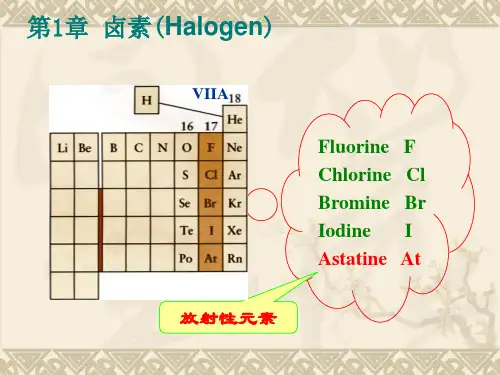
0族
2He 10Ne 18Ar 36Kr 54Xe
86Rn
I2 第4页/共110页
14.1.1 存在形式
卤素是最活泼的一族非金属元素,卤素就是“成盐元素”的意思,在自然界只 能以化合态的形式存在。
氟盐:萤石(CaF2)、冰晶石(Na3AlF6)、磷灰石 [Ca5F(PO4)3]
氯和溴盐:大量在海水中 NaCl、NaBr
-328 -349 -325 -295
氧化值
-1
-1, 1, 3, 5, 7
第7页/共110页
133 2.66 1008
第一电离能
气态电中性基态原子失去一个电子,转化为气态基态正离子所需要的最 低能量叫第一电离能。第一电离能越小,越易失去电子,金属性越强;第 一电离能越大,越难失去电子,金属性越弱
第12页/共110页
2.溶解性
氟与水激烈反应,氯有轻微反应, 氯、溴、碘易溶于有机溶剂。
为什么?
碘在极性溶剂(如醇) 因生成溶剂合物而呈 棕(红)色,
碘在C6H6中呈棕色;而在KI中呈黄棕色。 3.气味、毒性
X2都有刺激性;毒性从F2
I2减轻。
第13页/共110页
在非极性溶剂 中为紫红或紫 色。