天津大学无机化学卤素和氧族
- 格式:pptx
- 大小:756.09 KB
- 文档页数:93

第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 。
3.解:一瓶氧气可用天数33111-1222()(13.210-1.0110)kPa 32L9.6d 101.325kPa 400L d n p p V n p V -⨯⨯⨯===⨯⨯4.解:pV MpVT nR mR== = 318 K 44.9=℃ 5.解:根据道尔顿分压定律ii n p p n=p (N 2) = 7.6⨯104 Pap (O 2) = 2.0⨯104 Pa p (Ar) =1⨯103 Pa6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯ (3)4224(O )(CO ) 2.6710Pa0.2869.3310Pan p n p ⨯===⨯ 7.解:(1)p (H 2) =95.43 kPa (2)m (H 2) =pVMRT= 0.194 g 8.解:(1)ξ = 5.0 mol(2)ξ = 2.5 mol结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p - p ∆V = 0.771 kJ 10.解: (1)V 1 = 38.3⨯10-3m 3= 38.3L(2) T 2 =nRpV 2= 320 K (3)-W = - (-p ∆V ) = -502 J (4) ∆U = Q + W = -758 J (5) ∆H = Q p = -1260 J11.解:NH 3(g) +45O 2(g) 298.15K−−−−→标准态NO(g) + 23H 2O(g) m r H ∆= - 226.2 kJ ·mol -1 12.解:m r H ∆= Q p = -89.5 kJ m r U ∆= m r H ∆- ∆nRT= -96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ = m f H ∆(CO 2, g) = -393.509 kJ ·mol -121CO 2(g) + 21C(s) → CO(g)m r H ∆ = 86.229 kJ ·mol -1CO(g) +31Fe 2O 3(s) → 32Fe(s) + CO 2(g)m r H ∆ = -8.3 kJ ·mol -1各反应 m r H ∆之和m r H ∆= -315.6 kJ ·mol -1。




第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 。
3.解:一瓶氧气可用天数33111-1222()(13.210-1.0110)kPa 32L9.6d 101.325kPa 400L d n p p V n p V -⨯⨯⨯===⨯⨯4.解:pV MpVT nR mR== = 318 K 44.9=℃ 5.解:根据道尔顿分压定律ii n p p n=p (N 2) = 7.6⨯104 Pap (O 2) = 2.0⨯104 Pa p (Ar) =1⨯103 Pa6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯ (3)4224(O )(CO ) 2.6710Pa0.2869.3310Pan p n p ⨯===⨯ 7.解:(1)p (H 2) =95.43 kPa (2)m (H 2) =pVMRT= 0.194 g 8.解:(1)ξ = 5.0 mol(2)ξ = 2.5 mol结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p - p ∆V = 0.771 kJ 10.解: (1)V 1 = 38.3⨯10-3 m 3= 38.3L(2) T 2 =nRpV 2= 320 K (3)-W = - (-p ∆V ) = -502 J (4) ∆U = Q + W = -758 J (5) ∆H = Q p = -1260 J11.解:NH 3(g) +45O 2(g) 298.15K−−−−→标准态NO(g) + 23H 2O(g) m r H ∆= - 226.2 kJ·mol -112.解:m r H ∆= Q p = -89.5 kJ m r U ∆= m r H ∆- ∆nRT= -96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ =m f H ∆(CO 2, g) = -393.509 kJ·mol -121CO 2(g) + 21C(s) → CO(g) m r H ∆ = 86.229 kJ·mol -1CO(g) +31Fe 2O 3(s) → 32Fe(s) + CO 2(g)m r H ∆ = -8.3 kJ·mol -1各反应m r H ∆之和m r H ∆= -315.6 kJ·mol -1。

天津大学无机化学第五版习题答案天津大学无机化学第五版是众多化学专业学生学习的重要教材,而配套的习题对于巩固知识、提升能力起着关键作用。
然而,要获取准确且完整的习题答案并非易事。
首先,让我们来了解一下这本教材的特点和重要性。
天津大学无机化学第五版内容丰富、涵盖面广,包括化学原理、元素化学等多个方面。
它不仅注重基础知识的讲解,还紧跟学科前沿,引入了一些最新的研究成果和应用实例。
这使得学生在学习过程中,既能打下坚实的基础,又能拓宽视野,了解化学领域的最新动态。
对于教材中的习题,它们的设计精心且具有针对性。
通过完成这些习题,学生可以更好地理解和掌握所学的知识,提高分析问题和解决问题的能力。
然而,在解题过程中,学生可能会遇到各种各样的困难。
有些习题可能涉及到复杂的化学原理和计算,需要学生对相关概念有深刻的理解和熟练的运用能力。
比如,在化学平衡这一章节的习题中,要求计算平衡常数、判断反应的方向和限度等。
这就需要学生熟练掌握化学平衡的表达式、平衡常数的计算方法以及各种影响化学平衡的因素。
还有一些习题可能侧重于元素化学部分,要求学生熟悉各种元素的性质、化合物的制备和反应。
例如,在卤素这一元素族的习题中,可能会问到氯、溴、碘等元素的氧化性强弱比较,以及它们与其他物质的反应方程式的书写。
面对这些难题,学生们往往希望能够有一份详细准确的习题答案作为参考。
但是,仅仅依靠答案并不能真正提高学习效果。
重要的是,要通过自己的思考和努力去解题,然后对照答案进行检查和反思。
在寻找天津大学无机化学第五版习题答案的过程中,学生们可以通过多种途径。
其一,可以向老师请教。
老师具有丰富的教学经验和专业知识,能够给予学生针对性的指导和解答。
其二,可以与同学交流讨论。
同学们在解题过程中可能会有不同的思路和方法,通过交流可以相互启发,共同提高。
此外,现在网络上也有一些相关的学习资源。
但需要注意的是,网络上的答案质量参差不齐,有些可能存在错误。
因此,在参考网络答案时,要保持谨慎,进行仔细的甄别和判断。
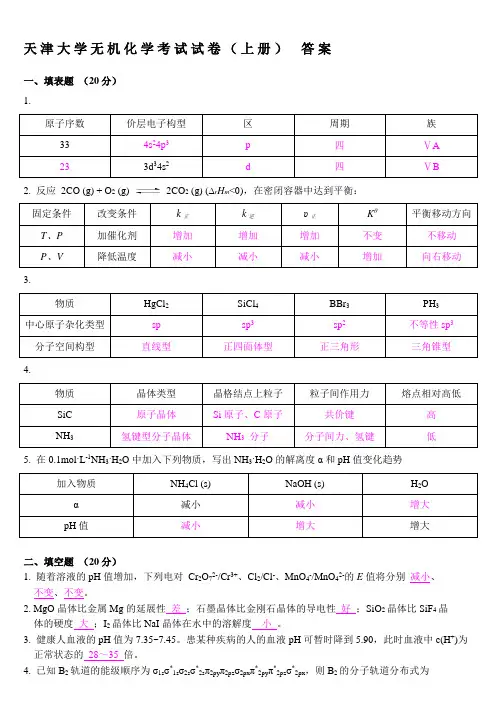
天津大学无机化学考试试卷(上册)答案一、填表题(20分)1.原子序数价层电子构型区周期族33 4s24p3 p 四ⅤA23 3d34s2 d 四ⅤB2. 反应2CO (g) + O2 (g) 2CO2 (g) (∆r H m<0),在密闭容器中达到平衡:固定条件改变条件k正k逆υ正Kθ平衡移动方向T、P 加催化剂增加增加增加不变不移动P、V 降低温度减小减小减小增加向右移动3.物质HgCl2 SiCl4 BBr3 PH3中心原子杂化类型sp sp3sp2不等性sp3分子空间构型直线型正四面体型正三角形三角锥型4.物质晶体类型晶格结点上粒子粒子间作用力熔点相对高低SiC 原子晶体Si原子、C原子共价键高NH3 氢键型分子晶体NH3分子分子间力、氢键低5. 在0.1mol·L-1NH3·H2O中加入下列物质,写出NH3·H2O的解离度α和pH值变化趋势加入物质NH4Cl (s) NaOH (s) H2O α减小减小增大pH值减小增大增大二、填空题(20分)1. 随着溶液的pH值增加,下列电对Cr2O72-/Cr3+、Cl2/Cl-、MnO4-/MnO42-的E值将分别减小、不变、不变。
2. MgO晶体比金属Mg的延展性差;石墨晶体比金刚石晶体的导电性好;SiO2晶体比SiF4晶体的硬度大;I2晶体比NaI晶体在水中的溶解度小。
3. 健康人血液的pH值为7.35~7.45。
患某种疾病的人的血液pH可暂时降到5.90,此时血液中c(H+)为正常状态的28~35 倍。
4. 已知B2轨道的能级顺序为σ1sσ*1sσ2sσ*2sπ2pyπ2pzσ2pxπ*2pyπ*2pzσ*2px,则B2的分子轨道分布式为(σ1s )2(σ*1s )2(σ2s )2(σ*2s )2(π2py )1(π2pz )1,成键数目及名称两个单电子π键,价键结构式为 。
5. 根据E θ(PbO 2/PbSO 4) >E θ(MnO 4-/Mn 2+) >E θ(Sn 4+/Sn 2+),可以判断在组成电对的六种物质中,氧化性最强的是 PbO 2 ,还原性最强的是 Sn 2+ 。

无机化学卤素和氧族元素无机化学是研究无机物质的性质、结构和变化规律的科学。
而卤素和氧族元素是无机化学中非常重要的两个元素家族。
本文将从两个方面分别对卤素和氧族元素进行探讨。
卤素是指元素周期表中第17族的元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
这些元素具有许多共同的性质。
首先,卤素是非金属元素,所以它们一般都是气体、液体或固体。
其次,卤素的化学性质活泼,容易与其他元素发生化学反应。
例如,卤素与金属反应会产生相应的卤化物,如氯化铁(FeCl2)。
再次,卤素具有较高的电负性,所以它们往往以阴离子的形式存在。
最后,卤素的原子半径随着周期增加而增加,电子亲和能随周期增加而减小。
卤素的重要性体现在许多方面。
首先,卤素广泛应用于化学和医药工业。
例如,氯被广泛用于消毒水和漂白剂中,碘被用于制备碘酒和碘盐以防止碘缺乏病。
其次,卤素化合物在有机合成中起着重要的作用。
例如,氯化亚砜(DMSO)被用作溶解剂和氧化剂,溴代反应是有机合成中常用的反应之一、此外,卤素在光电子学和材料学中也具有重要的应用。
例如,氟可以增强材料的抗腐蚀性能,氯和溴可以增加材料的阻燃性能。
接下来,我们来介绍一下氧族元素。
氧族元素是指元素周期表中第16族的元素,包括氧(O)、硫(S)、硒(Se)、碲(Te)和钋(Po)。
氧族元素的特点是具有六个价电子,所以它们往往以阴离子的形式存在。
此外,氧族元素也是非金属元素,它们的电负性较高,化学性质也比较活泼。
例如,氧为广泛存在于地壳中的元素,它与大多数金属反应会生成相应的金属氧化物。
此外,硫化物在地质学和有机化学中也具有重要的地位。
氧族元素的应用也非常广泛。
首先,氧族元素广泛应用于能源领域。
例如,硫被广泛用于制备硫铵磺酸铵炸药,在电池中的铅酸和锂硫电池中也有重要应用。
其次,氧族元素也在制药和化妆品中发挥着重要作用。
例如,硫化物被用于制备抗生素和眼药水,硒化物被用于制备护肤品和化妆品。

天津大学无机化学考试试卷(下册)答案一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画X)(每小题1分,共10分)1、( X)在周期表中,处于对角线位置的元素性质相似,这称为对角线规则。
2、( X)SnS溶于Na2S2溶液中,生成硫代亚锡酸钠。
3、( X )磁矩大的配合物,其稳定性强。
4、( X)氧族元素氢化物的沸点高低次序为H2O>H2S>H2Se>H3Te。
5、( √)已知[HgCl4]2-的K=1.0⨯10-16,当溶液中c(Cl-)=0.10mol·L-1时,c(Hg2+)/c([HgCl4]2-)的比值为1.0⨯10-12。
6、( √)如果某氢化物的水溶液为碱性,则此氢化物必为离子型氢化物。
7、( X)硼是缺电子原子,在乙硼烷中含有配位键。
8、( √)在浓碱溶液中MnO4-可以被OH-还原为MnO42-。
9、( √)配合物Na3[Ag(S2O3)2]应命名为二硫代硫酸根合银(Ⅰ)酸钠。
10、( X)Pb(OAc)2是一种常见的铅盐,是强电解质。
二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)(每小题1分,共20分)1、在下列各种酸中氧化性最强的是............... ( B)。
(A)HClO3;(B)HClO;(C)HClO4;(D)HCl。
2、下列浓酸中,可以用来和KI(s)反应制取较纯HI(g)的是............... ( C)。
(A)浓HCl;(B)浓H2SO4;(C)浓H3PO4;(D)浓HNO3。
3、用于说明Pb(Ⅳ)具有强氧化性的是............... ( D)。
(A)熵效应;(B)螯合效应;(C)屏蔽效应;(D)惰性电子对效应。
4、美国的阿波罗飞船上的天线是用钛镍合金制成的,这是因为钛镍合金. ............... ( C)。
(A)机械强度大;(B)熔点高;(C)具有记忆性能;(D)耐腐蚀。


(完整版)⽆机化学(天津⼤学版)第⼀章化学反应中的质量关系和能量关系[学习指导]1.“物质的量”(n)⽤于计量指定的微观基本单元或其特定组合的物理量,其单位名称为摩[尔],单位符号为mol。
2.摩尔质量(M) M = m/n3.摩尔体积(V m)V m = V/n4.物质的量浓度(c B)c B = n B/V5.理想⽓体状态⽅程pV = nRT6.理想⽓体分压定律p= Σp B ;p B = (n B/n)p7.化学计量式和化学计量数O = ΣνB B ;νBB8.反应进度(ξ)表⽰化学反应进⾏程度的物理量,符号为ξ,单位为mol。
随着反应的进⾏,任⼀化学反应各反应物及产物的改变量:Δn B = νBξ9.状态函数状态函数的改变量只与体系的始、终态有关,⽽与状态变化的途径⽆关。
10.热和功体系和环境之间因温差⽽传递的热量称为热。
除热以外,其它各种形式被传递的能量称为功。
11.热⼒学能(U)体系内部所含的总能量。
12.能量守恒定律孤⽴体系中能量是不会⾃⽣⾃灭的,它可以变换形式,但总值不变。
13.热⼒学第⼀定律封闭体系热⼒学能的变化:ΔU = Q + WQ > 0, W > 0, ΔU > 0;Q < 0, W< 0, ΔU < 0。
14.恒压反应热(Q p)和反应焓变(Δr H m)H(焓) ≡ U + pV, Q p= Δr H m15.赫斯定律Q p= ∑Q B, Δr H m= ∑Δr H m(B)B B16.标准状况:p = 101.325kPa, T = 273.15 K标准(状)态:pθ= 100kPa下⽓体:纯⽓体物质液体、固体:最稳定的纯液体、纯固体物质。
溶液中的溶质:摩尔浓度为1mol·L-1标准态下17.标准摩尔⽣成焓()最稳定的单质─────—→单位物质的量的某物质=18.标准摩尔反应焓变()⼀般反应cC + dD = yY + zZ=[y(Y) + z(Z)] - [c(C)+ d(D)]=Σνi(⽣成物) + Σνi(反应物)第⼆章化学反应的⽅向、速率和限度[学习指导]1.反应速率:单位体积内反应进⾏程度随时间的变化率,即:2.活化分⼦:具有等于或超过E c能量(分⼦发⽣有效碰撞所必须具备的最低能量)的分⼦。
⽆机化学课后答案全解(武⼤吉⼤第三版)第⼗⼆章1.卤素中哪些元素最活泼?为什么有氟⾄氯活泼性变化有⼀个突变?答:单质的活泼性次序为:F2>>Cl2>Br2>I2从F2到Cl2活泼性突变,其原因归结为F原⼦和F—离⼦的半径特别⼩。
F Cl Br I F— Cl— Br— I—r/pm 64 99 114 133 136 181 195 216(1)由于F的原⼦半径⾮常⼩,F—F原⼦间的斥⼒和⾮键电⼦对的斥⼒较⼤,使F2的解离能(155KJ/mol)远⼩于Cl2的解离能(240KJ/mol)。
(2)由于F-离⼦半径特别⼩,因此在形成化合物时,氟化物的离⼦键更强,键能或晶格能更⼤。
由于F-离⼦半径特别⼩,F-的⽔合放热⽐其他卤素离⼦多。
2.举例说明卤素单质氧化性和卤离⼦X-还原性递变规律,并说明原因。
答:氧化性顺序为:F2 >Cl2 >Br2>I2 ;还原性顺序为:I- >Br->Cl->F-.尽管在同族中氯的电⼦亲合能最⾼,但最强的氧化剂却是氟卤素单质是很强的氧化剂,随着原⼦半径的增⼤,卤素的氧化能⼒依次减弱。
尽管在同族中氯的电⼦亲合能最⾼,但最强的氧化剂却是氟。
⼀种氧化剂在常温下,在⽔溶液中值的⼤⼩和下列过程有关(见课氧化能⼒的强弱,可⽤其标准电极电势值来表⽰,θ本P524)3.写出氯⽓与钛、铝、氢、⽔和碳酸钾作⽤的反应式,并注明必要的反应条件。
答:(1) 2Cl2+Ti =TiCl4加热,⼲燥(2) 3Cl2+2Al =2AlCl3 加热,⼲燥(3) Cl2+H2 =2HCl 点燃(4) 3Cl2+2P(过量)=2PCl3 ⼲燥5Cl2(过量)+2P=2PCl5⼲燥(5) Cl2+H2O=HClO +HCl(6) Cl2+2K2CO3+H2O=KCl+KClO+2KHCO34.试解释下列现象:(1)I2溶解在CCl4中得到紫⾊溶液,⽽I2在⼄醚中却是红棕⾊。
1天津大学无机化学考试试卷 (下册) 答案一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画X )(每小题1分,共10分) 1、( X )在周期表中,处于对角线位置的元素性质相似,这称为对角线规则。
2、( X )SnS 溶于Na 2S 2溶液中,生成硫代亚锡酸钠。
3、( X )磁矩大的配合物,其稳定性强。
4、( X )氧族元素氢化物的沸点高低次序为H 2O>H 2S>H 2Se>H 3Te 。
5、( √ )已知[HgCl 4]2-的K =1.0⨯10-16,当溶液中c (Cl -)=0.10mol ·L -1时,c (Hg 2+)/c ([HgCl 4]2-)的比值为1.0⨯10-12。
6、( √ )如果某氢化物的水溶液为碱性,则此氢化物必为离子型氢化物。
7、( X )硼是缺电子原子,在乙硼烷中含有配位键。
8、( √ )在浓碱溶液中MnO 4-可以被OH -还原为MnO 42-。
9、( √ )配合物Na 3[Ag(S 2O 3)2]应命名为二硫代硫酸根合银(Ⅰ)酸钠。
10、( X )Pb(OAc)2是一种常见的铅盐,是强电解质。
二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)(每小题1分,共20分)1、在下列各种酸中氧化性最强的是............... ( B )。
(A)HClO 3;(B)HClO ;(C)HClO 4;(D)HCl 。
2、下列浓酸中,可以用来和KI(s)反应制取较纯HI(g)的是............... ( C )。
(A)浓HCl ;(B)浓H 2SO 4;(C)浓H 3PO 4;(D)浓HNO 3。
3、用于说明Pb(Ⅳ)具有强氧化性的是............... ( D )。
(A)熵效应;(B)螯合效应;(C)屏蔽效应;(D)惰性电子对效应。
4、美国的阿波罗飞船上的天线是用钛镍合金制成的,这是因为钛镍合金. ............... ( C )。
第十一章卤素和氧族思考题解析1.解释下列现象:(1)在卤素化合物中,Cl、Br、I可呈现多种氧化数。
解:因为Cl、Br、I原子的价层电子排布为ns2np5,当参加反应时,未成对的电子可参与成键外,成对的电子也可拆开参与成键,故可呈现多种氧化数。
(2)KI溶液中通入氯气是,开始溶液呈现红棕色,继续通入氯气,颜色褪去。
解:开始I-被CI2氧化成I2,使溶液呈现红棕色;继续通入氯气,I2被Cl2氧化成无色的IO3-,反应式如下:2I- + Cl2 I2 + 2Cl-I2 + 5Cl2 + 6H2O 2IO3-+ 10Cl-+ 12H+2.在氯水中分别加入下列物质,对氯水的可逆反应有何影响?(1)稀硫酸(2)苛性钠(3)氯化钠解:氯水中存在如下平衡:Cl2 + H2(2)加入苛性钠,平衡向右移动,有利于Cl2的歧化反应;(3)加入氯化钠,平衡向左移动,不利于Cl2的歧化反应。
3.怎样除去工业溴中少量Cl2?解:蒸馏工业溴时,加入少量KBr,使其发生下列反应:Cl2+2KBr →Br2+2KCl4.将Cl2通入熟石灰中得到漂白粉,而向漂白粉中加入盐酸却产生Cl2,试解释之。
解:因为上述过程发生了如下相应反应:40℃以下··3Ca(OH)2 + 2Cl2 Ca(ClO)2 + CaCl2 Ca(OH)2 H2O + H2OCa(ClO)2 + 4HCl 2Cl2 + CaCl2 + 2H2O5.试用三种简便的方法鉴别NaCl、NaBr、NaI。
解:(1)AgNO3(A)Cl-+Ag+→AgCl ↓白色(B)Br-+Ag+→AgBr ↓淡黄色(C)I-+Ag+→AgI ↓黄色(2)Cl2水+CCl4(A)2NaBr +Cl4→2NaCl +Br2在CCl4中呈桔黄色(B)2NaI +Cl4→2NaCl +I2在CCl4中呈紫红色(3)浓H2SO4(A)NaCl +H2SO4→NaHSO4 +HCl ↑(B)NaBr +H2SO4→NaHSO4 +HBr ↑2 HBr +H2SO4→Br2+2H2O +SO2 ↑使品红试纸褪色(C)NaI +H2SO4→NaHSO4 +HI ↑8HI +H2SO4→4I2+4H2O +H2S ↑使Pb(OAc)2试纸变黑6.下列两个反应在酸性介质中均能发生,如何解释?(1)Br2+2I-→2Br-+I2(2)2BrO3-+I2→2IO3-+Br2解:(1)E¢(Br2/ Br-)=1.065V>E¢(I2/I-)=0.5355V,反应能进行。