
研究所代码 代码研究所 80005 中国科学院武汉岩土力学研究所 80007 中国科学院力学研究所 80008 中国科学院物理研究所 80009 中国科学院高能物理研究所 80010 中国科学院声学研究所 80012 中国科学院理论物理研究所 80014 中国科学院上海原子核研究所 80017 中国科学院近代物理研究所 80018 中国科学院国家天文台南京天文光学技术研究所80019 中国科学院国家天文台长春人造卫星观测站80020 中国科学院武汉物理与数学研究所 80021 中国科学院紫金山天文台 80022 中国科学院上海天文台 80023 中国科学院云南天文台 80024 中国科学院国家授时中心 80025 中国科学院国家天文台 80026 中国科学院声学研究所东海研究站 80027 中国科学院渗流流体力学研究所 80028 中国科学院新疆理化技术研究所 80029 中国科学院自然科学史研究所 80030 中国科学院理化技术研究所 80032 中国科学院化学研究所 80033 中国科学院广州化学研究所 80035 中国科学院上海有机化学研究所 80036 中国科学院成都有机化学研究所 80037 中国科学院长春应用化学研究所 80038 中国科学院大连化学物理研究所 80039 中国科学院兰州化学物理研究所 80040 中国科学院上海硅酸盐研究所 80041 中国科学院过程工程研究所 80042 中国科学院生态环境研究中心 80043 中国科学院山西煤炭化学研究所 80045 中国科学院福建物质结构研究所 80046 中国科学院青海盐湖研究所 80053 中国科学院兰州地质研究所 80054 中国科学院古脊椎动物与古人类研究所 80055 中国科学院南京地质古生物研究所 80057 中国科学院测量与地球物理研究所 80058 中国科学院大气物理研究所 80060 中国科学院地理科学与资源研究所 80061 中国科学院南京地理与湖泊研究所
2015中科院海洋化学考研(海洋研究所)参考书、历年真题、报录比、研究生招生专业目录、复试分数线 一、学院介绍 中国科学院海洋研究所始建于1950年8月1日,是从事海洋科学基础研究与应用基础研究、高新技术研发的综合性海洋科研机构,是国际海洋科学领域具有重要影响的研究所。 研究所现有在职职工660余人,其中专业技术人员近500人;中科院院士4人、工程院院士2人,博士生导师101人,硕士生导师58人。作为中国科学院博士研究生重点培养基地,研究所设有海洋科学、环境科学与工程、水产3个一级博士点、9个二级博士点和10个硕士点,以及海洋科学博士后流动站。 建所60多年来,研究所面向国家需求和国际海洋科学前沿,不断凝练和调整学科方向,重点在蓝色农业优质、高效、持续发展的理论基础与关键技术,海洋环境与生态系统动力过程,海洋环流与浅海动力过程,以及大陆边缘地质演化与资源环境效应等领域开展了许多开创性和奠基性工作,为我国国民经济建设、国家安全和海洋科学技术的发展做出了重大创新性贡献。共取得900余项科研成果,其中国家一等奖6项,国家二等奖24项,全国科学大会奖15项,山东省科技最高奖3项,中科院和省部委重大成果奖、科技一等奖127项,国际奖16项。共发表论文9400余篇(其中SCI/EI收录论文2600余篇),出版专著210余部;共获国际发明专利授权7件,国家发明专利授权270余件,实用新型专利授权140余件,外观设计专利50余件。 “十二五”期间,研究所将紧紧围绕“一三五”发展规划目标,致力于综合性海洋科学基础研究和技术研发,立足近海环境演变与生物资源可持续利用的理论创新与关键技术的综合交叉与系统集成,拓展深海环境与战略性资源探索的先导性研究,重点在我国海洋生物资源的新认知、新品种和新生产体系,中国近海环境演变机理与生态灾害发生的预测和防控,热带西太平洋环流变异及其对气候、环境的影响方面研究取得重大突破,同时重点培育西太平洋地质演化与沉积记录、深海环境综合探测研究、海洋生物多样性与分子系统演化、海洋生物活性物质与生物能源发掘利用、海洋环境腐蚀与生物污损防护技术等学科方向,在我国海洋科技领域发挥不可替代的引领作用,成为有国际影响力的海洋科学和技术研究机构。 二、中科院海洋化学研究生招生专业目录
第三章 化学反应系统热力学 (习题答案) 2007-6-6 §3.1 标准热化学数据 练习 1 所有单质的 O m f G ? (T )皆为零?为什么?试举例说明? 答:所有处于标准状态的稳定单质的O m f G ? (T )(因为生成稳定单质,稳定单质的状态未发生改变);如单质碳有石墨和金刚石两种,O m f G ? (298.15K ,石墨,)=0kJmol -1.而O m f G ? (298.15K ,金刚石,)=2.9kJmol -1, (课本522页),石墨到金刚石状态要发生改变,即要发生相变,所以O m f G ? (298.15K ,金刚石,)=2.9kJmol -1, 不等于零。 2 化合物的标准生成热(焓)定义成:“由稳定单质在298.15K 和100KPaPa 下反应生成1mol 化合物的反应热”是否准确?为什么? 答:单独处于各自标准态下,温度为T 的稳定单质生成单独处于标准态下、温度为T 的1mol 化合物B 过程的焓变。此定义中(1)强调压力为一个标准大气压,而不强调温度;(2)变化前后都单独处于标准态。 所以题中的定义不准确, 3 一定温度、压力下,发生单位化学反应过程中系统与环境交换的热Q p 与化学反应摩尔焓变n r H ?是否相同?为什么? 答: 等压不作其他功时(W ’=0),数值上Q p =n r H ?; Q p 是过程量,与具体的过程有关,而n r H ?是状态函数与过程无关,对一定的化学反应有固定的数值;如将一个化学反应至于一个绝热系统中Q p 为零,但n r H ?有确定的数值。 §3.2 化学反应热力学函数改变值的计算. 练习 1 O m r G ?(T ),m r G ?(T ),O m f G ?(B ,相态,T )各自的含义是什么? 答:O m r G ?(T ): 温度为T ,压力为P θ,发生单位反应的ΔG; m r G ?(T ): 温度为T ,压力为P ,发生单位反应的ΔG; O m f G ?(B , 相态,T ): 温度为T ,压力为P θ ,由各自处于标准状态下的稳定单质,生成处于标准态1mol 化合物反应的ΔG; 2 25℃时,H 2O(l)及H 2O(g)的标准摩尔生成焓分别为-285.838及-241.825kJ mol -1 。计算水在25℃时的 气化焓。 答: 25℃时,P θ,H 2O(l)→25℃时,P θ , H 2O(g) ΔH=Δf H m θ(H 2O,g)- Δf H m θ (H 2O,l)=-241.825-(-285.838)=44.013kJmol -1 [ 44.01kJ ] 3 用热化学数据计算下列单位反应的热效应O m r H ?(298.15K)。 (1) 2CaO(s)+5C(s ,石墨)→2CaC 2(s)+CO 2(g) (2) C 2H 2(g)+H 2O(l)→CH 3CHO(g) (3) CH 3OH(l)+ 2 1O 2(g)→HCHO(g)+H 2O(l) 答: (1)2CaO(s)+5C(s ,石墨)→2CaC 2(s)+CO 2(g) Δf H m θ (B,298.15K) -635.09 0 -62.8 -393.509 (kJmol -1) Δr H m θ (B,298.15K)=[2×(-62.8)+(-393.509)]-0-2×(-635.09)=751.886 kJmol -1 (2) 或根据标准摩尔燃烧热 C 2H 2(g)+H 2O(l)→CH 3CHO(g) Δc H m θ -1300 0 -1193 Δr H m θ (B,298.15K)=-1300-(-1193)=-107 kJmol -1 (3) CH 3OH(l)+2 1O 2(g)→HCHO(g)+H 2O(l) Δf H m θ (B,298.15K) -238.06 0 -115.9 -285.83 Δr H m θ(B,298.15K)= Δf H m θ(HCHO(g),298.15K)+ Δf H m θ(H 2O(l),298.15K)- Δf H m θ (CH 3OH(l),298.15K)-(1/2)
读书破万卷下笔如有神 中科院研究生院硕士研究生入学考试 《物理化学(甲)》大纲 本《物理化学》(甲)考试大纲适用于报考中国科学院研究生院化学类专业的硕士研究生入学考试。《物理化学》是大学本科化学专业的一门重要基础理论课。它是从物质的物理现象和化学现象的联系入手探求化学变化基本规律的一门科学。物理化学课程的主要内容包括化学热力学(统计热力学)、化学动力学、电化学、界面化学与胶体化学等。要求考生熟练掌握物理化学的基本概念、基本原理及计算方法,并具有综合运用所学知识分析和解决实际问题的能力。 一、考试内容 (一)气体 1、气体分子动理论 2、摩尔气体常数 3、理想气体状态图 4、分子运动的速率分布 5、分子平动能的分布 6、气体分子在重力场中的分布 7、分子的碰撞频率与平均自由程 8、实际气体 9、气液间的转变—实际气体的等温线和液化过程 10、压缩因子图—实际气体的有关计算 (二)热力学第一定律 1、热力学概论 2、热平衡和热力学第零定律-温度的概念 3、热力学的一些基本概念 4、热力学第一定律 5、准静态过程与可逆过程 6、焓 7、热容 8、热力学第一定律对理想气体的应用 9、Carnot循环 10、Joule-Thomson效应-实际气体的
H和U、热化学11 、赫斯定律12.读书破万卷下笔如有神 13、几种热效应 14、反应焓变和温度的关系— Kirchhoff定律 15、绝热反应—非等温反应 (三)热力学第二定律 1、自发过程的共同特征—不可逆性 2、热力学第二定律 3、Carnot定理 4、熵的概念 5、Clausius不等式与熵增加原理 6、热力学基本方程与T-S图 7、熵变的计算 8、熵和能量退降 9、热力学第二定律的本质和熵统计意义 10、Helmholtz自由能和Gibbs自由能 11、变化的方向和平衡条件 、G的计算示例12 13、几个热力学函数间的关系 14、热力学第三定律与规定熵 (四)多组分体系热力学及其在溶液中的应用 1、多组分系统的组成表示法 2、偏摩尔量 3、化学势 4、气体混合物中各组分的化学势 5、稀溶液中的两个经验定律 6、理想液态混合物 7、理想稀溶液中任一组分的化学势 8、稀溶液的依数性 9、活度与活度因子 10、分配定律—溶质在两互不相溶液相中的分配 (五)相平衡 1、多相体系平衡的一般条件
学科、专业名称(代码) 研究方向 预计招生人数考试科目 共29人 ④852细胞生物学非编码RNA的功能和机理研究 ①101思想政治理论②201英语一8③612生物化学与分子生物学④851微生物学或852细胞生物学 ③612生物化学与分子生物学细菌性传染病相关机理及治疗研究 ①101思想政治理论②201英语一7③612生物化学与分子生物学④852细胞生物学 疫苗与大分子药物研发 ①101思想政治理论②201英语一6癌症生物治疗与机理研究 ③612生物化学与分子生物学④851微生物学或852细胞生物学 生物大分子结构功能研究;①101思想政治理论②201英语一5生物大分子结构功能研究同上 4代谢疾病分子机理的研究同上3干细胞与组织修复和再生同上2分子诊断技术研究③612生物化学与分子生物学④852细胞生物学071010生物化学与分子生物 学干细胞临床应用研究;①101思想政治理论②201英语一1干细胞命运调控 同上11Stem Cell Biology,Developmental Biology,Hematology 同上10细胞膜生物学 同上9免疫癌症疗法;干细胞与组织修复与再生同上8造血干细胞与白血病干细胞 同上7细胞类型转换及神经干细胞调控同上6干细胞命运调控及人类疾病的干细胞治疗同上5多能性干细胞的维持与分化调控同上4诱导多能干细胞及其命运调控研究同上3干细胞和肿瘤细胞的表观遗传调控同上2④852细胞生物学 干细胞生物学 ①101思想政治理论②201英语一1③612生物化学与分子生物学发育生物学同上 3071009细胞生物学生殖细胞发育同上2③612生物化学与分子生物学④852细胞生物学 071008发育生物学转基因动物与克隆动物 ①101思想政治理论②201英语一1
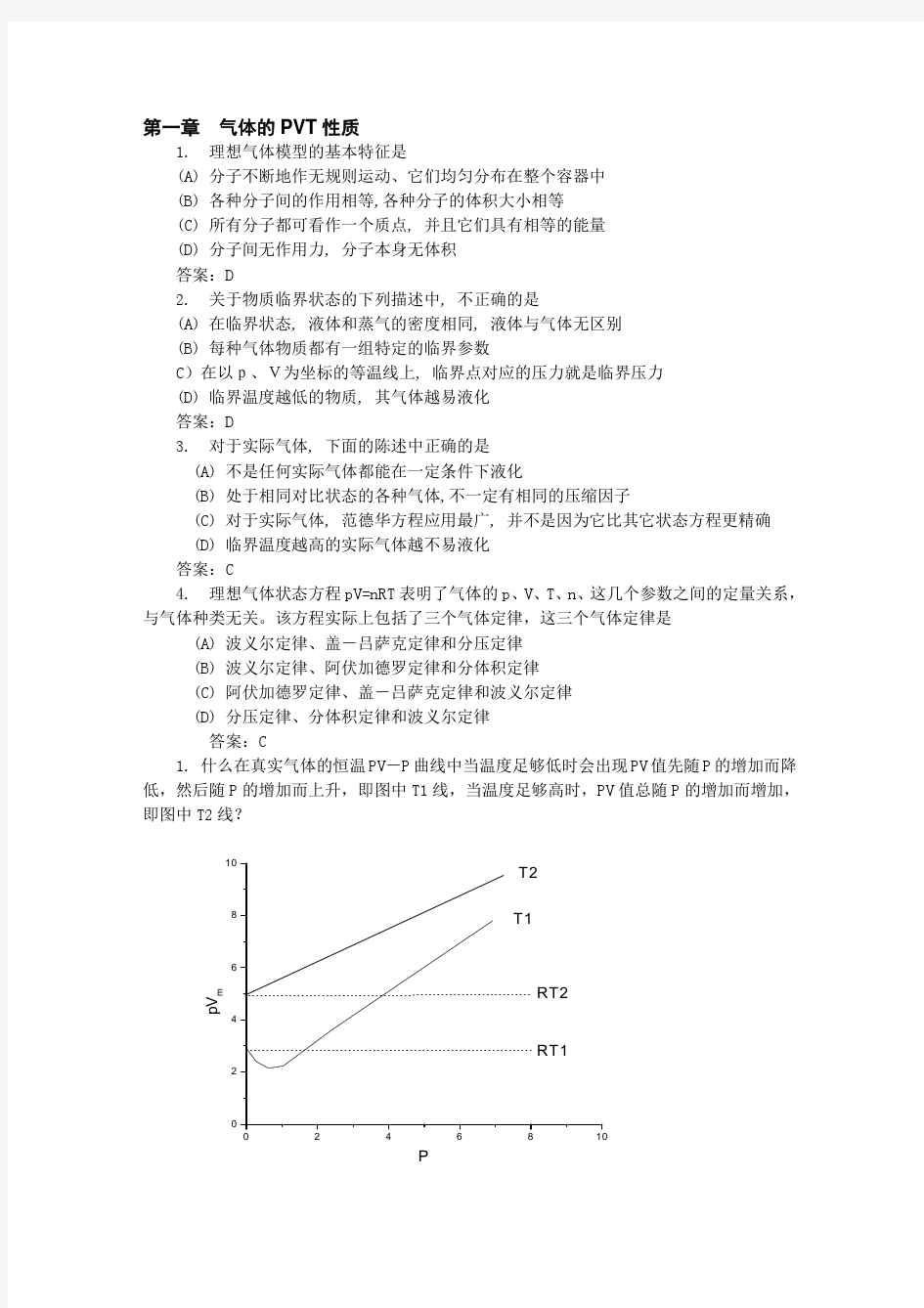
中国科学院长春应用化学研究所 2014年攻读博士学位研究生入学考试试题 高等物理化学 一、填空题(每空1分,共计7分) 1、在定温、定压的电池反应中,当反应达到平衡时,电池的电动势= 0(填 >、<、=、≠)。 2、液体在毛细管中上升的高度与毛细管体积基本无关。与毛细管半径、接触角、两相密度差有关。 3、三组分体系平衡共存的最大相数为5。,最大自由度为4 f=C+2-Q,三组分,所以C=3,Q为相数,f为自由度 4、范德华气体绝热向真空膨胀后,气体的温度将下降。 5、对弯曲液面所产生的附加压力一定≠ 0(填 >、<、=、≠)。 6、A及B二组分组成的凝聚体系能生成三种稳定的化合物,则于常压下在液相开 始冷却的过程中,最多有2种固相同时析出。 7、NH4HS(s)放入真空容器中,并与其分解产物NH3(g)和H2S(g)达到平衡,则该系统中组分数C= 2 ,相数P=2,自由度F=2 二、判断题(每题1分,共计7分, 对的“√”,错的“×”) 1、温度一定的时候,气体的体积与压力的乘积等于常数。(×) 2、系统的混乱度增加,则其熵值减小。(×) 3、处于标准状态的CO (g),其标准燃烧热为零。(×) 4、四个热力学基本方程适用于所有封闭体系的可逆过程。(√) 5、在纯溶剂中加入少量不挥发的溶质后形成的稀溶液沸点将升高。(√) 6、惰性组分的加入将使反应的平衡转化率降低。(×) 7、只受温度影响的平衡系统自由度F=C-P+1。(√) 三、选择题(每题2分,共计30分) 1、关于物质临界状态的下列描述中,不正确的是 A (A)在临界状态, 液体和蒸气的密度相同, 液体与气体无区别 (B)每种气体物质都有一组特定的临界参数 (C)在以p、V为坐标的等温线上, 临界点对应的压力就是临界压力 (D)临界温度越低的物质, 其气体越易液化 2、热力学第一定律ΔU=Q+W 只适用于 D
中国科学院大学 2019年招收攻读硕士学位研究生入学统一考试试题 科目名称:物理化学(甲) 考生须知: 1.本试卷满分为150 分,全部考试时间总计180 分钟。 2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。 3.可以使用不带储存及编程功能的计算器111111111111111111111111111111111111111111111111111111111111111111111 下列一些基本常数供解题时参考: 普朗克常数h=6.626×10-34J·s;玻尔兹曼常数k B=1.381×10-23J·K-1; 摩尔气体常数R=8.314J·mol-1·K-1;法拉第常数F=96500C·mol-1 一、是非题(每小题1分,共15分)(判断下列各题是否正确,正确用“√”表示,错误用“×”表示) 1.在动力学速率理论的发展史上,先后出现了阿伦尼乌斯理论、硬球碰撞模型、过渡态理论、单分子理论() 2.驰豫法测量,一定使离子运动速率减慢() 3.拉乌尔定律只适用于理想溶液() 4.到达CMC后,继续添加表面活性剂,界面张力会持续下降() 5.单斜硫的熔点为T,热效应为ΔH,熵变为ΔS=ΔH () T 二、单项选择题(每小题2分,共60分) 1.化学分析法的优点之一是() A.灵敏度高 B.操作简单 C.能直接测量瞬时绝对速度 D.仪器昂贵 2.在AgNO3溶液中加入过量KZ,生成AgZ胶体,下列物质聚沉能力最强的是() A.K3[Fe(CN)6] B.MgSO4
C.FeCl3 D.Na2SO4 3.下列哪个为基元反应() A.H2+I2→2HI B. H2+Cl2→2HCl C. CH3COOEt+OH-→CH3COO-+EtOH D. Br2+H2→2HBr 4.塑料汽渡金属原理是() A.电解 B.电沉积 C.电镀 D.电离 5.下列哪种方法不能测量离子的电迁移数() A.界面移动法 B.希托夫法 C.电导法 D.电动势法 6. Δr G mθ=-RTInKθ,反应自发进行,若使Kθ>1,温度应() T1=273.15K T2=273.15℃ A.低于T1 B.低于T2 C.高于T1 D.高于T2 三、计算和简答(共75分) 1. (4分)范德华对实际气体状态方程做了哪两项校正,写出状态方程(将气体分子看做硬球模型) 2. (4分)粒子基态和第一激发态简并度分别为g0、g1,能量分别为E0、E1,计算T1=300K,T2=3000K时,N0与N1之比
中国科学院研究生院2007年物理化学(甲) 一、是非题 1 对的教科书上有因为压力的单位:动量/面积*时间 2 对的 3 错的 4 对的 5 错的 6 对的 7 错的f=2 8 对的9 对的10 对的11错的原因:不一定要具体分析12 对的13 错的14 错的原因:丁达尔效应是胶体的特征,而只有憎液胶体才全面的表现出胶体的特征15 错的 二、选择题 1 D 2 C 3 D 4 C 5 B 6 B 7 A 8 C 9 B 10 C 11 A 12 B 13 B 14 D 15 B 16 C 17 C 18 A 19 C 20 A 21 B 22 B 23 D 24 B 25 BD 26 CD 27 AE 28 BE 三、计算和简答题 1.在溶液中,每个离子都被电荷相反的离子所包围,由于离子之间的相互作用,使得离子分布不均匀,从而形成离子氛。 离子氛对中心离子的影响主要是弛豫效应和电泳效应,由于这两种效应的存在使得离子的运动速率降低,使得离子摩尔电导率降低,进而影响离子的活度。 2.K(CaF2)=38.6×10(-4)-1.5×10(-4)=37.1×10(-4)S/m Λm∞(CaF2)=2Λm∞(CaCl2)- Λm∞(NaCl)+ Λm∞(NaF) = 0.0196 S.m2/mol C(CaF2)= K(CaF2)/Λm∞(CaF2)=0.1893mol/m3 Ksp=a+.(a-)2=(r+.c+/cθ).( r-.c-/cθ)2=4×(r±)3×(c/ cθ)3
= 0.0068 3. 解:PV=Nrt n(总)=PV/RT=0.00725mol n(H2S始)= n(总) ×0.513=0.0372mol n(CO2始)= n(总) ×(1-0.513)=0.0353mol 管子增加的量为H2O增加的量n(H2O)=0.0019mol H2S(g) + CO2(g) = COS(g) + H2O(g) 开始 0.0372 0.0352 0 0 平衡 (始-0.0019) (始-0.0019) 0.0019 0.0019 K=0.0019×0.0019/(0.0372-0.0019) ×(0.0352-0.009)=0.0031 4.两种解法 (一)COSθ= {-r(s-l)+r(s-g)}/r(l-g)=-1.77+1/0.88=-0.875 θ=151℃>90℃不能润湿 (二)S= r(s-g)- r(s-l)- r(l-g)=1-1.77-0.88<0 不能润湿 5. ρgh= 2r/R r=ρghR/2=2.33×10(-6) N2/m 6. (1)负极氧化 H2(Pθ)+2OH-(a0H-)→2H2O(l)+ 2e- 正极还原H2O(l) + 2e- + HgO(s) →Hg(l) +2OH-(a0H-) 净反应: H2(Pθ) + HgO(s)= Hg(l)+ H2O(l) (1) (2) H2O(l) →H2O(g) (2) (1)+(2)式得H2(Pθ) + HgO(s)= Hg(l)+ H2O(g) (3) △rGmθ(1)=-ZEF=-178.718kJ △rGmθ(3)= △rGmθ(1)+ △rGmθ(2) =-178.718kJ+8.598 kJ=-170.12 kJ
北京市 数学与系统科学研究院 力学研究所 物理研究所 高能物理研究所 声学研究所 理论物理研究所 国家天文台 渗流流体力学研究所 自然科学史研究所 理化技术研究所 化学研究所 过程工程研究所 生态环境研究中心 古脊椎动物与古人类研究所大气物理研究所 地理科学与资源研究所 遥感应用研究所 空间科学与应用研究中心 对地观测与数字地球科学中心地质与地球物理研究所 数学科学学院 物理学院 化学与化工学院 地球科学学院 资源与环境学院 生命科学学院 计算机与控制学院 管理学院 人文学院
外语系 工程管理与信息技术学院 材料科学与光电技术学院 电子电气与通信工程学院 华大教育中心 动物研究所 植物研究所 生物物理研究所 微生物研究所 遗传与发育生物学研究所 心理研究所 计算技术研究所 工程热物理研究所 半导体研究所 电子学研究所 自动化研究所 电工研究所 软件研究所 国家科学图书馆 微电子研究所 计算机网络信息中心 科技政策与管理科学研究所 北京基因组研究所 青藏高原研究所 光电研究院 国家纳米科学中心 信息工程研究所 空间应用工程与技术中心(筹)天津市 天津工业生物技术研究所
河北省 渗流流体力学研究所 遗传与发育生物学研究所农业资源研究中心山西省 山西煤炭化学研究所 辽宁省 大连化学物理研究所 沈阳应用生态研究所 沈阳计算技术研究所 金属研究所 沈阳自动化研究所 吉林省 长春人造卫星观测站 长春应用化学研究所 东北地理与农业生态研究所 长春光学精密机械与物理研究所 上海市 上海应用物理研究所 上海天文台 声学研究所东海研究站 上海有机化学研究所 上海硅酸盐研究所 上海生命科学研究院 上海药物研究所 上海微系统与信息技术研究所 上海光学精密机械研究所 上海技术物理研究所 上海巴斯德研究所
中科院2009年物理化学试题 注:本资料,由小蚂蚁化学社区(https://www.doczj.com/doc/588901647.html,)制作,仅供社区会员内部交流。由图片版逐一录入,原图清晰度较差,难以辨认,本文档出错在所难免,极少部分与原文表达方式略不同,忘谅解。 2009年7月13日一.是非题(每小题1分,共15分) 1. 某气体状态方程为p=f(V)T,f(V)只是体积的函数,恒温下该气 体的熵随体积V的增加而增加。 2. 在恒温恒压下不做非体积功的情况下,ΔH>0, Δ>0的过程不 一定能自发进行。 3. 已知X 和Y可构成固溶体。在X中,若加入Y则系统熔点升 高,则Y在固溶体中的含量比液相中的含量低 4. 稀溶液的依数性是指在指定溶液的种类和数量后,其性质仅决 定与所含溶质分子的数目,而与溶质的本性无关 5. 在非理想液态混合物中,正规混合物的非理想性是完全由混合 热效应引起的。 6. 多孔硅胶据具有强烈的吸水性能,这表明自由水分子的化学势 比干硅胶表面水分子的化学势低。 7. 在一定温度下,分子的平动,振动,转动的能级间隔顺序为,
振动>转动>平动。 8. 原电池的电动势等于组成电池的个相同的各个界面上所产生 的电势能的代数和。 9. 工业上用电解食盐水制造NaOH的反应为:2NaCl+2H2O→ 2NaOH+H2(g)+Cl(g),阴极反应为:2NaCl-2e→2Na+ +Cl2 (g) 10. 碰撞理论中的Ec与阿伦活化能Ea在数值上必须相等,碰撞 才是有效的。 11. 假设晶体上的被吸附的气体分子间无相互作用,则可把该气 体系统视为定域的独立子体系。 12. 在统热中,零点能(基态分子的能量)的选择可影响吉布斯 函数G的值 13. 绝大多数的液态物质的表面张力随温度升高而趋于最大值 14. 反应级数只能是0或正整数 15. 正常人体中,血液的糖分远高于尿中的糖分,是由于肾的渗 透功能阻止血液中的糖分进入尿液。 二.选择题(1-24 单选,每个2分,25-28多选,每个3分) 1. 在同一温度下,某气体无知的Cpm与Cvm的关系为 A Cpm
中国科学院理化技术研究所 科研物资采购管理暂行办法 为规范理化所科研物资采购管理,严格执行国家相关法规和管理制度,根据财政部和中国科学院有关事业单位国有资产管理实施办法以及政府采购的相关规定,结合我所实际情况特制订《理化所科研物资采购管理暂行办法》。 一、科研物资采购范围 科研物资采购范围包括科研材料与科研设备等。 科研材料主要指用于科研活动直接需要和间接需要的不纳入固定资产管理的各类物资; 科研设备包括整机设备、自行研制设备、委托加工设备等。 二、科研物资采购经费 科研物资采购经费包括课题项目经费、所公用经费以及研究所其它经费等。 三、科研物资采购流程 科研物资采购流程包括采购计划报批、确定采购方案、实施采购、验收入库等环节。 1.采购计划报批:
凡属政府采购范围内的科研物资,采购部门须在采购计划报批之前,根据上级部门的统一要求提前跨年度申报预算(具体申报时间以所资产办下发通知为准)。 采购3万元(含)以上科研物资,采购部门须填报《理化所科研物资采购审批表》(附件1)。其中主管业务部门须依据项目任务书或科研活动的需要对物资采购申请进行严格把关。 其中对于采购金额在50万元(含)以上的进口设备,采购部门实施采购前,还需通过资产办组织所外专家进行评审,并上报财政部审批。 2.确定采购方案: 采购部门在完成《理化所科研物资采购审批表》逐级审批后,即可进入采购方案的论证阶段。须组建采购小组,由采购小组组织并通过调研和论证等方式确定采购方案,填报《理化所科研物资采购方案论证报告》(附件2)。 对于单项或批量采购金额一次性在50万元(含)以上的科研物资,须执行政府采购相关规定。 对于单项或批量采购金额一次性在120万元(含)以上的科研物资,须采用公开招标方式(由资产办组织实施),附招投标过程相关文件与材料。 对于委托加工与研制的科研物资,附选定供货商的资质证明等(有效期限内的营业执照、生产许可证复印件)。
一、物理研究所简介 中国科学院物理研究所(以下简称“物理所”)前身是成立于1928年的国立中央研究院物理研究所和成立于1929年的北平研究院物理研究所,1950年在两所合并的基础上成立了中国科学院应用物理研究所,1958年9月30日启用现名。 物理所是1998年国务院学位委员会批准的首批物理学博士、硕士学位授予单位之一,现设有物理学、材料科学与工程等2个专业一级学科博士研究生培养点,材料工程、光学工程等2个专业学位硕士研究生培养点,并设有物理学1个专业一级学科博士后流动站,共有在学研究生882人(其中硕士生266人、博士生616人、留学生11人)。在站博士后65人。物理所是中国物理学会的挂靠单位;承办的科技期刊有《物理学报》、Chinese Physics Letters、Chinese Physics B和《物理》。 2019年物理所在本科起点的研究生招收中,预计计划招收学术型硕博连读生约110名(含推免生90人),全日制专业学位工程硕士研究生约10名。 二、中国科学院大学理论物理专业招生情况、考试科目
三、中国科学院大学理论物理专业分数线 2018年硕士研究生招生复试分数线 2017年硕士研究生招生复试分数线 四、中国科学院大学理论物理专业考研参考书目 601高等数学(甲) 《高等数学》(上、下册),同济大学数学教研室主编,高等教育出版社,1996年第四版,以及其后的任何一个版本均可。 617普通物理(甲) 全国重点大学理科类普通物理教材 809固体物理 黄昆编著,《固体物理学》,第1版,北京大学出版社,2009年9月1日 阎守胜编著,《固体物理基础》,第3版,北京大学出版社,2011年6月1日 811量子力学 《量子力学教程》曾谨言著(科学出版社 2003年第1版)。 五、中国科学院大学理论物理专业复试原则
中国科学院大学硕士研究生入学考试 《物理化学(乙)》考试大纲 本《物理化学》(乙)考试大纲适用于报考中国科学院大学化工类专业的硕士研究生入学考试。物理化学是化学学科的重要分支,是整个化学学科和化工学科的理论基础。它从物质的物理现象和化学现象的联系入手探求化学变化基本规律。物理化学课程的主要内容包括化学热力学(统计热力学)、化学动力学、电化学、界面化学与胶体化学等。要求考生熟练掌握物理化学的基本概念、基本原理及计算方法,并具有综合运用所学知识分析和解决实际问题的能力。 一、考试内容 (一)气体的PVT关系 1、理想气体状态方程 2、理想气体混合物 3、气体的液化及临界参数 4、真实气体状态方程 5、对应状态原理及普遍化压缩因子图 (二)热力学第一定律 1、热力学基本概念 2、热力学第一定律 3、恒容热、恒压热、焓 4、热容、恒容变温过程、恒压变温过程 5、焦耳实验,理想气体的热力学能、焓 6、气体可逆膨胀压缩过程 7、相变化过程 8、溶解焓及混合焓 9、化学计量数、反应进度和标准摩尔反应焓 10、由标准摩尔生成焓和标准摩尔燃烧焓计算标准摩尔反应焓
11、节流膨胀与焦耳—汤姆逊效应 12、稳流过程的热力学第一定律及其应用 (三)热力学第二定律 1、卡诺循环 2、热力学第二定律 3、熵、熵增原理 4、单纯pVT变化熵变的计算 5、相变过程熵变的计算 6、热力学第三定律和化学变化过程熵变的计算 7、亥姆霍兹函数和吉布斯函数 8、热力学基本方程 9、克拉佩龙方程 10、吉布斯—亥姆霍兹方程和麦克斯韦关系式 (四)多组分系统热力学 1、偏摩尔量 2、化学势 3、气体组分的化学势 4、拉乌尔定律和亨利定律 5、理想液态混合物 6、理想稀溶液 7、稀溶液的依数性 8、逸度与逸度因子 9、活度及活度因子 (五)化学平衡 1、化学反应的等温方程
2004年中科院—中科大《物理化学》考研笔记 2004年中科院—中科大《物理化学》考研笔记 第一章热力学第一定律 二、热力学平衡 n 如果体系中各状态函数均不随时间而变化,我们称体系处于 热力学平衡状态。严格意义上的热力学平衡状态应当同时具备三个平衡: 2. 机械平衡: n 体系的各部分之间没有不平衡力的存在,即体系各处压力相同。 §2、热力学第一定律 n 对于宏观体系而言,能量守恒原理即热力学第一定律。 n 热力学第一定律的表述方法很多,但都是说明一个问题 ¾ 能量守恒。 例如:一种表述为: n “第一类永动机不可能存在的” n 不供给能量而可连续不断产生能量的机器叫第一类永动机。 一、热和功 热和功产生的条件: n 与体系所进行的状态变化过程相联系,没有状态的变化过程就没有热和功的产生。 符号表示: n 功W:体系对环境作功为正值,反之为负值。 n 热Q:体系吸热Q为正值,反之Q为负值。 二、热力学第一定律的数学表达式 DU = Q-W (封闭体系) ?如果体系状态只发生一无限小量的变化,则上式可写为: dU = dQ-dW (封闭体系) 例1:设有一电热丝浸于水中,通以电流,如果按下列几种情况作为体系,试问DU、Q、W的正、负 号或零。 (a)以电热丝为体系; (b)以电热丝和水为体系; (c)以电热丝、水、电源和绝热层为体系; (d)以电热丝、电源为体系。 解答: DU Q W (a) + -- (b) + -- (c) 0 0 0
(d)-- 0 三、膨胀功(体积功):We n 功的概念通常以环境作为参照系来理解,微量体积功dWe可用P外×dV表示: dWe = P外×dV 式中P外为环境加在体系上的外压,即环境压力P环。 n 不同过程膨胀功: u (1)向真空膨胀 We = P外×DV = 0 u (2)体系在恒定外压的情况下膨胀 We = P外× DV u (3)在整个膨胀过程中,始终保持外压P外比体系压 力P小一个无限小的量 dP 此时,P外= P-dP,体系的体积功: W e =∫V1V2 P外·dV =∫V1V2 (P-dP)dV = ∫V1V2 P dV 此处略去二级无限小量dP·dV,数学上是合理的;即可用体系压力P代替P外。 n 封闭、理气、恒温可逆膨胀功: We = ∫V1V2 P外·dV = ∫V1V2 P·dV = ∫V1V2 nRT/V dV = nRT∫V1V2 dV/V = nRT ln (V2 /V1) = n RT ln (P1/P2) n *上述三种膨胀过程,体积功不同。 四、可逆相变及其膨胀功 对于可逆蒸发过程: We = ò P外dV = ò PdV = P DV 若蒸气为理想气体,则: We = P× nRT/P = nRT (n:蒸发液体mol数) *此式也适用于固体的可逆升华。 五、恒容和恒压下的热量(交换) n Qv = ?U (封闭体系、 Wf =0 、恒容过程) n Q P = ?H (封闭体系、 Wf =0 、恒压过程) 六、理想气体的内能(U)和焓(H) (U/V)T > 0 (实际气体) (U/P)T < 0 (实际气体) ( U/V )T = 0 (理想气体) ( U/P )T = 0 (理想气体) U = U ( T ) (理想气体) H = H ( T ) (理想气体)
中国科学院长春应用化学研究所 二O一O年攻读博士学位研究生入学考试试题 高等物理化学 一、选择题(每小题2分,共40分) 1. 物质的量为n 的纯理想气体,该气体的哪一组物理量确定后,其他状态函数方有定值?() (A)p (B)V (C)T,U (D)T, p 2. 273 K,10p 下,液态水和固态水(即冰)的化学势分别为μ(l) 和μ(s),两者的关系为:() (A) μ(l) >μ(s) (B) μ(l) = μ(s) (C) μ(l) < μ(s) (D) 不能确定 3. 一封闭钟罩中放一杯纯水A 和一杯糖水B,静止足够长时间后发现:() (A) A 杯水减少, B 杯水满后不再变化 (B) A 杯水变成空杯,B 杯水满后溢出 (C)B杯水减少, A 杯水满后不再变化 (D)B杯水变成空杯,A杯水满后溢出 4. 硫酸与水可形成H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s)三种水合物,问在101 325 Pa 的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种? ( ) (A) 3 种(B) 2 种 (C) 1 种(D) 不可能有硫酸水合物与之平衡共存。 5. 已知A 和B 可构成固溶体,在A 中,若加入B 可使A 的熔点提高,则B在此固溶体中的含量必_______ B 在液相中的含量。( ) (A) 大于(B) 小于 (C) 等于(D)不能确定 6. 已知反应2NH3= N2+ 3H2在等温条件下,标准平衡常数为0.25,那么,在此条件下,氨的合成反应(1/2) N2+(3/2) H2= NH3的标准平衡常数为:( )
中国科学院数学与系统科学研究院 *中国科学院数学研究所 *中国科学院应用数学研究所 *中国科学院系统科学研究所 *中国科学院计算数学与科学工程计算研究所 中国科学院物理研究所 中国科学院理论物理研究所 中国科学院高能物理研究所 中国科学院力学研究所 中国科学院声学研究所 中国科学院理化技术研究所 中国科学院化学研究所 中国科学院生态环境研究中心 中国科学院过程工程研究所 中国科学院地理科学与资源研究所 中国科学院国家天文台 *中国科学院云南天文台 *中国科学院乌鲁木齐天文工作站 *中国科学院长春人造卫星观测站 *中国科学院南京天文光学技术研究所 中国科学院遥感应用研究所 中国科学院地质与地球物理研究所 中国科学院古脊椎动物与古人类研究所 中国科学院大气物理研究所 中国科学院植物研究所 中国科学院动物研究所 中国科学院心理研究所 中国科学院微生物研究所 中国科学院生物物理研究所 中国科学院遗传与发育生物学研究所 *中国科学院遗传与发育生物学研究所农业资源研究中心(原中国科学院石家庄农业资源研究所) 中国科学院计算技术研究所 中国科学院软件研究所 中国科学院半导体研究所 中国科学院微电子研究所 中国科学院电子学研究所 中国科学院自动化研究所 中国科学院电工研究所 中国科学院工程热物理研究所 中国科学院空间科学与应用研究中心 中国科学院自然科学史研究所 中国科学院科技政策与管理科学研究所
中国科学院光电研究院 北京基因组研究所 中国科学院青藏高原研究所 国家纳米科学中心 院直属事业单位(京外) 中国科学院山西煤炭化学研究所 中国科学院沈阳分院 中国科学院大连化学物理研究所 中国科学院金属研究所 中国科学院沈阳应用生态研究所 中国科学院沈阳自动化研究所 中国科学院海洋研究所 青岛生物能源与过程研究所(筹) 烟台海岸带可持续发展研究所(筹) 中国科学院长春分院 中国科学院长春光学精密机械与物理研究所 中国科学院长春应用化学研究所 中国科学院东北地理与农业生态研究所 *中国科学院东北地理与农业生态研究所农业技术中心(原中国科学院黑龙江农业现代化研究所) 中国科学院上海分院 中国科学院上海微系统与信息技术研究所 中国科学院上海技术物理研究所 中国科学院上海光学精密机械研究所 中国科学院上海硅酸盐研究所 中国科学院上海有机化学研究所 中国科学院上海应用物理研究所(原子核研究所) 中国科学院上海天文台 中国科学院上海生命科学院 *生物化学与细胞生物学研究所 *神经科学研究所 *药物研究所 *植物生理生态研究所 *国家基因研究中心 *健康科学研究中心 *中国科学院上海生命科学信息中心 *营养科学研究所 *中国科学院上海生物工程研究中心 中国科学院上海巴斯德研究所(筹) 中国科学院福建物质结构研究所 中国科学院城市环境研究所 中国科学院宁波材料技术与工程研究所(筹) 中国科学院南京分院
关于2018年中科院619物理化学甲/825物理化学乙的复习方案 来自2017年考研鸟学长的建议首先说下题目的变化: 619物理化学甲:2017年中科院619物理化学甲题型变化:今年判断20个,选择27个,大题8个 825物理化学乙:2017年中科院825物理化学乙题型变化:今年判断20个,选择27个,大题9个(两个简答题) 总体分析:相比于以往,选择题多了5个。大题多了简答题。题目更加丰富,多样化,知识点涵盖范围大。选择题难度加大,大题难度变小,判断题难度不大。 通过同学们今年考研的情况以及近几年中科院619物理化学甲/825 物理化学乙出题的方向,建议大家按照以下复习思路复习 复习参考资料: 1、南大傅献彩物理化学课本上下册 2、南大傅献彩物理化学课后习题(找考研鸟要) 3、南大傅献彩物化学习指导(备选) 4、选择判断题题库(找考研鸟,物理化学考研QQ群295976617) 5、历年真题及解析(找考研鸟) 注意:825物理化学乙一定要按照南大的教材来,基本大题都是南大的课后习题。
整体复习思路: 第一遍 把南大课本好好复习一遍,需要注意课本中带星号的也需要复习。复习中不确定知识点的内容可以翻看考研鸟编写的中科院619物理化 学甲考研知识点全书。里面有每章重要的考点。第一遍要精,最好在上半年开始时开始准备专业课复习,第一遍是基础,时间大约3个月,做一遍课后习题。 第二遍 结合考研鸟提供的物理化学甲考研知识点全书来刷题,多做选择题和判断题,大题以课后习题为主,同时注意南大课后思考题,思考题是往年判断题的来源。选择和判断题题目的选择可以咨询考研鸟 QQ2376541525。如果大家自己有好的选择和判断题也可以按照自己的来复习。 第三遍 做考研鸟提供的真题,结合真题研究考研的出题思路和所考知识点。这时候要做第三遍课后习题。尽量保证课后习题的题都会做。考场上遇到原题时能全部拿分。 总结:大题主要看南大课后习题。选择判断多做题,题库找考研鸟。
2015中科院化学工程考研(成都有机化学研究所)参考书、历年真题、报录比、研究生招生专业目录、复试分数线 一、学院介绍 按照中国科学院知识创新工程的总体战略和布局调整,由创建于1958年的中国科学院成都有机化学研究所整体转制组建的中国科学院成都有机化学有限公司于2001年6月注册成立,是一家高技术创新和产业发展并重的医药化工和材料领域的高新技术企业。 中国科学院成都有机化学有限公司成立于1958年11月,是中国科学院四川分院第一批成立的研究所之一,当时定名为中国科学院四川分院化学化工研究所;1960年更名为中国科学院四川分院化学研究所;1962年,四川、云南、贵州三省分院合并为中国科学院西南分院,该所更名为中国科学院西南有机化学研究所;1971年下放给四川省领导,更名为四川省化学研究所;1978年重归中国科学院,使用中国科学院成都有机化学研究所;根据中国科学院知识创新工程的总体战略和布局调整,该所被确定为首批整体转制试点单位,于2001年6月8日完成了工商注册为中国科学院成都有机化学有限公司,股份比例为中国科学院国有资产经营有限责任公司占85%,有机公司职工占35%。 建所初期,研究所立足于四川省丰富的天然气资源,确定了“油气并举,以气为主”的研究方向,开展天然气化学与化工综合利用研究。随即分别派出3个工作组,赴重庆天然气化工研究所、自贡天然气化工研究所和永川天然气化工研究所进行合作研究。1965-1975年,在自贡凤凰坝建立了“自贡试验站”,利用当地的天然气资源进行研究。 1965年,为加强西南分院的科研力量,中国科学院采取了相应的措施,将中国科学院化学研究所的部分有机化学研究工作调整到该所,并先后从中国科学院化学研究所和长春应用化学研究所抽调一批科技骨干到该所工作,使科研力量大大加强。 1982年3月,中国科学院化学学部组织院内外学部委员、知名化学专家评议该所,充分肯定了成绩,明确了方向,确定该所是“以有机合成化学为学科领域的综合性研究所”,并应充分发挥多学科(有机化学、催化、高分子化学、分析化学、等离子体化学)的综合优势,集中主要力量,在天然气(低碳烃)、一氧化碳、皮革、多醣类天然纤维、饼粕等的化学改性及利用和新材料研究等方面,为国民经济建设作贡献;并以精干的力量从事天然气化学、金属有机化学及立体控制合成等为重点的基础研究,争取形成一定特色。 “七五”和“八五”期间,该所坚持贯彻中国科学院“一院两种运行机制”方针,将主要科技力量和研究任务投向国民经济建设主战场。