各国药典允许调整范围
- 格式:doc
- 大小:37.00 KB
- 文档页数:4
系统适应性——美国药典系统适应性是气相和液相色谱分析方法的重要组成部分,用于证明色谱系统的分离度和重现性能满足样品的分析要求。
测试基于这样的原理:仪器、电路、方法和样品组成一个整体系统,我们可以对这个系统进行测试评估。
影响色谱系统的因素包括:●流动相的组成、离子强度、温度和pH值●柱子大小、流速、柱温和压力●固定相特点,包括填料类型,载体形状、粒径、孔径、表面积等。
●常用固定相为反相硅胶,以十八碳烷基健合硅胶最常用,其它经过化学修饰的硅胶也有使用。
分离度R s是理论塔板数n的函数(也叫柱效),α是分离因子,k是容量因子(所有符号的意义见前文“色谱定义和说明”部分)。
在规定的色谱条件下,n表示洗脱物中相邻化合物的分离程度,可作为衡量色谱系统柱效能的指标,但是不如直接测试的结果可靠。
峰的尖锐程度部分反映柱效,这个参数对检查微量物质至关重要。
标准品或者标准溶液需要重复进样以确保精密度。
除非个论中有规定, 系统适用性五针的数据的相对标准偏差不超过2.0%, 如果超过2.0%的话, 需要进样六针。
在含量测定中,如果纯品含量100%,则相对标准偏差没有最大值限制,这个值可根据多次进样对照溶液来计算:%RSD=KB/t90%,n-1K为常数0.349,由公式k=(0.6/)×(t90%,5/)计算得来,表示B=1.0时六次进样的相对标准偏差。
B是个案中规定的上限。
n是对照溶液的进样次数(3≤n≤6),t90%,n-1是自由度为n-1、置信水平为90%,双侧检验时的t值。
除非另有规定,RSD不能超过下表中的值。
此规定不适用于相关物质检测。
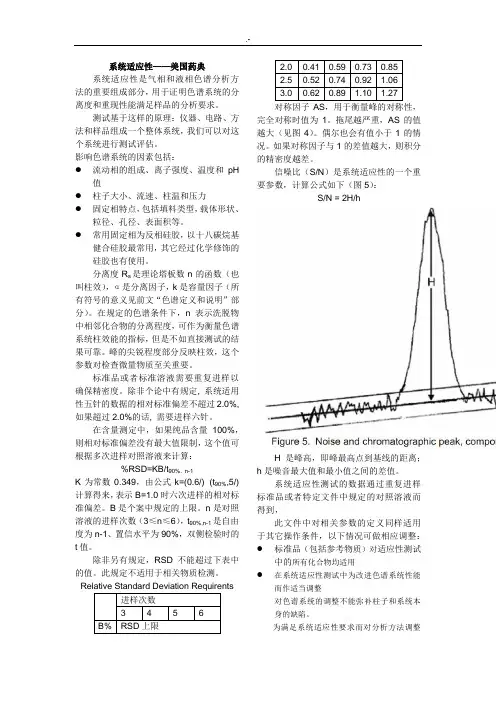
对称因子AS,用于衡量峰的对称性,完全对称时值为1。
拖尾越严重,AS的值越大(见图4)。
偶尔也会有值小于1的情况。
如果对称因子与1的差值越大,则积分的精密度越差。
信噪比(S/N)是系统适应性的一个重要参数,计算公式如下(图5):S/N = 2H/hH是峰高,即峰最高点到基线的距离;h是噪音最大值和最小值之间的差值。



药典对纯化水的ph范围药典对纯化水的pH范围概述纯化水是制药过程中必不可少的一种重要溶剂。
在制药工艺中,纯化水的质量直接关系到制剂的质量和稳定性。
因此,对于纯化水的质量要求非常高。
其中,pH值是评价纯化水质量的重要指标之一。
本文将介绍药典对纯化水的pH范围。
I. 纯化水的定义II. 纯化水pH值的意义III. 药典对纯化水pH值的要求A. 美国药典(USP)B. 欧洲药典(EP)C. 中国药典(CP)IV. pH值偏高或偏低时可能带来的影响V. pH值异常时应采取措施I. 纯化水的定义纯化水是指经过特殊处理后去除了其中大部分杂质和离子,达到一定纯度要求并符合特定用途需求的水。
其主要用于制药、生物技术、电子等领域。
II. 纯化水pH值的意义在制药工艺中,pH值是一个非常重要的指标。
pH值可以影响制剂的稳定性、药效、生物相容性等多个方面。
因此,对于纯化水而言,pH 值也是一个非常重要的评价指标。
III. 药典对纯化水pH值的要求各国药典对于纯化水的pH值有不同的要求,下面将分别介绍美国药典、欧洲药典和中国药典对于纯化水pH值的要求。
A. 美国药典(USP)美国药典规定,纯化水的pH值应在5.0~7.0之间。
如果使用了气体去除法(如CO2去除法),则其pH值应在5.0~8.0之间。
B. 欧洲药典(EP)欧洲药典规定,纯化水的pH值应在5.0~7.5之间。
C. 中国药典(CP)中国药典规定,注射用水和灭菌用水的pH值应在5.0~7.0之间;其他用途的纯化水则没有明确规定其pH范围。
IV. pH值偏高或偏低时可能带来的影响当纯化水的pH值偏高或偏低时,会影响制剂的稳定性和药效。
例如,当pH值偏高时,会使酸性药物的稳定性降低;而当pH值偏低时,会使碱性药物的稳定性降低。
此外,pH值还会影响生物相容性和溶解度等多个方面。
V. pH值异常时应采取措施当纯化水的pH值超出规定范围时,应及时采取措施进行调整。
一般来说,可以通过加入酸或碱来调整纯化水的pH值。
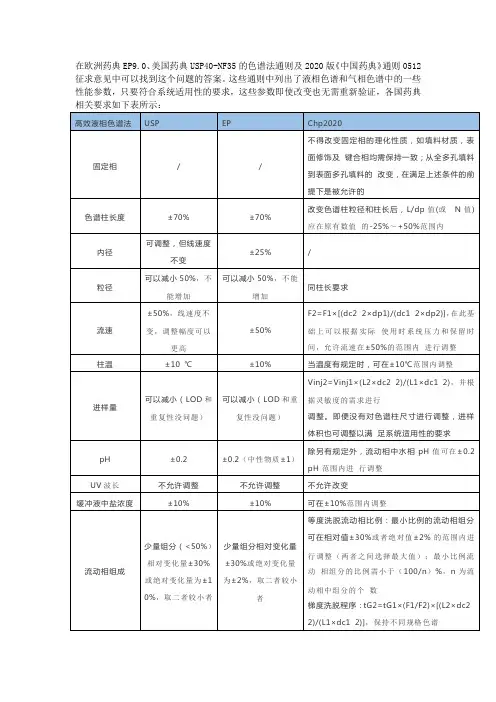
在欧洲药典EP9.0、美国药典USP40-NF35的色谱法通则及2020版《中国药典》通则0512征求意见中可以找到这个问题的答案。
这些通则中列出了液相色谱和气相色谱中的一些性能参数,只要符合系统适用性的要求,这些参数即使改变也无需重新验证,各国药典
的内径dc2:调整后方法中色谱柱的内径dp1:原方法中色谱柱的粒径dp2:调整后方法中色谱柱的粒径;Vinj1:原方法中进样体积;Vinj2:调整后方法中进样体积;L1:原方法中色谱柱柱长L2:调整后方法中色谱柱柱长tG1:原方法的梯度段洗脱时
间tG2:调整后的梯度段洗脱时间,可通过相关软件计算表 1 中流速、进样体积和梯度洗脱程序的调整范围,并根据色谱峰分离情况进行微调。
若调整超出上表中规定的范围,调整的方法应进行相应的方法学验证。
色谱系统的适用性试验通常包括理论板数、分离度、灵敏度、拖尾因子和重复性等五个参数。
按各品种正文项下要求对色谱系统进行适用性试验,即用规定的对照品溶液或系统适用性试验溶液在规定的色谱系统进行试验,必要时,可对色谱系统进行适当调整,以符合要求。
结论:各国药典对系统适用性的要求不尽相同,但涉及的计算公式基本一致,研究中应根据具体品种的特性,制定适合自己的系统适用性要求,确保检测数据的准确,可重现。
系统适应性——美国药典系统适应性是气相和液相色谱分析方法的重要组成部分,用于证明色谱系统的分离度和重现性能满足样品的分析要求。
测试基于这样的原理:仪器、电路、方法和样品组成一个整体系统,我们可以对这个系统进行测试评估。
影响色谱系统的因素包括:●流动相的组成、离子强度、温度和pH值●柱子大小、流速、柱温和压力●固定相特点,包括填料类型,载体形状、粒径、孔径、表面积等。
●常用固定相为反相硅胶,以十八碳烷基健合硅胶最常用,其它经过化学修饰的硅胶也有使用。
分离度R s是理论塔板数n的函数(也叫柱效),α是分离因子,k是容量因子(所有符号的意义见前文“色谱定义和说明”部分)。
在规定的色谱条件下,n表示洗脱物中相邻化合物的分离程度,可作为衡量色谱系统柱效能的指标,但是不如直接测试的结果可靠。
峰的尖锐程度部分反映柱效,这个参数对检查微量物质至关重要。
标准品或者标准溶液需要重复进样以确保精密度。
除非个论中有规定, 系统适用性五针的数据的相对标准偏差不超过2.0%, 如果超过2.0%的话, 需要进样六针。
在含量测定中,如果纯品含量100%,则相对标准偏差没有最大值限制,这个值可根据多次进样对照溶液来计算:%RSD=KB/t90%,n-1K为常数0.349,由公式k=(0.6/)×(t90%,5/)计算得来,表示B=1.0时六次进样的相对标准偏差。
B是个案中规定的上限。
n是对照溶液的进样次数(3≤n≤6),t90%,n-1是自由度为n-1、置信水平为90%,双侧检验时的t 值。
除非另有规定,RSD不能超过下表中的值。
此规定不适用于相关物质检测。
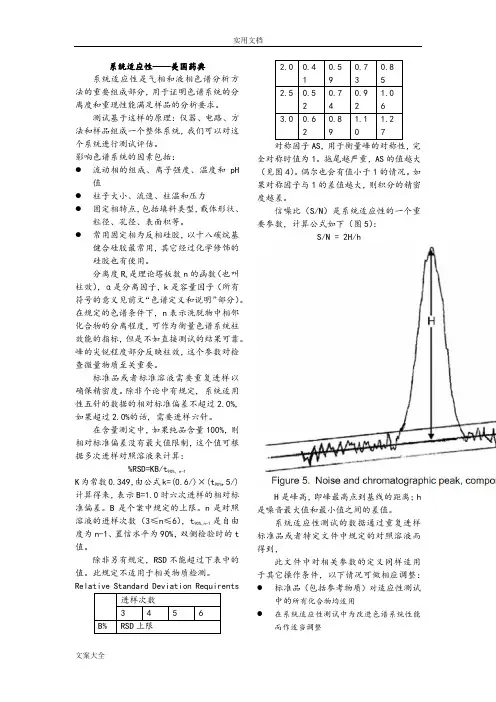
Relative Standard Deviation Requirents对称因子AS,用于衡量峰的对称性,完全对称时值为1。
拖尾越严重,AS的值越大(见图4)。
偶尔也会有值小于1的情况。
如果对称因子与1的差值越大,则积分的精密度越差。
信噪比(S/N)是系统适应性的一个重要参数,计算公式如下(图5):S/N = 2H/hH是峰高,即峰最高点到基线的距离;h 是噪音最大值和最小值之间的差值。

气相色谱参数调整范围在各国药典中通常有明确的规定,以确保分析结果的准确性和重现性。
这些参数包括但不限于:
1. 固定相粒径:对于填充柱,固定相颗粒的最大减小量通常不超过50%,不允许增大。
2. 膜厚:对于毛细管柱,膜厚可以在-50%到+100%的范围内调节,但需确保符合规定的要求。
3. 色谱柱长度:色谱柱长度可以±70%范围内调节,这取决于具体的实验要求和所用仪器的限制。
4. 色谱柱内径:色谱柱内径允许的调整范围没有明确说明,这可能因为不同应用和仪器对内径的要求不同。
5. 流动相pH值和浓度:例如,欧洲药典(EP)中规定,对于使用缓冲盐作为流动相的情况,pH值可在规定范围内的±0.2以内进行微调,且20mM磷酸钾可调整至18-22mM,只要最终pH值符合要求即可。
请注意,以上信息基于我之前记住的知识库内容,具体细节可能会随着各国药典更新而发生变化。

各国药典储存条件汇总各国药典储存条件汇总————————————————————————————————作者: ————————————————————————————————日期:药典储存条件的比较2012-11-27美国药典34 欧洲药典7.0 中国药典2010二部冷冻储存-25℃~-10℃深冷低于-15℃冷处不超过8℃冷处2℃~10℃控制的冷处2℃~8℃,允许在0℃~15℃之间冰箱中储存2℃~8℃阴凉储存8℃~15℃阴凉储存8℃~15℃阴凉处不超过20℃凉暗处避光并不超过20℃室温工作区的一般温度控制下的室温储存20℃~25℃,允许在15℃~30℃之间室温储存15℃~25℃常温10℃~30℃温暖30~40℃过热40℃以上干燥储存控制室温下湿度不超过40%见:药品GMP指南《质量控制实验室与物料系统》P387-388 药典加速、长期试验条件的比较中国药典二部附录试验名称试验条件备注1 备注2加速试验(一般情况)温度40℃±2℃、相对湿度75%±5%所用设备应能控制温度±2℃,相对湿度±5%,并能对真实温度和湿度进行检测溶液剂、混悬剂、乳剂、注射液等含有水性介质的制剂可不要求相对湿度加速试验(中间条件) 温度30℃±2℃、相对湿度65%±5%在温度40℃±2℃、相对湿度75%±5%加速6个月内不符合标准则采用该条件加速试验(温度敏感) 温度25℃±2℃、相对湿度60%±10%预计只能在冰箱中保存(4-8℃加速试验30℃±2℃、相对湿度65%±5%乳剂、混悬剂、软膏剂、乳膏剂、糊剂、凝胶剂、眼膏剂、栓剂、气雾剂、泡腾剂及泡腾颗粒宜直接采用加速试验40℃±2℃、相对湿度25%±5%包装在半透明容器中药物制剂,例如低密度聚乙烯制备的输液袋、塑料安瓿、眼用制剂容器等长期试验(一般情况)温度在25℃±2℃、相对湿度60%±10%或温度在30℃±2℃、相对湿度 65%±5%南方、北方气候差异长期试验(温度敏感)6℃±2℃长期试验温度在25℃±2℃、相对湿度40%±5%或温度在30℃±2℃、相对湿度35%±5%包装在半透明容器中药物制剂选择由研究者决定药典加速、长期试验条件的比较ICH试验名称试验条件备注1 备注2 加速试验(一般情况) 温度40℃±2℃、相对湿度75%±5%加速试验(中间条件) 温度30℃±2℃、相对湿度 60%±5%在温度40℃±2℃、相对湿度75%±5%加速6个月内不符合标准则采用该条件长期试验(一般情况) 温度在25℃±2℃、相对湿度60%±5%美国药典USP35试验名称试验条件备注1备注2 加速试验温度40℃±2℃、相对湿度75%±5%允许解释数据和信息的短期峰值在储存条件下除了受控室温允许的偏离长期试验温度在25℃±2℃、相对湿度60%±5%欧洲药品局试验名称试验条件备注1 备注2 影响因素试验温度:以10℃的增长量(10℃、2可评估药品在一定PH范围内的溶液或(原料药) 0℃、……50℃、60℃)高于加速试验相对湿度:≥75%混悬液对水解的敏感性光稳定性研究可作为影响因素试验的必要部分(条件按ICHQ1B)储存条件一般情况长期试验温度在25℃±2℃、相对湿度60%±5%或温度30℃±2℃、相对湿度 65%±5%选择由研究者决定中间条件温度30℃±2℃、相对湿度65%±5% 若长期试验条件为温度30℃±2℃、相对湿度 65%±5%,则无中间条件若长期试验条件为温度25℃±2℃、相对湿度60%±5%,且加速6个月内发生显著变化则应增加中间条件试验以评估显著变化的标准,最初申请应包括12个月的中间条件研究中至少6个月的数据加速试验温度40℃±2℃、相对湿度75%±5% 储存条件在冰箱保存长期试验温度5℃±3℃加速试验温度在25℃±2℃、相对湿度60%±5%储存条件冷藏长期试验温度-20℃±5℃加速试验在评估温度下进行,5℃±3℃或25℃±2℃储存条件低于-20℃根据个别方案而定制剂储存条件一般情况长期试验温度在25℃±2℃、相对湿度60%±选择由研究者决定5%或温度30℃±2℃、相对湿度65%±5%中间条件温度30℃±2℃、相对湿度65%±5% 若长期试验条件为温度30℃±2℃、相对湿度65%±5%,则无中间条件若长期试验条件为温度25℃±2℃、相对湿度60%±5%,且加速6个月内发生显著变化则应增加中间条件试验以评估显著变化的标准,最初申请应包括12个月的中间条件研究中至少6个月的数据加速试验温度40℃±2℃、相对湿度75%±5%储存条件不透水的容器可在任何可控的或环境湿度条件下进行储存条件半透水的容器长期试验温度在25℃±2℃、相对湿度40%±5%选择由研究者决定或温度30℃±2℃、相对湿度35%±5%中间条件温度30℃±2℃、相对湿度35%±5% 若长期试验条件为温度30℃±2℃、相对湿度 35%±5%,则无中间条件若长期试验条件为温度25℃±2℃、相对湿度40%±5%,且加速6个月内发生除水分流失外的显著变化则应增加中间条件试验以评估30℃时温度的影响若加速试验中发生的显著变化只是水分流失,则不需要增加中间条件试验,但是应有数据证明在提供的有效期内在温度25℃±2℃、相对湿度40%±5%的条件下不会发生显著的水分流失加速试验温度40℃±2℃、相对湿度不大于25%储存条件冰箱长期试验温度5℃±3℃加速试验温度在25℃±2℃、相对湿度60%±5%储存条件冷藏长期试验-20℃±5℃无加速条件试验但规定在冷藏条件下储存的,应取一批在评估温度(5℃±3℃或25℃±2℃)下进行适当时间的试验,以说明短期内偏离标示储存条件的影响储存条件低于-20℃根据个别方案而定。
部分国家、地区草药重金属和农药残留限量标准汇总加入WTO后,中药的国际贸易将以国际通行的标准进行。
目前,国际上虽然尚无植物类中药的国际标准,但是FAO和WHO均制定了食品、蔬菜及茶叶重金属的允许摄入量和农药残留限量。
美国、欧盟及传统出口中药的东南亚地区均对中药提出了重金属和农药残留限量的指标,并有提高的趋势。
近年来国际贸易中以环保标准为基础的绿色认证制度日趋盛行,“环保标签”在许多情况下变成贸易壁垒。
在中药材生产过程中,由于对土壤选择不严,以及长期施用农药、化肥和除草剂,加之对农药的盲目选择,施用时间和剂量等达不到技术要求,导致目前药材普遍存在农药残留量和有害重金属含量超标,这是造成中药材质量下降的重要因素,也是制约我国中药及其它农副产品难以走向国际市场的重要原因之一,直接影响了中药在国际市场上的竞争力。
在此情况下,一方面我们要建立适合我国产品质量的标准以适应国际标准。
另一方面中药在中国有数千年的使用历史,世界各国在制定相应的植物药产品质量标准中也多参考我国的中药标准,因此,制定绿色标准也可以影响世界,达到对我中药产品国际贸易相对有利的局面。
由外经贸部制定并颁布的《药用植物及制剂外经贸绿色行业标准》已于2001年07月01日起正式实施。
这是我国中药的第一个进出口质量标准,也是我国中药的第一个绿色标准,对推动我国中药进入国际市场,确保植物药进出口品质,有着重大的历史性意义。
一、中国大陆(一)中国药典(2010版)药典对植物药中重金属和农药残留量的限量要求( ×10- 6)(二)药用植物及制剂外经贸绿色行业标准(WM/T2-2004)适用范围:药用植物原料及制剂的外经贸行业品质检验 重金属及砷盐限量:重金属总量 ≤20.0 mg/kg 。
铅(Pb ) ≤5.0 mg/kg 。
镉(Cd ) ≤0.3 mg/kg 。
汞(Hg ) ≤0.2 mg/kg 。
铜(Cu ) ≤20.0 mg/kg 。
各国药典标准因国家而异,但一般来说,药典标准是指药品生产、使用和检测的法定标准。
药典收载的药品标准,是国家药品标准,具有法律效力。
在中国,《中华人民共和国药典》是药品生产、使用和检测的标准,由国家药典委员会负责制定和修订。
此外,各省市也会根据当地实际情况制定相应的药典标准。
在欧洲,欧洲药典(European Pharmacopoeia,简称EP)是欧洲药品质量管理局(European Directorate for the Quality of Medicines & Healthcare,简称EDQM)制定的药品质量标准。
欧洲药典涵盖了药品的原料、辅料、剂型、方法、质量控制和包装等方面的要求。
在美国,美国药典(United States Pharmacopeia,简称USP)是由美国药典委员会(United States Pharmacopeial Convention,简称USPC)制定的药品标准。
USP涵盖了药品的原料、辅料、剂型、方法、质量控制和包装等方面的要求。
此外,其他国家也有各自的药品标准制定机构和相应的药典标准,如日本的《日本药典》(The Japanese Pharmacopoeia,简称JP)等。
需要注意的是,药典标准的制定和修订是一个不断发展和完善的过程,各国的药典标准也在不断更新和改进。
部分国家、地区草药重金属和农药残留限量标准汇总发布时间:2010-05-24一、中国:(一)中国药典(05版)甘草重金属及有害元素:铅、镉、砷、汞、铜含量限定如下:铅不得过百万分之五,镉不得过千万分之三,砷不得过百万分之二,汞不得过千万分之二,铜不得过百万分之二十。
有机氯农药残留量:六六六(总BHC)不得过千万分之二,滴滴涕(总DDT)不得过千万分之二,五氯硝基苯(PCNB)不得过千万分之一。
黄芪重金属及有害元素:铅、镉、砷、汞、铜含量限定如下:铅不得过百万分之五,镉不得过千万分之三,砷不得过百万分之二,汞不得过千万分之二,铜不得过百万分之二十。
有机氯农药残留量:六六六(总BHC)不得过千万分之二,滴滴涕(总DDT)不得过千万分之二,五氯硝基苯(PCNB)不得过千万分之一。
丹参重金属及有害元素:铅、镉、砷、汞、铜含量限定如下:铅不得过百万分之五,镉不得过千万分之三,砷不得过百万分之二,汞不得过千万分之二,铜不得过百万分之二十。
白芍重金属及有害元素:铅、镉、砷、汞、铜含量限定如下:铅不得过百万分之五,镉不得过千万分之三,砷不得过百万分之二,汞不得过千万分之二,铜不得过百万分之二十。
西洋参重金属及有害元素:铅、镉、砷、汞、铜含量限定如下:铅不得过百万分之五,镉不得过千万分之三,砷不得过百万分之二,汞不得过千万分之二,铜不得过百万分之二十。
金银花重金属及有害元素:铅、镉、砷、汞、铜含量限定如下:铅不得过百万分之五,镉不得过千万分之三,砷不得过百万分之二,汞不得过千万分之二,铜不得过百万分之二十。
石膏重金属:含重金属不得过百万分之十;含砷量不得过百万分之二。
芍药 0.118) 三泰芬(Triadimefon)芍药 0.0119) 赛福宁(Triforine)芍药 0.120) 赛福唑(Triflumizole)黄芪 0.1 芍药 1.021) 芬瑞莫(Fenarimol)黄芪 0.522) 二甲戊乐灵(Pendimethalin)当归 0.2 麦门冬 0.2 柴胡 0.2芍药 0.2 红花 0.123) 芬普宁(Fenpropathrin)当归 0.224) 福赛绝(Fosthiazate)柴胡 0.0225) 甲基锌乃浦(Propineb)芍药 0.226) 派灭净(Pymetrozine)红花 0.05 黄芪 0.0527) 勿落菌恶(Fludioxonil)芍药 0.1八、日本:重金属及砷盐限量:铅(Pb)≤20PPM砷As2O3 ≤ 2PPM农药残留限量:1、中药材:(生药农药残留量的行业标准)适用范围:黄芪、远志、甘草、桂皮、细辛、山茱萸、苏叶、大枣、陈皮、枇杷叶、牡丹皮BHC总量≤0.2 mg/kgDDT总量≤0.2 mg/kg2、中药制剂:(汉方及生药制剂农药残留量的行业标准)1)有机氯类农药:适用范围:含有黄芪、远志、甘草、桂皮、细辛、山茱萸、苏叶、大枣、陈皮、枇杷叶、牡丹皮、人参、红参、番泻叶的汉方及生药制剂BHC总量≤0.2 mg/kgDDT总量≤0.2 mg/kg2)有机磷类农药:适用范围:含有远志、山茱萸、苏叶及陈皮的汉方制剂对硫磷≤0.5 mg/kg甲基对硫磷≤0.2 mg/kg杀扑磷≤0.2 mg/kg马拉硫磷≤1.0 mg/kg3)菊酯类农药适用范围:含有远志、苏叶、大枣、陈皮及枇杷叶的汉方制剂氰戊菊酯≤1.5 mg/kg氯氰菊酯≤1.0 mg/kg九、德国:重金属限量:铅(Pb)≤5 mg/kg。
世界各国药典大汇总为了大家方便下载,本帖把中国,美国,英国,日本等主要国家的药典做一个汇总,欢迎大家跟帖补充。
A、中国药典(CHP):不介绍了…… 国家药典委网址/cms/home/B、美国药典/国家处方集(简称USP/NF)U.S. Pharmacopeia / National Formulary:/uspnf/login由美国政府所属的美国药典委员会(The United States Pharmacopeial Convention)编辑出版。
USP于1820年出第一版,1950年以后每5年出一次修订版,到2005年已出至第28版。
NF1883年第一版,1980年15版起并入USP,但仍分两部分,前面为USP,后面为NF。
美国药典是美国政府对药品质量标准和检定方法作出的技术规定,也是药品生产、使用、管理、检验的法律依据。
NF收载了美国药典(USP)尚未收入的新药和新制剂。
美国药典正文药品名录分别按法定药名字母顺序排列,各药品条目大都列有药名、结构式、分子式、CAS登记号、成分和含量说明、包装和贮藏规格、鉴定方法、干燥失重、炽灼残渣、检测方法等常规项目,正文之后还有对各种药品进行测试的方法和要求的通用章节及对各种药物的一般要求的通则。
可根据书后所附的USP 和NF的联合索引查阅本书。
C、英国药典(BP):/《英国药典》是英国药品委员会(British Pharmacopoeia Commission)的正式出版物,是英国制药标准的重要来源。
英国药典不仅为读者提供了药用和成药配方标准以及公式配药标准,而且也向读者展示了许多明确分类并可参照的欧洲药典专著。
英国药典出版周期不定。
BP2004该药典由三卷本组成。
其中两卷为英国药典、一卷为英国兽药典(兽医药品部分)。
各条目均以药品名称字母顺序排列,内容包括药品性质、制法、血产品、免疫产品、电磁药品制法及外科材料等部分。
英国药典书后附有全部内容关键词索引。
中药标准⼤汇总:国内外药典标准各省最新中药材标准部颁标准⾹港标准等电
⼦版
最近,国家对中药整顿⼒度加⼤,未来将更注重中药材质量标准监管。
⽬前我国药材的鉴定标准分为
三级,即⼀级国家药典标准;⼆级部颁标准;三级地⽅标准。
现将相关中药标准汇总如下:主要包括
中国药典、兽药典及其修订本增补本;卫⽣部药品标准20册;各省最新中药材标准;⾹港中药材标
准;欧洲药典中英⽂版等。
⼀、《中国药典》2015年版及其修订增补本
该⽂件夹包括2015年版《中国药典》四部、⼀部到四部主要增修订内容汇编、2015年版《中国药典》
第⼀增补本。
⼆、《中国兽药典》2015版和《兽药质量标准》2017版
三、各省最新中药材标准及卫⽣部标准
前⼏天,《河北省中药材标准》正式发布,2019年6⽉1⽇起正式实施,这个后期会给⼤家推送。
最近⼏年各省陆续更新了地⽅标准,现将部颁标准20册及最新的地⽅标准整理出来,其中天津市、⼴东省、浙江省、陕西省等中药材标准都是2015年以后的。
四、⾹港中药材标准
⾹港中药材标准⽬前已更新到第九册,这⾥整理成电⼦版的有6册,7-9册可去官⽅⽹站在线查看,后期整理好也会给⼤家推送。
⾹港卫⽣署中医药事务部官⽹:
.hk/html/gb/health_info/publication.html
五、欧洲药典中⽂版和英⽂版
六、本草纲⽬
这⾥给⼤家分享⼀个本草纲⽬的软件,可以点击查询本草纲⽬各部分内容,使⽤⽅便!
⼤家如果还想要什么资料可在⽂章下留⾔,后期会整理好推送给你们!。
各国药典液相色谱条件调整范围在采用药典方法对药品进行检测时,难免需要对药典中的方法进行调整,以达到更好的分离检测效果。
好多朋友并不能准确清晰了解能不能调、怎么调?下面就这个问题进行了说明,主要是以药典的液相色谱条件中流动相调整为例,其他部分如色谱柱、温度、进样量等可自行参考药典相关部分。
首先,能不能对药典液相色谱条件进行调整?答案当然是可以,但是要遵循一定的调整要求,超出该范围的就需要进行再验证。
调整范围是多少?不同的药典有不同的要求,下面以中国药典2015版、欧洲药典8.0版和美国药典USP36版为例进行说明。
1. 中国药典中国药典-0521高效液相法对此进行了说明,调整流动相组分比例时:当小比例组分的百分比例X小于等于33%时,允许改变范围为0.7 X~1.3 X ;当X大于33%时,允许改变范围为X-10%~X + 10%。
都是中文,这里就不在举例说明了,见下面附图。
2. 欧洲药典欧洲药典-2.2.46 Chromatographic separation techniques对此进行了说明,以等度洗脱为例,调整流动相组分比例时:小比例组分的调整范围是“相对30%或绝对2%”,取其大。
举个栗子:对于一个10%的组分,相对30%的调整范围是7%-13%,绝对2%的调整范围是8%-12%,因此适用相对30%的调整范围。
对于一个5%的组分,相对30%的调整范围是3.5%-6.5%,绝对2%的调整范围是3%-7%,因此适用绝对2%的调整范围。
3. 美国药典美国药典-<621> Chromatography部分对此进行了说明,调整流动相组分比例时:小比例组分(≤50%)的调整范围是“相对30%或绝对10%”,就不再举栗进行细节说明了,感兴趣的朋友可以参阅以下部分:。
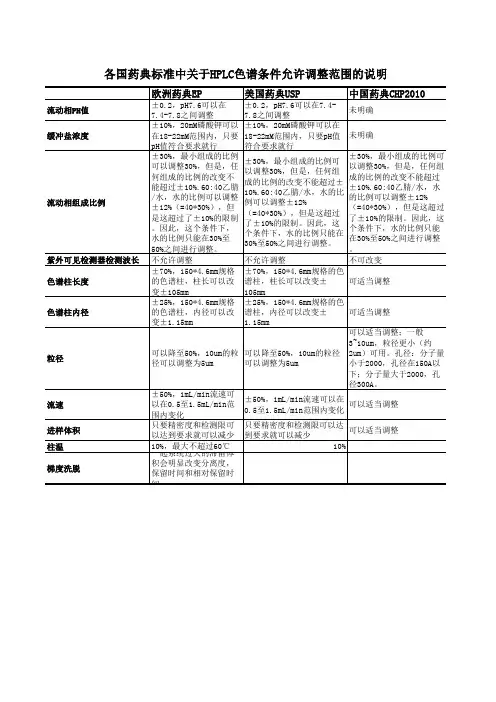
各国药典允许调整范围
Adjusting Ph. Eur. Methods
欧洲药典调整范围
1. Mobile phase pH: ± 0.2 units
• pH of 7.6 can be adjusted from 7.4 – 7.8
流动相pH:0.2单位
例如:pH为7.6可以调整为7.4-7.8
2. Concentration of salts in buffer: ± 10 %
• 20 mM Potassium phosphate can be 18 – 22 mM, as long as proper pH is maintained as above
2.缓冲盐浓度:正负10%
20mM磷酸钾可以调整到18-22mM,pH的可调整范围如上。
3. Ratio of components in mobile phase: ± 30 %
The amount(s) of the minor component(s) can be modified by ± 30 % relative or ±2 % absolute. However a change in any component cannot exceed ± 10 % absolute. • 60:40 Acetonitrile/Water could be adjusted to ± 12 % water (= 30 % of 40),
but this exceeds the ±10 % maximum absolute change. Therefore the amount of water can range from 30 % to 50 % in this case.
3.流动相组分的比率:正负30%
较少的组分能改变相对比率正负30%或绝对比率正负2%。
但是任何组分的比率改变不能超过绝对比率的正负10%。
60:40乙腈:水可以调整为水的比率正负12%(30%乘以40),但是这超过了绝对比率正负10%。
所以水的比率在这里可以在30%到50%的范围里调整。
4. Wavelength of UV-Visible Detector: no deviations permitted
4.紫外可见检测器的波长:不允许偏差
5. Column length: ± 70 %
• 150 x 4.6 mm col umn can be varied ± 105 mm in length
5.柱长:正负70%
150*4.6mm的柱子可以在长度上改变正负105mm。
6. Column inner diameter: ± 25 %
• 150 x 4.6 mm column can be varied ± 1.15 mm in diameter
6.柱内径:正负25%
150*4.6mm柱可以在直径上改变正负1.15mm
7. Particle size: can be reduced as much as 50 %
• 10 μm particles can be switched with 5 μm particles
7.填料粒径:可以减少50%
10微米填料可以改变为5微米填料
8. Flow rate: ± 50 %
• 1 mL/min can be varied from 0.5 to 1.5 mL/min
8.流速:正负50%。
1mL/min可以改变为从0.5-1.5mL/min。
9. Injection volume: can be reduced as long as precision and detection limits are achieved
9.进样量:可以减少到精密度和检测限能够实现的程度。
10. Column temperature: ± 10 % to a maximum of 60°C
10.柱温:正负10%,最高为60度。
11. Gradient elution: Excessive dwell volume of the equipment may significantly alter the resolution, retention time and relative retentions.
11.设备的过多的死体积会大大改变分离度、保留时间和相对保留。
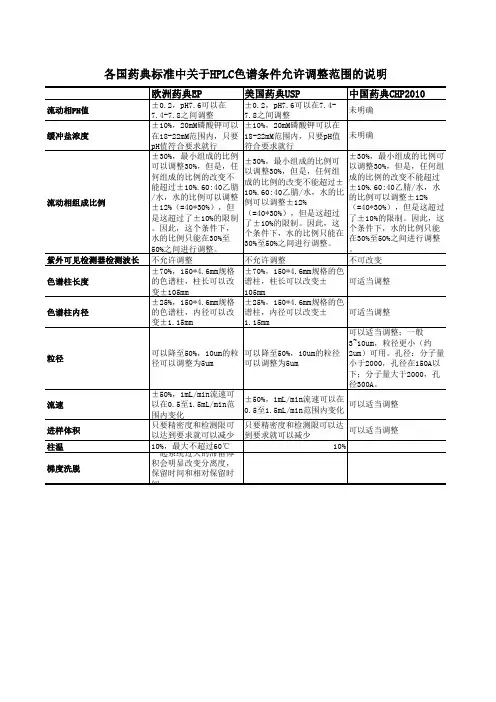
Adjusting USP Methods
1. Mobile phase pH: ± 0.2 units
• pH of 7.6 can be adjusted from 7.4 – 7.8
流动相pH:0.2单位
例如:pH为7.6可以调整为7.4-7.8
2. Concentration of salts in buffer: ± 10 %
• 20 mM Potassium phosphate can be 18 – 22 mM, as long as proper pH is maintained as above
2.缓冲盐浓度:正负10%
20mM磷酸钾可以调整到18-22mM,pH的可调整范围如上。
3. Ratio of components in mobile phase: ± 30 %
• The amount(s) of the minor component(s) can be modified by ± 30 %. However a
change in any component cannot exceed ± 10 % absolute.
• 60:40 Acetonitrile/Water could be adjusted to ± 12 % water (= 30 % of 40),
but this exceeds the ±10 % maximum absolute change. Therefore the amount of water can range from 30 % to 50 % in this case.
3.流动相组分的比率:正负30%
较少的组分能改变相对比率正负30%或绝对比率正负2%。
但是任何组分的比率改变不能超过绝对比率的正负10%。
60:40乙腈:水可以调整为水的比率正负12%(30%乘以40),但是这超过了绝对比率正负10%。
所以水的比率在这里可以在30%到50%的范围里调整。
4. Wavelength of UV-Visible Detector: no deviations permitted
4.紫外可见检测器的波长:不允许偏差
5. Column length: ± 70 %
• 150 x 4.6 mm column can be varied ± 105 mm in length
5.柱长:正负70%
150*4.6mm的柱子可以在长度上改变正负105mm。
6. Column inner diameter: ± 25 %
• 150 x 4.6 mm column can be varied ± 1.15 mm in diameter
6.柱内径:正负25%
150*4.6mm柱可以在直径上改变正负1.15mm
7. Particle size: can be reduced as much as 50 %
• 10 μm particles can be switched with 5 μm particles
7.填料粒径:可以减少50%
10微米填料可以改变为5微米填料
8. Flow rate: ± 50 %
• 1 mL/min can be varied from 0.5 to 1.5 mL/min
8.流速:正负50%。
1mL/min可以改变为从0.5-1.5mL/min。
9. Injection volume: can be reduced as long as precision and detection limits are achieved
9.进样量:可以减少到精密度和检测限能够实现的程度。
10. Column temperature: ± 10 °C 10.柱温:正负10%。