高二化学范德华力教案
- 格式:docx
- 大小:34.59 KB
- 文档页数:4

高二化学范德华力与物质性质教案Document number【980KGB-6898YT-769T8CB-246UT-18GG08】第4节分子间作用力与物质性质第1课时范德华力与物质性质【教学目标】1.使学生知道分子间作用力的广泛存在及其对物质性质(如熔点、沸点)的影响。
2.使学生了解分子间作用力对于水的特殊性质的影响作用【教学重点】掌握化学键、范德华力的区别2. 掌握范德华力对物质熔、沸点等性质的影响。
【教学难点】掌握范德华力存在的条件以及它对物质熔沸点的影响。
【教学方法】自学为主,重点讲解,分析归纳训练相结合。
【教师具备】酒精灯、烧杯、圆底烧瓶、多媒体【教学过程】【展示图片】水在通电条件下分解和冰与水的转化,引导学生分析、讨论两个过程的区别【交流讨论】(1)电解水的过程是一个(填“物理”或“化学”)过程,而冰与水的转化过程是一个(填“物理”或“化学” )过程。
(2)前者的实质是而后者(填“有”或“无”)破坏化学键。
(3)通过对两个过程的分析,你对冰与水之间的转化有什么看法(从化学键的破坏角度分析)【导入】分子晶体在物质状态发生变化时,没有破坏化学键,而是破坏了另外的一种作用力,我们把这种作用力称为分子间作用力,并且分子间作用力也影响着物质的性质。
【阅读】教材第一段,完成练习:①分子间作用力存在于和之间。
②常见的分子间作用力有和。
③与化学键相比,分子间作用力是一种(填“强”或“弱”)的作用力【板书】第四节分子间作用力与物质性质【师】引导学生阅读教材完成练习【生】阅读教材,分组讨论,完成练习。
1.范德华力的实质是,一般地,范德华力存在于 ________微粒之间。
2.化学键作用能一般为,而分子间作用能一般为。
3.完成表格物质名称熔点沸点熔化时破坏的作用力氯化钠不填氯化氢氯化钠熔点比氯化氢高的原因。
4.通过对氯化钠氯化氢熔点的分析,你对分子间作用力与化学键的区别的看法。
5.从日常生活中,具体说明破坏范德华力的例子。

信息化教学设计学院:姓名:学科:学科教学(化学)教材版本:人教版年级:选修三章节:高中化学选修三第二章第三节第二课时《范德华力及其对物质性质的影响》信息化教学设计一、学习任务概述1.学生通过观察图片,思考:为什么水三态之间的转化会伴随着能量的变化。
2.掌握分子间作用力的概念,知道分子间作用力的分类。
3.掌握范德华力的概念,了解范德华力的特点。
4.知道范德华力的大小,掌握影响范德华力大小的因素。
5.掌握范德华力对物质性质的影响。
6.通过对化学键与范德华力的对比,从本质上理解范德华力,对范德华力进行概念建构,从而重新建构自己的知识结构。
二、学习对象特征分析(一)教学对象高二年级的学生,经过之前共价键和分子立体结构以及键的极性和分子极性的学习,已经有了一定的分子构型和化学键基础知识,掌握了一定的归纳学习方法和读图分析法,有一定的分析以及总结归纳能力,虽然对抽象的概念的理解不是很困难,但是对范德华力概念的形成还是本节课的重要。
(二)教学背景本课是高二年级的一堂分子的性质的概念建立的基础知识课,本节课主要是学习有关范德华力及其对物质性质的影响的一些知识,根据幻灯片展示的三张生活中的图片提出分子间的作用力概念,再根据分子间的作用力的分类,提出范德华力的概念,紧接着再让学生观察图片,分析图片,得出影响范德华力大小的因素和范德华力对物质性质的影响。
(三)知识基础本节课是主要介绍一个化学基础概念,学生在学习了键的极性和分子的极性之后,根据幻灯片展示的三张生活中的图片提出分子间的作用力概念,再根据分子间的作用力的分类,提出范德华力的概念,紧接着再让学生观察图片,分析图片,得出影响范德华力大小的因素和范德华力对物质性质的影响。
再通过对比范德华力和化学键让这次课的知识得到升华。
(四)能力基础1. 学生思维活跃,善于思考,有积极加入课堂活动中的倾向。
2. 在教师给予一定的引导下,学生具有一定的分析能力和相互讨论的能力,具有从一般事物中提炼总结出共同特征,提出上位概念的能力。

第三节分子的性质第二课时范德华力和氢键【三维目标】知识与技能:1 进一步认识范德华力和氢键,能举例说明共价键和分子间作用力的区别;2能例举含有氢键的物质,能举例说明和解释有关范德华力、氢键对物质性质的影响。
过程与方法:采用图表、比较、讨论、归纳、综合的方法进行教学,培养学生分析、归纳、综合的能力。
情感态度与价值观:培养学生应用知识解决问题的能力和严谨认真的科学态度,通过知识在实际中的应用回归来体现化学学科的价值。
【教学重点】范德华力、氢键及其对物质性质的影响。
【教学难点】范德华力、氢键对物质性质影响的分析应用。
【教学过程】<创设问题情景,导入新课>你知道壁虎为什么能爬墙吗?氯、溴、碘单质熔沸点为什么逐渐升高?为什么冰的密度比水小?DNA中碱基配对形成双螺旋结构靠的是什么作用?双螺旋结构的形成离不开哪种作用力?<问题导学>阅读教材P47,小组讨论后回答:1什么是范德华力?2范德华力有何特点?3 范德华力对物质的哪些性质有影响?4 范德华力的大小受什么因素影响?<交流互学>学生代表交流、汇报;教师引导归纳知识要点:一、范德华力及其对物质性质的影响1 概念:范德华力是一种普遍存在的分子之间的作用力。
(把分子聚集在一起的作用力)2 范德华力的特点:(1)很弱(约比化学键能小1~2个数量级,大约只有几到几十KJ·mol-1 );(2)在分子间普遍存在;(3)无方向性和饱和性。
3 范德华力对物质性质的影响------物理性质其它条件相同时,范德华力越大,熔、沸点越高。
4 影响范德华力大小的因素相对分子质量越大,范德华力越大;分子极性越大,范德华力越大。
<知识回归>解释:氯、溴、碘单质熔沸点为什么逐渐升高?<知识应用>(1)教材表2-7 ,比较哪几组数据,可发现范德华力大小的有关规律?(2)将干冰气化,破坏了固体CO2的。
(3)将CO2气体溶于水生成碳酸,破坏了CO2分子的。

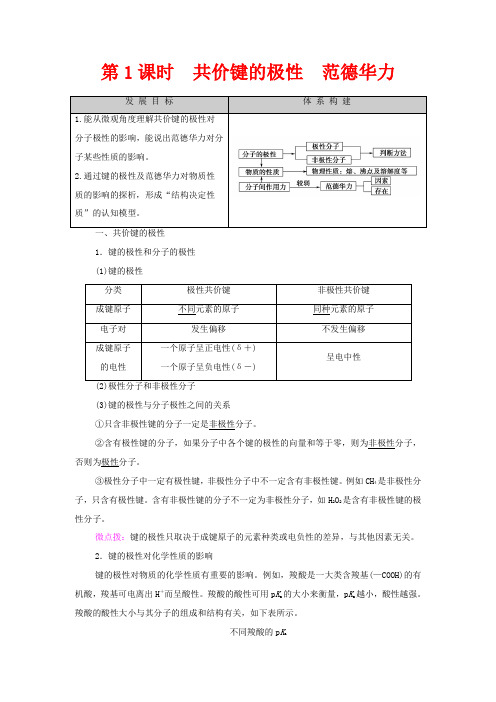
第1课时共价键的极性范德华力发展目标体系构建1.能从微观角度理解共价键的极性对分子极性的影响,能说出范德华力对分子某些性质的影响。
2.通过键的极性及范德华力对物质性质的影响的探析,形成“结构决定性质”的认知模型。
1.键的极性和分子的极性(1)键的极性分类极性共价键非极性共价键成键原子不同元素的原子同种元素的原子电子对发生偏移不发生偏移成键原子的电性一个原子呈正电性(δ+)一个原子呈负电性(δ-)呈电中性(3)键的极性与分子极性之间的关系①只含非极性键的分子一定是非极性分子。
②含有极性键的分子,如果分子中各个键的极性的向量和等于零,则为非极性分子,否则为极性分子。
③极性分子中一定有极性键,非极性分子中不一定含有非极性键。
例如CH4是非极性分子,只含有极性键。
含有非极性键的分子不一定为非极性分子,如H2O2是含有非极性键的极性分子。
微点拨:键的极性只取决于成键原子的元素种类或电负性的差异,与其他因素无关。
2.键的极性对化学性质的影响键的极性对物质的化学性质有重要的影响。
例如,羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。
羧酸的酸性可用p K a的大小来衡量,p K a越小,酸性越强。
羧酸的酸性大小与其分子的组成和结构有关,如下表所示。
不同羧酸的p K a羧酸p K a丙酸(C2H5COOH) 4.88乙酸(CH3COOH) 4.76甲酸(HCOOH) 3.75氯乙酸(CH2ClCOOH) 2.86二氯乙酸(CHCl2COOH) 1.29三氯乙酸(CCl3COOH) 0.65三氟乙酸(CF3COOH) 0.23为什么甲酸、乙酸、丙酸的酸性逐渐减弱?[提示] 烃基是推电子基团,烃基越长推电子效应越大,使羧基中的烃基的极性越小,羧酸的酸性越弱。
所以,甲酸的酸性大于乙酸的,乙酸的酸性大于丙酸的……随着烃基加长,酸性的差异越来越小。
二、范德华力1.分子间的作用力——范德华力(1)概念:物质的分子之间存在着相互作用力,把这类分子间作用力称为范德华力。

第4节分子间作用力与物质性质第1课时范德华力与物质性质学习目标 1.掌握范德华力的实质和特征,并知道影响范德华力大小的因素。
2.掌握范德华力的大小对物质物理性质的影响。
一、分子间作用力1.概念________之间存在的多种____的____________。
2.分类分子间作用力常见的是____________和________。
二、范德华力与物质性质1.范德华力____________普遍存在的________________,它能使分子凝聚成________或________。
2.范德华力的特征(1)范德华力的作用能通常比________的键能______的多。
(2)范德华力是存在于________之间的一种____________作用力。
其本质为________作用,所以没有________性和________性。
(3)范德华力是一种________作用力,距离越大,范德华力越____。
3.范德华力的影响因素一般说:________和________相似的物质,随着________________的增加,范德华力逐渐________。
4.范德华力和物质的物理性质(1)范德华力主要影响物质的________、________等物理性质。
(2)范德华力弱的时候物质一般呈____态,强的时候一般呈____态或____态。
(3)范德华力越强,物质的熔、沸点越____。
1.下列说法中,正确的是( )A.范德华力存在于所有分子之间B.范德华力是影响所有物质物理性质的因素C.Cl2相对于其他气体来说,是易液化的气体,由此可以得出结论,范德华力属于一种强作用D.范德华力属于既没有方向性也没有饱和性的静电作用2.下列各组中的两种物质:①CCl4和CF4②Cl2和F2③O2和N2④CO和N2⑤正戊烷与异戊烷,它们各自的分子间的范德华力前者大于后者的是( )A.只有①② B.只有③④⑤C.只有②③④ D.①②③④⑤3.下列各组中的两种物质:①HI和HBr ②CF4和CH4③PCl3和NF3④N2和H2⑤ICl和Br2⑥NO和N2⑦正丁烷和异丁烷,它们的熔、沸点前者高于后者的是( )A.只有①②③④ B.只有⑤⑥⑦C.都是 D.都不是4.固体乙醇晶体中不存在的作用力是( )A.离子键 B.极性键C.非极性键 D.范德华力5.卤素单质从F2到I2,在常温、常压下的聚集状态由气态、液态到固态的原因是( )A.原子间的化学键键能逐渐减小B.范德华力逐渐增大C.原子半径逐渐增大D.氧化性逐渐减弱练基础落实知识点一范德华力1.下列关于范德华力的叙述不正确的是( )A.是一种较弱的化学键B.范德华力较弱,破坏它所需能量较少C.范德华力对物质的熔、沸点有影响D.稀有气体原子之间存在范德华力2.下列各组物质汽化或熔化时,所克服的微粒间作用力属于同种类型的是( )①碘和干冰的升华②二氧化硅和生石灰熔化③氯化钠和铁的熔化④苯和己烷的蒸发A.①② B.②③C.①④ D.③④3.下列各组中的两种固态物质熔化(或升华)时,克服的微粒间相互作用力属于同种类型的是( ) A.碘和碘化钠B.金刚石和重晶石C.冰醋酸和硬脂酸甘油酯D.干冰和二氧化硅4.下列变化是在克服分子间作用力的情况下进行的是( )A.碘的升华 B.氨的液化C.铝的熔化 D.食盐的溶解知识点二影响范德华力大小的因素5.下列有关范德华力的强弱对比,正确的是( )知识点三范德华力对物质物理性质的影响6.下列各组物质中,按熔点由低到高排列的是( )A.O2、I2、Hg B.CO2、Al2O3、KClC.Na、K、Rb D.H2S、H2Se、H2Te7.下列物质的沸点,从高到低的顺序正确的是( )A.HCl>HBr>HI B.CI4>CBr4>CCl4>CF4C.KBr>NaBr>NaCl D.Na>Mg>Al8.下列关于范德华力影响物质性质的叙述中,正确的是( )A.范德华力是决定由分子构成物质的熔点、沸点高低的惟一因素B.范德华力与物质的性质没有必然的联系C.范德华力能够影响物质的化学性质和物理性质D.范德华力仅是影响物质部分物理性质的一种因素练综合拓展9.三氯化氮(NCl3)在常温下是一种淡黄色液体,其分子结构呈三角锥形。
高二化学范德华力与物质性质教案高二化学范德华力与物质性质教案SANY GROUP system office room 【SANYUA16H-第4节分子间作用力与物质性质第1课时范德华力与物质性质【教学目标】1.使学生知道分子间作用力的广泛存在及其对物质性质(如熔点、沸点)的影响。
2.使学生了解分子间作用力对于水的特殊性质的影响作用【教学重点】1. 掌握化学键、范德华力的区别2. 掌握范德华力对物质熔、沸点等性质的影响。
【教学难点】掌握范德华力存在的条件以及它对物质熔沸点的影响。
【教学方法】自学为主,重点讲解,分析归纳训练相结合。
【教师具备】酒精灯、烧杯、圆底烧瓶、多媒体【教学过程】【展示图片】水在通电条件下分解和冰与水的转化,引导学生分析、讨论两个过程的区别【交流讨论】(1)电解水的过程是一个(填“物理”或“化学”)过程,而冰与水的转化过程是一个(填“物理”或“化学” )过程。
(2)前者的实质是而后者(填“有”或“无”)破坏化学键。
(3)通过对两个过程的分析,你对冰与水之间的转化有什么看法?(从化学键的破坏角度分析)【导入】分子晶体在物质状态发生变化时,没有破坏化学键,而是破坏了另外的一种作用力,我们把这种作用力称为分子间作用力,并且分子间作用力也影响着物质的性质。
【阅读】教材第一段,完成练习:①分子间作用力存在于和之间。
②常见的分子间作用力有和。
③与化学键相比,分子间作用力是一种(填“强”或“弱”)的作用力【板书】第四节分子间作用力与物质性质【师】引导学生阅读教材完成练习【生】阅读教材,分组讨论,完成练习。
1.范德华力的实质是,一般地,范德华力存在于 ________微粒之间。
2.化学键作用能一般为,而分子间作用能一般为。
3.完成表格物质名称熔点沸点熔化时破坏的作用力氯化钠不填氯化氢氯化钠熔点比氯化氢高的原因。
4.通过对氯化钠氯化氢熔点的分析,你对分子间作用力与化学键的区别的看法。
5.从日常生活中,具体说明破坏范德华力的例子。
高二化学范德华力教案 Revised by Petrel at 2021第四单元分子间作用力分子晶体第一课时范德华力【学习目标】1.了解范德华力的类型,把握范德华力大小与物质物理性质之间的辨证关系2.初步认识影响范德华力的主要应素,学会辨证的质量分析法【学习内容】一、分子间作用力1.提出分子间存在作用力的依据气体分子能够凝聚成相应的固体或液体2.分子间作用力的本质存在于分子间的一种较弱的相互作用力。
3.分子间作用力的类型(1)取向力——极性分子之间靠永久偶极与永久偶极作用称为取向力。
仅存在于极性分子之间(2)诱导力——诱导偶极与永久偶极作用称为诱导力。
极性分子作用为电场,使非极性分子产生诱导偶极或使极性分子的偶极增大(也产生诱导偶极),这时诱导偶极与永久偶极之间形成诱导力,因此诱导力存在于极性分子与非极性分子之间,也存在于极性分子与极性分子之间。
(3)色散力——瞬间偶极与瞬间偶极之间有色散力。
由于各种分子均有瞬间偶极,故色散力存在于极性分子与极性分子、极性分子与非极性分子及非极性分子与非极性分子之间。
色散力不仅存在广泛,而且在分子间力中,色散力经常是重要的。
取向力、诱导力和色散力统称范德华力, 它具有以下的共性:(1)它是永远存在于分子之间的一种作用力。
(2)它是弱的作用力(几个——几十个kJ·mol-1)。
(3)它没有方向性和饱和性。
(4)范德华力的作用范围约只有几个pm。
(5)分子间的三种作用力。
其中对大多数分子来说色散力是主要的,水分子除外。
4.影响范德华力的因素阅读下表,分析影响范德华力的因素-1分子取向力诱导力色散力总和ArCOHIHBrHClNH3H2O(1)组成和结构相似的分子,相对分子质量越大,范德华力越大。
(2)分子的极性越大,范德华力越大,一般来说极性分子间的作用力大于非极性分子间的作用力。
5.范德华力对物质熔沸点的影响(1)结构相似,相对分子质量越大,范德华力越大,熔沸点越高(2)相对分子质量相同或相近时,分子的极性越大,范德华力越大, ,其熔沸点越高【科学探究】分子的偶极矩是衡量分子极性大小的物理量,分子偶极矩的数据可由实验测定。
高二化学范德华力教案 Document number【980KGB-6898YT-769T8CB-246UT-18GG08】
第四单元分子间作用力分子晶体
第一课时范德华力
【学习目标】了解范德华力的类型,把握范德华力大小与物质物理性质之间的辨证关系
2.初步认识影响范德华力的主要应素,学会辨证的质量分析法
【学习内容】
一、分子间作用力
1.提出分子间存在作用力的依据
气体分子能够凝聚成相应的固体或液体
2.分子间作用力的本质
存在于分子间的一种较弱的相互作用力。
3.分子间作用力的类型
(1)取向力——极性分子之间靠永久偶极与永久偶极作用称为取向力。
仅存在于极性分子之间(2)诱导力——诱导偶极与永久偶极作用称为诱导力。
极性分子作用为电场,使非极性分子产生诱导偶极或使极性分子的偶极增大(也产生诱导偶极),这时诱导偶极与永久偶极之间形成诱导力,因此诱导力存在于极性分子与非极性分子之间,也存在于极性分子与极性分子之间。
(3)色散力——瞬间偶极与瞬间偶极之间有色散力。
由于各种分子均有瞬间偶极,故色散力存在于极性分子与极性分子、极性分子与非极性分子及非极性分子与非极性分子之间。
色散力不仅存在广泛,而且在分子间力中,色散力经常是重要的。
取向力、诱导力和色散力统称范德华力, 它具有以下的共性:
(1)它是永远存在于分子之间的一种作用力。
(2)它是弱的作用力(几个——几十个kJ·mol-1)。
(3)它没有方向性和饱和性。
(4)范德华力的作用范围约只有几个pm。
(5)分子间的三种作用力。
其中对大多数分子来说色散力是主要的,水分子除外。
4.影响范德华力的因素阅读下表,分析影响范德华力的因素
几种分子间作用力的分配(kJ·mol-1)
分子取向力诱导力色散力总和
Ar
CO
HI
HBr
HCl
NH
3
O
H
2
(1)组成和结构相似的分子,相对分子质量越大,范德华力越大。
(2)分子的极性越大,范德华力越大,一般来说极性分子间的作用力大于非极性分子间的作用力。
5.范德华力对物质熔沸点的影响
(1)结构相似,相对分子质量越大,范德华力越大,熔沸点越高
(2)相对分子质量相同或相近时,分子的极性越大,范德华力越大, ,其熔沸点越高
【科学探究】分子的偶极矩是衡量分子极性大小的物理量,分子偶极矩的数据可由实验测定。
永久偶极、诱导偶极和瞬时偶极
(1)永久偶极极性分子的固有偶极称永久偶极。
(2)诱导偶极和瞬时偶极
非极性分子在外电场的作用下,可以变成具有一定偶极的极性分子,而极性分子在外电场作用下,其偶极也可以增大。
在电场的影响下产生的偶极称为诱导偶极。
诱导偶极用△μ表示,其强度大小和电场强度成正比,也和分子的变形性成正比。
所谓分子的变形性,即为分子的正负电重心的可分程度,分子体积越大,电子越多,变形性越大。
非极性分子无外电场时,由于运动、碰撞,原子核和电子的相对位置变化,其正负电重心可有瞬间的不重合;极性分子也会由于上述原因改变正负电重心。
这种由于分子在一瞬间正负电重心不重合而造成的偶极叫瞬间偶极。
瞬间偶极和分子的变形性大小有关。