实验八肉桂酸的制备
- 格式:doc
- 大小:451.50 KB
- 文档页数:4

大学有机化学实验报告:肉桂酸的制备一、实验目的1.了解肉桂酸的制备原理和方法;2.掌握水蒸气蒸馏的原理、用处和操作;3.学习并掌握固体有机化合物的提纯方法:脱色、重结晶。
二、实验原理1.用苯甲醛和乙酸酐作原料,发生Perkin反应,反应式为:2.反应机理如下:乙酸肝在弱碱作用下打掉一个H,形成CH3COOCOCH2-,然后三、主要试剂及物理性质1.主要药品:无水碳酸钾、苯甲醛、乙酸酐、氢氧化钠水溶液、1:1盐酸、活性炭2.物理性质主要试剂的物理性质名称分子量熔点/℃沸点/℃外观与性状苯甲醛106.12 -26 179 纯品为无色液体;工业品为无色至淡黄色液体;有苦杏仁气味乙酸酐102.09 -73.1 138.6 无色透明液体;有刺激气味;其蒸气为催泪毒气肉桂酸 148.17 133 300白色至淡黄色粉末;微有桂皮香气四、试剂用量规格试剂用量五、仪器装置1. 仪器:150ml 三口烧瓶、500ml 烧杯、玻璃棒、量筒、200℃温度计、直形冷凝管、电磁炉、球形冷凝管、表面皿、滤纸、布氏漏斗、吸滤瓶、锥形瓶2. 装置:图1.制备肉桂酸的反应装置图2.水蒸气蒸馏装置六、实验步骤及现象实验步骤及现象时间 步骤现象将7.00g 无水碳酸钾、14.5ml 乙酸酐和5.0ml 苯甲醛依次加入150ml 三口烧瓶中摇匀烧瓶底部有白色颗粒状固体,上部液体无色透明13:33加热至微沸后调解电炉高度使近距离加热回流30~45min加热后有气泡产生,白色颗粒状固体逐渐溶解,由奶黄色逐渐变为淡黄色,并出现一定的浅黄色泡沫,随着加热泡沫逐渐变为红棕色液体,表面有一层油状物14:07 冷却到100℃以下,再加入40ml水浸泡随着冷却温度的降低,烧瓶底部逐渐产生越来越多的固体;随着玻璃棒的搅拌,固体颗粒减小,液体变黏稠 用玻璃棒搅拌、轻压底部固体14:15 搭好水蒸气蒸馏装置,对蒸气发烧瓶底部物质开始逐渐溶解,表面的试剂 苯甲醛 乙酸酐 无水碳酸钾 10% NaOH 盐酸 理论用量5.0ml14.0ml7.00g40.0ml40.0ml生器进行加热,待蒸气稳定后在通入烧瓶中液面下开始蒸气蒸馏;待检测馏出物中无油滴后停止蒸馏油层逐渐融化;溶液由橘红色变为浅黄色将烧瓶冷却,再把其中的物质移至500ml烧杯中,用NaOH水溶液清洗烧瓶,并把剩余的NaOH溶液也加入烧杯中,搅拌使肉桂酸溶解,再加入90.0ml水和0.50g活性炭加热至沸腾加入活性炭后液体变为黑色趁热过滤,移至500ml烧杯冷却至室温后,边搅拌边加入1:1盐酸调节溶液至酸性抽滤后滤液是透明的,加入盐酸后变为乳白色液体冷水冷却结晶完全后过滤,再称量烧杯中有白色颗粒出现,抽滤后为白色固体;称重得m=6.56g七、实验结果实验数据记录试剂苯甲醛乙酸酐无水碳酸钾10%NaOH活性炭1:1盐酸表面皿表面皿+成品成品实际用量5.0ml14.5ml7.00ml40.0ml0.14g40.0ml30.20g36.76g6.56g理论产量:0.05*148.17=7.41g实际产量:6.56g产率:6.56/7.41*100%=88.53%八、实验讨论1.产率较高的原因:1)抽滤后没有干燥,成品中还含有一些水分,使产率偏高;2)加活性炭脱色时间太短,加入活性炭量太少。
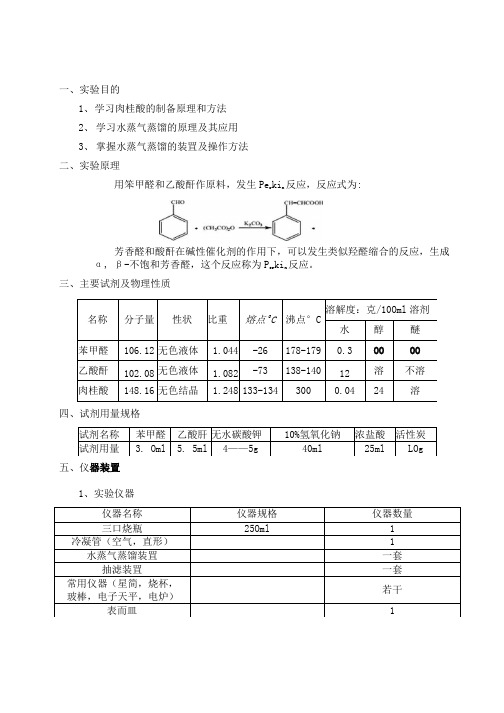
一、实验目的1、学习肉桂酸的制备原理和方法2、学习水蒸气蒸馏的原理及其应用3、掌握水蒸气蒸馏的装罝及操作方法二、实验原理用笨甲醛和乙酸酐作原料,发生Per kin反应,反应式为:芳香醛和酸酐在碱性催化剂的作用下,可以发生类似羟醛缩合的反应,生成α, β-不饱和芳香醛,这个反应称为Per kin反应。
三、主要试剂及物理性质名称分子量性状比重熔点O C沸点°C 溶解度:克/10Oml溶剂水醇醚苯甲醛106.12 无色液体 1.044 -26 178-179 0.3 OO OO 乙酸酐102.08 无色液体 1.082 -73 138-140 12 溶不溶肉桂酸148.16 无色结晶 1.248 133-134 300 0.04 24 溶四、试剂用量规格试剂名称苯甲醛乙酸肝无水碳酸钾10%氢氧化钠浓盐酸活性炭试剂用量 3. Oml 5. 5ml 4——5g 40ml 25ml LOg五、仪器装置1、实验仪器仪器名称仪器规格仪器数量三口烧瓶25Oml 1 冷凝管(空气,直形) 1 水蒸气蒸馏装罝一套抽滤装罝一套常用仪器(星简,烧杯,玻棒,电子天平,电炉)若干表而皿 12、仪器装置图回流装置水蒸气蒸馏装六、实验步骤及现象时间步骤现象13:30—13:40 将3. Oml笨甲醛、5. 5InI乙酸酐和4. OOg无水碳酸钟依次加入250Inl三口烧瓶中摇匀烧瓶底部有白色颗粒状固体,上部液体无色透明,反应剧烈,有白烟冒出13:40—14:42 搭好回流装罝,开始加热回流(约1小时,温度控制在 170 —18O e C)加热后有气泡产生,白色颗粒状固体逐渐溶解,由奶黄色逐渐变为淡黄色,并出现一定的浅黄色泡沫,随着加热泡沫逐渐变为红棕色液体,表而有一层油状物14:42—14:50 加入40ml 10%的氢氧化钠水溶液和20ml水,将装罝改力水蒸气蒸馏装罝,开始加热蒸馏14: 50—15:10 对蒸气发生器进行加热,待蒸气稳定后在通入烧瓶中液而下开始蒸气蒸馏:待检测馏出物中无油滴后停止蒸馏溶液由橘红色变为浅黄色15:10—15:15 加入LOg活性炭脱色,热过滤加入活性炭后液体变为黑色15:15—15:20 加入25ml浓盐酸,冰水浴烧杯中有白色颗粒出现15:20—15:25 抽滤(用冰水洗涤)抽滤后为白色固体15:25—15:30 烘箱干燥,称量称重得m=0. 33g七、实验结果理论产量:0.03* 148.17=4.45g实际产量:O.33g产率:理论产量/实际产量*100%=0.33∕4.45*100%=7.42%八、实验讨论1. 实验结果分析:肉桂酸率很低可能的原因有:a Per kin反应是缩合反应,缩合产物在髙温下易发生脱羧反应,因而温度过髙副产物增多,从而影响产率b实验过程中在冰水中冷却时间不够,所以粗产物较少2. 魏雌注意祕a.所用仪器必须是干燥的。

肉桂酸的制备实验报告肉桂酸的制备实验报告引言:肉桂酸是一种常见的天然有机化合物,广泛存在于植物中。
它具有独特的香气和药用价值,被广泛应用于食品、香料、药物等领域。
本实验旨在通过合成的方法制备肉桂酸,以探索其制备过程和反应机理。
实验材料和方法:1. 材料:肉桂醛、无水乙醇、氢氧化钠、硫酸、氯化铁。
2. 仪器:反应瓶、加热器、冷却器、漏斗、烧杯、试管等。
实验步骤:1. 将肉桂醛溶解在无水乙醇中,制备肉桂醛醇溶液。
2. 在反应瓶中加入适量的氢氧化钠溶液,并将肉桂醛醇溶液缓慢滴加入反应瓶中。
3. 加热反应瓶,使反应溶液保持沸腾状态,并继续加热一段时间。
4. 将反应溶液冷却至室温,然后用醋酸酐进行酯化反应。
5. 将反应溶液中的酯化产物经过酸化处理,得到肉桂酸。
6. 通过加入氯化铁溶液,观察肉桂酸的颜色变化。
实验结果:通过上述步骤,成功合成了肉桂酸。
合成的肉桂酸呈现出浅黄色的结晶体,具有独特的香气。
在加入氯化铁溶液后,肉桂酸溶液呈现出深红色的反应,进一步证明了合成的肉桂酸的纯度和稳定性。
实验讨论:本实验采用了醇酸酯化反应的方法,通过肉桂醛和无水乙醇的反应制备肉桂酸。
氢氧化钠的加入起到了催化剂的作用,促使反应的进行。
酯化反应后,通过酸化处理得到了纯净的肉桂酸产物。
实验结论:通过本实验,成功合成了肉桂酸,并验证了合成产物的纯度和稳定性。
肉桂酸的制备过程中,醇酸酯化反应是关键步骤,氢氧化钠的加入起到了重要的催化作用。
本实验结果为肉桂酸的制备提供了一种有效的方法。
结语:肉桂酸作为一种重要的有机化合物,在食品、香料、药物等领域具有广泛的应用。
通过本实验,我们深入了解了肉桂酸的制备过程和反应机理。
通过合成实验,我们不仅学到了实验技术,还加深了对有机化合物合成的理解。
希望本实验能为相关研究和应用提供一定的参考价值。


实验八 肉 桂 酸 的 制 备
[实验目的] 1.了解肉桂酸的制备原理和方法。
2.掌握回流,水蒸汽蒸馏等操作。
[实验药品]新蒸馏过的苯甲醛1ml ,新蒸馏过的醋酐2.7ml ,研细的无水碳酸钾1.4克,
10%NaOH 溶液6.7ml ,浓盐酸,刚果红试纸。
[仪器设备] 普通抽滤装置、水蒸气蒸馏装置、标准磨口仪
[实验原理] 1.水蒸气蒸馏原理:当有机物与水一起共热时,整个系统的蒸汽压根据分压定
律,各组分蒸汽压之和, 即P=P(H 2O)+P A 当总蒸汽压()与大气压力相等时,则
液体沸腾。
显然,混合物的沸点低于任何一个组分的沸点。
有机物可以在比其正
常沸点低得多的温度,而且在低于100℃的温度下随蒸汽一起蒸馏出来。
2. 肉桂酸的制备原理: CHO
+C O
CH 3O C O CH 3CH 3COOK 140-180。
C CH=CHCOOH +CH
3COOH
[实验步骤] 按图安装装置
10 mL 热水水蒸汽蒸馏冷却10%NaOH 6.7mL 抽滤冷却至室温浓盐酸
称重,计算产率,测其熔点
[注意事项] 1.苯甲醛,醋酐使用前重新蒸馏。
2.回流所需的仪器必须干燥。
3.回流完毕后,不必冷却,且加热水,否则固体难以捣碎。
4.利用水蒸气蒸馏的物质必须以下条件:
(1)不溶或难溶于水;
(2)与水煮沸很久不发生化学反应;
(3)在100℃时至少具有10mmHg 压力.
作业:122页1、4题。

实验八肉桂酸
一、实验目的:
1.掌握肉桂酸的制备原理和实验操作
2.了解水蒸气蒸馏的原理和应用范围, 掌握水蒸气蒸馏的操作技能
二、实验原理:
CH=CHCOOH
CHO
+(CH3CO)2O K2CO3
150℃~170℃
主要副反应:
四、主要试剂用量及规格:
无水K2CO3 3.5g 醋酸酐 7g(7ml0.039mol)苯甲醛 2.5ml(新蒸;2.7g;0.025mol) 活性炭少量
固体Na2CO3 ~5g 浓盐酸若干
五、仪器装置图:
水蒸气蒸馏图六、实验步骤与现象:
八、产率计算:
理论产量= 0.025×148.17=3.7g 实际产量= g
产率=100%⨯实际产量
理论产量=3.7
100%⨯= %
九、问题解答
1, 芳香醛
2, 产物分别为, , A 先在碱性条件下水解, 然后酸化加热脱羧;B 和碘在碱性条件下发生碘仿反应, 然后酸化;C 和Ag(NH3)2+反应, 在酸化可转化为肉桂酸。
3,
4, 氢氧化钠碱性太强, 苯甲醛易歧化产生苯甲酸, 将难以分离。
5, 苯甲醛, 苯甲醇。
九、讨论:
1.第一步的反仪器要干燥, 因为水会影响到碳负离子的形成。
2、在加活性炭后加热沸腾时, 最好在冷凝管的保护下, 这样溶剂沸腾时不会挥发太多。
如果在此步溶剂挥发太多, 在热过滤的时候, 可能析出肉桂酸盐。
肉桂酸的制备实验 HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】肉桂酸的制备实验一、实验原理利用柏琴(Perkin)反应制备肉桂酸。
一般认为脂肪酸钾盐或钠盐为催化剂,提供CH3COO-负离子,从而使脂肪酸酐生成负碳离子,然后负碳离子和醛或羧酸衍生物(酐和酯)分子中的羰基发生亲核加成,形成中间体。
在珀金反应中,是碳酸钾夺取乙酐分子中的α-H,形成乙酸酐负碳离子。
实验所用的仪器必须是干燥的。
主反应:副反应:在本实验中,由于乙酸酐易水解,无水碳酸钾易吸潮,反应器必须干燥。
提高反应温度可以加快反应速度,但反应温度太高,易引起脱羧和聚合等副反应,所以反应温度控制在150~170℃左右。
未反应的苯甲醛通过水蒸气蒸馏法分离。
机理:【此机理中的碱为无水乙酸钾】二、反应试剂、产物、副产物的物理常数三、药品四、实验流程图五、实验装置图(1)合成装置(2)水蒸气蒸馏(3)抽滤装置(4)干燥装置六、实验内容在250ml三口烧瓶中放入3ml( ,新蒸馏过的苯甲醛、8ml,新蒸馏过的乙酸酐,以及研细的无水碳酸钾。
三口烧瓶的侧口插入一根200℃温度计,温度计要求插入液面以下,采用空气冷凝管缓缓回流加热45min。
由于反应中二氧化碳逸出,可观察到反应初期有大量泡沫出现。
反应完毕,在搅拌下向反应液中分批加入20ml水,再慢慢加入碳酸钠中和反应液至pH等于8。
然后进行水蒸汽蒸馏,蒸出未反应完的苯甲醛。
待三口烧瓶中的剩余液体冷却后,加入活性炭煮沸10-15min,进行趁热过滤,将滤液冷却至室温,在搅拌下用浓盐酸酸化至刚果红试纸变蓝(或溶液pH=3)。
冷却,待晶体析出后进行抽滤,用少量冷水洗涤沉淀。
抽干,让粗产品在空气中晾干。
产量:约(产率约65%)。
粗产品可用热水或3:1的水-乙醇重结晶。
肉桂酸有顺反异构体,通常以反式存在。
纯肉桂酸为微有桂皮香气的无色针状晶体。
熔点mp=133℃。
实验八肉桂酸的制备及表征请同学们一定阅读教材第70页的水蒸气蒸馏和第218页的实验64。
实验七肉桂酸的制备及表征一、实验目的1(了解肉桂酸的制备原理及方法。
2(掌握回流、热过滤、重结晶等操作。
3( 掌握水蒸汽蒸馏的原理及应用。
二、实验原理肉桂酸又名β,苯丙烯酸,有顺式和反式两种异构体。
通常以反式形式存在,为无色晶体,熔点133?。
肉桂酸是香料、化妆品、医药(肉桂酸是生产冠心病药物“心可安”的重要中间体)、农药、塑料和感光树脂等的重要原料。
肉桂酸的合成方法有多种,实验室里常用珀金(Pe-ruin)反应来合成肉桂酸。
以苯甲醛和醋酐为原料,在无水醋酸钾(钠)的存在下,发生缩合反应,即得肉桂酸。
珀金法制肉桂酸具有原料易得、反应条件温和、分离简单、产率高、副反应少等优点,工业上也采用此法。
芳香醛和酸酐在碱性催化剂的作用下,可以发生类似羟醛缩合的反应,生成α,β-不饱和芳香醛,这个反应称为Perkin反应。
催化剂通常是相应酸酐的羧酸的钾或钠盐,也可以用碳酸钾或叔胺。
反应时,酸酐受醋酸钾(钠)的作用烯醇化,生成酸酐负离子;负离子和芳醛发生亲核加成生成β,羧基酸酐;然后再发生失水和水解作用得到不饱和酸。
反应机理:醋酸酐受醋酸钾的作用,生成一个酸酐的负离子,负离子和醛发生亲核加成反应,生成中间物β,羟基酸酐,然后再发生失水和水解作用得到不饱和酸。
本实验中,反应物苯甲醛和乙酐的反应活性都较小,反应速度慢,必须提高反应温度来加快反应速度。
但反应温度又不宜太高,一方面由于乙酐和苯甲醛的沸点分别为140?和178?,温度太高会导致反应物的挥发,另外,温度太高,易引起脱羧、聚合等副反应,故反应温度一般控制在150-170?左右。
合成得到的粗产品通过水蒸汽蒸馏、重结晶等方法提纯精制。
三、药品及物理常数比溶解度化合物熔点沸点折光率分子量性状重乙名称 (?) (?) (,) 水乙醚醇 (d )无色苯甲醛 ,26 微溶溶溶 106.12 1.046 179.1 1.5456 液体无色水水乙酸酐 ,73 溶 102.09 1.081 140.0 1.3900 液体解解单斜晶溶热135~13肉桂酸可溶溶 148.16 1.245 300 棱柱体水 6无水碳白色颗溶不溶不溶 138.19 2.428 891 酸钾粒试剂:苯甲醛(新蒸)、乙酸酐(新蒸)、无水碳酸钾(新熔融)、10%氢氧化钠溶液、盐酸、活性炭四、实验装置图1 制备肉桂酸的反应装置图图2 水蒸气蒸馏装置五、实验步骤(本次实验采用方法一)实验方法一:用无水醋酸钾做缩合剂实验方法二:用无水碳酸钾做缩合剂六、注意事项1、由于乙酐遇水易水解,催化剂无水乙酸钾(钠)易吸水,故要求反应器是干燥的。
肉桂酸的制备预习内容:请参考周科衍等编《有机化学实验》P108~109一、 实验目的1. 掌握用柏金反应制备肉桂酸的原理及方法。
2. 练习高温反应和空气冷凝管的使用方法。
3. 进一步练习水蒸气蒸馏装置的安装及使用。
4. 进一步练习固体产品的纯化方法。
二、 实验原理芳香醛与乙酐在碱催化下发生的缩合反应叫柏金反应。
反应式: CHO +CH 3C O O C O CH 3CH 3COOKCH CH C O OH +CH 3COOH H 2O +由于该反应在高温下回流反应,因此,不能用水冷凝的球形冷凝管回流,要用空气冷凝管回流。
未反应的苯甲醛用水蒸气蒸馏的方法除去。
三、无水碳酸钾(新融) 3g(0.03mol)乙酐 5.5mL(6g , 0.06mol)饱和碳酸钠溶液、浓盐酸、活性碳苯甲醛久置后含有苯甲酸,后者不但会影响反应的进行,而且混在产物中不易除去,会影响产品质量。
因此实验所用的苯甲醛必须重新蒸馏,收集170~180︒C 的馏分。
本实验中使用的无水醋酸钾必须新鲜熔焙。
将含水醋酸钾放入蒸发皿中加热,则盐先在自己的结晶水中溶化。
水分挥发后又结成固体。
强热使固体再熔化,并不断搅拌,使水分蒸发后,趁热倒在金属板上,冷后用研钵研碎,放入干燥器中待用。
仪器:250ml 二口瓶或三口瓶(19mm )、空气冷凝管、200︒C 的温度计、水蒸汽蒸馏装置一套、抽滤装置、250ml 烧杯、表面皿等。
四、 仪器装置和教师讲解要点本实验操作训练的重点是水汽蒸馏操作。
1.什么是水蒸气蒸馏?水蒸气蒸馏是将水蒸气通入不溶或难溶于水但有一定挥发性的有机物质中,使该有机物质在低于100︒C 的温度下,随着水蒸气一起蒸馏出来。
水蒸气蒸馏是分离和纯化有机物的常用方法,尤其是在反应产物中有大量树脂状杂质的情况下,效果较一般蒸馏或重结晶为好。
使用这种方法时,被提纯物质应该具备下列条件:不溶(或几乎不溶)于水;在沸腾下与水长时间共存而不起化学变化;在100︒C 左右时必须具有一定的蒸气压。
肉桂酸的制备概述肉桂酸是一种常见的天然有机化合物,具有多种生物活性和药理作用。
本文档将介绍肉桂酸的制备方法及相关实验步骤。
实验材料1.乙酰乙酸乙酯(AAEE)2.硫酸氢钠(NaHSO4)3.硫酸实验步骤步骤一:制备芳香醛和醛类酮类的亚硫酸氢盐1.将1mol的醛化合物(如苯甲醛)加入到500ml的AAEE中,搅拌均匀。
2.将得到的混合物加入到综合漏斗中,并加入适量石脑油,摇晃混合。
3.将漏斗中的混合物慢慢滴加入到150ml的1.5mol/L的NaHSO4溶液中,同时用漏斗中适量的AAEE 清洗残液。
4.室温下静置12小时,之后分离有机相和水相。
5.将有机相用硫酸洗涤3次,收集有机相。
步骤二:制备肉桂酸的亚硫酸氢盐1.将1mol的肉桂酸加入到500ml的AAEE中,搅拌均匀。
2.将得到的混合物加入到综合漏斗中,并加入适量石脑油,摇晃混合。
3.将漏斗中的混合物慢慢滴加入到150ml的1.5mol/L的NaHSO4溶液中,同时用漏斗中适量的AAEE 清洗残液。
4.室温下静置12小时,之后分离有机相和水相。
5.将有机相用硫酸洗涤3次,收集有机相。
步骤三:制备肉桂酸1.将得到的肉桂酸的亚硫酸氢盐溶解在少量的AAEE 中。
2.将溶解的溶液加入到500ml的酒精中,搅拌均匀。
3.在搅拌过程中,缓慢加入稀硫酸溶液。
4.搅拌反应物混合物3小时,反应完成。
5.将反应混合物过滤,收集沉淀。
6.将沉淀用醇溶解,挥发溶剂,收集肉桂酸晶体。
实验注意事项1.实验过程中需注意安全,佩戴防护眼镜和手套。
2.实验器材需洗净干燥,以免影响实验结果。
3.实验过程中需进行密封操作,以防化学品挥发。
4.需要仔细控制反应时间和反应温度,以保证产品质量。
结论通过以上实验步骤,可以制备出纯度较高的肉桂酸。
使用这种方法可以在实验室内制备肉桂酸,为进一步研究和应用提供了便利。
肉桂酸在医药和食品工业中有广泛的应用前景,因此其制备方法的探索具有重要的意义。
实验八 肉桂酸的制备
一、实验目的
1.学习肉桂酸的制备原理和方法。
2.学习水蒸气蒸馏的原理及其应用,掌握水蒸气蒸馏的装置及操作方法。
二、基本原理
1、Perkin 反应制备肉桂酸
芳香醛与具有α-H 原子的脂肪酸酐在相应的无水脂肪酸钾盐或钠盐的催化下共热发生缩合反应,生成芳基取代的α ,β-不饱和酸,此反应称为Perkin 反应。
反应式如下:
CHO +
CH 3C O
O CH 3C
KAc
150~170℃
CH=CHCOOH + CH 3COOH
Perkin 反应的催化剂通常是相应酸酐的羧酸钾或钠盐,有时也可用碳酸钾或叔胺代替。
反应时,可能是酸酐受醋酸钾(钠)的作用,生成一个酸酐的负离子,负离子和醛发生亲核加成,生成中间物 -羟基酸酐,然后再发生失水和水解作用而得到不饱和酸。
反应机理如下:
(CH 3CO)2O + CH 3COOK [
C
O
O
CH 2C O CH 3]K ++ CH 3COOH
O O
CH 2O CH 3
C O H
+
C O -CH 2
O
O C
CH
3
O CH 3COOH C OH H
CH 2
O
O CH 3
O - 2HC
CH
O
O
CH 3
O 水解
HC
CH
COOH + CH 3COOH
2、水蒸气蒸馏的基本原理及实验操作 (1) 水蒸气蒸馏的基本原理
当有机物与水一起共热时,根据道尔顿(Dalton)分压定律,整个系统的蒸气压应为各组分蒸气压之和,即:P =O H P 2 +P A
其中P 代表总的蒸气压,O H P 2为水的蒸气压,P A 为与水不相溶物或难溶物质的蒸气压。
当总蒸气压P 与大气压相等时,则液体沸腾。
这时的温度即为它们的沸点。
这时的沸点必定较任一组分的沸点低。
因此在常压下用水蒸气蒸馏,就能在低于100℃的情况下将高沸点组分与水一起蒸出来。
例如水与苯甲醛混合物的沸点为97.9℃。
此时:
P =760mmHg O H P 2=703.5mmHg P 苯甲醛=65.5mmHg
水蒸气蒸馏法的优点在于使所需要的有机物可在较低的温度下从混合物中蒸馏出来,可以避免在常压下蒸馏时所造成的损失,提高分离提纯的效率。
同时在操作和装置方面也较减压蒸馏简便一些,所以水蒸气蒸馏可以应用于分离和提纯有机物。
水蒸气蒸馏常在下列情况下使用:
(a )混合物中含有大量的固体,通常的蒸馏、过滤、萃取等分离方法都不适用。
(b )混合物中含有焦油状物质,采用通常的蒸馏、萃取等方法非常困难。
(c )在常压下蒸馏高沸点有机物质会发生分解。
被提纯物质必须具备以下几个条件: (a )不溶或难溶于水。
(b )在沸腾下与水不发生化学反应。
(c )在100℃左右必须具有一定的蒸气压(一般不小于10mmHg )。
(2)水蒸气蒸馏的实验操作
水蒸气蒸馏装置如图2所示。
用500 mL 圆底烧瓶作水蒸气发生器,内盛水约占其容量的1/2~2/3,以长玻璃管作为安全管,管的下端接近瓶底,根据管中水柱的高低,可以估计水蒸气压力的大小。
水蒸气导管末端应接近蒸馏烧瓶底部,以使水蒸气和被蒸馏物质充分接触并起搅拌作用。
发生器的水蒸气导出管与一个T 形管相连,T 形管的支管套一个短橡皮管,橡皮管上用螺旋夹夹住,T 形管的另一端与蒸馏部分的导管相连,T 形管用来除去水蒸气中冷凝下来的水分。
在操作中,如果发生不正常现象,应立刻打开螺旋夹,使之与大气相通。
将反应装置按图2连接好,打开T 形管上的螺旋夹,把水蒸气发生器里的水加热到沸腾,当有水蒸气从T 形管的支管冲出时,再旋紧螺旋夹,让水蒸气通入烧瓶中,这时可以看到烧瓶中的混合物翻腾不息,不久在冷凝管中就会出现有机物质和水的混合物。
调节加热温度,使瓶内的混合物不致飞溅得太厉害,并控制馏出液的速度约为每秒种2~3滴。
为了使水蒸气不致于在烧瓶内过多地冷凝,在进行水蒸气蒸馏时通常也可用小火将蒸馏烧瓶加热。
在操作时,要随时注意安全管中的水柱是否发生不正常的上升现象,以及蒸馏烧瓶中的液体是否发生倒吸现象,一旦发生这种现象,应立刻打开螺旋夹,移去热源,找出发生故障的原因。
必须把故障排除后,方可继续蒸馏。
当馏出液澄清透明,不再含有油滴时,一般即可停止蒸馏,这时应首先打开螺旋夹,然后移去热源,以免发生倒吸现象。
三、主要试剂与仪器
1.试剂 苯甲醛 6 mL (0.06mol),乙酸酐 11 mL (0.12mol),无水醋酸钾 6g (0.06mol),饱和碳酸钠溶液,浓盐酸,活性炭。
2.仪器 250 mL 三口烧瓶,空气冷凝管, 250mL 圆底烧瓶,75度弯管, 直形冷凝管,支管接引管,锥形瓶,量筒,烧杯,布氏漏斗,吸滤瓶,表面皿,红外灯。
四、主要试剂与产品的物理常数
五、实验装置
制备肉桂酸的实验装置如图1、图2所示。
图1 制备肉桂酸的反应装置图图2 水蒸气蒸馏装置图
六、实验步骤
1.在250 mL三口烧瓶中依次加入无水醋酸钾6g,苯甲醛6 mL,乙酸酐11 mL,沸石2粒。
2.安装反应装置如图1,三口烧瓶一口堵塞,一口插入温度计进液相,一口装空气冷凝管。
3.用电夹套加热,控制温度在150~170℃回流1h。
要注意控制加热速度,防止物料从空气冷凝管顶端逸出,必要时可再接一个冷凝管。
4.将反应液冷却至约100℃左右,加入40 mL热水,此时有固体析出。
5.向三口烧瓶内加入饱和碳酸钠溶液,并摇动三口烧瓶,用pH试纸检验,直到pH值为8左右,约需饱和碳酸钠溶液30~40 mL。
6.如图2搭好水蒸气蒸馏装置,蒸出未反应的苯甲醛,蒸到馏出液澄清无油珠时停止蒸馏(可用盛水的烧杯去接引管下接几滴馏出液,检验有无油珠),约需20min。
7.将剩余液转入400mL烧杯中,补加少量水至液体总量为200~250mL,再加1~2匙活性炭。
8.煮沸脱色5min。
9.趁热减压过滤,滤液转入干净的烧杯,冷却到室温。
10.搅拌下慢慢加入浓盐酸,到pH试纸变红,大约需要20~40mL。
11、冷却到室温后,减压过滤,滤饼用5~10 mL冷水洗涤,抽干。
12、滤饼转入表面皿,红外灯下干燥。
产品称量,回收,计算产率。
七、注意事项
1.久置的苯甲醛含苯甲酸,故需蒸馏提纯。
苯甲酸含量较多时可用下法除去:先用10%碳酸钠溶液洗至无CO2放出,然后用水洗涤,再用无水硫酸镁干燥,干燥时加入1%对苯二酚以防氧化,减压蒸馏,收集79℃/25mmHg或69℃/15mmHg,或62℃/10mmHg的馏分,沸程2℃,贮存时可加入0.5%的对苯二酚。
2.无水醋酸钾需新鲜熔融。
将含水醋酸钾放入蒸发皿内,加热至熔融,立即倒在金属板上,冷后研碎,置于干燥器中备用。
3.反应混合物在加热过程中,由于CO2的逸出,最初反应时会出现泡沫。
4.反应混合物在150~170℃下长时间加热,发生部分脱羧而产生不饱和烃类副产物,并进而生成树脂状物,若反应温度过高(200℃),这种现象更明显。
5.肉桂酸有顺反异构体,通常以反式存在,为无色晶体,熔点133℃。
6.如果产品不纯,可在水或3∶1稀乙醇中进行重结晶。
八、思考题
1、具有何种结构的醛能进行Perkin反应?
2、本实验中在水蒸气蒸馏前为什么用饱和碳酸钠溶液中和反应物?
3、为什么不能用氢氧化钠代替碳酸钠溶液来中和反应物?
4、水蒸气蒸馏通常在哪三种情况下使用?被提纯物质必须具备哪些条件?
5、肉桂酸能溶于热水,难溶于冷水,试问如何提纯之?定出操作步骤,并说明每一步的作用。
6、苯甲醛和丙酸酐在无水的丙酸钾存在下相互作用得到什么产物?写出反应式?
答:
(CH3CH2CO)2
CHO+CH=CCOOH+ CH3COOH
CH3
7、反应中,如果使用与酸酐不同的羧酸盐,会得到两种不同的芳香丙烯酸,为什么?
答:酸性条件下,羧酸盐自身也能形成碳负离子,因而反应体系中存在两种不同的碳负离子。