过渡系元素的磁性
- 格式:ppt
- 大小:164.00 KB
- 文档页数:10
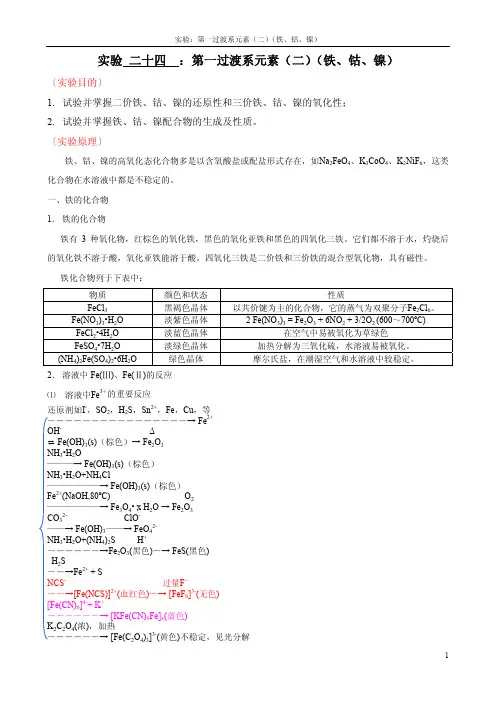
实验二十四:第一过渡系元素(二)(铁、钴、镍)〔实验目的〕1.试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2.试验并掌握铁、钴、镍配合物的生成及性质。
〔实验原理〕铁、钴、镍的高氧化态化合物多是以含氧酸盐或配盐形式存在,如Na2FeO4、K3CoO4、K2NiF6,这类化合物在水溶液中都是不稳定的。
一、铁的化合物1.铁的化合物铁有3种氧化物,红棕色的氧化铁,黑色的氧化亚铁和黑色的四氧化三铁。
它们都不溶于水,灼烧后的氧化铁不溶于酸,氧化亚铁能溶于酸。
四氧化三铁是二价铁和三价铁的混合型氧化物,具有磁性。
铁化合物列于下表中:物质颜色和状态性质FeCl3黑褐色晶体以共价键为主的化合物,它的蒸气为双聚分子Fe2Cl6。
Fe(NO3)3 = Fe2O3 + 6NO2 + 3/2O2 (600~700ºC) Fe(NO3)3•H2O 淡紫色晶体 2FeCl2•4H2O 淡蓝色晶体在空气中易被氧化为草绿色FeSO4•7H2O 淡绿色晶体加热分解为三氧化硫,水溶液易被氧化。
(NH4)2Fe(SO4)2•6H2O 绿色晶体摩尔氏盐,在潮湿空气和水溶液中较稳定。
2.溶液中Fe(Ⅲ)、Fe(Ⅱ)的反应⑴溶液中Fe3+的重要反应还原剂如I-,SO2,H2S,Sn2+,Fe,Cu,等――――――――――――――――→ Fe2+OH-Δ⇌ Fe(OH)3(s)(棕色)→ Fe2O3NH3•H2O———→ Fe(OH)3(s)(棕色)NH3•H2O+NH4Cl——————→ Fe(OH)3(s)(棕色)Fe2+(NaOH,80ºC) O2——————→ Fe3O4• x H2O → Fe2O3CO32-ClO-——→ Fe(OH)3——→ FeO42-NH3•H2O+(NH4)2S H+――――――→Fe2O3(黑色)―→ FeS(黑色)H2S――→Fe2+ + SNCS-过量F-――→[Fe(NCS)]2+(血红色)―→ [FeF6]3-(无色)[Fe(CN)6]4-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)K2C2O4(浓),加热――――――→ [Fe(C2O4)3]3-(黄色)不稳定,见光分解⑵溶液中Fe2+的重要反应氧化剂如Cr2O72-,浓HNO3等―――――――――――→ Fe3+OH-O2⇌ Fe(OH)2(s)(纯白色)→Fe(OH)3(s)(棕色)NH3•H2O――→ Fe(OH)2(s)(纯白色)NH3•H2O+NH4Cl――――――→无沉淀CO32-H2O + CO2 O2――→ FeCO3(白色)――→ Fe(HCO3)2―→Fe(OH)3(s)(NH4)2S―――→ FeS(黑色)NO――→[Fe(NO)( H2O)5]2+( 棕色)H2O2 +过量F-―――――→ [FeF6]3-(无色)NCS-――→无溶液、无颜色CN-过量CN-Cl2―→Fe(CN)2(s) (白色) ――→[Fe(CN)6]4-――→[Fe(CN)6]3-[Fe(CN)6]3-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)二、钴的化合物1. 钴的化合物钴的氧化物与铁的氧化物类似,为暗褐色的Co2O3•xH2O和灰绿色的CoO。




第53节过渡元素简介一、过渡元素简介过渡元素在元素周期表中的位置和外围电子层排布从元素周期表上可以看到,表的中部从ⅢB 族到ⅡB 族10个纵行,包括镧系和锕系,共有63种元素,这些元素包括了第VI 族和全部副族元素,人们习惯上把它们叫做过渡元素。
过渡元素的价层电子构型为1~101~2(1)ds n n (Pd 为0ns )。
在元素周期表中,它们处于s 区元素和p 区元素之间。
从性质上看,s 区元素的单质均为活泼元素,形成的化合物以离子型为主,其氧化数单一,离子没有颜色;p 区元素只有部分是金属元素,形成的化合物多为共价型,含有多种氧化数;d 区介于s 区和p 区之间。
因此,人们又称d 区元素为过渡元素。
它们分属于第四周期到第七周期,如图11-1所示过渡元素原子的电子层排布有共同的特征。
从图中可以看出,它们的最外电子层上都有1~2个s 电子(Pd 除外),随着原子序数的递增,增加的电子大多填充在次外层的d 轨道上其中镧系和锕系元素的原子,增加的电子主要填充在倒数第三层的f 轨道上,少数填充在次外层的d 轨道上。
过渡元素原子的外围电子层排布反映了它不同于主族元素原子的核外电子排布的特征。
例如,钪(Sc )的外围电子层排布为3d4s2,铀(U )的外围电子层排布为5f6d7s2。
过渡元素的许多性质,都跟它们的外围电子层排布有关。
二、过渡元素的通性过渡元素原子的最外层一般只有1~2个电子,在化学反应中较易失去,故它们都是金属元素。
相对于主族元素而言,过渡元素的特性及其性质变化规律主要表现在以下几个方面1.单质的物理性质过渡元素的单质有些是高熔点、高沸点、密度大、硬度大、导电和导热性良好的金属。
在金属元素中,熔点最高的是钨,密度最大的是锇,硬度最大的是铬。
例如:铂的密度是21.45g/cm 3,约是铝的8倍;钨的熔点是3410℃,是所有金属中最难熔的。
造成这些特性的原因是过渡元素的单质因原子半径小,采取最紧密堆积,原子之间除了有电子外,还用部分d电子参与成键,在金属键之外有部分共价键,因此结合牢固。





第一过渡系元素(一)(钛、钒、铬、锰)第一过渡系元素是指周期表中第3至第12族的元素,它们在化学性质上有相似之处。
其中,钛(Ti)、钒(V)、铬(Cr)和锰(Mn)是第一过渡系元素中的前四个元素,它们具有一些共通的特性,同时也存在一些区别。
本文将从以下几个方面来介绍这四个元素:元素性质、物理性质、化学性质以及地质应用。
一、元素性质1.钛(Ti)钛是一种质轻、高强度、高耐腐蚀性、抗疲劳性能好的金属。
它具有优异的机械性能,被广泛应用于航空、航天、化工、海洋开发等领域。
同时,钛也是一种生物医用材料,被用于制作人体骨骼支架、人造关节、人工心脏瓣膜等。
2.钒(V)钒是一种银白色金属,比铁硬但稍加工艺处理后可以获得良好的延展性和强度。
它还有广泛的应用,用于制造钢、化学试剂和合金等。
不仅如此,钒还是一种强化剂,在钢铁生产过程中起到重要的作用。
3.铬(Cr)铬是一种具有高度耐腐蚀性的银白色金属,它主要应用于不锈钢、电子元器件、航空航天、制药等领域。
除此之外,铬还是一种环保型材料,可以用于净水和净化技术。
4.锰(Mn)锰是金属元素中的一种,它是一种银灰色的金属,具有良好的延展性和韧性。
锰还是钢铁生产中的一种重要元素,可以增强钢的硬度和韧性。
二、物理性质钛是一种具有低密度和高强度的金属,密度为4.54克/厘米立方。
它具有较高的熔点(1668℃)和沸点(3287℃),同时也具有较高的热导率和电导率。
三、化学性质钛是一种化性非常稳定的金属,在常温下不会被大多数酸和碱腐蚀。
它可以与氧、氮、氢反应,产生相应的氧化物、氮化物和氢化物。
此外,钛还可以和卤素反应,如氯、溴和碘等,生成相应的卤化物,例如TiCl4、TiBr3等。
锰可以和许多元素和化合物发生反应。
它可以与氧、氯、酸、弱碱等反应,生成各种不同的化合物。
在大气环境下,锰会逐渐氧化形成氧化锰,该过程是一种蓝黑色的化学反应。
四、地质应用钒是一种重要的工业金属,在地球上的丰度较低,但在一些特定的矿物中含量较高。

元素周期表中的过渡金属元素周期表是描述元素的分类和性质的重要工具。
其中,过渡金属是指在周期表中位于主族元素和稀土金属之间的一组元素。
它们具有一系列独特的性质和应用,对我们的日常生活和科学领域都有重要影响。
过渡金属的定义在元素周期表中,过渡金属通常被定义为具有部分填充的d轨道的元素。
它们的原子结构特点是d电子层不是满电子层,即d轨道中存在未配对或未填满的电子。
这使得过渡金属具有许多独特的性质,例如可变的氧化态、良好的导电性和热导性等。
典型的过渡金属元素过渡金属包括铬(Cr)、锰(Mn)、铁(Fe)、钴(Co)、镍(Ni)、铜(Cu)、锌(Zn)等。
它们具有共同的特征,如高熔点、高密度、良好的导电性和热导性等。
这些元素在自然界中广泛存在,且大多数用途广泛。
性质和应用过渡金属具有许多重要的物理和化学性质,为它们带来了广泛的应用。
以下是一些常见的例子:1. 催化剂:过渡金属广泛用于催化反应,例如铂(Pt)催化剂在汽车尾气净化和氢气燃料电池中起着重要作用。
2. 磁性材料:铁、钴和镍等过渡金属是制造磁性材料的重要成分。
它们被广泛应用于电子设备、电动机和磁存储介质等领域。
3. 合金:过渡金属在合金制备中起着关键作用。
例如,钢是由铁和碳以及其他过渡金属组成的合金,拥有优异的强度和耐腐蚀性能。
4. 荧光材料:某些过渡金属离子在激发条件下能够发出明亮的荧光,例如钐(Sm)和铕(Eu)等离子常用于荧光显示器和照明装置中。
5. 生物学应用:许多过渡金属离子在生物体内具有重要的生理功能,如铁在血红蛋白中的运输氧气。
过渡金属的周期性和趋势过渡金属元素在元素周期表中按照原子序数的增加排列。
它们的性质和趋势在一定程度上与原子序数的变化相吻合,但也存在一些异常现象。
1. 电子结构:过渡金属的电子结构具有一定的规律性。
它们的原子结构中的d电子数目逐渐增加,从Sc(21)到Cu(29)的元素具有各自特定的电子组态。
2. 原子半径:在过渡金属族中,原子半径从左到右逐渐减小。
元素周期表中的过渡元素元素周期表是化学家们用来组织和分类元素的基本工具。
其中,过渡元素是周期表中一个重要的类别,它们在化学和物理性质上都有着独特的特点。
本文将介绍过渡元素的概念、特性以及它们在日常生活中的应用。
一、过渡元素的概念元素周期表是按照原子核中的质子数(即原子序数)递增的顺序排列的。
而过渡元素是指周期表中的d区元素,这些元素具有不完全填充的d电子层。
具体来说,它们的最外层电子结构可表示为(n-1)d(n-2)fnp,其中n代表能级,np代表填充的外层电子。
过渡元素包括3d系、4d系、5d系和6d系,分别位于周期表的第3至12组、第4至12组、第5至12组和第6至12组。
由于它们的外层电子结构不同,导致了它们之间的化学特性差异。
二、过渡元素的特性1. 化学性质:过渡元素在化学反应中通常表现出多价性。
由于d电子的相对能量较高,容易参与化学反应,并能形成稳定的离子化合物。
此外,由于外层电子的分布情况不同,过渡元素在形成氧化物时可能会形成不同的氧化态,这也是其多价性的表现。
2. 金属性质:过渡元素大多数都是金属,具有良好的导电性和导热性。
此外,它们还具有韧性、延展性和磁性等金属特性。
3. 催化性质:许多过渡元素、尤其是过渡金属,具有良好的催化活性。
它们可以通过吸附、解离或转移电子等方式参与化学反应,从而降低反应活化能,加速反应速率。
4. 彩色离子:过渡元素离子在溶液中呈现出丰富的颜色。
这是由于过渡元素离子的d电子能级间的跃迁所引起的。
三、过渡元素的应用1. 催化剂:由于过渡金属的催化活性,它们被广泛应用于化学工业中的催化反应过程,如重要的工业过程氨合成、有机合成和汽车尾气催化转化等。
2. 电池材料:过渡金属在电池材料中具有重要作用。
例如,锂电池中的过渡金属氧化物可用作正极材料。
3. 金属合金:过渡金属常用于制备各种金属合金,如不锈钢、合金钢等。
这些合金通常具有较高的强度和耐腐蚀性能。
4. 彩色玻璃和陶瓷:某些过渡金属元素可以通过调节其氧化态来改变颜色。
含义周期表中从IIIB族到VIII族的元素。
共有三个系列的元素,电子逐个填入他们的3d、4d和5d轨道。
有时人们把过渡元素的范围扩大到包括镧系元素和(IIB)形成稳定配位化合物的能力上与过渡元素很相似,因此也有人建议把锌族元素归入过渡元素范围。
各系列概述过渡元素位于周期表中部,原子中d或f亚层电子未填满。
这些元素都是金属,也称为过渡金属。
根据电子结构的特点,过渡元素又可分为:外过渡元素(又称d区元素)及内过渡元素(又称f区元素)两大组。
● 外过渡元素包括镧、锕和除镧系锕系以外的其它过渡元素,它们的d轨道没有全部填满电子,f轨道为全空(四、五周期)或全满(第六周期)。
● 内过渡元素指镧系和锕系元素,它们的电子部分填充到f轨道。
d区过渡元素可按元素所处的周期分成三个系列:①位于周期表中第4周期的Sc~Ni------称为第一过渡系元素②第5周期中的Y~Pd称为第二过渡系元素③第6周期中的La~Pt称为第三过渡系元素一般性质特征,不同的过渡金属之间可形成多种合金。
②过渡金属的原子或离子中可能有成单的d电子,3。
③过渡元素的d,过渡元素原子的电子构型过渡元素原子电子构型的特点是它们的d 轨道上的电子未充满(Pd例外),最外层仅有1~2个电子,它们的价电子构型为(n-1)d1-9ns过渡元素的氧化态及其稳定性过渡元素最外层s电子和次外层d电子可参加成键,所以过渡元素常有多种氧化态。
一般可由+Ⅱ依次增加到与族数相同的氧化态(ⅧB族除Ru、Os外,其它元素尚无+Ⅷ氧化态)同一周期从左到右,氧化态首先逐渐升高,随后又逐渐降低。
随3d轨道中电子数的增加,氧化态逐渐升高;当3d轨道中电子数达到5或超过5时,3d轨道逐渐趋向稳定,高氧化态逐渐不稳定(呈现强氧化性),此后氧化态又逐渐降低。
三个过渡系元素的氧化态从左到右的变化趋势是一致的。
不同的只是第二、三过渡系元素的最高氧化态表现稳定,而低氧化态化合物并不常见。
同一族中从上至下,高氧化态趋向于比较稳定-----和主族元素不同。