无机化学实验—第一过渡系元素(II)(铁,钴,镍)
- 格式:doc
- 大小:60.00 KB
- 文档页数:3
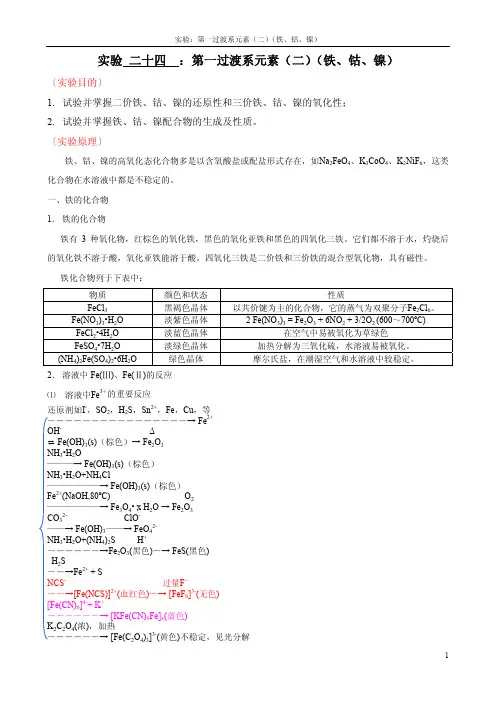
实验二十四:第一过渡系元素(二)(铁、钴、镍)〔实验目的〕1.试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2.试验并掌握铁、钴、镍配合物的生成及性质。
〔实验原理〕铁、钴、镍的高氧化态化合物多是以含氧酸盐或配盐形式存在,如Na2FeO4、K3CoO4、K2NiF6,这类化合物在水溶液中都是不稳定的。
一、铁的化合物1.铁的化合物铁有3种氧化物,红棕色的氧化铁,黑色的氧化亚铁和黑色的四氧化三铁。
它们都不溶于水,灼烧后的氧化铁不溶于酸,氧化亚铁能溶于酸。
四氧化三铁是二价铁和三价铁的混合型氧化物,具有磁性。
铁化合物列于下表中:物质颜色和状态性质FeCl3黑褐色晶体以共价键为主的化合物,它的蒸气为双聚分子Fe2Cl6。
Fe(NO3)3 = Fe2O3 + 6NO2 + 3/2O2 (600~700ºC) Fe(NO3)3•H2O 淡紫色晶体 2FeCl2•4H2O 淡蓝色晶体在空气中易被氧化为草绿色FeSO4•7H2O 淡绿色晶体加热分解为三氧化硫,水溶液易被氧化。
(NH4)2Fe(SO4)2•6H2O 绿色晶体摩尔氏盐,在潮湿空气和水溶液中较稳定。
2.溶液中Fe(Ⅲ)、Fe(Ⅱ)的反应⑴溶液中Fe3+的重要反应还原剂如I-,SO2,H2S,Sn2+,Fe,Cu,等――――――――――――――――→ Fe2+OH-Δ⇌ Fe(OH)3(s)(棕色)→ Fe2O3NH3•H2O———→ Fe(OH)3(s)(棕色)NH3•H2O+NH4Cl——————→ Fe(OH)3(s)(棕色)Fe2+(NaOH,80ºC) O2——————→ Fe3O4• x H2O → Fe2O3CO32-ClO-——→ Fe(OH)3——→ FeO42-NH3•H2O+(NH4)2S H+――――――→Fe2O3(黑色)―→ FeS(黑色)H2S――→Fe2+ + SNCS-过量F-――→[Fe(NCS)]2+(血红色)―→ [FeF6]3-(无色)[Fe(CN)6]4-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)K2C2O4(浓),加热――――――→ [Fe(C2O4)3]3-(黄色)不稳定,见光分解⑵溶液中Fe2+的重要反应氧化剂如Cr2O72-,浓HNO3等―――――――――――→ Fe3+OH-O2⇌ Fe(OH)2(s)(纯白色)→Fe(OH)3(s)(棕色)NH3•H2O――→ Fe(OH)2(s)(纯白色)NH3•H2O+NH4Cl――――――→无沉淀CO32-H2O + CO2 O2――→ FeCO3(白色)――→ Fe(HCO3)2―→Fe(OH)3(s)(NH4)2S―――→ FeS(黑色)NO――→[Fe(NO)( H2O)5]2+( 棕色)H2O2 +过量F-―――――→ [FeF6]3-(无色)NCS-――→无溶液、无颜色CN-过量CN-Cl2―→Fe(CN)2(s) (白色) ――→[Fe(CN)6]4-――→[Fe(CN)6]3-[Fe(CN)6]3-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)二、钴的化合物1. 钴的化合物钴的氧化物与铁的氧化物类似,为暗褐色的Co2O3•xH2O和灰绿色的CoO。




铁钴镍实验报告
实验目的,通过实验了解铁钴镍的性质和用途,掌握相关实验操作技能。
实验仪器和试剂,铁钴镍样品、酸、碱、试管、酒精灯、玻璃棒、试剂瓶等。
实验步骤:
1. 取一小块铁钴镍样品,放入试管中;
2. 加入适量酸,观察样品的反应情况;
3. 加入适量碱,观察样品的反应情况;
4. 使用酒精灯加热样品,观察其变化;
5. 用玻璃棒测试样品的导电性。
实验结果:
1. 酸的作用,铁钴镍样品与酸接触后,发生了明显的气体生成反应,同时产生了气泡。
观察样品表面,发现有气体释放的迹象,推测为氢气的生成反应。
2. 碱的作用,加入碱后,铁钴镍样品发生了部分溶解,生成了混合溶液。
观察到溶液中有悬浮物质,可能是未反应完全的铁钴镍残留。
3. 加热反应,使用酒精灯加热样品后,观察到样品表面发生了颜色变化,从原来的灰色变成了暗红色,推测为铁钴镍的氧化反应。
4. 导电性测试,用玻璃棒测试样品的导电性,发现铁钴镍具有一定的导电性,但不如金属导电性强。
实验结论:
通过本次实验,我们了解到铁钴镍在酸、碱、加热和导电性方面的性质。
铁钴镍在酸中会产生氢气,与碱发生部分溶解,加热后会发生氧化反应,具有一定的导电性。
这些性质使得铁钴镍在工业生产和科学研究中具有重要的应用价值,例如用于制造电池、合金等材料。
通过本次实验,我们不仅了解了铁钴镍的性质和用途,还掌握了相关实验操作技能,为今后的实验和科研工作打下了良好的基础。
希望通过今后的实验学习,我们能够更加深入地了解各种物质的性质和应用,为科学研究和技术创新做出更大的贡献。





实验第一过渡系元素(II)(铁,钴,镍)一、实验目的与要求:1.掌握二价铁,钴,镍的还原性和氧化性。
2.掌握铁,钴,镍配合物的生成及性质。
二、教学重点与难点:掌握二价铁,钴,镍的还原性和氧化性;掌握铁,钴,镍配合物的生成及性质。
三、教学方法与手段:讲授法;演示法四、教学课时: 4课时五、课的类型:实验课六、教学内容:[实验内容]:一、铁(II)、钴(II)、镍(II)的化合物的还原性1、铁(II)的还原性(1)酸性介质:往盛有0.5ml氯水的试管中加入3滴6 mol.L-1H2SO4溶液,然后滴加(NH4)2Fe(SO4)2溶液,观察现象,写出反应式:2Fe2+ + Cl2 === 2Fe3++ 2Cl-Fe3++nSCN-====[Fe(SCN)n]3-n(血红色)说明:Fe2+被氧化为Fe3+的现象不明显(淡绿色 黄棕色),可用KSCN检验Fe3+。
亚铁盐一般用硫酸亚铁铵,它稳定,不易分解,为防万一还需要加硫酸。
(2)碱性介质:在一试管中放入2ml蒸馏水和3滴6mol.L-1H2SO4溶液煮沸,以赶尽溶于其中的空气,然后溶于少量硫酸亚铁铵晶体。
在另一试管中加入3ml 6mol.L-1NaOH溶液煮沸。
冷却后,用一长滴管吸收NaOH溶液,插入(NH4)2Fe(SO4)2溶液到底部,慢慢挤出NaOH,观察产物颜色和状态。
Fe2++2OH- ====Fe(OH)2(为纯白色沉淀)4Fe(OH)2+O2+2H2O====4Fe(OH)3 (红褐色)说明:为了得到纯净的白色氢氧化亚铁沉淀,将溶液加热以赶净溶解在其中的氧气。
放置一段时间白色沉淀变为灰绿色,至实验结束也没有变为红褐色。
【现象:沉淀由白变成灰绿色再变成红棕色】2、钴(II)的还原性(1)、往盛有CoCl2溶液的试管中加入氯水,观察有何变化两者不反应.2Co2++Cl2+2H+ 不反应说明:在酸性溶液中,Co2+比较稳定,不易被氧化。
(2)、在盛有1ml CoCl2溶液的试管中滴入稀NaOH溶液(注:),观察沉淀的生成。

第一过渡系元素(二)——铁、钴、镍铁、钴、镍是第一过渡系元素中应用广泛的三种金属。
它们都具有相似的化学性质和金属特性,因此在很多方面都有类似的应用。
下面我们就来看看这三种金属的特性和应用。
铁(Fe)是地球上广泛存在的元素,人类使用铁的历史已经有几千年了。
铁是一种重要的结构材料,它的强度和硬度很高,并且具有很好的可塑性和可焊性。
此外,铁还有很好的耐腐蚀性能。
由于其性能稳定、价格低廉,因此广泛应用于制造汽车、船舶、建筑等领域。
此外,铁还应用于电力行业,比如铁芯变压器核心、电缆等。
铁还是一种重要的磁性材料,被广泛应用于制作各种永磁体。
钴(Co)是一种稀有金属,它具有高强度、高耐磨性、高熔点等特性,因此被广泛应用于军工、航空航天等领域。
钴还是一种重要的磁性材料,被广泛用于制作磁记录材料、计算机硬盘等。
钴还被广泛应用于医疗行业,如制作人工骨骼、人工关节等。
钴的化合物被用作化学反应催化剂、生物体内一些酶的结构成分等。
镍(Ni)是一种有色金属,与铁、钴类似,具有高强度、高耐腐蚀性、高温性等特性。
镍是一种重要的合金元素,被广泛用于制造高强度的合金钢、高温合金、耐腐蚀合金等。
比如,合金钢通常采用镍铬或镍铬钼合金,具有较高的强度和硬度,广泛应用于汽车、船舶、机械制造等领域。
此外,镍还被广泛应用于电镀行业,用于制作各种饰品、厨房用具、电器外壳等。
镍的化合物也被广泛用作催化剂、电池材料等。
除了以上的应用,铁、钴、镍还有很多重要的应用,如铁和镍被用于生产不锈钢、硬质合金等材料,钴被用于生产永磁体、高温涂层等材料。
此外,在新能源、电子信息、医疗等领域,铁、钴、镍的应用也越来越广泛。
总之,铁、钴、镍是第一过渡系元素中应用广泛的三种金属,它们的性质相似,应用领域也有很大的交叉。
随着科技的不断发展和应用需求的不断变化,铁、钴、镍的应用也会不断扩展和深化。
第一过渡系元素实验报告实验目的:通过实验,了解第一过渡系元素的性质和特点,掌握相关实验技能。
实验材料:1. 锌粉。
2. 铜片。
3. 硫酸。
4. 精密天平。
5. 试剂瓶。
6. 燃烧瓶。
7. 火柴。
8. 烧杯。
9. 玻璃棒。
10. 镊子。
实验原理:本实验主要通过观察锌和铜在不同条件下的反应,来了解第一过渡系元素的化学性质。
锌是第一过渡系元素,它具有较活泼的化学性质,在酸性溶液中可以与氧气反应生成氢气。
而铜则不具备这种性质,因此可以通过观察它们在硫酸溶液中的反应来区分它们的化学性质。
实验步骤:1. 使用精密天平称取一定质量的锌粉,并记录下质量。
2. 将称取好的锌粉放入试剂瓶中,加入适量的硫酸,观察并记录下反应现象。
3. 使用玻璃棒和镊子将铜片放入烧杯中,加入适量的硫酸,观察并记录下反应现象。
4. 用燃烧瓶收集锌和铜在硫酸溶液中产生的气体,并进行气体性质的测试。
实验结果:1. 锌与硫酸反应生成氢气,氢气可以点燃并燃烧。
2. 铜与硫酸无明显反应产生气体。
实验分析:通过实验可以得出锌具有较活泼的化学性质,能够在酸性溶液中与氧气反应生成氢气,而铜则不具备这种性质。
这与第一过渡系元素的化学性质有关,锌属于较活泼的金属,而铜则属于不活泼的金属。
这也说明了第一过渡系元素的化学性质是多样的,具有一定的活性差异。
实验总结:本次实验通过观察锌和铜在硫酸溶液中的反应,加深了对第一过渡系元素的化学性质的理解。
通过实验,我们了解到第一过渡系元素具有多样的化学性质,这对于我们进一步学习和研究元素的化学性质具有重要意义。
同时,实验也锻炼了我们的实验操作技能和观察分析能力,为今后的学习打下了基础。
实验存在的不足和改进方法:在实验中,我们发现了一些问题,比如实验操作中的一些细节需要更加注意,实验结果的记录和分析需要更加准确。
在今后的实验中,我们将更加认真地进行实验操作,提高实验技能和实验数据的准确性。
通过本次实验,我们对第一过渡系元素的化学性质有了更深入的了解,也积累了宝贵的实验经验,相信在今后的学习和实验中能够更好地运用所学知识,做出更多有意义的成果。
一、实验目的1. 了解过渡元素的基本性质及其在化学反应中的行为。
2. 掌握过渡元素化合物的制备方法和性质测试方法。
3. 通过实验探究过渡元素在不同条件下的化学变化,加深对过渡元素化学性质的理解。
二、实验原理过渡元素位于元素周期表的d区,具有独特的电子排布和化学性质。
它们在化学反应中既能表现出金属性,又能表现出非金属性。
本实验主要通过制备和测试过渡元素化合物,观察其颜色、溶解性、反应产物等,以了解过渡元素的性质。
三、实验用品1. 仪器:烧杯、试管、滴管、酒精灯、加热器、磁力搅拌器、离心机、电子天平等。
2. 药品:过渡元素金属(如铜、铁、锌等)、盐酸、硫酸、硝酸、氢氧化钠、氨水等。
四、实验步骤1. 过渡元素金属的制备:将过渡元素金属与盐酸反应,制备金属离子溶液。
2. 过渡元素化合物的制备:将金属离子溶液与不同试剂反应,制备相应的过渡元素化合物。
3. 过渡元素化合物的性质测试:- 观察化合物颜色、溶解性等物理性质。
- 进行化学反应,观察反应产物、颜色变化、沉淀生成等。
- 利用离心机分离混合物,观察沉淀和溶液的性质。
五、实验结果与分析1. 铜的制备与性质:- 将铜片与盐酸反应,生成CuCl2溶液。
- CuCl2溶液呈蓝色,溶解性好。
- 与氨水反应,生成深蓝色沉淀Cu(NH3)4Cl2。
2. 铁的制备与性质:- 将铁片与盐酸反应,生成FeCl2溶液。
- FeCl2溶液呈绿色,溶解性好。
- 与氢氧化钠反应,生成棕色沉淀Fe(OH)2。
- 加热沉淀,转化为红棕色沉淀Fe(OH)3。
3. 锌的制备与性质:- 将锌片与盐酸反应,生成ZnCl2溶液。
- ZnCl2溶液呈无色,溶解性好。
- 与氢氧化钠反应,生成白色沉淀Zn(OH)2。
六、实验讨论1. 过渡元素化合物的颜色与溶解性与其离子价态有关。
例如,Cu2+离子呈蓝色,Zn2+离子呈无色。
2. 过渡元素化合物在化学反应中既能表现出金属性,又能表现出非金属性。
例如,铁既能与酸反应生成氢气,又能与碱反应生成氢氧化物沉淀。
实验24 第一过渡系元素(铬、锰、铁、钴、镍)一、实验目的掌握铬、锰主要氧化态的化合物的重要性质及各氧化态之间相互转化的条件。
掌握铁、钴、镍的氢氧化物及配合物的生成和性质。
掌握铁盐的性质。
学习Fe2+、、Fe3+和Ni2+的鉴定方法。
二、实验前应思考的问题1.转化反应须在何种介质(酸性或碱性)中进行?为什么?2.从电势值和还原剂被氧化后产物的颜色考虑,选择哪些还原剂为宜?如果选择亚硝酸钠溶液可以吗?3.转化反应须在何种介质中进行?为什么?4.从电势值和氧化剂被还原后产物的颜色考虑,应选择哪些氧化剂?3%H2O2溶液可用否?三、实验用品仪器:试管、台秤、沙浴皿、蒸发皿、试管、离心试管、烧杯、玻璃棒、滴管、点滴板、酒精灯固体药品:二氧化锰、亚硫酸钠、高锰酸钾、FeSO4·7H2O、KCl、NH4Cl液体药品:H2SO4(浓,1 mol·L-1),H2O2(3%)、NaOH(40%,6 mol·L-1,2 mol·L-1,0.1 mol·L-1),CuCl2(0.2 mol·L-1)、HCl(浓,6 mol·L-1,2 mol·L-1,0.1 mol·L-1)、H2SO4(2 mol·L-1)、HAc(2 mol·L-1)、NH3·H2O(浓)、K2SO4·Cr2(SO4)3·24H2O(0.2 mol·L-1)、NH3·H2O(2 mol·L-1)、K2Cr2O7(0.1 mol·L-1)、FeSO4(0.5 mol·L-1)、K2CrO4(0.1 mol·L-1)、AgNO3(0.1 mol·L-1)、BaCl2(0.1 mol·L-1)、Pb(NO3)2(0.1 mol·L-1)、MnSO4(0.2 mol·L-1,0.5 mol·L-1)、NH4C1(2 mol·L-1 )、NaClO(稀)、H2S(饱和)、Na2S(0.1 mol·L-1、0.5 mol·L-1),KMnO4(0.1 mol·L-1)、Na2SO3(0.1 mol·L-1)、K4[Fe(CN)6] (0.1 mol·L-1)、K3[Fe(CN)6] (0.1 mol·L-1)、CoCl2(0.1 mol·L-1)、NiSO4(0.1 mol·L-1)、FeCl3(0.1 mol·L-1)、KI(0.1 mol·L-1)、Na2CO3(0.1 mol·L-1)、KMnO4(0.1 mol·L-1)MnSO4(0.1 mol·L-1)、CrCl3(0.1 mol·L-1)、NH4F(1 mol·L-1)、NH4Cl(1 mol·L-1)、KSCN(0.1 mol·L-1、25%)、Pb(Ac)2(0.5 mol·L-1)、KNO2(饱和)溴水、淀粉溶液、二乙酰二肟(1%)、H2O2(3%)、滤纸、淀粉KI试纸、邻菲罗啉、戊醇材料:pH试纸、沸石四、实验内容1 铬的化合物的重要性质⑴铬(Ⅵ)的氧化性Cr2O72-转变为Cr3+。
无机化学实验第四版实验24铁钴镍(总4页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--实验24 铁钴镍一、实验目的1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验内容(实验现象根据自己所观察到的为准)三、实验讨论(从自己实验操作展开)四、实验思考题和习题1.实验步骤(2)要求整个实验不能带入空气到溶液中,为什么?Fe(Ⅱ)易被氧化,如若带入了空气,可能不能观察到颜色的转化过程。
2.根据实验现象总结+2价的铁、钴、镍化合物的还原性和+3价的铁钴镍化合物氧化性的变化规律。
Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)的氢氧化物都有还原性,其还原能力依Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)的顺序减弱。
Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)在酸性介质中的氧化能力依Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)的顺序增加。
3.比较钴镍氨配合物的氧化还原性相对大小及溶液稳定性。
钴盐和镍盐生成碱式盐溶于过量的氨水生成氨配合物,Co(Ⅱ)氨配合物易氧化转化成 Co(Ⅲ)氨配合物。
即镍盐更稳定。
4.为什么制取+3价的钴镍氢氧化物要用+2价为原料在碱性条件下进行氧化,而不+3价直接制取?首先,作为最高价氧化值,Co3+、Ni3+氧化性比较不稳定,易变成其它价态,故不用采用+3价直接氧化得到。
其次,而Co(OH)2、Ni(OH)2两性,在碱性条件下易被氧化成+3价氢氧化物。
5.如何分离混合液中的?Fe3+、Cr3+2+6.总结Fe(Ⅱ、Ⅲ)、Co(Ⅱ、Ⅲ)、Ni(Ⅱ、Ⅲ)主要化合物性质。
Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)具有强的还原性,都易形成配合物,且Co的配合物极易被氧化,它们的氢氧化物也易被氧化;Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)具有强的氧化性,也易生成配合物。
7.(此题面字太多,不好打得,请谅解)A:(NH4)2Fe (SO4)2B:(NH4)2Fe (SO4)2溶液C:Fe(OH)2D:NH3E:I2F:Fe3+G:KFe[Fe(CN)6]H:BaSO4这些方程式都是简单的,都可以轻易写出,在此我不一一写出了。
第一过渡系元素(铬、锰、铁、钴、镍)(3学时)一、实验目的及要求1.掌握铬、锰主要性质及个氧化态之间相互转化的条件。
2.练习沙浴加热操作。
3.试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性。
4.实验并掌握铁、钴、镍配合物的生成及性质。
二、实验药品MnSO(0.2mol/L)、NaOH(aq)、HCl(aq)、重铬酸钾溶液、NH4C l(2mol/L)、H2SO4(6mol/L)、CoCl2(aq)、NiSO4(aq)、FeCl3(aq)、K4[Fe(CN)6]、氨水、MnO2(s)、KMnO4(aq)、NH4Cl(s)三、实验内容及步骤1、铬的化合物的重要性质(1).铬(Ⅵ)的氧化性Cr2O72-转变为Cr3+(2).铬(Ⅵ)的缩合平衡Cr2O72-与CrO42-相互转化(3).Cr(OH)3的两性(4).铬(Ⅲ)的还原性(5).重铬酸钾和铬酸盐的溶解性分别在CrO42-、Cr2O72-溶液中各加入少量的Pb(NO3)2、BaCl2、AgNO3、观察产物的颜色。
2、锰的化合物的重要性质(1).氢氧化锰的生成和性质第一份、往0.2mol/L MnSO4中加入少量氢氧化钠,观察沉淀的颜色。
第二份往0.2mol/L MnSO4中加入少量氢氧化钠,再加过量的氢氧化钠,观察现象第三份往0.2mol/L MnSO4中加入少量氢氧化钠,再加入盐酸,观察现象第四份往0.2mol/L MnSO4中加入少量氢氧化钠,再加氯化铵,观察现象(2).锰的化合物的重要性质1)Mn2+的氧化2)硫化锰的生成和性质3)二氧化锰的生成和氧化性(2).高锰酸钾的性质分别试验高锰酸钾与亚硫酸钠在中性、酸性、碱性介质中的反应。
3、铁(Ⅱ)、钴(Ⅱ)、镍(Ⅱ)的化合物的还原性(1)、铁(Ⅱ)的还原性1)酸性介质2)碱性介质(2).钴(Ⅱ)的还原性1)往盛有CoCl2溶液的试管中加入氯水,观察现象。
2)往两支分别盛有0.5mL0.5mol/L CoCl2溶液的试管中,滴加2mol/L NaOH溶液,制得两份沉淀,一份置于空气中,一份加入新配制的氯水,观察。
实验25 第一过渡系元素(II)(铁,钴,镍)
一、实验目的与要求:
1.掌握二价铁,钴,镍的还原性和氧化性。
2.掌握铁,钴,镍配合物的生成及性质。
二、教学重点与难点:
掌握二价铁,钴,镍的还原性和氧化性;掌握铁,钴,镍配合物的生成及性质。
三、教学方法与手段:讲授法;演示法
四、教学课时: 4课时
五、课的类型:实验课
六、教学内容:
[实验内容]:
一、铁(II)、钴(II)、镍(II)的化合物的还原性
1、铁(II)的还原性
(1)酸性介质:
往盛有0.5ml氯水的试管中加入3滴6 mol.L-1H2SO4溶液,然后滴加(NH4)2Fe(SO4)2溶液,观察现象,写出反应式:
2Fe2+ + Cl2 === 2Fe3++ 2Cl-
Fe3++nSCN-====[Fe(SCN)n]3-n(血红色)
说明:Fe2+被氧化为Fe3+的现象不明显(淡绿色 黄棕色),可用KSCN检验Fe3+。
亚铁盐一般用硫酸亚铁铵,它稳定,不易分解,为防万一还需要加硫酸。
(2)碱性介质:
在一试管中放入2ml蒸馏水和3滴6mol.L-1H2SO4溶液煮沸,以赶尽溶于其中的空气,然后溶于少量硫酸亚铁铵晶体。
在另一试管中加入3ml 6mol.L-1NaOH溶液煮沸。
冷却后,用一长滴管吸收NaOH溶液,插入(NH4)2Fe(SO4)2溶液到底部,慢慢挤出NaOH,观察产物颜色和状态。
Fe2++2OH- ====Fe(OH)2(为纯白色沉淀)
4Fe(OH)2+O2+2H2O====4Fe(OH)3 (红褐色)
说明:为了得到纯净的白色氢氧化亚铁沉淀,将溶液加热以赶净溶解在其中的氧气。
放置一段时间白色沉淀变为灰绿色,至实验结束也没有变为红褐色。
【现象:沉淀由白变成灰绿色再变成红棕色】
2、钴(II)的还原性
(1)、往盛有CoCl2溶液的试管中加入氯水,观察有何变化两者不反应.
2Co2++Cl2+2H+ 不反应
说明:在酸性溶液中,Co2+比较稳定,不易被氧化。
(2)、在盛有1ml CoCl2溶液的试管中滴入稀NaOH溶液(注:),观察沉淀的生成。
所得沉淀分成两份,一份置于空气中,一份加入新配置的氯水,观察有何变化,第二份留作下面实验用。
①、Co2+ +2OH- ====Co(OH)2↓(粉红色)
②、4Co(OH)2+O2+2H2O====4Co(OH)3↓(棕色)(反应慢)
③、2Co(OH)2+Cl2+2NaOH====2Co(OH)3↓(棕色)+2NaCl (反应快)
说明:①中刚开始生成蓝紫色的沉淀,摇荡后变为粉红色沉淀。
蓝紫色的沉淀可能是因为Co2+结合的水分子少而引起的。
3、镍(II)的还原性
用NiSO4溶液按2(1),(2)实验方法操作,观察现象,第二份沉淀留作下面实验用。
2Ni2++Cl2+2H+ 不反应
Ni2++2OH- ====Ni(OH)2↓(绿色)
Ni(OH)2+O2+H2O 不反应
2Ni(OH)2+Cl2+2NaOH====2Ni(OH)3↓(黑色)+2NaCl (反应慢)
说明:Ni2+比较稳定,不易被氧化,在碱性溶液中也不能被空气中的氧气氧化,只有用强氧化剂Cl2才能使之氧化。
二、铁(III)、钴(III)、镍(III)的化合物的氧化性
(1) 、在前面实验中保留下来的Fe(OH)3、Co(OH)3、Ni(OH)3沉淀中均加入浓盐酸,振荡后各有何变化,并用碘化钾淀粉试纸检验所放出的气体。
Fe(OH)3 + 3HCl === FeCl3 + 3H2O
2Co(OH)3 + 6HCl(浓) === 2CoCl2 + 6H2O + Cl2↑
2Ni(OH)3 + 6HCl(浓)=== 2NiCl2 + 6H2O + Cl2↑
说明:Co(III)、Ni(III)具有强氧化性,氧化Cl放出Cl2,能使湿润的淀粉KI试纸变蓝,再变为无色。
(2)、在上述制得的FeCl3溶液中加入KI溶液,再加入CCl4振荡后观察现象,写出反应方程式。
2Fe3+ +2I- ====2Fe2+ +I2 (CCl4)
说明:在介电常数较大的溶剂中,如不饱和烃、二氧化硫(液态)、醇等,碘呈现棕色或棕红色;而在介电常数较小的溶剂中,如四氯化碳、二硫化碳等,则呈紫色。
碘溶液颜色的不同是由于碘在极性溶剂中形成溶剂化物,而在非极性或极性较低的溶剂内,碘不发生溶剂化作用,溶解的碘以分子状态存在,故溶液的颜色与碘蒸气相同。
三、配合物的生成
1、铁的配合物
(1)、往盛有1毫升亚铁氰化钾溶液的试管中加入约0.5毫升的碘水振荡后,滴入数滴硫酸亚铁铵溶液,观察现象。
此为Fe2+的鉴定反应。
2[Fe(CN)6]4-+I2=====2[Fe(CN)6]3-+2I2
2[Fe(CN)6]3-+3Fe2+ ===Fe3[Fe(CN)6]2(滕氏蓝)
说明:由于配合物的生成,降低了Fe(II)的电极电势,使I2能氧化Fe(II)生成Fe(III):I2+2e =====2I- Eө =0.5355V
[Fe(CN)6]3-+e ====[Fe(CN)6]4-Eө =0.358V
Fe3+ +e ====Fe2+Eө =0.771V
(2)、向盛有1毫升新制(NH4)2Fe(SO4)2溶液的使馆中加入碘水,振荡试管后,将溶液分为两份,各滴入数滴硫氰酸钾溶液,然后向其中一支试管中注入约0.5毫升3%H2O2溶液,观察现象,此为Fe3+的鉴定反应。
Fe2++I2不反应
2Fe2++H2O2+2H+ =====2Fe3++2H2O
3Fe3+ + nSCN- === [Fe(SCN)n]3-n血红色,n值随SCN-的浓度而变化。
说明:目的是用KSCN 检验是否有Fe3+生成,但是,碘水与Fe(SCN)n]3-n的颜色相近,很难区分红色是碘水的颜色还是[Fe(SCN)n]3-n的颜色。
加入H2O2后,有黑色沉淀漂浮在溶液表面,是H2O2把I3-氧化为I2。
(3)、往FeCl3中加入K4[Fe(CN)6]溶液,观察现象。
写出反应方程式。
此为Fe3+的鉴定反应的常用方法:
3[Fe(CN)6]4-+4Fe3+ =====Fe4[Fe(CN)6]3↓(普鲁士蓝)
(4)、向盛有0.5毫升0.2mol/l FeCl3的试管中,滴入浓氨水直至过量,观察沉淀是否溶解:
Fe3++NH3H2O=====Fe(OH)3+3NH4+
说明:Fe(II)、Fe(III)均不形成氨的配合物。
2、钴的配合物
(1)、向盛有1毫升CoCl2溶液的试管中加入少量的硫氰酸钾固体,观察固体周围的颜色,再加入0.5毫升戊醇和0.5毫升乙醚,振荡后观察水相和有机相的颜色。
这个反应可用来鉴定Co2+。
Co2+ +4SCN-=====[Co(SCN)4] 2-(蓝色)K稳=10-3
说明:KSCN晶体周围呈现[Co(SCN)4]2的蓝色,它在水溶液中不稳定易解离,但它溶于丙酮或戊醇,在有机溶剂中比较稳定。
水相中是粉红色。
(2)、向盛有0.5毫升CoCl2溶液滴加浓氨水,直到生成的沉淀刚好溶解为止,静置一段时间后,观察溶液的颜色有何变化。
CoCl2+ NH3H2O=====Co(OH)Cl↓+NH4Cl (NH3·H2O适量)Co(OH)Cl+ 7NH3H2O=====[Co(NH3)6](OH)2(黄色)+NH4Cl (黄色不稳定)4[Co(NH3)6](OH)2+O2+2H2O====4[Co(NH3)6](OH)3 (橙黄色)
说明:[Co(NH3)6]2+不稳定,易氧化成[Co(NH3)6]3+。
这是因为当形成氨合物后,其电极电势发生了很大的变化:
[Co(NH3)6]3++e ======[Co(NH3)6]2+Eө =0.1V
[Co(H2O)6]3+ +e ======[Co(H2O)6]2+Eө =1.84 V
可见,配位前的Eө =1.84 V 降至配位后的Eө =0.1V,说明氧化态为+3的钴由于形成氨配合物而变得相当稳定。
以致空气中O2能把[Co(NH3)6]2+氧化成稳定的[Co(NH3)6]2+。
3、镍的配合物
向盛有2毫升0.1mol/l NiSO4溶液加入6mol/l氨水,观察现象,静置片刻,再观察现象,写出离子反应方程式。
将溶液分为四份:一份加入2mol/lNaOH溶液,一份加入1mol/lH2SO4一份加水稀释,一份煮沸,观察有何变化。
Ni2++6NH3====[Ni(NH3)6]2+ (蓝色)K稳=1.1×108
①、[Ni(NH3)6]2+ +6H+ =====Ni2++6NH4+ (正)
②、[Ni(NH3)6]2+ 2OH- =====Ni(OH)2↓+6NH3↑(由碱生成过来, 不能溶解)
③、2[Ni(NH3)6]SO4+2H2O====Ni2(OH)2SO4↓+10NH3↑+(NH4)2SO4
(稀释只是颜色变淡)
说明:[Ni(NH3)6]2+遇酸、遇碱,遇水稀释,受热均可发生分解反应。
Fe(OH)2(白色) Co(OH)2(粉红色)Ni(OH)2 (绿色)还原性依次减弱Fe(OH)3(棕红色) Co(OH)3(棕色)Ni(OH)3 (黑色)氧化性依次增强。