生物膜离子通道
- 格式:docx
- 大小:15.77 KB
- 文档页数:5

生物膜的通透性生物膜是生物体表面或内部细胞膜的一种特殊结构,它起到分隔和保护细胞的作用。
膜的通透性是指物质在膜上的透过性和选择性。
在生物膜中,通过不同的机制,一些物质可以自由地穿过膜,而其他物质则受到限制。
本文将探讨生物膜的通透性及其机制。
一、细胞膜的结构细胞膜是生物膜中最重要的一种,它包裹和保护着细胞。
细胞膜主要由脂质双层、蛋白质和糖类组成。
脂质双层是由两层脂质分子排列成的,其中疏水性脂质分子朝内,亲水性头基朝外。
蛋白质则嵌在脂质双层中,起到传输物质和细胞识别的作用。
糖类附着在蛋白质或磷脂的头基上,参与细胞信号传导和黏附。
二、生物膜的通透性机制1. 扩散:扩散是一种物质自由从高浓度区域向低浓度区域传播的过程。
小分子化合物,如氧气、二氧化碳和水,可以通过膜的脂质双层进行简单扩散。
这些物质在膜内形成浓度梯度,自动通过膜来达到浓度均衡。
2. 蛋白通道:细胞膜上存在多种特定的蛋白质通道,用于特定物质的跨膜运输。
这些蛋白质通道通常是选择性的,只允许特定类型的离子或分子通过。
例如,钠离子通道和钾离子通道在神经细胞的兴奋传导中起到关键作用。
3. 膜运输蛋白:膜中存在多种膜运输蛋白,它们可以主动地将物质从一个浓度较低的区域转运到浓度较高的区域。
这种运输过程需要能量的消耗,可通过原位合成的ATP或与电化学潜能耦合的转运蛋白完成。
4. 胞吞作用和胞吐作用:胞吞作用是细胞将颗粒状的物质包围并吞噬到细胞内部形成胞吞体,胞吐作用则是将细胞内物质通过囊泡运输到细胞膜并释放到外部。
这种运输机制可以使大分子物质或细胞外颗粒通过细胞膜。
三、膜通透性的调控膜通透性可以通过多种机制进行调控,这些机制可以根据细胞的需求和环境条件来调整膜的通透性。
1. 膜受体的修饰:细胞膜上的受体蛋白质可以通过糖基化、磷酸化等修饰作用来调控物质的识别和结合。
修饰可以增强或抑制受体与特定物质的结合,并改变膜的通透性。
2. 细胞外环境的调节:细胞外环境的pH值、离子浓度、温度等因素都可以影响细胞膜的通透性。
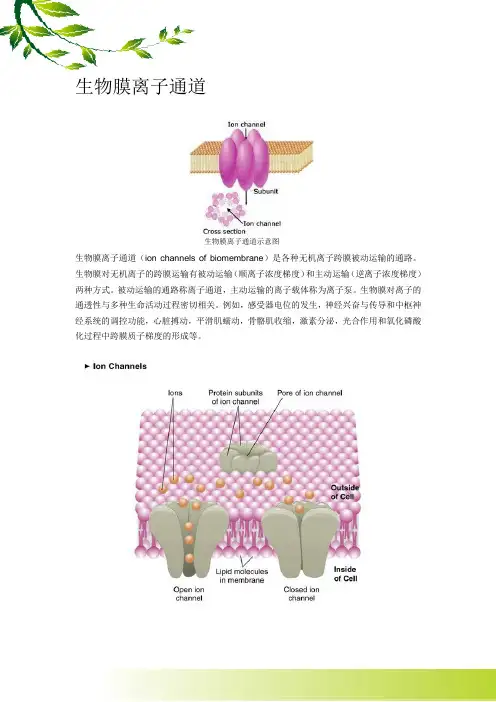
生物膜离子通道生物膜离子通道示意图生物膜离子通道(ion channels of biomembrane)是各种无机离子跨膜被动运输的通路。
生物膜对无机离子的跨膜运输有被动运输(顺离子浓度梯度)和主动运输(逆离子浓度梯度)两种方式。
被动运输的通路称离子通道,主动运输的离子载体称为离子泵。
生物膜对离子的通透性与多种生命活动过程密切相关。
例如,感受器电位的发生,神经兴奋与传导和中枢神经系统的调控功能,心脏搏动,平滑肌蠕动,骨骼肌收缩,激素分泌,光合作用和氧化磷酸化过程中跨膜质子梯度的形成等。
细胞膜离子通道细胞膜上离子通道的功能,除了可以调节细胞内外的渗透压,也是维持细胞膜电位的重要分子,而神经细胞要进行讯号传导,便是靠离子的进出以造成膜电位的变化。
虽然科学家对于细胞膜上离子通道已有相当程度的了解,对于离子通道所具有的特殊选择性,也从能蛋白质的结构大略获得解释,但是一直缺乏一套完整详细的分子作用机制。
原因是,要做出膜蛋白三维结构的高解析度影像,非常不容易。
1998年,麦金农做出了链霉菌的离子通道蛋白质KcsA的高解析三维结构影像,并首度从原子层次去了解离子通道的作用方式。
KcsA离子通道中有一种“滤嘴”,能让钾离子(K+)通过,却不允许同族元素中体积更小的钠离子(Na+)通过,这令科学家百思不得其解。
但是麦金农根据KcsA的立体结构,发现离子通道中“滤嘴”边上的四个氧原子的位置,恰好跟钾离子在水溶液中的情况一样,亦即滤嘴边上的氧与水分子的氧距离相同,所以钾离子能够安然通过通道,一如在水中一样;但钠离子尺寸较小,无法顺利接上滤嘴边上的四个氧原子,因此只能留在水溶液,而无法轻易穿过通道。
而离子通道的开关会受到细胞的控制,麦金农发现,离子通道的底部有个闸门,当离子通道接收到特定的讯号,离子通道蛋白质结构便会发生改变,因此造成闸门的开关。
麦金农对于钾离子通道的结构与作用机制的研究,是生物化学、生物物理等领域的一大突破,也为神经疾病、肌肉与心脏疾病的新药物开发,指引了新的方向。

膜片钳技术的原理及应用(综述)Intro:细胞是构成生物体的基本单位。
细胞内和细胞之间的信号传导的重要途径是通过镶嵌在细胞膜上的离子通道蛋白进行的。
1976年,德国的两位细胞生物学家埃尔温. 内尔(Er win Neher)和贝尔特. 萨克曼(Bert Sakmann)建立了一种以记录通过离子通道的离子电流来反映细胞膜上单一或多数离子通道分子活动的技术,成为膜片钳技术(Patch Clamp)。
这一技术使对细胞电活动的研究精度提高到1pA的电流分辨率,1μm的空间分辨率和10μs的时间分辨率水平,是细胞和分子水平的生理学研究领域的一次革命性突破。
它与基因克隆技术(Gene Cloning)并驾齐驱,推动了生命科学研究的迅速发展。
为此,1991年的诺贝尔医学与生理学奖授予了这两位学者,以表彰他们的突出贡献。
这一能精确描述细胞通道特征的实验方法在问世后的短短十几年时间里,已经在生物学研究领域显示出了非常重要的意义和广阔的应用前景。
一. 膜片钳技术的基本原理膜片钳技术运用微玻管电极(膜片电极或膜片吸管)接触细胞膜,以千兆欧姆[gigaoh m seal,1010欧姆(GΩ)]以上的阻抗使之对接,使与电极尖开口处相接的细胞膜小片区域(膜片)与其周围在电学上分隔,在此基础上固定电位,对此膜片上的离子通道的离子电流(pA级)进行检测记录。
(如图1)图1 膜片钳技术原理图Rs是与膜片阻扰相串联的局部串联电阻(或称入路阻扰),Rseal是封接阻抗。
Rs通常为1-5MΩ,若Rseal高达1 0GΩ以上时成为Ip/I=Rseal/(Rs+Rseal)-1,此Ip可作为在I-V转换器(点线)内的高阻扰反馈电阻(Rf)的电压下降而被检出。
实际上这时场效应管运算放大器(A1)的输出中包括着膜电阻成分,这部分将在通过第二级场管效应运算放大器(A2)时被减掉。
用场效应管运算放大器(图1-A1)构成的I-V转换器[converter,即膜片钳放大器的前级探头(Head stage)]是整个测量回路的核心部分。

组成生物膜的主要成分生物膜是存在于生命体内外的一种特殊结构,由多种生物大分子构成而成,其主要功能是维持细胞结构、调节细胞内外环境和传递信号。
组成生物膜的主要成分有脂质、蛋白质、糖类和核酸等。
脂质是生物膜中最主要的成分之一,它们主要包括磷脂和胆固醇等。
磷脂是一种疏水性的分子,在水中可以自组装成为双层结构,形成生物膜的骨架。
磷脂分子的极性头部和非极性尾部让它们能够在水中形成大片双层结构,使得生物膜成为一个有效的屏障,阻止细胞内外溶质的扩散和运输。
胆固醇是一种人体内生产的甾体物质,也是膜中的重要成分。
它可以插入到生物膜的磷脂双层中,增加膜的稳定性和流动性,维持生物膜和细胞的结构和功能。
蛋白质是生物膜的另一个主要成分,泛指所有嵌入膜中或与膜结合的蛋白质,包括离子通道、受体和转运体等。
离子通道可以通过膜中的水分子形成疏水环境,帮助离子穿越生物膜。
受体可以感知细胞外环境的变化,转发信息并调节细胞内外的生命活动。
转运体可以在膜上形成孔道,使得溶质通过膜而进入或离开细胞,实现物质转运。
糖类是生物膜中的另一个主要组分,它们主要连接在蛋白质或脂质的糖基上,形成糖基化蛋白或糖基化脂质。
这些结构在膜上起着不可或缺的作用,可以帮助细胞与外界环境互动,调节细胞信号传导和免疫反应等。
例如,膜上的糖基化蛋白可以作为免疫识别器官来识别特定分子,促进免疫细胞的攻击和清除;而糖基化脂质则可以作为细胞识别的重要标志,帮助细胞定位和区分。
核酸则是组成生物膜的另一个重要成分。
在细胞膜上附着的核酸分子主要指RNA和DNA。
它们的功能包括传递基因信息、调控基因表达、参与蛋白质合成等。
同时,膜上的核酸分子还可以作为信号转导的重要介质,传递大量的生命活动信息,从而影响细胞的生长、分化和凋亡等。
总而言之,生物膜是一个复杂的结构,由多种生物大分子构成而成。
这些分子之间通过各种机制相互联系,从而形成一个相互依存、相互作用的整体。
生物膜的结构和成分对细胞生命活动至关重要,因此研究生物膜组成及其功能具有重大意义。


离子通道蛋白和载体蛋白(离子泵)的异同相同点:化学本质均为蛋白质、分布均在细胞的膜结构中、都有控制特定物质跨膜运输的功能不同点:1.通道蛋白参与的只是被动运输,在运输过程中并不与被运输的分子结合,也不会移动,并且是从高浓度向低浓度运输,所以运输时不消耗能量。
2.载体蛋白参与的有主动运输和协助扩散,在运输过程中与相应的分子结合,并且会移动。
在主动运输过程中由低浓度侧向高浓度运动,且消耗代谢能量;在协助扩散过程中,由高浓度侧向低浓度侧运动,不消耗代谢能。
(注;协助扩散也属于被动运输)相关资料:1、被动运输的通路称离子通道,主动运输的离子载体称为离子泵。
生物膜对离子的通透性与多种生命活动过程密切相关。
例如,感受器电位的发生,神经兴奋与传导和中枢神经系统的调控功能,心脏搏动,平滑肌蠕动,骨骼肌收缩,激素分泌,光合作用和氧化磷酸化过程中跨膜质子梯度的形成等。
离子通道依据其活化的方式不同,可分两类:一类是电压活化的通道,即通道的开放受膜电位的控制,如Na+、Ca+、Cl-和一些类型的K+通道;另一类是化学物活化的通道,即靠化学物与膜上受体相互作用而活化的通道,如Ach受体通道、氨基酸受体通道、Ca+活化的K+通道等。
2、细胞膜上存在两类主要的转运蛋白,即:载体蛋白(carrier protein)和通道蛋白(channel protein)。
载体蛋白又称做载体(carrier)、通透酶(permease)和转运器(transporter)。
能够与特异性溶质结合,通过自身构象的变化,将与它结合的溶质转移到膜的另一侧。
载体蛋白有的需要能量驱动,如:各类ATP驱动的离子泵;有的则不需要能量,以自由扩散的方式运输物质,如:缬氨酶素。
这里要注意,之所以称为通透酶,是因为它与所运输物质之间有对应关系,特意性强。
通道蛋白与所转运物质之间的结合较弱,它能形成亲水的通道(可以想象为亲水的孔,如porin),当通道打开时能允许特定大小的溶质通过,特异性不如载体蛋白强。

离子通道的工作原理
离子通道是细胞膜上的一类疏水膜蛋白,具有亲水孔道,能够选择性通透不同离子,如K+、Na+、Ca2+、Cl-等。
它们的工作原理主要依赖于跨膜电位的变化。
当离子通道打开时,不同离子会根据其浓度差和电位差通过通道进行移动。
这一过程是由细胞膜内外带电离子的浓度差驱动的。
一旦在细胞膜内外创造出带电离子的浓度差,电位差产生的电场力就可以瞬间驱动离子运动。
不同类型的离子通道对膜电位的变化有不同的反应。
例如,电压门控离子通道的孔道开放与关闭受细胞膜两边的膜电位调节,去极化(膜内电压高于膜外电压)或超极化(膜外电压高于膜内电压)可以调节不同离子通道的开放和关闭。
在神经细胞中,离子通道的开闭影响跨膜电位的变化,从而影响神经信号的传递速度。
例如,钾离子通道的开放有助于钾离子的外流,降低膜电位,而钠离子通道的开放则有助于钠离子的内流,增加膜电位。
这些离子的移动会在很短的时间内引起电信号的变化,进而实现快速神经传导。
综上所述,离子通道通过选择性通透不同离子来实现对细胞膜内外离子平衡的调节,对神经传导、肌肉收缩等生理过程起着关键作用。
如需更具体的信息,建议阅读生物科学类文献或请教专业人士。



离子通道研究进展河北北方学院基础医学院李京泽【摘要】细胞是通过细胞膜与外界隔离的,在细胞膜上有很多种离子通道,细胞通过这些通道与外界进行离子交换。
离子通道在许多细胞活动中都起关键作用,它是生物电活动的基础,在细胞内和细胞间信号传递中起着重要作用。
生物膜对离子的通透性与多种生命活动过程密切相关。
由于离子通道在医学上的重要作用,近年来人们在离子通道上的研究日益加深。
【关键词】离子通道研究进展前景展望活体细胞不停地进行新陈代谢活动,就必须不断地与周围环境进行物质交换,而细胞膜上的离子通道就是这种物质交换的重要途径。
人们已经知道,大多数对生命具有重要意义的物质都是水溶性的,如各种离子,糖类等,它们需要进入细胞,而生命活动中产生的水溶性废物也要离开细胞,它们出入的通道就是细胞膜上的离子通道。
离子通道由细胞产生的特殊蛋白质构成,它们聚集起来并镶嵌在细胞膜上,中间形成水分子占据的孔隙,这些孔隙就是水溶性物质快速进出细胞的通道。
离子通道的活性,就是细胞通过离子通道的开放和关闭调节相应物质进出细胞速度的能力,对实现细胞各种功能具有重要意义。
离子通道的特点和类型离子通道是能选择性的允许某些离子进出细胞的细胞膜孔道,它是跨膜离子转运体系的转运机制之一,离子通道有三个特性:①选择性。
对被转运离子的大小和电荷有高度的选择性,不同的离子通道通过不同的离子。
例如,钾离子通道可以让钾离子以高达每秒108个离子的速率通过,但是略小一点的钠离子却无法通过。
离子通道的这种高度选择性是由通道空间够向的特异性和相对结合强度两方面因素造成的。
②高速运转性。
驱动离子跨膜转运的动力来自于两种因素的结合。
一种是被转运离子的浓度梯度,另一种是跨膜电位差,这种驱动力构成了离子跨膜的电化学梯度,决定了离子跨膜的被动运输方向。
③门控性。
离子通道犹如生物膜上的“分子开关”,具有开放,关闭和失活等状态,这些状态受多种因素的调控,成为各种生理功能的基础和药物作用的靶点。

一.名词解释1.胞间连丝:是指贯穿细胞壁、胞间层,连接相邻细胞原生质体的管状通道。
2.温周期现象与光周期现象:在自然条件下气温是呈周期性变化的,许多生物适应温度的某种节律性变化,并通过遗传成为其生物学特性,这一现象称为温周期现象。
生物在暴露于阳光期间对变化产生的反应,尤指通过生物过程显示出来的反应称光周期现象。
3.质壁分离与质壁分离复原:如果把具有液泡的细胞置于水势较低的溶液中,液泡失水,细胞收缩,体积变小。
由于细胞壁的伸缩性有限,而原生质体的伸缩性较大,随着细胞继续失水,原生质层便和细胞壁分离开来,这种现象被称为质壁分离。
如果把发生了质壁分离的细胞浸在水势较高的稀溶液或清水中,外液中的水分又会进入细胞,液泡变大,整个原生质层很快会恢复原来的状态,重新与细胞壁想贴,这种现象称为质壁分离复原。
4.根系的主动吸水与被动吸水:由根系代谢活动而引起的根系吸水过程称为主动吸水。
由蒸腾拉力引起的根系吸水称为被动吸水。
5.植物的水分临界期与最大需水期:指植物在生命周期中对水分最敏感、最易受伤害的时期。
一般而言,植物水分临界期多处于花粉母细胞四分体形成期,此时若缺水,使性器官发育不正常。
植物的最大需水期指植物生活周期中需水最多的时期。
6.大量元素与微量元素:植物生命活动必需的、且需要量较多的一些元素,它们约占植物体干重的0.01-10%,有C、H、O、N、P、S、K、Ga、Mg等9种元素。
植物生命活动必需的、而需要量很少的一类元素。
它们约占植物体干重的10(-5)-10(-3)%,有Fe、Mn、Zn、Cu、B、Mo、Cl等。
7.RuBP羧化酶与PEP羧化酶:核酮糖二磷酸羧化酶,催化1,5-二磷酸核酮糖和CO2生成二分子甘-3-磷酸甘油酸反应的酶。
亦称羧基歧化酶。
催化以磷酸烯醇型丙酮酸为底物,固定CO2形成草酰乙酸的酶,简称PEP羧化酶8.CO2饱和点与CO2补偿点:光合速率随CO2浓度增高而增加,当光合速率达到最大值时CO2浓度即为CO2饱和点。
工作细胞动作电位产生机制工作细胞动作电位的产生是细胞膜上离子运动的结果,这种运动是由于膜上离子通道的开放或关闭而发生的。
这篇文章将探讨工作细胞动作电位产生机制的基本过程及其控制机制。
1. 膜通道细胞膜是一个由脂质双层构成的包裹细胞的生物膜,它能够限制溶质和离子通过。
但是,膜上有特殊的蛋白质,称为离子通道,它们可以善于特定的离子,并在适当的条件下产生开放或关闭的反应。
这些通道可以分为电压门控离子通道、配体门控离子通道和机械门控离子通道三类。
2. 离子流动当离子通道开放时,离子可以自由地在胞外液和胞内液之间跨越膜,这就形成了离子电流。
离子通过膜的方向,取决于离子的浓度梯度和电位差。
在工作细胞中,离子流动主要是钠离子和钾离子的流动,它们通过不同的通道从胞外进入胞内或从胞内流出胞外。
这种离子流动产生的电势差称为膜电位。
3. 膜电位的变化工作细胞的膜电位是动态变化的,这是由于离子通道的开放和关闭引起的。
例如,当电压门控钠离子通道在兴奋条件下打开时,钠离子从胞外流入胞内,在其开放的位置形成一个高浓度的离子云,这使得靠近通道的区域的膜电位降低。
如果这种情况持续下去,膜电位将会快速变化。
这种突然的电位变化就是工作细胞动作电位的典型表现。
4. 动作电位的传导工作细胞动作电位的传导是由于离子通道的紧密连接和电化学力的作用。
离子通道的开放和关闭是一种协调的过程,它基于离子流动和充电的变化。
这种过程可以形成沿膜表面的离子电流,这种电流会激励邻近的离子通道开放,并使电位从一个位置到另一个位置传导。
这种传导是迅速的,因为离子电流可以通过细胞膜快速地传递,同时离子流动和充电的变化可以很快地改变离子通道的状态。
5. 控制机制工作细胞动作电位的产生和传导是由多种控制机制维持的。
这些机制包括离子通道的特殊结构、阈值和瞬变性,还有膜表面的离子浓度和电化学梯度等等。
此外,许多激素和神经递质可以影响工作细胞动作电位的产生和传导。
例如,去甲肾上腺素可能会保持钠通道关闭并加强钾通道的开放,从而降低膜电位并抑制兴奋性。
铜离子通道一、什么是铜离子通道?铜离子通道是一种膜蛋白通道,使铜离子在生物体内进行跨膜转运。
这种通道具有高度选择性,可以选择性地运输铜离子,同时阻止其他离子的通过。
二、铜离子通道的结构铜离子通道通常由蛋白质组成,具有特定的结构。
铜离子通道的结构可以分为两种主要类型:单纯型和复合型。
2.1 单纯型铜离子通道单纯型铜离子通道由单个蛋白质组成。
这种通道具有相对简单的结构,主要由螺旋、折叠和环状结构组成,形成一个电导孔道,使铜离子能够通过。
2.2 复合型铜离子通道复合型铜离子通道由多个蛋白质组成。
这种通道结构更加复杂,由多个亚单位组装而成,形成一个复合的结构。
每个亚单位在复合通道中担任不同的角色,共同协调铜离子的运输。
三、铜离子通道的功能铜离子通道在生物体内发挥着重要的功能,包括以下几个方面:3.1 调节铜离子浓度铜离子通道能够调节细胞内外的铜离子浓度。
在铜离子过剩的情况下,通道会限制铜离子的进入,防止铜离子过度积累。
而在铜离子不足的情况下,通道会增加通透性,促进铜离子的进入。
3.2 参与铜离子转运铜离子通道是铜离子跨越细胞膜的主要通道。
铜离子在生物体内具有重要的功能,包括参与能量代谢、参与免疫反应等。
铜离子通道的存在能够确保铜离子在细胞内外的有效转运。
3.3 参与氧化还原反应铜离子通道可参与细胞内外的氧化还原反应。
铜离子在还原态和氧化态之间转变,参与多种氧化还原酶的催化反应。
这些酶催化的反应对于维持细胞的正常代谢过程至关重要。
四、铜离子通道的研究进展近年来,对铜离子通道的研究取得了许多重要进展。
以下是一些研究领域和技术:4.1 结构和功能研究通过高分辨率的结构分析技术,研究人员能够揭示铜离子通道的精确结构和功能。
这些研究为深入理解铜离子转运的机制提供了重要的依据。
4.2 蛋白工程技术蛋白工程技术的发展使得研究人员能够对铜离子通道的性质进行修改和改变。
通过改变通道的选择性和活性,可以使其在不同的生物工艺过程中发挥更大的作用。
镁离子通道
镁离子通道是一种由生物膜蛋白组成的离子通道,它可以把镁离子渗透过细胞膜。
镁离子通道由跨膜蛋白组成,跨膜蛋白有两种:P-类镁离子通道和T-类镁离子通道。
P-类镁离子通道是一种不同于其它离子通道的通道,它不依赖ATP,并且能够快速通过低浓度的镁离子。
T-类镁离子通道是一种需要ATP的通道,它可以调节细胞内的镁离子浓度,但它的通速要比P-类镁离子通道慢得多。
镁离子通道在神经系统中有着重要的作用,它可以调节神经元的膜电位,影响神经元信号传导和发放,从而影响神经传导的效率。
此外,镁离子通道也可以调节细胞的代谢和凋亡,对细胞的健康和稳态有着重要作用。
生物膜结构与功能分析生物膜是由生物大分子组成的薄层结构,是细胞外膜、细胞壁和细胞内膜的重要组成部分,也是细菌、真菌和植物细胞等生物体内的关键结构。
生物膜的结构与功能对生物体的生存和发展起着至关重要的作用。
本文将对生物膜的结构和功能进行深入分析。
一、生物膜的结构生物膜由一系列生物分子组成,其中最重要的是脂质类物质、蛋白质和多糖。
不同种类的生物膜中,其中生物大分子的种类和含量都有所不同。
例如,细菌细胞膜主要由磷脂和蛋白质组成,而植物细胞膜则包含磷脂、蛋白质和纤维素等多种物质。
生物膜中最基本的结构单元是磷脂分子。
磷脂是一类由磷酸、甘油和脂肪酸组成的生物大分子,它在生物膜中扮演着重要的角色。
在生物膜中,磷脂分子相互结合形成一个双分子层结构。
其中,分子层中的脂肪酸链群在一起,磷酸基、甘油等则布置在膜层的两侧。
在生物膜中,蛋白质是另一个非常重要的生物大分子。
生物膜中的蛋白质相对于磷脂分子来说,具有更多的种类和更加复杂的结构。
生物膜蛋白质可分为两类:一类是嵌入膜层的膜蛋白,它们的一部分或全部位于磷脂层内;另一类是与膜表面相连的表面蛋白,它们与磷脂分子没有直接的相互作用。
膜蛋白可以通过构成通道和受体等方式实现细胞对外界物质的选择性转运和信号传递等功能。
多糖是生物膜中第三类重要的生物大分子。
多糖是由多种单糖基元组成的较大分子,例如葡萄糖、半乳糖、果糖等。
生物膜中的多糖具有很多功能,例如它们可以增强细胞对离子和大分子的吸附性,帮助稳定生物膜的结构,提供能量和维持生物代谢的平衡等。
二、生物膜的功能生物膜的结构对它的功能有着至关重要的影响。
生物膜通过其结构与调节膜蛋白和磷脂层的多种物质之间的相互作用,从而实现对外部环境的响应与适应。
1.维持细胞内外环境的稳定生物膜通过缩小细胞与外界的接触面积,防止细胞内外物质的充分混合,从而实现对细胞环境的维持与调节。
其中,在生物膜中,磷脂分子是细胞内外之间的物质交换的主要调节者,它可以调节细胞内外离子和小分子物质的浓度差。
离子通道转运体
摘要:
1.离子通道转运体的定义和作用
2.离子通道转运体的种类和结构
3.离子通道转运体在生物体内的功能
4.离子通道转运体在医学和科学研究中的应用
5.离子通道转运体的未来发展前景
正文:
离子通道转运体是一种生物膜蛋白,负责细胞膜上离子的跨膜转运。
离子通道转运体在生物体内起着至关重要的作用,它们参与了细胞内外离子浓度的维持、神经信号传递、肌肉收缩等许多生物过程。
离子通道转运体的种类繁多,根据所转运的离子类型,可以分为钾离子通道转运体、钠离子通道转运体、钙离子通道转运体等。
这些离子通道转运体在结构上具有相似性,通常由一个或多个跨膜域组成,形成通道,允许特定离子通过。
离子通道转运体在生物体内有多种功能,如调节细胞内外离子浓度、维持细胞膜电位、参与神经信号传递等。
例如,钾离子通道转运体在神经细胞中起着稳定细胞膜电位的作用,钙离子通道转运体则参与了肌肉收缩过程。
离子通道转运体在医学和科学研究中具有广泛的应用。
研究离子通道转运体的结构和功能,有助于深入了解许多疾病的发生机制,如心血管疾病、神经系统疾病等。
此外,离子通道转运体还作为药物靶点,用于开发治疗相关疾病
的药物,如抗心律失常药物、镇痛药物等。
随着科学技术的发展,离子通道转运体的研究取得了重要进展。
在未来,离子通道转运体研究将继续深入,有望为疾病的诊断、治疗和预防提供更多新思路。
生物膜离子通道百科名片生物膜离子通道示意图生物膜离子通道(ion channels of biomembrane)是各种无机离子跨膜被动运输的通路。
生物膜对无机离子的跨膜运输有被动运输(顺离子浓度梯度)和主动运输(逆离子浓度梯度)两种方式。
被动运输的通路称离子通道,主动运输的离子载体称为离子泵。
生物膜对离子的通透性与多种生命活动过程密切相关。
例如,感受器电位的发生,神经兴奋与传导和中枢神经系统的调控功能,心脏搏动,平滑肌蠕动,骨骼肌收缩,激素分泌,光合作用和氧化磷酸化过程中跨膜质子梯度的形成等。
目录1111111111展开生物膜离子通道简介活体细胞不停地进行新陈代谢活动,就必须不断地与周围环境进行物质交换,而细胞膜上的离子通道就是这种物质交换的重要途径.人们已经知道,大多数对生命具有重要意义的物质都是水溶性的,如各种离子,糖类等,它们需要进入细胞,而生命活动中产生的水溶性废物也要离开细胞,它们出入的通道就是细胞膜上的离子通道. 离子通道由细胞产生的特殊蛋白质构成,它们聚集起来并镶嵌在细胞膜上,中间形成水分子占据的孔隙,这些孔隙就是水溶性物质快速进出细胞的通道.离子通道的活性,就是细胞通过离子通道的开放和关闭调节相应物质进出细胞速度的能力,对实现细胞各种功能具有重要意义.两名德国科学家埃尔温·内尔和贝尔特·扎克曼即因发现细胞内离子通道并开创膜片钳技术而获得1991年的诺贝尔生理学奖.研究简史在生物电产生机制的研究中发现了对离子通透性的变化。
1902年J.伯恩斯坦在他的膜学说中提出神经细胞膜对钾离子有选择通透性。
1939年A.L.霍奇金与A.F.赫胥黎用微电极插入枪乌贼巨神经纤维中,直接测量到膜内外电位差。
1949年 A.L.霍奇金和B.卡茨在一系列工作基础上提出膜电位离子假说,认为细胞膜动作电位的发生是膜对纳离子通透性快速而特异性地增加,称为“钠学说”。
尤其重要的是,1952年A.L.霍奇金和 A.F.赫胥黎用电压钳技术在巨神经轴突上对细胞膜的离子电流和电导进行了细致地定量研究,结果表明Na+和K+的电流和电导是膜电位和时间的函数,并首次提出了离子通道的概念。
他们的模型(H-H模型)认为,细胞膜的K+通道受膜上4个带电粒子的控制,当4个粒子在膜电场作用下同时移到某一位置时,K+才能穿过膜。
另一方面,1955年,卡斯特罗和B.卡茨对神经-肌肉接头突触传递过程的研究发现:突触后膜终板电位的发生,是由于神经递质乙酰胆碱(Ach)作用于终板膜上受体的结果,从而确认了受化学递质调控的通道。
60年代,用各种生物材料对不同离子通透性的研究表明,各种离子在膜上各自有专一性的运输机构,曾经提出运输机构是载体、洞孔和离子交换等模型。
1973年和1974年,C.M.阿姆斯特朗、F.贝萨尼利亚及R.D.凯恩斯、E.罗贾斯两组分别在神经轴突上测量到与离子通道开放相关的膜内电荷的运动,称为门控电流,确认了离子通道的开放与膜中带电成分运动的依从性。
1976年 E.内尔和B.萨克曼创立了离子单通道电流记录技术,并迅速得到推广应用,近年用这种技术发现了一些新型离子通道,为深入研究通道的结构和功能提供了有力的工具。
80年代初,学者们先后从细胞膜上分离和纯化了一些运输离子的功能性蛋白质,并在上成功地重建了通道功能,从而肯定了离子通道实体就是膜上一些特殊蛋白质分子或其复合物。
近年,科学家应用基因重组技术研究的结构,1982和1984年,纽莫及合作者先后测定了N型Ach受体和Na+通道蛋白的氨基酸序列。
研究方法离子通道结构和功能的研究需综合应用各种技术,包括:电压和电流钳位技术、单通道电流记录技术、通道蛋白分离、纯化等生化技术、人工膜离子通道重建技术、通道药物学、基因重组技术及一些物理和化学技术。
电压钳位技术一般而言,膜对某种离子通透性的变化是膜电位和时间的函数。
通过玻璃微电极与细胞膜之间形成紧密封接,利用电子学技术施加一跨膜电压并把膜电位固定于某一数值,可以测定该膜电位条件下离子电流随时间变化的动态过程。
利用药物或改变细胞内外的溶液成分,使其他离子通道失效,即可测定被研究的某种离子通道的功能性参量,分析离子电流的稳态和动力学与膜电位、离子浓度等之间的关系,可推断该种通道的电导、活化和失活速率、离子选择性等,并能测量和分析通道的门控电流的特性。
单通道电流记录技术又称膜片钳位技术,用特制的玻璃微吸管吸附于细胞表面,使之形成10~100GΩ的密封(giga-seal),被孤立的小膜片面积为μm2量级,内中仅有少数离子通道。
然后对该膜片实行电压钳位,可测量单个离子通道开放产生的pA(10-12安培)量级的电流,这种通道开放是一种随机过程。
通过观测单个通道开放和关闭的电流变化,可直接得到各种离子通道开放的电流幅值分布、开放几率、开放寿命分布等功能参量,并分析它们与膜电位、离子浓度等之间的关系。
还可把吸管吸附的膜片从细胞膜上分离出来,以膜的外侧向外或膜的内侧向外等方式进行实验研究。
这种技术对小细胞的电压钳位、改变膜内外溶液成分以及施加药物都很方便。
通道药物学研究应用电压钳位或单通道电流记录技术,可分别于不同时间、不同部位(膜内侧或外侧)施用各种浓度的药物,研究它们对通道各种功能的影响。
结合对药物分子结构的了解,不但可以深入了解药物和毒素对人和动物生理功能作用的机制,还可以从分子水平得到通道功能亚单位的类型和构象等信息。
通道蛋白分离、通道重建和基因重组技术利用与通道特异结合的毒剂标记,可把通道蛋白质从膜上分离下来,经过纯化,可以测定各亚单位多肽的分子量。
然后,把它们加入人工膜,可重新恢复通道功能。
用于确定蛋白质氨基酸序列的基因重组技术的程序是:从细胞中分离出含有与该种通道蛋白相关的mRNA,置入某种细胞(如大肠杆菌),经逆转录得到cDNA。
用限制性内切酶将cDNA切割成特定片段,再用核酸杂交方法钓出特定的DNA并克隆化。
通过测定阳性克隆DNA的核苷酸顺序,推断出相应的蛋白质氨基酸序列。
类型和功能特征离子通道依据其活化的方式不同,可分两类:一类是电压活化的通道,即通道的开放受膜电位的控制,如Na+、Ca+、Cl-和一些类型的K+通道;另一类是化学物活化的通道,即靠化学物与膜上受体相互作用而活化的通道,如Ach受体通道、氨基酸受体通道、Ca+活化的K+通道等。
钠通道各种生物材料中,与电兴奋相关的Na+通道有相似的基本特征。
通道活化时间常数小于1毫秒,失活时间常数为数毫秒,Na+电流的反转电位约+55毫伏。
单通道电流记录显示,Na+单通道电导为4~20pS,平均开放寿命数毫秒。
根据一些药物和毒素对Na+通道功能的不同影响,可分为4种类型:①通道阻断剂,如河豚毒素(TTX)、石房蛤毒素(STX)。
②通道活化增强剂,如β-蝎毒、箭毒蛙毒素(BTX)、藜芦碱毒素(VER)等。
③通道活化抑制剂,如一些局部麻醉剂及其衍生物。
④通道失活抑制剂,如链霉蛋白酶、N-溴乙酰胺(NBA)等。
钾通道根据功能特性的不同,K+通道可分为以下类型:①慢(延迟)K+通道(K通道),也就是H-H模型中的K+通道。
单通道电流记录显示,单个K通道电导在2~20pS,通道平均开放寿命为数十毫秒。
该种通道可被四乙胺(TEA)等特异性阻断,通道对K+有高度选择性,但R姾和NH嬃亦能通过,这种通道在神经轴突和骨骼肌细胞膜中有较高密度。
②快(早期)K+通道(A通道),该种通道外向的K+流在膜去极化的早期就出现,表明通道的活化时间常数比慢K+通道小得多,但在-40毫伏以上该通道即关闭。
电压钳位实验表明,其宏观电流动力学与Na+电流相似。
较低浓度的4-氨基吡啶即能阻断该通道,它也可被四乙胺阻断。
③Ca2+活化的K+通道〔K(Ca)通道〕,该种通道的开放,不但与膜电位有关,而且依赖于细胞内Ca2+的浓度,每个通道需结合两个Ca2+才能活化。
单通道电导可高达300pS,并有较长的开放寿命,这种通道与Ca2+通道协同作用,对调节细胞膜电兴奋性的节律有重要意义。
它可被四乙胺、N'-四乙酸(EGTA)、奎尼丁和Ba2+阻断。
④内向整流的K+通道,其特征是:在膜超极化时通道开放与膜电位和胞外K+浓度密切相关,通道开放时产生内向K+电流,单通道电导在5~10pS范围。
钙通道Ca2+通道广泛存在于各种生物组织的细胞膜中。
宏观的Ca2+电流动力学特征与Na2+电流相似,但峰值小且失活过程慢,可达数十到数百毫秒。
Ca2+通道对Ca2+、Ba2+、Sr2+都有高通透性,但Ni2+、Cd2+、Co2+、Mn2+等离子能有效地阻断Ca2+通道。
药物对Ca2+通道的作用可分为:①通道阻断或抑制剂,可分为苯烷基胺类(如异博定、甲基异博定D600)、苯硫氮类、双氢吡啶类等类型。
②通道激活剂,一些双氢吡啶化合物如BayK8644等药物可活化Ca2+通道。
近年,对小鸡背根神经节细胞的研究发现有3种类型的Ca2+通道:①L型,该种通道在膜电位大于-20毫伏时活化,电流失活缓慢。
单通道电导约25pS。
②T型,膜电位约-60毫伏时通道即活化,-10毫伏以上通道电流幅值反而下降,单通道电导约8pS。
③N型,该种通道在膜电位不小于-10毫伏才能活化,但又必须超极化到-80毫伏以下才能克服通道的失活。
电流动力学比L 型快但比T型慢,单通道电导约13pS。
以上3类Ca2+通道在不同细胞膜上选择性分布及密度的差别,将影响各种细胞的生理功能。
Ca2+通道除了对细胞电兴奋性有贡献外,它通过调节细胞内Ca2+浓度,可进一步调节许多细胞功能。
N型乙酰胆碱受体通道它是由神经递质Ach活化的正离子通道。
当突触前膜一次量子化释放数千个Ach 分子,它们作用于突触后膜上的N型受体时,受体通道开放,产生Na+和K+电流,引发突触后膜一个小终板电位(mEPP)。
N-AchR单通道电导在20~60pS范围,平均开放寿命数毫秒,通道电流反转电位约-10毫伏,近年发现该种通道有多种电导态(见图)。
通道的离子选择性较差,可允许数十种无机和有机正离子通过,许多毒素和有机物能阻断或抑制该种通道,α-银环蛇毒(α-BGTX)是N型Ach受体通道的特异性阻断剂。
80年代以来,已发现多种由神经递质和激素活化的受体通道,如谷氨酸受体通道、多巴胺受体通道、5-羟色胺受体通道、γ-氨基丁酸受体通道等。
分子构象和门控动力学离子通道研究的前沿是试图从分子水平揭示通道蛋白的空间构象、构象变化与通道门控动力学之间的关系。
N-AchR通道已测定了受体蛋白质分子量是250000,并测定了它的全部氨基酸序列,确证该受体通道由、α、γ和δ5个亚基组成,这4种亚基有相似的氨基酸顺序,但只有α亚基上有α-BGTX的特异结合位点。
一种构象模型是:5个亚基各有若干个α螺旋跨膜排列,共同形成五瓣状的蛋白质复合物,两个α亚基间是亲水的离子通道,通道开口约25埃,中间是6~7埃的狭窄孔道,其中排列有负电性氨基酸残基侧链。