生物膜离子通道
- 格式:docx
- 大小:15.64 KB
- 文档页数:9

细胞膜离子通道机制分析细胞膜离子通道是一种能够通过细胞膜进行离子传输的蛋白质,其结构和功能都非常关键。
在生物体内,细胞膜离子通道能够调控细胞的离子平衡、神经信号传递、肌肉收缩等多种生理过程,因此其机制的研究具有重要意义。
本文就细胞膜离子通道的结构、功能和调控机制进行分析。
一、细胞膜离子通道的结构细胞膜离子通道是一种膜蛋白,其分子结构主要由四个亚单位组成。
这些亚单位在细胞膜上形成一个长而细长的通道,其中心区域形成了一个离子通道。
这个通道内侧是一个负载着离子的位置,而通道外侧则是一个分子空间。
离子通过这个通道从一个空间传输到另一个空间。
不同的离子通道具有不同的选择性,其中一些仅允许一种离子通过,而其他离子通道则具有更大的选择性,可以容纳多种不同的离子传输。
二、细胞膜离子通道的功能细胞膜离子通道能够在医学和生物学领域发挥非常重要的作用。
这种蛋白质可以通过控制细胞的电位和离子浓度来调节细胞内外的离子平衡。
例如,细胞膜钾通道能够控制神经传递,这是神经系统正常功能的关键。
另外,钠通道和钾通道的不同选择性可以控制肌肉收缩和心跳的节律。
除此之外,细胞膜离子通道还有其他不同的功能,如调节光敏;控制细胞的酸碱平衡;促进钙的进入和出入等。
三、细胞膜离子通道的调节细胞膜离子通道的活性可以受到多种调节,包括电压、细胞内和外部的离子浓度、药物和其他分子等。
例如,钠通道的活性会受到细胞内钠离子浓度的调节,而钾通道则会受到钾离子和酸碱平衡的影响。
此外,药物也可以通过影响细胞膜离子通道的结构和活性来产生不同的作用。
例如,利多卡因就是通过阻断细胞膜钠通道的活性来产生局麻作用的。
总之,细胞膜离子通道具有非常重要的生理功能,其结构、功能和调节机制正在被广泛研究。
通过深入理解细胞膜离子通道的机制和作用,我们可以更好地了解生物体内离子平衡和神经传导的规律,为人类健康和药物研究提供更有效的方法和手段。
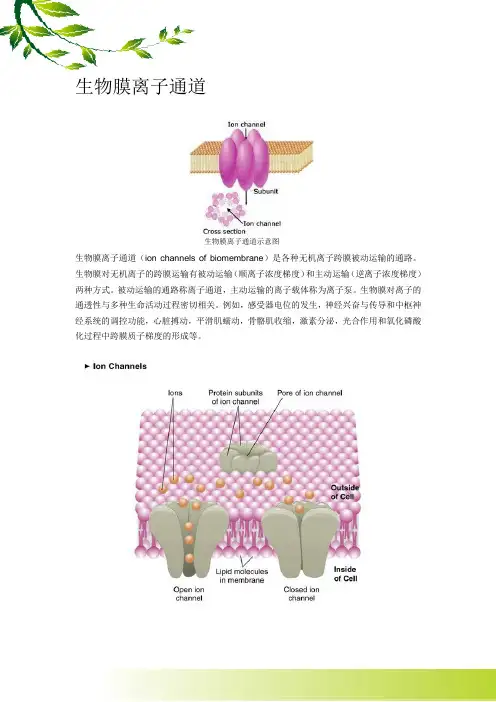
生物膜离子通道生物膜离子通道示意图生物膜离子通道(ion channels of biomembrane)是各种无机离子跨膜被动运输的通路。
生物膜对无机离子的跨膜运输有被动运输(顺离子浓度梯度)和主动运输(逆离子浓度梯度)两种方式。
被动运输的通路称离子通道,主动运输的离子载体称为离子泵。
生物膜对离子的通透性与多种生命活动过程密切相关。
例如,感受器电位的发生,神经兴奋与传导和中枢神经系统的调控功能,心脏搏动,平滑肌蠕动,骨骼肌收缩,激素分泌,光合作用和氧化磷酸化过程中跨膜质子梯度的形成等。
细胞膜离子通道细胞膜上离子通道的功能,除了可以调节细胞内外的渗透压,也是维持细胞膜电位的重要分子,而神经细胞要进行讯号传导,便是靠离子的进出以造成膜电位的变化。
虽然科学家对于细胞膜上离子通道已有相当程度的了解,对于离子通道所具有的特殊选择性,也从能蛋白质的结构大略获得解释,但是一直缺乏一套完整详细的分子作用机制。
原因是,要做出膜蛋白三维结构的高解析度影像,非常不容易。
1998年,麦金农做出了链霉菌的离子通道蛋白质KcsA的高解析三维结构影像,并首度从原子层次去了解离子通道的作用方式。
KcsA离子通道中有一种“滤嘴”,能让钾离子(K+)通过,却不允许同族元素中体积更小的钠离子(Na+)通过,这令科学家百思不得其解。
但是麦金农根据KcsA的立体结构,发现离子通道中“滤嘴”边上的四个氧原子的位置,恰好跟钾离子在水溶液中的情况一样,亦即滤嘴边上的氧与水分子的氧距离相同,所以钾离子能够安然通过通道,一如在水中一样;但钠离子尺寸较小,无法顺利接上滤嘴边上的四个氧原子,因此只能留在水溶液,而无法轻易穿过通道。
而离子通道的开关会受到细胞的控制,麦金农发现,离子通道的底部有个闸门,当离子通道接收到特定的讯号,离子通道蛋白质结构便会发生改变,因此造成闸门的开关。
麦金农对于钾离子通道的结构与作用机制的研究,是生物化学、生物物理等领域的一大突破,也为神经疾病、肌肉与心脏疾病的新药物开发,指引了新的方向。

组成生物膜的主要成分生物膜是存在于生命体内外的一种特殊结构,由多种生物大分子构成而成,其主要功能是维持细胞结构、调节细胞内外环境和传递信号。
组成生物膜的主要成分有脂质、蛋白质、糖类和核酸等。
脂质是生物膜中最主要的成分之一,它们主要包括磷脂和胆固醇等。
磷脂是一种疏水性的分子,在水中可以自组装成为双层结构,形成生物膜的骨架。
磷脂分子的极性头部和非极性尾部让它们能够在水中形成大片双层结构,使得生物膜成为一个有效的屏障,阻止细胞内外溶质的扩散和运输。
胆固醇是一种人体内生产的甾体物质,也是膜中的重要成分。
它可以插入到生物膜的磷脂双层中,增加膜的稳定性和流动性,维持生物膜和细胞的结构和功能。
蛋白质是生物膜的另一个主要成分,泛指所有嵌入膜中或与膜结合的蛋白质,包括离子通道、受体和转运体等。
离子通道可以通过膜中的水分子形成疏水环境,帮助离子穿越生物膜。
受体可以感知细胞外环境的变化,转发信息并调节细胞内外的生命活动。
转运体可以在膜上形成孔道,使得溶质通过膜而进入或离开细胞,实现物质转运。
糖类是生物膜中的另一个主要组分,它们主要连接在蛋白质或脂质的糖基上,形成糖基化蛋白或糖基化脂质。
这些结构在膜上起着不可或缺的作用,可以帮助细胞与外界环境互动,调节细胞信号传导和免疫反应等。
例如,膜上的糖基化蛋白可以作为免疫识别器官来识别特定分子,促进免疫细胞的攻击和清除;而糖基化脂质则可以作为细胞识别的重要标志,帮助细胞定位和区分。
核酸则是组成生物膜的另一个重要成分。
在细胞膜上附着的核酸分子主要指RNA和DNA。
它们的功能包括传递基因信息、调控基因表达、参与蛋白质合成等。
同时,膜上的核酸分子还可以作为信号转导的重要介质,传递大量的生命活动信息,从而影响细胞的生长、分化和凋亡等。
总而言之,生物膜是一个复杂的结构,由多种生物大分子构成而成。
这些分子之间通过各种机制相互联系,从而形成一个相互依存、相互作用的整体。
生物膜的结构和成分对细胞生命活动至关重要,因此研究生物膜组成及其功能具有重大意义。


离子通道的工作原理
离子通道是细胞膜上的一类疏水膜蛋白,具有亲水孔道,能够选择性通透不同离子,如K+、Na+、Ca2+、Cl-等。
它们的工作原理主要依赖于跨膜电位的变化。
当离子通道打开时,不同离子会根据其浓度差和电位差通过通道进行移动。
这一过程是由细胞膜内外带电离子的浓度差驱动的。
一旦在细胞膜内外创造出带电离子的浓度差,电位差产生的电场力就可以瞬间驱动离子运动。
不同类型的离子通道对膜电位的变化有不同的反应。
例如,电压门控离子通道的孔道开放与关闭受细胞膜两边的膜电位调节,去极化(膜内电压高于膜外电压)或超极化(膜外电压高于膜内电压)可以调节不同离子通道的开放和关闭。
在神经细胞中,离子通道的开闭影响跨膜电位的变化,从而影响神经信号的传递速度。
例如,钾离子通道的开放有助于钾离子的外流,降低膜电位,而钠离子通道的开放则有助于钠离子的内流,增加膜电位。
这些离子的移动会在很短的时间内引起电信号的变化,进而实现快速神经传导。
综上所述,离子通道通过选择性通透不同离子来实现对细胞膜内外离子平衡的调节,对神经传导、肌肉收缩等生理过程起着关键作用。
如需更具体的信息,建议阅读生物科学类文献或请教专业人士。



生物膜的功能主治概述生物膜是一种多细胞生物内部或外部形成的薄膜结构,由细胞颗粒、细胞外基质、细胞外气膜等组成。
生物膜在维持生物体正常功能方面起着至关重要的作用。
本文将介绍生物膜的功能主治,包括保护作用、细胞识别与信号传导、选择性通透性、附着能力等。
保护作用生物膜作为细胞的外部屏障,能有效保护细胞免受外界环境的损害。
以下是生物膜保护作用的几个方面:•防止物质和溶剂的扩散:生物膜的疏水性使其具有隔离功能,能够防止溶质和溶剂自由扩散,从而维持细胞内外环境的稳定。
•防止病原菌的侵入:某些生物膜能够有效阻止病原菌的侵入,起到保护机体免受感染的作用。
•防止机械损伤:生物膜可以像一个“波浪墙”一样,吸收外界的冲击力,从而减少细胞受到机械损伤的可能。
细胞识别与信号传导生物膜在细胞间的识别与信号传导中发挥着重要作用。
以下是生物膜在细胞识别和信号传导中的几个方面:•细胞间相互识别:生物膜上的特定蛋白质可以与其他细胞表面的配体结合,从而实现细胞间的识别和相互作用。
•信号传导:生物膜上的受体蛋白可以感知外界信号,并将其转化为细胞内信号传递的起始点。
这一过程对于细胞正常的生长和发育至关重要。
•细胞黏附和运动:生物膜上的一些黏附蛋白可以帮助细胞附着在其他细胞或基质上,从而促进细胞的聚集和组织形成。
选择性通透性生物膜具有一定的选择性通透性,能够对物质的进出进行调控。
以下是生物膜的选择性通透性的几个方面:•单一物质的通透性:生物膜上的蛋白质和脂质可以形成通道或载体,使得特定物质能够通过生物膜进入或离开细胞。
•对离子的调节:生物膜上的离子通道能够调控细胞内外离子的浓度差,维持细胞膜的稳态。
•对水分的调控:生物膜上的水分通道可以调节细胞内外水分的平衡,防止细胞膜因水分过多或过少而发生损伤。
附着能力生物膜具有较强的附着能力,能够固定在细胞或基质表面。
以下是生物膜的附着能力的几个方面:•胞外基质的合成:生物膜上的细胞能够产生胞外基质,将其固定在细胞或基质表面,从而形成具有附着能力的生物膜。

一.名词解释1.胞间连丝:是指贯穿细胞壁、胞间层,连接相邻细胞原生质体的管状通道。
2.温周期现象与光周期现象:在自然条件下气温是呈周期性变化的,许多生物适应温度的某种节律性变化,并通过遗传成为其生物学特性,这一现象称为温周期现象。
生物在暴露于阳光期间对变化产生的反应,尤指通过生物过程显示出来的反应称光周期现象。
3.质壁分离与质壁分离复原:如果把具有液泡的细胞置于水势较低的溶液中,液泡失水,细胞收缩,体积变小。
由于细胞壁的伸缩性有限,而原生质体的伸缩性较大,随着细胞继续失水,原生质层便和细胞壁分离开来,这种现象被称为质壁分离。
如果把发生了质壁分离的细胞浸在水势较高的稀溶液或清水中,外液中的水分又会进入细胞,液泡变大,整个原生质层很快会恢复原来的状态,重新与细胞壁想贴,这种现象称为质壁分离复原。
4.根系的主动吸水与被动吸水:由根系代谢活动而引起的根系吸水过程称为主动吸水。
由蒸腾拉力引起的根系吸水称为被动吸水。
5.植物的水分临界期与最大需水期:指植物在生命周期中对水分最敏感、最易受伤害的时期。
一般而言,植物水分临界期多处于花粉母细胞四分体形成期,此时若缺水,使性器官发育不正常。
植物的最大需水期指植物生活周期中需水最多的时期。
6.大量元素与微量元素:植物生命活动必需的、且需要量较多的一些元素,它们约占植物体干重的0.01-10%,有C、H、O、N、P、S、K、Ga、Mg等9种元素。
植物生命活动必需的、而需要量很少的一类元素。
它们约占植物体干重的10(-5)-10(-3)%,有Fe、Mn、Zn、Cu、B、Mo、Cl等。
7.RuBP羧化酶与PEP羧化酶:核酮糖二磷酸羧化酶,催化1,5-二磷酸核酮糖和CO2生成二分子甘-3-磷酸甘油酸反应的酶。
亦称羧基歧化酶。
催化以磷酸烯醇型丙酮酸为底物,固定CO2形成草酰乙酸的酶,简称PEP羧化酶8.CO2饱和点与CO2补偿点:光合速率随CO2浓度增高而增加,当光合速率达到最大值时CO2浓度即为CO2饱和点。


细胞膜离子通道的结构与功能细胞膜离子通道是一种膜蛋白,它通过细胞膜中的离子通道使离子在细胞膜上跨膜。
细胞膜离子通道可以根据其通透性和区分度被分为很多不同类型,包括钾离子通道、钠离子通道和氯离子通道等。
钾离子通道通过调节细胞的内外钾离子浓度和电位水平来控制许多生理生化过程。
钠离子通道可以影响神经肌肉细胞的动作电位,这对于神经传导非常重要。
氯离子通道在电动势调制中也起着重要的作用。
细胞膜离子通道的特殊性质大大增强了细胞对于不同的磁场、电场和其他刺激源的响应能力,并且对于人类健康和疾病的发生和进展也具有很大的影响。
一、细胞膜离子通道的基本结构细胞膜离子通道由一些单独的蛋白亚单位组成,它们通过与细胞膜中的脂质相互作用来形成细胞膜上的特异性孔道。
细胞膜离子通道主要由四个或五个轴突结构域组成。
每个结构域包含六个横式跨膜α螺旋,其中第四个α螺旋称为“色胺酸残基”,这个位置可以灵活转换造成离子通道的开放和关闭。
另外,细胞膜离子通道通常和一些调节因子和离子结合来形成复杂的膜蛋白,这些因子为它们对离子的通透性和特异性选择起到至关重要的作用。
细胞膜内面的大部分离子通道都是可打开的,而这种开启和关闭可以通过刺激信号、分子绑定、电化学影响、机械力等多种因素调节。
有些离子通道可以随着时间的推移发生“失活”或“不激活”,这导致它们对离子数量和流通率的影响发生改变。
二、细胞膜离子通道的功能细胞膜离子通道在许多细胞重要的生理生化过程中发挥了作用。
例如,在肌肉细胞中,钙离子和钾离子的通道通过细胞膜的电位差联合来调节细胞肌肉收缩。
在神经元中,钠离子和钾离子的通道通过细胞膜内的电势差调节神经元的动作电位。
在胰岛细胞中,钙离子和钾离子的通道在胰岛素的分泌过程中发挥关键的作用。
除此之外,还有一些离子通道的活动还可以通过信号转导机制调节在细胞分化、增殖、凋亡、细胞周期、固态化和因子释放等方面。
可以说,细胞膜离子通道的开放和关闭对于机体的正常代谢和生物学等生理过程的控制有着极为重要的影响。
离子通道在细胞功能调节中的作用细胞是生物体最基本的结构单元。
通过细胞内各种化学反应的发生,维持着生物体内稳定有序的运转。
而这些化学反应能够顺利进行的前提,就是需要保持细胞内外环境的电位平衡和离子浓度平衡。
而这些平衡状态,依赖于细胞膜上的离子通道。
本文将从离子通道的定义、类型、电势依赖性以及功能等方面,来介绍离子通道在细胞功能调节中的作用。
一、离子通道的定义和类型细胞膜上存在大量的蛋白质通道,可以让离子在细胞膜两侧之间进行转运。
而离子通道则是一种具有高度特异性的通道蛋白。
通道蛋白是由完全足够的氨基酸序列形成的一个或多个亚单位的超大分子。
离子通道分为离子选择性通道和非选择性通道两类。
离子选择性通道根据通过通道的离子类型,又可分为钾通道、钠通道、钙通道等。
非选择性通道则包括压敏离子通道和氨基酸敏感离子通道等。
压敏离子通道因其响应机制与压力有关,被广泛应用于传感和机械感受领域。
而氨基酸敏感离子通道因其响应机制与氨基酸结合有关,主要参与感觉系统的功能调节。
二、离子通道的电势依赖性离子通道能够实现离子的选择性导通,是因为其对于特定离子具有较高的亲和力。
而在细胞内外环境之间存在一定的电势差,采用正电荷离子如钠离子从高电势端向低电势端运动,采用负电荷离子如钾离子则相反。
因此,离子通道的开放和关闭与细胞膜电势状态密切相关,称为电势依赖性。
离子通道的电势依赖性和离子选择性,是细胞内外环境之间进行离子转运的决定性因素。
细胞膜电位的变化可以导致离子通道的状态发生改变,这种状态改变对离子浓度的控制起到了重要的作用。
三、离子通道在细胞功能调节中的作用十分重要。
细胞膜上的离子通道不仅负责实现细胞内外环境的电位平衡和离子浓度平衡,而且也直接参与了细胞内信号的传递和细胞膜上的各种膜电位变化。
细胞在代谢过程中,会产生一些物质,这些物质可以扮演的信号分子,使细胞膜上的离子通道开放和关闭,传递相关的信号信息。
此外,离子通道也参与到神经传递中。
离子通道转运体
摘要:
1.离子通道转运体的定义和作用
2.离子通道转运体的种类和结构
3.离子通道转运体在生物体内的功能
4.离子通道转运体在医学和科学研究中的应用
5.离子通道转运体的未来发展前景
正文:
离子通道转运体是一种生物膜蛋白,负责细胞膜上离子的跨膜转运。
离子通道转运体在生物体内起着至关重要的作用,它们参与了细胞内外离子浓度的维持、神经信号传递、肌肉收缩等许多生物过程。
离子通道转运体的种类繁多,根据所转运的离子类型,可以分为钾离子通道转运体、钠离子通道转运体、钙离子通道转运体等。
这些离子通道转运体在结构上具有相似性,通常由一个或多个跨膜域组成,形成通道,允许特定离子通过。
离子通道转运体在生物体内有多种功能,如调节细胞内外离子浓度、维持细胞膜电位、参与神经信号传递等。
例如,钾离子通道转运体在神经细胞中起着稳定细胞膜电位的作用,钙离子通道转运体则参与了肌肉收缩过程。
离子通道转运体在医学和科学研究中具有广泛的应用。
研究离子通道转运体的结构和功能,有助于深入了解许多疾病的发生机制,如心血管疾病、神经系统疾病等。
此外,离子通道转运体还作为药物靶点,用于开发治疗相关疾病
的药物,如抗心律失常药物、镇痛药物等。
随着科学技术的发展,离子通道转运体的研究取得了重要进展。
在未来,离子通道转运体研究将继续深入,有望为疾病的诊断、治疗和预防提供更多新思路。
细胞膜离子通道的结构与功能分析细胞膜离子通道是细胞膜上具有选择性通透特定离子的蛋白质通道,它是控制细胞内离子稳态和神经、心肌等细胞兴奋性和肌肉收缩等生理功能的主要机制。
近年来,离子通道的结构和调控机制的深入研究,为了解许多神经系统疾病、代谢性疾病等提供了重要的信息。
下面将从结构和功能两个方面来分析细胞膜离子通道。
结构分析1. 离子通道蛋白的基本组成离子通道蛋白的基本组成由四个同源亚基组成的单体或多聚物,每个亚基包括约300-400个氨基酸残基,其中包含6个跨越膜的α螺旋,它们形成一个α螺旋通道。
离子通道蛋白不仅在氨基酸序列上具有相似性,而且在二级和三级结构上也非常相似。
在细胞膜上的位置不同,离子通道蛋白可分为一类、二类、三类和四类。
2. 离子通道蛋白的跨膜结构离子通道蛋白的跨越膜结构具有各种特殊的性质,如跨膜α螺旋的长度、形状和分布、跨膜α螺旋之间的构象相互依存关系以及跨膜氨基酸的沿膜面分布等。
这些结构特征决定了离子通道蛋白的对特定离子选择通透性。
3. 离子通道蛋白的分子结构离子通道蛋白的分子结构在晶体结构和电镜结构上得到了深入的研究。
以电镜技术为代表的单粒子分析技术在研究离子通道蛋白的分子结构方面发挥了重要作用。
通过单粒子分析,我们可以了解离子通道蛋白的三维结构、不同构象和亚基构成等信息。
功能分析1. 离子通道在调节生理功能中的作用离子通道在调节生理功能中发挥了重要作用。
它们可以控制神经元、心肌细胞和平滑肌细胞等的兴奋性和肌肉收缩,还可以调节胰岛素分泌和肾脏功能,参与酸碱平衡、水盐平衡、细胞体积调节等生理功能。
2. 离子通道的疾病相关性离子通道的异常功能可能导致一系列疾病。
某些遗传病致病基因编码的离子通道蛋白的突变可以导致失调的离子通道功能,从而导致一系列遗传性神经疾病、心脏病和代谢性疾病等。
在神经疾病方面,离子通道的疾病包括癫痫、晕厥、麻痹性疾病等。
3. 离子通道药物治疗的研究离子通道是很多药物作用靶点之一。
中文摘要分子动力学模拟研究质子调节酸感性离子通道的构象变化生物膜上的离子通道蛋白是神经系统的主要组成部分,控制着各种离子的跨膜运输。
在神经传导、中枢神经系统的调控以及激素分泌等生命活动中,它们都扮演着中重要角色。
近些年来,离子通道蛋白倾向于结构和功能的研究。
伴随着计算机水平的发展,分子动力学模拟为大分子生物体系的构象变化与门控之间的动态关系提供了强有力的方法,并在微观上揭示了蛋白活动的本质规律。
同时,为相应的实验研究提供了重要的理论依据。
酸敏感性离子通道1a(ASIC1a)蛋白广泛的存在于中枢神经系统,属于上皮钠离子通道/退化蛋白超家族成员。
同时,ASIC1a作为质子受体激活的阳离子通道,可以产生感觉传导、抑郁和恐惧等有关的行为。
在生理病理学过程中,ASIC1a可以还可能引起缺血性卒中,记忆力减退,疼痛,焦虑等症状。
近些年来,不断的对ASIC1a进行实验研究,并且发现离子在通过离子通道时主要由跨膜域来控制离子的进入。
在酸性条件下,离子通道将被激活并允许离子通过使过多的离子进入细胞内部,导致细胞超载死亡,这就是我们常说的酸中毒。
然而到目前为止,人们仍然没有发现跨膜域的离子通道门控是如何被调控的。
因此,我们将对离子通道门控的过程进行研究。
在本文中,我们通过分子动力学(MD)模拟研究在不同pH值的条件下离子通道孔径的变化。
用主成分分析的方法确定了从胞外域到跨膜域的长程构象变化的路径,并且用相关性网络分析的方法进一步分析了亚基之间的相互作用对离子通道门控的影响。
其中β1、β2、β10、α6、α7、β11和β12是调解离子通道孔径变化的关键区域。
我们的研究结果揭示了细胞得胞外域远程调节离子通道孔径变化的过程。
同时,我们的研究为防止酸中毒的药物的设计和研究提供了重要信息。
关键词:ASIC1a,分子动力学模拟,离子通道门控,质子ABSTRACTElucidating Proton-mediated Conformational Changes in an Acid-sensing Ion Channel 1a through molecular dynamics simulationIon channel proteins on the biological membrane are the main components of the nervous system and control the transmembrane transport of ions. In the process of nerve conduction, central nervous system regulation, hormone secretion and other activities of life, they play an important role. In recent years, the research of ion channel proteins tends to study the structure and function. With the development of computer, the method of molecular dynamics simulation provides a powerful method for the dynamic relationship between biological macromolecules and the channel gating, and reveals the essence of protein activity in microcosm. At the same time, it provides important theoretical basis for the corresponding experimental research.Acid-sensitive ion channel 1a (ASIC1a) protein is widely present in the central nervous system and belongs to the Epithelial sodium ion channel / Degenerate protein superfamily member. At the same time, ASIC1a acts as proton-activated receptor cation channel, contributes to sensory transduction, depression and fear-related behaviors throughout nervous system. In the physiological pathology process, ASIC1a cause ischemic stroke, pain, anxiety, memory deterioration and other symptoms. So far, ASIC1a has been studied experimentally, and it is found that the ion channel proteins are mainly controlled the entry of ions by the transmembrane domain. Under acidic conditions, the ion channel gating will be activated and allow ions to pass through. Too much ions pass into the cell interior leading to the cell overload and death. This is what we call acidosis. But how proton mediates the channel gating process still remains elusive. Therefore, we will research the process of the protein domain controlling the channel gating process.Here we report that the ion pore changes at different PH values through molecular dynamics (MD) simulations. The path of long-range conformational changes from the extracellular domain to the transmembrane domain was determined by the method of principal component analysis; further, the correlation network analysis reveals how the interactions between subunits influence the channel gatingchanges. β1, β2, β10, α6, α7, β11 and β12 are the crucial regions by forming a passageway to regulate the ion pore changes. Our results reveal the process that the extracellular domain remotely regulates the pore changes. Meantime, our researches have improved important information for the design and research of drugs to prevent acidosis.Keywords:ASIC1a,molecular dynamics simulation,ion channel gating,proton目录第一章绪论 (1)1.1蛋白质的结构 (1)1.2计算机分子模拟 (1)1.3研究对象和研究意义 (2)第二章理论基础与计算方法 (3)2.1B ORN-O PPENHEIMER 近似 (3)2.2力场 (4)2.2.1 力场的组成 (4)2.2.2 常用力场模型 (4)2.3分子力学及结构优化算法 (5)2.4分子动力学 (6)2.4.1 分子动力学基本原理 (6)2.4.2 积分算法 (6)2.5恒温恒压下的分子动力学模拟 (7)2.6主成分分析 (8)第三章分子动力学模拟研究质子调节酸敏感性 (9)离子通道的构象变化 (9)3.1引言 (9)3.2理论方法 (11)3.2.1 体系的构建 (11)3.2.2 相关性网络分析 (12)3.3结果与讨论 (12)3.3.1 离子通道跨膜域的变化 (14)3.3.2 PH值为4时离子通道变化的路径 (17)3.3.3 手指域-关节域调节通道门控 (20)3.3.4 拇指域-手掌域调节通道门控 (22)3.4结论 (25)参考文献 (26)个人简介及攻读硕士学位期间发表论文 (33)致谢 (34)第一章绪论计算机技术的发展使得生物信息迅速发展[1, 2]。
生物膜通透性调节机制生物膜,这个在细胞世界中起着关键作用的结构,其通透性的调节对于细胞的正常生理功能至关重要。
生物膜就如同细胞的“守门员”,控制着物质的进出,从而维持细胞内环境的稳定。
那么,这个“守门员”是如何被精确调控的呢?首先,我们来了解一下生物膜的基本结构。
生物膜主要由磷脂双分子层构成,其中镶嵌着各种蛋白质分子。
磷脂双分子层具有一定的流动性,这为物质的跨膜运输提供了基础。
而镶嵌在膜中的蛋白质,则在调节膜的通透性方面发挥着重要作用。
其中,一种常见的调节机制是通过载体蛋白和通道蛋白来实现的。
载体蛋白能够与特定的物质结合,然后通过自身构象的改变,将物质从膜的一侧转运到另一侧。
比如,葡萄糖转运蛋白可以将葡萄糖分子从细胞外转运到细胞内。
通道蛋白则像是形成了一个通道,让特定的离子或小分子能够快速地通过膜。
例如,钾离子通道允许钾离子顺着浓度梯度快速进出细胞。
这些蛋白质的活性和数量会受到多种因素的调节。
从细胞内部来说,细胞内的信号分子可以与这些蛋白质结合,从而改变它们的构象或者活性。
比如,当细胞内的能量水平降低时,某些与能量代谢相关的物质转运蛋白的活性会增强,以增加能量物质的摄入。
从细胞外部来看,环境因素也对生物膜的通透性有着重要影响。
温度的变化会影响磷脂双分子层的流动性,进而影响膜的通透性。
在低温条件下,磷脂双分子层的流动性降低,物质通过膜的速度会减慢;而在高温条件下,膜的稳定性可能会受到破坏,导致通透性异常增加。
pH 值也是一个重要的调节因素。
当细胞外环境的 pH 值发生变化时,膜上的一些蛋白质的电荷状态会改变,从而影响它们与物质的结合能力和转运效率。
例如,在酸性环境中,某些氨基酸转运蛋白的活性可能会受到抑制。
此外,生物膜的通透性还受到膜电位的调节。
膜电位的变化会影响离子通道的开放和关闭。
比如,神经细胞中的钠离子通道在膜电位达到一定阈值时会迅速开放,导致钠离子大量内流,从而产生神经冲动。
除了上述因素,细胞还可以通过调节膜上蛋白质的表达水平来长期改变膜的通透性。
生物膜功能特点生物膜是生物体内一种非常重要的结构,它具有许多功能特点。
以下将介绍生物膜的主要功能特点。
首先,生物膜具有选择性通透性的功能特点。
生物膜通过脂质双层的结构,使得只有特定的物质能够通过,而其他物质被阻止。
这种选择性通透性是由膜上的蛋白质通道和离子通道控制的。
这种功能特点使得细胞能够通过调节物质的进出来维持细胞内外环境的稳定。
其次,生物膜具有细胞识别和支持功能。
生物膜上的糖蛋白质可以识别特定的物质和其他细胞,从而参与细胞间的相互作用和通信。
此外,生物膜也可以提供细胞的支持和结构,使细胞能够保持形态和结构的稳定。
另外,生物膜还具有细胞内外界面的分隔和保护功能。
生物膜使细胞内部与外部环境相分隔,从而可以控制物质的进出,维持细胞内环境的稳定。
同时,生物膜还能够保护细胞免受外界环境的攻击和损伤。
此外,生物膜还具有传递和转导信号的功能特点。
生物膜上的受体蛋白质和信号分子可以进行相互作用,从而传递和转导信号,使得细胞能够对外界的刺激做出相应的反应。
这种功能特点使得生物膜在细胞生理和生物学过程中起到了至关重要的作用。
最后,生物膜还具有调节细胞内外物质交换平衡的功能。
生物膜通过调节物质的进出来维持细胞内外环境的平衡。
它可以通过扩散、被动转运和主动转运等方式来控制物质的进出,从而保持细胞内外物质交换的平衡,维持细胞正常的功能和生活活动。
总之,生物膜具有选择性通透性、细胞识别和支持、分隔和保护、传递和转导信号、调节物质交换平衡等多种功能特点。
这些特点使得生物膜在细胞的正常生理和生物学过程中起到了重要的作用。
对于我们理解细胞生物学和生物体内生理过程具有重要的意义。
生物膜离子通道百科名片生物膜离子通道示意图生物膜离子通道(ion channels of biomembrane)是各种无机离子跨膜被动运输的通路。
生物膜对无机离子的跨膜运输有被动运输(顺离子浓度梯度)和主动运输(逆离子浓度梯度)两种方式。
被动运输的通路称离子通道,主动运输的离子载体称为离子泵。
生物膜对离子的通透性与多种生命活动过程密切相关。
例如,感受器电位的发生,神经兴奋与传导和中枢神经系统的调控功能,心脏搏动,平滑肌蠕动,骨骼肌收缩,激素分泌,光合作用和氧化磷酸化过程中跨膜质子梯度的形成等。
目录1111111111展开生物膜离子通道简介活体细胞不停地进行新陈代谢活动,就必须不断地与周围环境进行物质交换,而细胞膜上的离子通道就是这种物质交换的重要途径.人们已经知道,大多数对生命具有重要意义的物质都是水溶性的,如各种离子,糖类等,它们需要进入细胞,而生命活动中产生的水溶性废物也要离开细胞,它们出入的通道就是细胞膜上的离子通道. 离子通道由细胞产生的特殊蛋白质构成,它们聚集起来并镶嵌在细胞膜上,中间形成水分子占据的孔隙,这些孔隙就是水溶性物质快速进出细胞的通道.离子通道的活性,就是细胞通过离子通道的开放和关闭调节相应物质进出细胞速度的能力,对实现细胞各种功能具有重要意义.两名德国科学家埃尔温·内尔和贝尔特·扎克曼即因发现细胞内离子通道并开创膜片钳技术而获得1991年的诺贝尔生理学奖.研究简史在生物电产生机制的研究中发现了对离子通透性的变化。
1902年J.伯恩斯坦在他的膜学说中提出神经细胞膜对钾离子有选择通透性。
1939年A.L.霍奇金与A.F.赫胥黎用微电极插入枪乌贼巨神经纤维中,直接测量到膜内外电位差。
1949年A.L.霍奇金和B.卡茨在一系列工作基础上提出膜电位离子假说,认为细胞膜动作电位的发生是膜对纳离子通透性快速而特异性地增加,称为“钠学说”。
尤其重要的是,1952年 A.L.霍奇金和 A.F.赫胥黎用电压钳技术在巨神经轴突上对细胞膜的离子电流和电导进行了细致地定量研究,结果表明Na+和K+的电流和电导是膜电位和时间的函数,并首次提出了离子通道的概念。
他们的模型 (H-H模型)认为,细胞膜的K+通道受膜上4个带电粒子的控制,当4个粒子在膜电场作用下同时移到某一位置时,K+才能穿过膜。
另一方面,1955年,卡斯特罗和B.卡茨对神经-肌肉接头突触传递过程的研究发现:突触后膜终板电位的发生,是由于神经递质乙酰胆碱(Ach)作用于终板膜上受体的结果,从而确认了受化学递质调控的通道。
60年代,用各种生物材料对不同离子通透性的研究表明,各种离子在膜上各自有专一性的运输机构,曾经提出运输机构是载体、洞孔和离子交换等模型。
1973年和1974年,C.M.阿姆斯特朗、F.贝萨尼利亚及R.D.凯恩斯、E.罗贾斯两组分别在神经轴突上测量到与离子通道开放相关的膜内电荷的运动,称为门控电流,确认了离子通道的开放与膜中带电成分运动的依从性。
1976年E.内尔和B.萨克曼创立了离子单通道电流记录技术,并迅速得到推广应用,近年用这种技术发现了一些新型离子通道,为深入研究通道的结构和功能提供了有力的工具。
80年代初,学者们先后从细胞膜上分离和纯化了一些运输离子的功能性蛋白质,并在上成功地重建了通道功能,从而肯定了离子通道实体就是膜上一些特殊蛋白质分子或其复合物。
近年,科学家应用基因重组技术研究的结构,1982和1984年,纽莫及合作者先后测定了N型Ach 受体和 Na+通道蛋白的氨基酸序列。
研究方法离子通道结构和功能的研究需综合应用各种技术,包括:电压和电流钳位技术、单通道电流记录技术、通道蛋白分离、纯化等生化技术、人工膜离子通道重建技术、通道药物学、基因重组技术及一些物理和化学技术。
电压钳位技术一般而言,膜对某种离子通透性的变化是膜电位和时间的函数。
通过玻璃微电极与细胞膜之间形成紧密封接,利用电子学技术施加一跨膜电压并把膜电位固定于某一数值,可以测定该膜电位条件下离子电流随时间变化的动态过程。
利用药物或改变细胞内外的溶液成分,使其他离子通道失效,即可测定被研究的某种离子通道的功能性参量,分析离子电流的稳态和动力学与膜电位、离子浓度等之间的关系,可推断该种通道的电导、活化和失活速率、离子选择性等,并能测量和分析通道的门控电流的特性。
单通道电流记录技术又称膜片钳位技术,用特制的玻璃微吸管吸附于细胞表面,使之形成10~100GΩ的密封(giga-seal),被孤立的小膜片面积为μm2量级,内中仅有少数离子通道。
然后对该膜片实行电压钳位,可测量单个离子通道开放产生的pA(10-12安培)量级的电流,这种通道开放是一种随机过程。
通过观测单个通道开放和关闭的电流变化,可直接得到各种离子通道开放的电流幅值分布、开放几率、开放寿命分布等功能参量,并分析它们与膜电位、离子浓度等之间的关系。
还可把吸管吸附的膜片从细胞膜上分离出来,以膜的外侧向外或膜的内侧向外等方式进行实验研究。
这种技术对小细胞的电压钳位、改变膜内外溶液成分以及施加药物都很方便。
通道药物学研究应用电压钳位或单通道电流记录技术,可分别于不同时间、不同部位(膜内侧或外侧)施用各种浓度的药物,研究它们对通道各种功能的影响。
结合对药物分子结构的了解,不但可以深入了解药物和毒素对人和动物生理功能作用的机制,还可以从分子水平得到通道功能亚单位的类型和构象等信息。
通道蛋白分离、通道重建和基因重组技术利用与通道特异结合的毒剂标记,可把通道蛋白质从膜上分离下来,经过纯化,可以测定各亚单位多肽的分子量。
然后,把它们加入人工膜,可重新恢复通道功能。
用于确定蛋白质氨基酸序列的基因重组技术的程序是:从细胞中分离出含有与该种通道蛋白相关的mRNA,置入某种细胞(如大肠杆菌),经逆转录得到cDNA。
用限制性内切酶将cDNA切割成特定片段,再用核酸杂交方法钓出特定的DNA并克隆化。
通过测定阳性克隆DNA的核苷酸顺序,推断出相应的蛋白质氨基酸序列。
类型和功能特征离子通道依据其活化的方式不同,可分两类:一类是电压活化的通道,即通道的开放受膜电位的控制,如Na+、Ca+、Cl-和一些类型的K+通道;另一类是化学物活化的通道,即靠化学物与膜上受体相互作用而活化的通道,如 Ach受体通道、氨基酸受体通道、Ca+活化的K+通道等。
钠通道各种生物材料中,与电兴奋相关的Na+通道有相似的基本特征。
通道活化时间常数小于1毫秒,失活时间常数为数毫秒,Na+电流的反转电位约+55毫伏。
单通道电流记录显示,Na+单通道电导为4~20pS,平均开放寿命数毫秒。
根据一些药物和毒素对Na+通道功能的不同影响,可分为4种类型:①通道阻断剂,如河豚毒素(TTX)、石房蛤毒素(STX)。
②通道活化增强剂,如β-蝎毒、箭毒蛙毒素(BTX)、藜芦碱毒素(VER)等。
③通道活化抑制剂,如一些局部麻醉剂及其衍生物。
④通道失活抑制剂,如链霉蛋白酶、N-溴乙酰胺(NBA)等。
钾通道根据功能特性的不同,K+通道可分为以下类型:①慢(延迟)K+通道(K通道),也就是H-H模型中的K+通道。
单通道电流记录显示,单个K通道电导在2~20pS,通道平均开放寿命为数十毫秒。
该种通道可被四乙胺(TEA)等特异性阻断,通道对K+有高度选择性,但R姾和NH 嬃亦能通过,这种通道在神经轴突和骨骼肌细胞膜中有较高密度。
②快(早期)K+通道(A通道),该种通道外向的K+流在膜去极化的早期就出现,表明通道的活化时间常数比慢K+通道小得多,但在-40毫伏以上该通道即关闭。
电压钳位实验表明,其宏观电流动力学与Na+电流相似。
较低浓度的4-氨基吡啶即能阻断该通道,它也可被四乙胺阻断。
③Ca2+活化的K+通道〔K(Ca)通道〕,该种通道的开放,不但与膜电位有关,而且依赖于细胞内Ca2+的浓度,每个通道需结合两个Ca2+才能活化。
单通道电导可高达300pS,并有较长的开放寿命,这种通道与Ca2+通道协同作用,对调节细胞膜电兴奋性的节律有重要意义。
它可被四乙胺、N'-四乙酸(EGTA)、奎尼丁和Ba2+阻断。
④内向整流的K+通道,其特征是:在膜超极化时通道开放与膜电位和胞外K+浓度密切相关,通道开放时产生内向K+电流,单通道电导在5~10pS范围。
钙通道Ca2+通道广泛存在于各种生物组织的细胞膜中。
宏观的Ca2+电流动力学特征与Na2+电流相似,但峰值小且失活过程慢,可达数十到数百毫秒。
Ca2+通道对Ca2+、Ba2+、Sr2+都有高通透性,但Ni2+、Cd2+、Co2+、Mn2+等离子能有效地阻断Ca2+通道。
药物对Ca2+通道的作用可分为:①通道阻断或抑制剂,可分为苯烷基胺类(如异博定、甲基异博定D600)、苯硫氮类、双氢吡啶类等类型。
②通道激活剂,一些双氢吡啶化合物如BayK8644等药物可活化Ca2+通道。
近年,对小鸡背根神经节细胞的研究发现有3种类型的Ca2+通道:①L型,该种通道在膜电位大于-20毫伏时活化,电流失活缓慢。
单通道电导约25pS。
②T型,膜电位约-60毫伏时通道即活化,-10毫伏以上通道电流幅值反而下降,单通道电导约8pS。
③N型,该种通道在膜电位不小于-10毫伏才能活化,但又必须超极化到-80毫伏以下才能克服通道的失活。
电流动力学比 L型快但比T型慢,单通道电导约13pS。
以上3类Ca2+通道在不同细胞膜上选择性分布及密度的差别,将影响各种细胞的生理功能。
Ca2+通道除了对细胞电兴奋性有贡献外,它通过调节细胞内Ca2+浓度,可进一步调节许多细胞功能。
N型乙酰胆碱受体通道它是由神经递质Ach活化的正离子通道。
当突触前膜一次量子化释放数千个 Ach分子,它们作用于突触后膜上的N型受体时,受体通道开放,产生Na+和K+电流,引发突触后膜一个小终板电位(mEPP)。
N-AchR单通道电导在20~60pS范围,平均开放寿命数毫秒,通道电流反转电位约-10毫伏,近年发现该种通道有多种电导态(见图)。
通道的离子选择性较差,可允许数十种无机和有机正离子通过,许多毒素和有机物能阻断或抑制该种通道,α-银环蛇毒(α-BGTX)是 N型Ach受体通道的特异性阻断剂。
80年代以来,已发现多种由神经递质和激素活化的受体通道,如谷氨酸受体通道、多巴胺受体通道、5-羟色胺受体通道、γ-氨基丁酸受体通道等。
分子构象和门控动力学离子通道研究的前沿是试图从分子水平揭示通道蛋白的空间构象、构象变化与通道门控动力学之间的关系。
N-AchR通道已测定了受体蛋白质分子量是250000,并测定了它的全部氨基酸序列,确证该受体通道由、α、γ和δ5个亚基组成,这4种亚基有相似的氨基酸顺序,但只有α亚基上有α-BGTX的特异结合位点。