化学反应工程教案5(化工13)胡江良
- 格式:doc
- 大小:85.05 KB
- 文档页数:4


化学反应工程课程教案
2、内扩散影响的消除
基本原则:改变催化剂粒度,缩短扩散距离,减小内扩散阻力。
当催化剂粒度(尺寸)的变化对反应动力学不产生影响时,即可认为消除了内扩散的影响
实验测定:在恒定条件下(反应器入口气体组成、温度和停留时间等)
本征动力学测试的基本要求
(1)反应气体需高度净化,严格控制有害杂质含量
(2)测试用反应器应严格控温(等温或绝热)
(3)根据物系特性,选取适宜分析和流量计量方法
(4)严格消除内、外扩散过程的影响
4.4.2 本征动力学测试常见的反应器。

化学反应工程教案10_胡江良教案:化学反应工程教案一、基本信息1.教学对象:高中化学学生2.授课内容:化学反应工程3.教学目标:了解化学反应工程的基本概念、原理和应用二、教学方法1.讲授法:通过讲解概念、原理和应用,深入理解化学反应工程的内容;2.实验法:进行一些简单的实验,帮助学生理解反应工程的实际操作;3.讨论法:组织学生进行小组讨论,共同解决实际问题;4.案例分析法:通过一些典型案例的分析,帮助学生理解反应工程的具体应用。
三、教学内容1.化学反应工程的概念和基本原理A.反应工程的定义和分类B.化学反应的热力学和动力学基础C.反应的速度方程和速率常数D.反应的平衡和反应热2.化学反应的实际操作A.反应的热平衡和控制B.反应的物质平衡和控制C.反应的高效与高选择性控制D.反应的安全控制3.化学反应工程的应用A.化学反应的工业应用B.化学反应的环境应用C.化学反应的能源应用四、教学过程第一节:化学反应工程的概念和基本原理1.介绍反应工程的定义和分类2.介绍反应的热力学和动力学基础3.介绍反应的速度方程和速率常数4.介绍反应的平衡和反应热第二节:化学反应的实际操作1.讲解反应的热平衡和控制方法2.讲解反应的物质平衡和控制方法3.讲解反应的高效与高选择性控制方法4.讲解反应的安全控制方法第三节:化学反应工程的应用1.介绍化学反应的工业应用案例2.介绍化学反应的环境应用案例3.介绍化学反应的能源应用案例五、教学评估1.参与讨论2.完成小组作业3.完成实验报告六、教学资源1.教材:高中化学教材2.实验设备:反应瓶、试管、温度计等3.实验药品:氢氧化钠、盐酸、过氧化氢等七、教学反思化学反应工程是一个很重要的学科,它是化学技术和工程技术的基础。
通过本节课的教学,学生可以了解化学反应工程的基本概念、原理和应用。
通过实验和案例分析,可以帮助学生更好地理解反应工程的实际操作和应用。
此外,通过小组讨论和评估,可以帮助学生更好地掌握反应工程的知识和技能。


化学反应工程课程教案授课题目(教学章、节或主题)第2章复合反应与反应器选型2.2自催化反应特性与反应器选型 2.3可逆反应特性与反应器选型教学目的、要求(分掌握、熟悉、了解三个层次)熟悉自催化反应和可逆反应的特点;教学重点及难点:重点:自催化反应和可逆反应的特点。
难点:自催化反应和可逆反应反应器的选择。
教学基本内容22自催化反应特性与反应器选型自催化反应是复合反应中的一类。
其主要特点是反应产物能对该反应 过程起催化作用,加速该反应过程的进行。
特点:反应产物中含有对此反应有催化作用的组分。
因此,常在反应开始时加入少量有催化作用的产物。
反应1;話一>尸用]一>火=一加=比恒曲4反应 2: A + P —> P-\-—> r 2 = —p 4-「A =二(t j )=(总1)(%) =KC A k2(MP在整个反应过程中,A 组分被反应掉了,但是生成了等量的 P 组分, 则A 与P 的总摩尔数是恒定的,即:C A0C P0= C A C P = C 0 = C P 二 C A0 C P0 - C A- r A - ( ~r Aj ) = ("T AI )(_rA2^ k 1C Ak 2C AC^= k 1CAk 2C A(CA0Go〜CA)dC ^ =k i C A 【1 +代 / kJ©。
+c p° -C A )] dt1. 2. 了解自催化和可逆反应反应器的选择; 3. 了解自催化和可逆反应反应器类型;方法及手段第2章复合反应与反应器选型讲解A 组分的消耗速率为:最大反应速率对应的反应物浓度(极值原理)2k2在反应初期,尽管反应物的浓度较高,但是由于产物的浓度很低, 所有总反应速率不大;随着反应的进行,产物浓度增加,反应物浓度虽然降低,但是其值仍然较大,因此,反应速率将是增加的。
当反应进行到某一时刻时,反应物浓度的降低对反应速率的影响超过了产物浓度增加对反应速率的影响,反应速率开始下降。



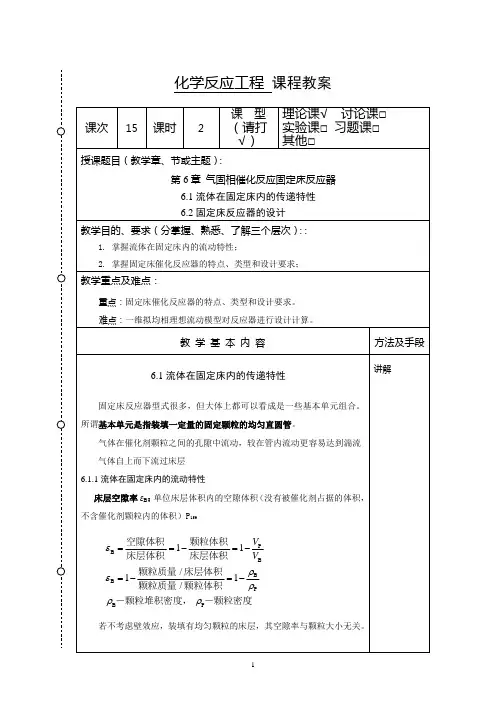
化学反应工程课程教案
颗粒的定型尺寸
颗粒的定型尺寸是颗粒体系的重要参数,常用粒径来表示。
对于球形颗粒,粒径自然是球的直径。
对于其他形状颗粒,最能代表颗粒性质的尺寸为颗粒的当量直径。
对于非球形颗粒,可将其折合成球形颗粒,以当量直径表示。
方法有三:体积当量直径(dv )、外表面积当量直径(da ) 、比表面积当量直径(ds )
体积当量直径(dv) :(非球形颗粒折合成同体积的球形颗粒应当
具有的直径)Vs:颗粒体积
非球形颗粒折合成相同外表面积的球
非球形颗粒折合成相同比表面积的球V
3
1
S 3S π66π
d V d V =⎪⎭
⎫
⎝⎛⇒
=球形体积:a
2
1
S πd S =⎪⎭
⎫ ⎝⎛⇒
3S V
冷激(quench):又称骤冷。
在多层固定床绝热反应器中进行放热反应时,在催化剂层间注入冷的原料,与高温的反应物混合,以直接换热的方式降低反应物的温度,称为冷激。
反应物通过一层催化剂产生一定的。

化学反应工程教案10(化工13)- 胡江良课型理论课"讨论课口课次10 课时2 (请打实验课口习题课口V)其他口授课题目(教学章、节或主题):第4章气固相催化反应本征动力学4.1气固相催化过程4.2固体催化剂教学目的、要求(分掌握、熟悉、了解三个层次)::1.理解催化过程及特征;2.掌握非均相催化过程七个步骤;3.掌握催化剂的组成、制备;教学重点及难点:重点:非均相催化过程。
难点:催化剂的组成。
教学基本内容方法及手段4.1气固相催化过程只有平衡常数很大而反应速率较小的过程,催化剂才能充分发挥作用。
4.1.1催化过程及特征例子:A+B R+S吸附:A + a A CTB + - B a表面反应:A* + B CT R + S CT脱附:亡二R + -S = s + a催化剂(▽)作用:参与反应(改变反应历程),但其质和量在反应前后维持不变催化定义:这种物质的加入改变了讲解化学反应工程课程教案原化学反应的历程,尽管它参与了反 应,但其质和量在反应前后维持不变, 因此被称为催化剂。
有催化剂存在的反 应过程称为催化反应过程。
非均相催化反应过程:若催化剂与 原物料形成的混合物是同一相时,该反 应过程称为非均相催化反应过程。
催化反应过程的特征催化剂改变反应历程和反应速催化剂的存在不改变反应过程 的热力学平衡特性( GO=-RTInK ;3)催化剂等速加快/减小可逆反应 的正逆反应速率;4 )催化剂对反应过程有良好的选 择性;5)如果希望催化剂充分发挥作用, 应当尽可能增加反应物与催化剂的接 触;4.1.3、非均相催化反应速率表达均相反应定义:1昭r = - V dt以催化剂体稅为基准:「丄空或「“丄坐恫则说)]%说 A V s dl [' 创以催化剂质量为基准:2、 率;拧剛化)]4.1.3、均相催化 应过程 (步骤)催化剂多为多孔性介质,相对于丰 富的内孔,外表面的催化作用贡献量可 忽略不计探1外扩散:反应组分由物流主体 ,催化剂外表面探2内扩散:反应组分由催化剂外 表面,催化剂内表面探3吸附:反应组分在催化剂活性 中心上吸附探4表面化学反应:在催化剂表面 进行化学反应探5脱附:反应产物在催化剂表面 解吸探6内扩散:反应产物由催化剂内 表面,催化剂外表面探7外扩散:反应产物由催化剂外 表面,物流主体气固相催化反应的7个步骤、3个 过程探1,7为外扩散过程; 探2,6为内扩散过程探3,4,5为化学动力学过程探 控制步骤的速率决定了整个宏观非 一—上一一以觥剂内麺辎基鬲反应的速率化物可增加活性组分表面积和热稳定性(AI2O3、MgO等)3)载体(稳定剂和分散剂)。
化学反应工程课程教案
从本质上说,物理过程不改变反应过程的动力学规律。
也就是说,反应的动力学方程并不因为物理过程的存在而发生变化。
但是,流体的流动、传质、传热过程会影响实际反应场所的浓度和温度在时间、空间上的分布,从而影响实际反应场的浓度和温度在时间、空间上的分布,从而影响反应的最终结果。
对某个具体反应,选择反应器、操作条件和操作方式主要考虑化学反应本身的特征与反应器特征,最终选择的依据将取决于所有过程:一是反应器的大小,二是产物分布济性。
过程的经济性主要受两个因素影响;而对于复合反应,首先要考虑产物分布。
2.1单一不可逆反应过程与反应器
2.1.1单一不可逆反应过程平推流反应器与全混流反应器的比较
在反应器设计评比中,只考虑如何有利于反应速率的提高。
当然,其中一个重要因素是,考察反应器的大小.
一、理想流动反应器的体积比较
基本条件:
和反应温度均相同;等容过程。
V R ,V RP ,V RM 分别表示间歇反应器体积、平推流反应器
体积和全混流反应器体积,则:
当转化率越大,则两者的差距
较大,所以可采用低转化率操作。
1、对同一单一的正级
数反应,在相同工艺
00,,A Af V C x Af A 0A00A x R dx V V C r =⎰Af A 0A00A x Rp
dx V V C r =⎰00()A Af RM A f
V C x V
r =0000[]
[]
Rp A RM A V V C OABD V V C OCBD ==1
<RM RP
V V。