铁的化学性质及其化合物(精)
- 格式:doc
- 大小:74.50 KB
- 文档页数:1



高中化学必修一铁及其化合物要点一:单质铁的物理及化学性质1、铁单质的物理性质铁具有金属的通性,具有被吸引的特性,一般铁粉为黑色,铁块为银白色。
2、化学性质3、注意事项(1)铁与弱氧化剂(如S、I2、H+、Fe3+、Cu2+)等反应所得产物为Fe2+,铁元素的价态为+2价。
(2)铁与强氧化剂(如Cl2、Br2、浓H2SO4、硝酸等)反应所得产物为Fe3+,铁元素的价态为+3价。
①在氯气中燃烧,只生成氯化铁;与稀硝酸反应时则先产生+3价铁,若铁过量时则+3价铁再变为+2价铁;②铁在常温下遇到冷的浓硫酸、浓硝酸时发生钝化,属于化学反应。
(3)铁在纯氧中燃烧以及在高温下与H2O(g)反应得到的产物为Fe3O4,铁元素的价态为+2、+3价。
(4)铁不能与冷、热水反应,但能与水蒸气反应,与水蒸汽反应的产物也是Fe3O4。
典型例题1、某稀溶液中含有4mol KNO3和2.5mol H2SO4,向其中加入1.5mol Fe,充分反应(已知NO3﹣被还原为NO).下列说法正确的是()A.反应后生成NO的体积为28 LB.所得溶液中c(Fe2+):c(Fe3+)=1:1C.所得溶液中c(NO3﹣)=2.75 mol/LD.所得溶液中的溶质只有FeSO4解:溶液中氢离子总物质的量为:n(H+)=2.5mol×2=5mol,n(NO3﹣)=4mol,铁粉的物质的量为1.5mol,由3Fe+2NO3﹣+8H+=3Fe2++2NO↑+4H2O,3 2 81.5mol 1mol 4mol,则1.5molFe完全反应时,硝酸根离子与氢离子均过量,则发生Fe+NO3﹣+4H+=Fe3++NO↑+2H2O,若1.5molFe完全反应时,氢离子不足,则两个反应均发生,Fe+NO3﹣+4H+=Fe3++NO↑+2H2Ox 4x x x3Fe+2NO3﹣+8H+=3Fe2++2NO↑+4H2Oy y y y则:x+y=1.5、4x+y=5,解得:x=0.75mol,y=0.75mol生成NO的体积为(0.75mol+0.75mol×)×22.4L/mol=28L,A.根据分析可知,反应后生成标况下28LNO,不是标况下,NO气体不一定为28L,故A错误;B.反应后生成铁离子为0.75mol,亚铁离子为0.75mol,c(Fe2+):c(Fe3+)=n(Fe2+):n(Fe3+)=1:1,故B正确;C.反应消耗硝酸根离子等于生成NO的量=0.75mol+0.75mol×=1.25mol,缺少溶液体积,无法计算溶液中硝酸根离子浓度,故C错误;D.反应后中含有硫酸铁和硫酸亚铁,故D错误;故选B.变式训练1、向500mL 2mol/L 的CuSO4溶液中插入一块铁片,反应片刻后取出铁片,经洗涤、烘干,称其质量比原来增重2.0g.下列说法错误的是(设反应后溶液的体积不变)()A.则此过程中参加反应的铁的质量是14gB.析出铜物质的量是0.25molC.反应后溶液中溶质物质的量浓度:c(CuSO4)=1.5mol/LD.反应后溶液中溶质物质的量浓度:c(FeSO4)=1.5mol/L2、将15g两种金属的混合物投入足量的盐酸中,反应完全后得到11.2L H2(标准状况),该混合物的组成可能是()A.钠和铁B.镁和铜C.铝和镁D.锌和铁要点二:铁的氧化物要点三:铁的氢氧化物1、常见的物理及化学性质4Fe(OH)2 + O2 + 2H2O =4Fe(OH)32Fe(OH)3Fe2O3+3H2O(受热分解)(2)Fe(OH)2的制备Fe(OH)2易被空气中的氧气氧化,生成Fe(OH)3,所以在制备Fe(OH)2时:①要确保Fe2+溶液中无Fe3+,故需加Fe粉,把Fe3+转化为Fe2+。

化学铁及其化合物的知识点总结
铁是一种常见的金属元素,它在自然界中广泛存在,并且在人类历史上也扮演了非常重要的角色。
以下是关于化学铁及其化合物的知识点总结:
1. 铁的物理性质:铁是一种银灰色的金属,具有良好的延展性和导电性。
它的密度约为7.87克/立方厘米,熔点为1538℃,沸点为2862℃。
2. 铁的化学性质:铁可以与许多元素和化合物反应,包括氧气、水、酸、碱等。
与氧气反应生成的氧化铁是最常见的铁化合物之一。
3. 铁的同位素:铁具有多种同位素,其中最常见的是铁-56。
其他铁同位素包括铁-54、铁-57、铁-58等。
4. 铁的存在形式:铁可以以多种形式存在,包括天然铁矿石、铁合金、生铁等。
天然铁矿石包括赤铁矿、磁铁矿、菱铁矿等。
5. 铁的生产:铁的生产通常通过高炉冶炼来实现。
该过程涉及将铁矿石和焦炭一起加热,以将铁从矿石中分离出来。
6. 铁的化合物:铁可以形成多种化合物,包括氧化铁、氯化铁、硫酸铁、亚硫酸铁等。
这些化合物在生活和工业中都有广泛的应用。
7. 铁的生物学作用:铁是人体必需的元素之一,它在体内参与形成血红蛋白和肌红蛋白,帮助携带氧气。
铁还是许多酶的重要组成部分。
总之,化学铁及其化合物在我们的生活和工业中都具有重要的地位。
了解铁的性质和应用有助于我们更好地利用和保护这种资源。

元素铁化学知识点总结一、铁的基本性质1. 原子结构:铁的原子序数为26,原子结构为1s2 2s2 2p6 3s2 3p6 4s2 3d6。
它是一种过渡金属,具有6种价态:-2、-1、0、+2、+3、+6。
2. 物理性质:铁是一种银白色的金属,具有良好的延展性和导电性。
在常温下,铁的晶体结构为面心立方,熔点为1535°C,沸点为2750°C。
3. 化学性质:铁能够与许多元素发生化学反应,如氧气、水、卤素等。
它易氧化,因此常常需要进行防腐处理,以延长其使用寿命。
二、铁的化合物1. 氧化物:铁的氧化物包括FeO、Fe2O3和Fe3O4等。
其中,FeO是黑色的、可溶于酸的一种氧化物,Fe2O3是红色的、不溶于酸的氧化物,Fe3O4是黑色的磁性氧化物。
2. 氢化物:铁和氢的化合物包括FeH2和FeH3等。
这些化合物在高压高温条件下可以稳定存在,但在常温常压下会发生分解反应。
3. 氧化物:铁的氧化物包括FeO、Fe2O3和Fe3O4等。
其中,FeO是黑色的、可溶于酸的一种氧化物,Fe2O3是红色的、不溶于酸的氧化物,Fe3O4是黑色的磁性氧化物。
4. 硫化物:铁和硫的化合物包括FeS、FeS2等。
这些化合物在自然界中普遍存在,如闪锌矿、辰砂等就是铁的硫化物。
5. 卤化物:铁和卤素的化合物包括FeCl2、FeCl3、FeBr2、FeI2等。
这些化合物具有不同的颜色和溶解性质,可用于化学实验和工业生产中。
6. 碳化物:铁和碳的化合物主要是Fe3C,即碳化铁,也称为水钢。
它是一种硬度很高的物质,常用于制作工具和机械部件。
三、铁的化学反应1. 与氧气的反应:铁在高温条件下能够和氧气发生燃烧反应,生成氧化铁。
4Fe + 3O2 → 2Fe2O32. 与水的反应:铁在冷水中不发生反应,但在热水或蒸汽中能够发生还原反应,生成氢气和氢氧化铁。
3Fe + 4H2O → Fe3O4 + 4H23. 与酸的反应:铁在稀盐酸或稀硫酸中能够发生还原反应,生成氢气和铁离子。

铁及其化合物的性质铁是一种化学元素,其化学符号为Fe,原子序数为26,属于过渡元素。
在自然界中,铁广泛存在于岩石、土壤和矿物中,也是人类历史上最早被使用的金属之一。
铁的性质:1. 物理性质:铁是一种银白色或灰色的金属,密度为7.87 g/cm³,熔点为1535°C,沸点为2750°C。
在常温下易氧化,变成红色锈。
2. 化学性质:铁与氧气反应,生成黑色的三氧化二铁(Fe3O4),也叫做磁性氧化铁。
铁还可与二氧化碳反应,生成一种黑色的碳酸铁(FeCO3)。
铁可以与盐酸和硫酸反应,产生氢气和相应的铁盐或硫酸盐。
3. 磁性:铁是有磁性的金属。
在未受磁场影响时,铁原子的磁矩互相抵消,没有总的磁性。
但在受到外加磁场时,铁原子的磁矩会趋向于沿磁场方向排列,从而形成磁性体。
4. 导电性:铁是良好的导电体,因为铁原子中含有不少自由电子,可以在金属内部自由移动。
铁的化合物性质:1. 氧化铁:氧化铁是铁和氧气反应得到的一种化合物。
常见的氧化铁有三种:亚铁氧化物(FeO)、氧化亚铁(Fe2O3)和磁性氧化铁(Fe3O4)。
氧化铁具有一定的酸碱性,可以中和酸或碱,是一种常用的化学试剂。
2. 碳酸铁:碳酸铁是铁与二氧化碳反应得到的一种化合物。
在空气中易受到氧化反应,从而变成亚铁氧化物。
碳酸铁是一种不溶于水的白色粉末,可以作为一种矿物材料,广泛应用于建筑、陶瓷等行业。
3. 偏铁酸盐:偏铁酸盐是一类含有羟基的铁离子的化合物,如三偏铁酸钾(KFeO4)。
这些偏铁酸盐具有氧化性和还原性,在某些化学反应中有重要的作用。
4. 亚铁离子:亚铁离子是铁在溶液中的一种离子形式,可以形成各种铁盐。
亚铁离子在氧气存在的条件下,容易被氧化为氧化亚铁和磁性氧化铁。
5. 铁配合物:铁可以和许多有机配体形成稳定的铁配合物,如血红蛋白、酰胺铁等。
这些铁配合物对生命活动具有重要作用,在药物、生化学等领域具有广泛的应用。
总体来说,铁及其化合物具有多样的性质和广泛的应用,是现代工业和生活中不可或缺的重要物质之一。

铁及其重要化合物的性质1.铁的性质(1)(2)化学性质铁单质性质活泼,有较强的还原性,主要化合价为+2价和+3价。
①与非金属单质的反应:a.与O2的反应:常温:铁被腐蚀生成铁锈,其主要成分为Fe2O3。
点燃:b.与Cl2的反应:c.与S的反应:②与水的反应:常温下铁与水不反应,在高温条件下与水蒸气反应:③与酸的反应:a.与非氧化性酸反应的离子方程式:b.与氧化性酸反应:遇冷的浓硫酸或浓硝酸,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应,但无H2产生。
④与某些盐溶液的反应:a.与CuSO4溶液反应的离子方程式:b.与FeCl3溶液反应的离子方程式:。
提醒:①铁分别与氯气和盐酸反应所得的产物中铁元素的价态不同,Fe与Cl2反应生成FeCl3,而Fe与盐酸反应生成FeCl2。
②铁在潮湿的空气中生成的铁锈的主要成分是Fe2O3,而铁在纯氧中燃烧的产物是Fe3O4。
③铁与硫蒸气反应生成的是FeS而不是Fe2S3;铁与碘蒸气反应生成的是FeI2而不是FeI3。
2.铁的化合物(1)铁的氧化物②化学性质FeO、Fe2O3、Fe3O4分别与盐酸反应的离子方程式为,,。
(2)铁的氢氧化物①物理性质②化学性质a.稳定性Fe(OH)2:不稳定,分解产物复杂;在空气中易被氧化成Fe(OH)3,反应的化学方程式为,现象为白色固体变成,最终变为。
Fe(OH)3:不稳定,受热易分解,化学方程式为。
b.碱性Fe(OH)2属于二元弱碱,Fe(OH)3属于三元弱碱,与非氧化性强酸反应的离子方程式分别为。
③制备分别由可溶性的亚铁盐和铁盐与碱反应制得,离子方程式分别为。
(3)Fe2+和Fe3+的相互转化上述转化关系中标号反应的离子方程式为①,②,③。
提醒:①Fe3O4的组成可理解为FeO·Fe2O3,与非氧化性酸(如盐酸、稀硫酸)反应时生成Fe2+和Fe3+;与氧化性酸(如HNO)反应时生成Fe3+;与还原性酸(如HI)反应时生成Fe2+。
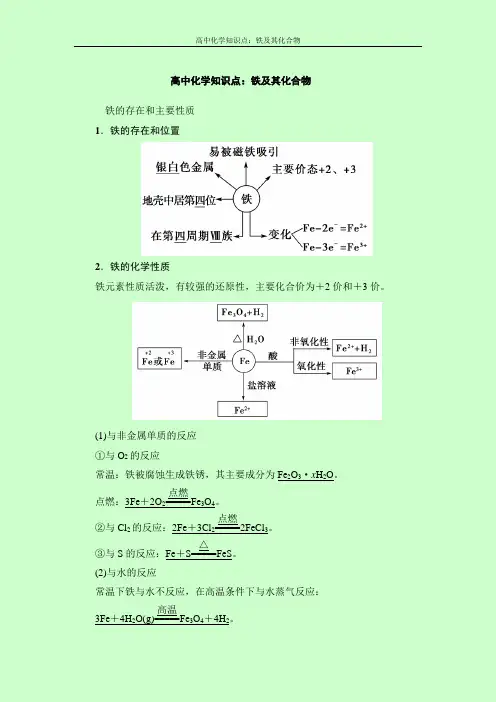
高中化学知识点:铁及其化合物铁的存在和主要性质 1.铁的存在和位置2.铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
(1)与非金属单质的反应 ①与O 2的反应常温:铁被腐蚀生成铁锈,其主要成分为Fe 2O 3·x H 2O 。
点燃:3Fe +2O 2=====点燃Fe 3O 4。
②与Cl 2的反应:2Fe +3Cl 2=====点燃2FeCl 3。
③与S 的反应:Fe +S=====△FeS 。
(2)与水的反应常温下铁与水不反应,在高温条件下与水蒸气反应: 3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
(3)与酸的反应①与非氧化性酸反应的离子方程式:Fe+2H+===Fe2++H2↑。
②与氧化性酸遇冷的浓硫酸或浓硝酸钝化,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应无H2产生。
Fe与足量稀HNO3反应的离子方程式为Fe+4H++NO-3===Fe3++NO↑+2H2O。
(4)与某些盐溶液的反应①与CuSO4溶液反应的离子方程式:Fe+Cu2+===Cu+Fe2+。
②与FeCl3溶液反应的离子方程式:Fe+2Fe3+===3Fe2+。
铁的重要化合物1.铁的氧化物氧化亚铁(FeO) 氧化铁(Fe2O3) 四氧化三铁(Fe3O4) 俗名铁红磁性氧化铁色态黑色粉末红棕色粉末黑色晶体铁元素价态+2 +3 +2、+3 说明:①FeO、Fe2O3、Fe3O4分别与盐酸反应的离子方程式:FeO+2H+===Fe2++H2O、Fe2O3+6H+===2Fe3++3H2O、Fe3O4+8H+===2Fe3++Fe2++4H2O。
②FeO与硝酸反应的化学方程式:3FeO+10HNO3===3Fe(NO3)3+NO↑+5H2O。
2.铁的氢氧化物Fe(OH)2Fe(OH)3色态白色固体红褐色固体与H+反应Fe(OH)2+2H+=== Fe2++2H2O Fe(OH)3+3H+=== Fe3++3H2O二者的关在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,反应方程式为4Fe(OH)2+系O2+2H2O===4Fe(OH)3说明:Fe(OH)2、Fe(OH)3的制备可利用相应亚铁盐、铁盐与碱液反应。

化学铁及其化合物的知识点总结铁是一种常见的化学元素,其化合物在生活和工业中具有重要的应用。
本文将从铁的性质、铁的化合物以及其应用领域等方面对铁及其化合物的知识进行总结。
一、铁的性质铁是一种化学元素,其化学符号为Fe,原子序数为26。
它是一种具有金属光泽的银白色固体,具有较高的密度和熔点。
铁在常温下具有良好的延展性和导电性,是一种重要的结构材料。
二、铁的化合物铁的化合物主要包括氧化铁、硫化铁、碳酸铁等。
其中,氧化铁是最常见的铁化合物之一。
氧化铁根据氧化态的不同可以分为三种类型,分别是亚铁氧化物(FeO)、三氧化二铁(Fe2O3)和四氧化三铁(Fe3O4)。
亚铁氧化物是一种黑色的固体,常用于陶瓷和颜料的制备。
三氧化二铁是一种红色的固体,被广泛应用于染料和磁性材料的制备。
四氧化三铁是一种黑色的固体,常用于磁性材料和催化剂的制备。
硫化铁是由铁和硫元素组成的化合物,化学式为FeS。
它是一种黑色的固体,常用于制备铁矿石和硫化铁矿。
碳酸铁是由铁、碳和氧元素组成的化合物,化学式为FeCO3。
它是一种白色的固体,常用于制备铁矿石和石灰石。
三、铁及其化合物的应用铁及其化合物在多个领域具有广泛的应用。
首先,铁是制备钢铁的主要原料,钢铁被广泛应用于建筑、交通工具、机械设备等领域。
其次,铁及其化合物在电子和电气领域也有重要的应用,例如电磁铁、变压器、电池等。
此外,铁的氧化物还可以用于催化剂的制备,如铁三氧化物在催化有机反应中具有重要的应用价值。
在生活中,铁及其化合物也有一些应用。
例如,铁饰品和装饰品常用于室内装饰,如吊灯、壁灯等。
此外,铁也可以用于制备烹饪用具,如铁锅和烧烤架等。
此外,铁的氧化物还可以用于制备颜料,如红色颜料和黑色颜料等。
总结:铁是一种常见的化学元素,其化合物具有重要的应用价值。
铁及其化合物在钢铁、电子、催化剂等领域有广泛的应用。
在生活中,铁及其化合物也被用于室内装饰、烹饪用具和颜料等方面。
铁的性质和化合物的应用使得它在各个领域都具有重要的地位。
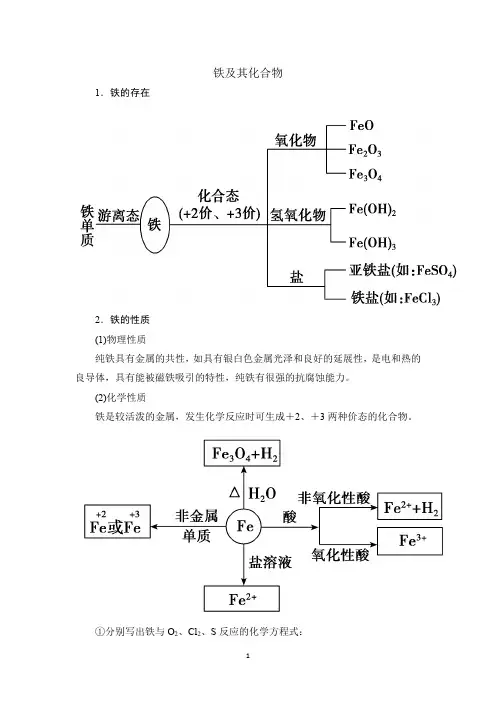
铁及其化合物1.铁的存在2.铁的性质(1)物理性质纯铁具有金属的共性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。
(2)化学性质铁是较活泼的金属,发生化学反应时可生成+2、+3两种价态的化合物。
①分别写出铁与O2、Cl2、S反应的化学方程式:3Fe +2O 2=====点燃Fe 3O 4; 2Fe +3Cl 2=====点燃2FeCl 3;Fe +S=====△FeS 。
②分别写出铁与HCl 、CuCl 2溶液、FeCl 3溶液、稀HNO 3(过量)反应的离子方程式:Fe +2H +===Fe 2++H 2↑; Fe +Cu 2+===Cu +Fe 2+; 2Fe 3++Fe===3Fe 2+;Fe +4H ++NO -3===Fe 3++NO ↑+2H 2O 。
3.铁的氧化物和氢氧化物 (1)铁的氧化物(2)铁的氢氧化物4.亚铁盐和铁盐(1)亚铁盐:含有Fe2+的溶液呈浅绿色,Fe2+既有氧化性,又有还原性,Fe2+与Zn、Cl2反应的离子方程式分别为Zn+Fe2+===Zn2++Fe,2Fe2++Cl2===2Fe3++2Cl-。
(2)铁盐:①氧化性:含有Fe3+的溶液呈棕黄色,Fe3+具有氧化性,Fe3+与Fe、Cu反应的离子方程式分别为2Fe3++Fe===3Fe2+,2Fe3++Cu===2Fe2++Cu2+。
②特性:含有Fe3+的盐溶液遇到KSCN时变成血红色。
③易水解:FeCl3滴入沸水中的离子方程式:Fe3++3H2O Fe(OH)3(胶体)+3H+。
按要求书写离子反应方程式(1)FeO和稀HNO3反应。
(2)Fe3O4和稀HNO3反应。
(3)Fe2O3和HI反应。
(4)Fe(OH)2和稀HNO3反应。
(5)Fe(OH)3和HI反应。
提示:(1)3FeO+10H++NO-3===3Fe3++NO↑+5H2O(2)3Fe3O4+28H++NO-3===9Fe3++NO↑+14H2O(3)Fe2O3+6H++2I-===2Fe2++I2+3H2O(4)3Fe(OH)2+10H++NO-3===3Fe3++NO↑+8H2O(5)2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O友情提示1.铁元素有+2、+3等多种价态,反应环境不同,可能反应产物不同,铁与非氧化性酸生成Fe2+。

铁及其化合物的性质铁是一种常见的金属元素,其化学符号为Fe,原子序数为26。
铁是一种坚硬、有光泽、银白色金属,具有良好的导电性和导热性。
铁在大气中很容易被氧化,因此常常涂上一层防锈漆来保护其表面。
铁的物理性质铁的密度为7.87克/厘米立方,熔点约为1535摄氏度,沸点为2750摄氏度。
它是一种较为软的金属,可以比较容易地被锻造成各种形状。
铁具有很好的磁性,在温度高于770摄氏度时,铁会失去其磁性。
铁的化学性质铁是一种容易与其他元素形成化合物的金属元素。
铁在酸性条件下可以形成两价离子Fe2+,在碱性条件下可以形成三价离子Fe3+。
铁可以与氧反应生成氧化铁(Fe2O3),这使得铁特别容易生锈。
铁的化合物氧化铁氧化铁是铁最常见的化合物之一。
它最常见的形式是Fe2O3,也称为赤铁矿(hematite)。
这种物质是一种红色的晶体,通常用作建筑材料和制造钢铁。
Fe2O3还可以被还原为Fe3O4,这是一种黑色的磁性晶体。
Fe3O4在酸性环境下能够将氧气还原为水,并产生电子,因此可以用于制造电池。
氯化铁氯化铁(FeCl3)是一种常见的无机化合物,具有黄褐色的颜色。
它可以通过将铁粉直接与氯气反应或通过加热含铁离子的氯化物溶液得到。
氯化铁可以用作控制水的pH值,还可以用于染料的制造、医学和水处理等领域。
硫酸铁硫酸铁(FeSO4)是一种白色晶体,也称为重晶石。
它通常是通过将铁与硫酸反应得到的。
硫酸铁可以用作营养补充剂,还可以用于制造磁性材料和药物。
铁的应用钢铁铁是钢铁制造的关键原料。
钢铁是一种强度和硬度都很高的金属,由铁和一定量的碳混合而成。
钢铁可以用于制造建筑材料、汽车、机械、电器等各种产品。
磁铁铁是一种磁性金属,可以用于制造各种磁性材料,如磁铁和电机。
这些产品广泛应用于电子设备、医疗设备和交通工具等领域。
其它铁还可以用于制造刀具、锅具和珠宝等各种产品。
此外,铁也可以用于冶炼其他金属,如铜、锡和铅等。
铁及其重要化合物一、铁1.物理性质:银白色,有金属光泽、质软;密度是7.86g/cm 3,熔点1535℃,沸点2750℃;具有良好的延性和展性;是电和热的导体具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。
2.化学性质:铁元素性质活泼,有较强的还原性,发生化学反应时可生成+2、+3两种价态的化合物。
(1)铁与非金属单质的反应 ①铁与氧气的反应Ⅰ.加热反应方程式:3Fe+2O2Fe 3O 4(剧烈燃烧,火星四射,放出大量的热,生成黑色固体物质)Ⅱ.常温下,铁在干燥的空气中很难跟氧气发生化学反应; Ⅲ.在潮湿的空气中,能跟氧气发生化学反应,生成铁锈:2Fe+O 2+2H 2O=2Fe(OH)2 ;4Fe(OH)2+O 2+2H 2O=4Fe(OH)3 ;2Fe(OH)3=Fe 2O 3+3H 2O②铁与氯气的反应方程式:2Fe + 3Cl 22FeCl 3(铁在氯气中燃烧,生成棕黄色的烟)(注意:常、低温下,Fe 与Cl 2不易发生反应,故可用钢瓶盛贮液氯。
③铁与硫单质的反应方程式:Fe + S (2)铁与水的反应【科学探究】按图组装实验装置进行实验:操作要领先加热湿棉花部位,待形成水蒸气后再加热铁粉,以防止发生倒吸。
加热最初排出的是空气,应加热一会儿后,再将导管插入到肥皂水中。
肥皂水不宜太稀,否则吹起的氢气泡太小,点燃时难以有较大的爆鸣声。
实验结束时,先将导气管撤出,再移去酒精灯,以防止倒吸。
反应方程式:3Fe +4H 2O(g)Fe 3O4+4H 2 ;3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2(3)铁与非氧化性酸的反应方程式:Fe+2 HCl=FeCl 2+H 2↑点燃点燃△△(4)铁与氧化性酸反应:①遇冷的浓硫酸或浓硝酸钝化。
在加热条件下与浓硫酸、浓硝酸反应但无H 2产生。
②在加热条件下与浓硫酸、浓硝酸反应但无H 2产生。
与稀硝酸在常温下可以发生如下反应:Ⅰ.HNO 3 (稀)过量时生成Fe 3+:Fe +4HNO 3(稀)=Fe(NO 3)3+NO↑+2H 2O 。
铁及其化合物【学习目标】1、铁的性质;2、铁的重要化合物及其相互转化。
【要点梳理】要点一、铁铁的原子结构示意图如下:1.物理性质⑴常温下,纯铁是银白色具有金属光泽的金属(纯铁的抗蚀力相当强),易导电、导热,有延展性。
⑵铁的熔沸点都很高:熔点是1535℃,沸点是2750℃。
⑶铁能被磁体吸引,在磁场的作用下,自身也能产生磁性。
2.化学性质当跟弱氧化剂反应时:Fe-2e-=Fe2+;当跟强氧化剂反应时:Fe-3e-=Fe3+。
⑴铁与非金属的反应:3Fe+2O2 Fe3O42Fe+3Cl22FeCl3, 2Fe+3Br2=2FeBr3Fe+I2=FeI2, Fe+S FeS⑵铁和某些盐(如CuSO4)溶液的反应:Fe+Cu2+=Fe2++Cu⑶铁与酸的反应:与非氧化性酸:Fe+2H+=Fe2++H2↑⑷铁与水蒸汽的反应:3Fe+4H2O(g) Fe3O4+4H2(注意产物是Fe3O4)注意:①该实验所用铁粉为还原铁粉(即刚用还原的方法得到的铁粉)。
②实验中收集气体,并通过爆鸣实验来验证氢气的产生。
要点二、铁的化合物1.铁的氧化物(1)FeO不稳定,在空气里受热,就迅速被氧化成Fe3O4。
(2)Fe2O3常用作红色油漆和涂料,赤铁矿(主要成分是Fe2O3)是炼铁的原料。
(3)Fe的常见化合价只有+2价和+3价,Fe3O4可以看成由FeO和Fe2O3按物质的量之比1∶1组合而成的复杂氧化物,通常也可写成FeO·Fe2O3的形式。
FeO、Fe2O3属于碱性氧化物,Fe3O4不属于碱性氧化物。
2.铁的氢氧化物名称氢氧化亚铁氢氧化铁化学式Fe(OH)2Fe(OH)3分类碱碱性质色态白色固体红褐色固体水溶性不溶于水不溶于水与酸反应Fe(OH)2+2H+=Fe2+ + 2H2O Fe(OH)3+3H+=Fe3++3H2O还原性稳定性4Fe(OH)2 + O2 + 2H2O =4Fe(OH)32Fe(OH)3Fe2O3+3H2O(受热分解)制法原理Fe2+ +2OH-=Fe(OH)2↓Fe3+ +3OH-=Fe(OH)3↓现象白色絮状沉淀红褐色沉淀2①硫酸亚铁要现配(配制时,蒸馏水要煮沸,以减少蒸馏水中溶解的氧,防止亚铁离子被氧化)。
铁及其重要化合物一、铁的性质:1.物理性质银白色光泽、密度大,熔沸点高,延展性、导电、导热性较好、能被磁铁吸引。
2.化学性质铁是较活泼的金属,铁原子的最外层电子数为2个,可失去2个或3个电子而显+2价或+3价,但+3价的化合物较稳定。
(1)与非金属反应: 3Fe + 2O 2Fe 3O 42Fe + 3C122FeCl 3(铁丝在氯气中燃烧时,生成棕黄色的烟,加水振荡后,溶液显黄色) Fe + SFeS 说明 铁跟氯气、硫反应时,分别生成+2价和+3价的铁,说明氧化性:氯气>硫. (2)与水反应:①在常温下,在水和空气中的O 2、CO 2等的共同作用下,Fe 易被腐蚀(铁生锈). ②在高温下,铁能与水蒸气反应生成H 2:3Fe + 4H 2O(g) Fe 3O 4 + 4H 2(3)与酸反应:①与非氧化性酸(如稀盐酸、稀H 2SO 4等)的反应.例如: Fe + 2H += Fe 2++ H 2↑②与氧化性酸。
a.HNO 3(稀)过量时生成Fe 3+:Fe +4HNO 3(稀)===Fe(NO 3)3+NO ↑+2H 2O 。
b .铁粉过量时生成Fe 2+:3Fe +8HNO 3(稀)===3Fe(NO 3)2+2NO ↑+4H 2Oc.铁遇到冷的浓H 2SO 4、浓HNO 3时,产生钝化现象,因此金属铁难溶于冷的浓H 2SO 4或浓HNO 3中.(4)铁与盐溶液的反应①铁能与比它活动性弱的金属的盐溶液反应,置换出这种金属。
Fe +CuSO 4===Cu +FeSO 4。
②铁能与FeCl 3溶液反应生成FeCl 2。
离子方程式:2Fe3++Fe===3Fe 2+。
二、铁的氧化物及氢氧化物1.铁的氧化物FeO Fe2O3(铁红) Fe3O4(磁性氧化铁)化合价+2 +2 +2、+3 色、态黑色粉未红棕色粉未黑色晶体水溶性均不溶于水和H+反应FeO + 2H+ = Fe2+ + H2O Fe2O3 + 6H+ = 2Fe3+ + 3H2O Fe3O4 + 8H+ = 2Fe3+ + Fe2++4H2O与CO的反应稳定性在空气中氧化为Fe3O4空气中稳定在空气中稳定制备高温熔融,过量的铁与O2反应:2Fe+O22FeO 氢氧化铁加热分解2Fe(OH)3Fe2O3+3H2O铁在氧气中燃烧3Fe + 2O2Fe3O42.铁的氢氧化物氢氧化亚铁(Fe(OH)2) 氢氧化铁- Fe(OH)3色态白色固体红褐色固体水溶性难溶于水与酸反应Fe(OH)2 + 2H+ = Fe2+ + 2H2O Fe(OH)3 + 3H+ = Fe3+ + 3H2O与强氧化酸反应3Fe(OH)2+ 10HNO3= 3Fe(NO3)3+ NO↑+8H2OFe(OH)3 + 3H+ = Fe3+ + 3H2O稳定性不稳定,易被空气中的氧气氧化,颜色变化:白色→灰绿色→红褐色4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3较稳定空气中久置会部分失水成铁锈受热易分解制取新制FeSO4溶液与NaOH溶液隔绝空气反应:Fe2+ + 2OH- = Fe(OH)2↓铁盐与可溶性碱反应Fe3+ + 3OH- = Fe(OH)3↓【要点名师透析】一、铁的三角转化关系1.关系:2.应用(1)共存问题①Fe2+在酸性条件下不能与强氧化性离子共存,如:NO3-、MnO4-、ClO-等。
铁的化学性质及其化合物
化学性质铁的电子构型为(Ar)3d64s2,氧化态有0、+2、+3、+4、+5、+6。
铁的化学性质活泼,为强还原剂,在室温条件下可缓慢地从水中置换出氢,在500℃以上反应速率增高:
3Fe+4H O─→Fe O+4H
铁在干燥空气中很难与氧发生作用,但在潮湿空气中很易腐蚀,若含有酸性气或卤素蒸气时,腐蚀更快。
铁可从溶液中还原金、铂、银、汞、铋、锡、镍或铜等离子,如:
CuSO+Fe─→FeSO+Cu
铁溶于非氧化性的酸如盐酸和稀硫酸中,形成二价铁离子并放出氢气;在冷的稀硝酸中则形成二价铁离子和硝酸铵:
Fe+H SO─→FeSO+H4Fe+10HNO─→4Fe(NO)+NH NO+3H O
铁溶于热的或较浓的硝酸中,生成硝酸铁并释放出氮的氧化物。
在浓硝酸或冷的浓硫酸中,铁的表面形成一层氧化薄膜而被钝化。
铁与氯在加热时反应剧烈。
铁也能与硫、磷、硅、碳直接化合。
铁与氮不能直接化合,但与氨作用,形成氮化铁Fe N。
铁的最重要的氧化态是+2和+3。
二价铁离子呈淡绿色,在碱性溶液中易被氧化成三价铁离子。
三价铁离子的颜色随水解程度的增大而由黄色经橙色变到
棕色。
二价和三价铁均易与无机或有机配位体形成稳定的配位化合物,如FeCl、Fe(CN)、Fe(CN)、 Fe(Phen)、Fe(C O)等(Phen为菲罗林),配位数通常
为6。
零价铁还可与一氧化碳形成各种羰基铁,如Fe(CO)、Fe(CO)、Fe(CO)。
羰基铁有挥发性,蒸气剧毒。
铁也有+4、+5、+6价态的化合物,但在水溶液中只有+6价的。
化合物主要有两大类:亚铁Fe(Ⅱ)和正铁Fe(Ⅲ)化合物,亚铁化合物有氧化亚铁、氯化亚铁、硫酸亚铁、氢氧化亚铁等;正铁化合物有三氧化二铁、三氯化铁、硫酸铁、氢氧化铁等。
亚铁和正铁离子与氰根都可形成很稳定的配离子
Fe(CN)和 Fe(CN),如在亚铁氰化钾 K[Fe(CN)]·3H O和铁氰化钾K
[Fe(CN)]中。
铁与环戊二烯的化合物二茂铁,是一种具有夹心结构的金属有机化合物。