空气中氮氧化物
- 格式:doc
- 大小:49.50 KB
- 文档页数:3

_一、实验目的与要求1、掌握氮氧化物测定的基本大气中氮氧化物的原理和方法。
2、绘制实验室空气中氮氧化物的日变化曲线。
3、了解并掌握大气中氮氧化物的有关知识。
二、实验方案1、实验仪器(1)大气取样器;(2)分光光度计;(3)棕色多孔玻板吸收管;(4)双球玻璃管;(5)比色管;(6)移液管。
2、实验药品(1)吸收原液标准液;(2)吸收原液;(3)蒸馏水。
3、实验原理主要反应方程式为:4、实验步骤1)氮氧化物的采集用一个内装5mL采样液用吸收的多孔玻板吸收管,接上氧化管,并使管口微向下倾斜,朝上风向,避免潮湿空气将氧化管弄湿,而污染吸收液,如图1-1所示。
分别以每分钟0.1L、0.3L的流量抽取空气30min。
采样高度为1.5m,若氮氧化物含量很低,可增加采样量,采样至吸收液呈浅玫瑰红色为止。
记录采样时间和地点,根据采样时间和流量,算出采样体积。
把一天分成几个时间段进行采样(7次),如10:300~11:00、11:30~12:00、12:30~13:00、13:30~14:00、14:30~15:00、15:30~16:00、16:30~17:00。
图1-1 氮氧化物采样装置的连接图示2)氮氧化物的测定①标准曲线的绘制:取7支50mL 比色管,按表1-1配制标准系列。
将各管摇匀,避免阳光直射,放置15 min ,以蒸馏水为参比,用1cm 比色皿,在540nm 波长处测定吸光度。
根据吸光度与浓度的对应关系,用最小二乘法计算标准曲线的回归方程式:y = bx + a式中:y ——(A-A 0),标准溶液吸光度(A )与试剂空白吸光度(A 0)之差; x ——NO 2-浓度,μg/mL ;a 、b ——回归方程式的截距和斜率。
ρNO x =76.0)(0⨯⨯--V b a A A式中:ρNO x ——氮氧化物浓度,mg/m 3; A ——样品溶液吸光度; A 0、a 、b 表示的意义同上;V ——标准状态下(25℃,760mmHg )的采样体积,L ;0.76——NO2(气)转换成NO2-(液)的转换系数。

空气中氮氧化物(NOx)的测定(盐酸萘乙二胺分光光度法)摘要:本文采用盐酸萘乙二胺分光光度法测定室内空气中氮氧化物(NOx),根据配置标准溶液用分光光度计测定其吸光度,绘制标准曲线,分析空气中氮氧化物的含量结果。
关键词:氮氧化物分光光度法含量综述大气中氮氧化物主要包括一氧化氮和二氧化氮,其中绝大部分来自于化石燃料的燃烧过程,包括汽车及一切内燃机所排放的尾气,也有一部分来自与生产和使用硝酸的化工厂、钢铁厂、金属冶炼厂等排放的废气中。
动物实验证明,氮氧化物对呼吸道和呼吸器官有刺激作用,是导致目前支气管哮喘等呼吸道疾病不断增加的原因之一,二氧化氮与二氧化硫和浮游颗粒物共存时,其对人体的影响不仅比单独二氧化氮对人体的影响严重的多,而且也大于各自污染物之和。
对人体的实际影响是各污染物之间的协同作用。
因此大气氮氧化物的监测分析是环境保护部门日常工作的重要项目之一。
采用化学发光法测定空气中氮氧化物较以往的盐酸禁乙二胺分光光度法具有灵敏度高、反应速度快、选择性好等特点 ,现已被很多国家和世界卫生组织全球监测系统作为监测氮氧化物的标准方法 ,也已引起我国环保部门的注意和重视 ,相信不久将来 ,此方法也会成为我国环境空气监测氮氧化物的首推方法。
1、实验目的(1)熟悉、掌握小流量大气采样器的工作原理和使用方法;(2)熟悉、掌握分光光度计的工作原理及使用方法。
(3)掌握大气监测工作中监测布点、采样、分析等环节的工作内容及方法。
2、实验原理,测定氮大气中的氮氧化物(NOx)主要是一氧化氮(NO)和二氧化氮(NO2))氧化管将一氧化氮成二氧化氮。
二氧化氧化物浓度时,先用三氧化铬(CrO3),与对氨基苯磺酸起重氧化反应,再与盐氮被吸收在溶液中形成亚硝酸(HNO2酸萘乙二胺偶合,生成玫瑰红色偶氮染料。
于波长540~545之间测定显色溶液的吸光度,根据吸光度的数值换算出氮氧化物的浓度,测定结果以二氧化氮表示。
本法检出限为0.05μg/5mL,当采样体积为6L时,最低检出浓度为0.01μg /m3。

大气中氮氧化物的形成与化学反应机制大气中的氮氧化物(NOx)是指氮氧化物(氮气(N2)氧化产生的化合物)的总称,主要包括一氧化氮(NO)和二氧化氮(NO2)。
它们是大气中的重要污染物,对人类健康和环境造成不良影响。
因此,了解大气中氮氧化物的形成与化学反应机制对于减少这些污染物的排放至关重要。
1. 氮氧化物的来源氮氧化物主要来自燃烧过程,包括工业生产、交通运输和能源消耗等活动产生的废气排放。
具体而言,机动车辆排放是城市大气中氮氧化物的重要来源,尤其是柴油车的排放更为显著。
此外,燃煤、燃油以及其他高温燃烧过程也会释放大量氮氧化物。
森林、农田和废物处理等体系也可释放一定量的氮氧化物。
2. 形成机制氮氧化物的形成涉及多个化学反应。
首先,在高温(1000°C以上)下,氧气和氮气发生反应,生成一氧化氮:N2 + O2 → 2NO。
这个反应在燃烧过程中是主要的氮氧化物形成途径。
其次,一氧化氮会与大气中的氧气进一步反应,生成二氧化氮:2NO + O2 → 2NO2。
在大气中,氮氧化物的平衡浓度主要由一氧化氮和二氧化氮之间的反应控制。
3. 其他影响因素氮氧化物的形成还受到其他环境因素的影响。
温度是一个重要的因素,高温有利于氮氧化物的形成;而低温有助于一氧化氮与氮氧化物的转化为无毒的氮气。
此外,湿度也会影响氮氧化物的浓度。
高湿度条件下,氮氧化物会与大气中的水反应,生成硝酸等氮酸,从而减少氮氧化物的浓度。
4. 化学反应机制大气中氮氧化物的化学反应机制较为复杂。
一氧化氮和二氧化氮可以通过光解反应或与其他气体反应而进一步转化为其他化合物。
例如,一氧化氮可以通过与大气中的臭氧反应生成一氧化氮过氧化物:NO + O3 → NO2 + O2。
一氧化氮过氧化物是重要的臭氧生成物,它与VOC(挥发性有机化合物)在有光照的条件下进行反应,形成下午的臭氧。
此外,大气中的氮氧化物还可以与其他大气污染物发生复杂的化学反应。
例如,氮氧化物可以与二氧化硫(SO2)反应,生成硝酸和亚硫酸:NO2 + SO2 → HNO3 + HSO4。

《环境监测》电子教材氮氧化物的测定一、空气中氮氧化物的现状来源及危害1、空气中氮氧化物的来源氮氧化物是氮和氧的多种化合物的总称,包括一氧化氮、二氧化氮、三氧化二氮、四氧化二氮、五氧化二氮等多种形式,空气中氮氧化物主要以一氧化氮、二氧化氮形式存在。
主要来源于石化燃料高温燃烧和硝酸、化肥等生产排放的废气,以及汽车尾气。
2、空气中氮氧化物的危害一氧化氮是无色、无臭、微溶于水的气体,在大气中易被氧化为二氧化氮。
二氧化氮为红棕色,有强烈刺激性臭味的气体,具有腐蚀性和较强的氧化性,毒性比一氧化氮高4倍,是引起支气管炎、肺损害等等呼吸道疾病的有害气体。
同时,二氧化氮在低温时形成四氧化二氮,二氧化氮和四氧化二氮易于水作用,因此在潮湿空气中除氮氧化物外,尚有硝酸和亚硝酸的存在,易于形成酸雨,危害环境。
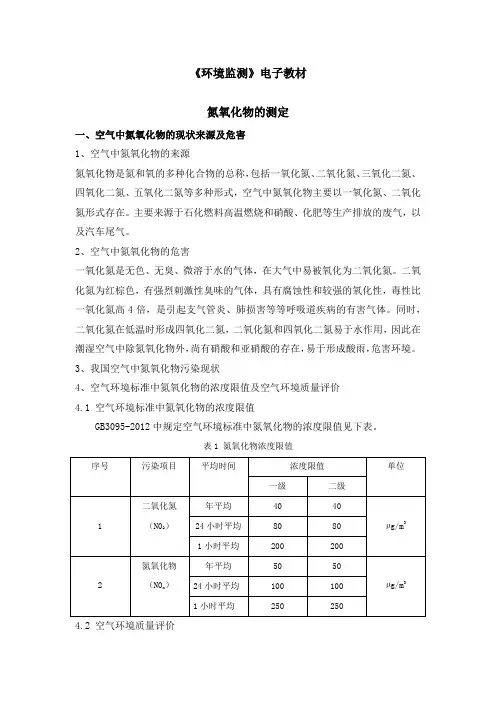
3、我国空气中氮氧化物污染现状4、空气环境标准中氮氧化物的浓度限值及空气环境质量评价4.1 空气环境标准中氮氧化物的浓度限值GB3095-2012中规定空气环境标准中氮氧化物的浓度限值见下表。
表1 氮氧化物浓度限值4.2 空气环境质量评价例:在同一工业区采样测定二氧化氮的浓度,在中午采样测得结果是0.25mg/m3,在傍晚采样测得结果为0.25ppm(10-6).试问日变化中何时的二氧化氮污染严重,是否超标?解:M(NO2)=46,则3460.250.51(/)22.4A mg m⨯==根据GB3095-2012中规定空气环境标准中二氧化氮的浓度限值可知,均超标。
二、氮氧化物分析测定方法依据HJ479-2009《环境空气氮氧化物(一氧化氮和二氧化氮)的测定盐酸萘乙二胺分光光度计》进行分析测定。
1、原理空气中的二氧化氮被串联的第一支吸收瓶中的吸收液吸收并反应生成亚硝酸(HNO2),与对氨基苯磺酸起重氮化反应,再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料。
空气中的一氧化氮不与吸收液反应,通过氧化管时被酸性高锰酸钾溶液氧化成二氧化氮,被串联的第二支吸收瓶中的吸收液吸收并反应生成玫瑰红色偶氮染料。

大气中氮氧化物的测定(盐酸萘乙二胺分光光度法)一、原理大气中的氮氧化物主要是一氧化氮和二氧化氮。
在测定氮氧化物浓度时,应先用三氧化铬将一氧化氮氧化成二氧化氮。
二氧化氮被吸收液吸收后,生成亚硝酸和硝酸,其中,亚硝酸与对氨基苯磺酸发生重氮化反应,再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料,据其颜色深浅,用分光光度法定量。
因为NO2(气)转变为NO2—(液)的转换系数为0.76,故在计算结果时应除以0.76。
二、仪器1.多孔玻板吸收管。
2.双球玻璃管(内装三氧化铬-砂子)。
3.空气采样器:流量范围0-1L/min。
4.分光光度计。
三、试剂所有试剂均用不含亚硝酸根的重蒸馏水配制。
其检验方法是:所配制的吸收液对540nm光的吸光度不超过0.005。
1.吸收液:称取5.0g对氨基苯磺酸,置于1000mL容量瓶中,加入50mL冰乙酸和900mL水的混合溶液,盖塞振摇使其完全溶解,继之加入0.05g盐酸萘乙二胺,溶解后,用水稀释至标线,此为吸收原液,贮于棕色瓶中,在冰箱内可保存两个月。
保存时应密封瓶口,防止空气与吸收液接触。
采样时,按4分吸收原液与1份水的比例混合配成采样用的吸收液。
2.三氧化铬-砂子氧化管:筛取20-40目海砂(或河沙),用(1+2)的盐酸溶液浸泡一夜,用水洗至中性,烘干。
将三氧化铬与砂子按重量比(1+20)混合,加少量水调匀,放在红外灯下或烘箱内于105℃烘干,烘干过程中应搅拌几次。
制备好的三氧化铬-砂子应是松散的,若粘在一起,说明三氧化铬比例太大,可适当增加一些砂子,重新制备。
称取约8g三氧化铬-砂子装入双球玻璃管内,两端用少量脱脂棉塞好,用乳胶管或塑料管制的小帽将氧化管两端密封,备用。
采样时将氧化管与吸收管用一小段乳胶管相接。
3.亚硝酸钠标准贮备液:称取0.1500g粒状亚硝酸钠(NaNO2,预先在干燥器内放置24h以上),溶解于水,移入1000mL容量瓶中,用水稀释至标线。
此溶液每毫升含100.0μgNO2—,贮存于棕色瓶内,冰箱中保存,可稳定三个月。

大气中的氮氧化物(NOx):气相色谱分析介绍氮氧化物(NOx) 是一组高反应性气体,通过燃烧化石燃料(如煤、石油和天然气)以及某些工业过程产生。
它们是造成空气污染的主要原因,会对健康和环境造成严重影响。
在本文中,我们将研究大气中氮氧化物的来源和影响,以及用于测量和控制它们的方法。
大气中氮氧化物的来源当空气中的氮气和氧气在高温下发生反应时会形成氮氧化物,例如在内燃机、发电厂和工业锅炉中发现的那些。
交通运输是氮氧化物排放的主要来源,道路车辆(包括汽车、卡车和公共汽车)占这些排放的大部分。
其他氮氧化物来源包括飞机、越野车辆(如建筑和农业设备)和船舶。
NOx除了由燃烧产生外,还可以通过大气中的化学反应形成。
闪电和森林火灾会产生氮氧化物,农业中使用的某些类型的化肥和杀虫剂也会产生氮氧化物。
氮氧化物对健康和环境的影响NOx 对人类健康和环境有许多负面影响。
它们有助于地面臭氧的形成,这会导致呼吸系统问题,尤其是儿童、老人和哮喘患者。
NOx 还有助于形成颗粒物,这会导致心脏和肺部问题,并可能使过敏和哮喘恶化。
NOx 还会对环境产生负面影响。
它们会导致酸雨,从而破坏农作物、森林和水体。
NOx 还可能导致臭氧层的破坏,臭氧层保护地球免受有害的紫外线(UV) 辐射。
测量大气中的氮氧化物NOx 通常以十亿分之一(ppb) 或百万分之一(ppm) 为单位进行测量。
多种方法用于测量大气中的氮氧化物,包括:1.化学分析仪:这些设备使用化学反应来测量空气中氮氧化物的浓度。
它们通常用于监测工业源(例如发电厂和工厂)的氮氧化物排放。
2.气相色谱法:该方法涉及分离样品中的不同气体,然后使用气相色谱仪测量每种气体的浓度。
这种方法常用于测量环境空气中的氮氧化物。
3.被动采样器:这些设备使用化学反应从空气中吸收氮氧化物,通常用于测量氮氧化物的长期平均浓度。
氮氧化物的控制措施可以采取多种措施来减少氮氧化物排放和改善空气质量。
一些最有效的策略包括:1.规范车辆排放:政府可以对车辆实施更严格的排放标准,或鼓励使用替代交通方式,例如公共交通、自行车或步行。

摘要本文主要介绍了空气中氮氧化物的来源与危害。
氮的氧化物有一氧化氮、二氧化氮、三氧化二氮、四氧化三氮和五氧化二氮等多种形式。
大气中的氮氧化物主要以一氧化氮(NO)和二氧化氮(NO2)形式存在。
一氧化氮为无色、无臭、微溶于水的气体,在大气中易被氧化为NO2。
NO2为棕红色气体,具有强刺激性臭味,是引起支气管炎等呼吸道疾病的有害物质。
大气中的NO和NO2可以分别测定,也可以测定二者的总量。
它们主要来源于石化燃料高温燃烧和硝酸、化肥等生产排放的废气,以及汽车排气。
测定方法化学发光法,盐酸萘乙二胺分光光度法,传感器法,库仑原电池法,阐述了这几种方法的原理,并从优缺点,适用的范围等方面进行了分析对比,为测定以及防治氮氧化物提供了依据。
氮氧化物是评价空气质量的控制标准之一。
空气中的氮氧化物主要包括一氧化氮(NO)和二氧化氮(NO2)。
据有关部门统计,随着工业化生产的迅猛发展,特别是煤炭、石油、天然气的大量开采使用,我国多数城市已呈现出NOx深度增加的趋势。
因此,了解氮氧化物的来源及危害机理,建立适合的氮氧化物的分析方法,了解其变化规律,对环保管理及环境整治,保障人类的生存环境具有重大意义。
AbstractThis paper mainly introduces the source of nitrogen in the air with hazards. Nitrogen oxide have nitric oxide, no2, trioxide nitrogen, four oxidation three nitrogen and five oxidation 2 nitrogen, and other forms. Atmospheric nitrogen oxide mainly nitric oxide (NO) and nitrogen dioxide (NO2) form existence. Nitric oxide is a colourless, odourless, slightly soluble in water, the gas in the atmosphere for easy oxidation alters. NO2 gas, strongly for palm red irritating smell, is a cause bronchitic etc respiratory diseases hazardous substances. The atmosphere were determined aubject and NO2 can, also can determine the amount of both. They mainly comes from fossil fuels temperature combustion and nitric acid, fertilizer and other production exhaust emissions, and vehicle exhaust. Determination methods chemiluminescence method, hydrochloric acid naphthalene ethylenediamine spectrophotometry, sensor method, coulomb YuanDianChi method, expatiated on the principle of these methods, and the advantages and disadvantages, applicable range from aspects was analyzed and compared, and the prevention for determination of nitrogen oxide to provide the basis.No air quality control standard evaluation of one. The air (nitrogen oxide mainly includes nitric oxide (NO) and nitrogen dioxide alters). According to concerning sectional statistic, along with the rapid development of industrial production, especially coal, oil and gas mass exploitation in most cities use, has presented the NOx depth trend of increase. Therefore, understanding the mechanism of nitrogen oxides origin and harm of nitrogen oxides, establish a suitable analysis methods, understand the change rule, to the environmental protection management and controlling the environment, ensuring human survival environment is of great significance.Key word: source ;substances ;nitric oxide目录前言…………………………………………………………………………………( 1 )1.氮氧化物危害…………………………………………………………………( 2 )2.氮氧化物含量测定……………………………………………………………( 2 )3.化学发光法……………………………………………………………………( 2 )3.1化学发光法具有以下几个特点………………………………………………( 2 )3.2基本原理………………………………………………………………………( 3 )3.3荧光和磷光的产生……………………………………………………………( 4 )3.4气相化学发光…………………………………………………………………( 5 )3.5液相化学发光…………………………………………………………………( 6 )3.6激发光谱和发射光谱…………………………………………………………( 6 )3.7测量仪器………………………………………………………………………( 7 )3.8分离取样式……………………………………………………………………( 7 )3.9流动注射式……………………………………………………………………( 7 )3.10影响因素……………………………………………………………………( 10 )3.11化学发光法测定卷烟主流烟气中的氮氧化物……………………………( 10 )4.盐酸萘乙二胺分光光度法…………………………………………………(15 )4.1盐酸萘乙二胺分光光度法的特点…………………………………………( 15 )4.2基本原理……………………………………………………………………( 16 )4.3测定…………………………………………………………………………( 16 )4.4车间空气中氧化氮的盐酸萘乙二胺分光光度测定方法…………………( 17 )5.库仑电池法……………………………………………………………………(20 )6.传感器法………………………………………………………………………( 20 )7.总结……………………………………………………………………………( 20 )参考文献…………………………………………………………………………( 22 )致谢辞……………………………………………………………………………( 23 )。

空气中氮氧化物存在形态
空气中的氮氧化物是指氮气和氧气在大气中发生反应形成的化合物。
这些化合物包括一氧化氮(NO)、二氧化氮(NO2)和三氧化二氮(N2O3),它们的存在形态各异,对环境和人类健康产生不同的影响。
一氧化氮是一种无色无臭的气体,它主要来源于燃烧过程,如汽车尾气、工业排放和化石燃料燃烧等。
一氧化氮在大气中很容易与氧气反应生成二氧化氮,这是一种红棕色气体,有刺激性气味。
二氧化氮是空气中最常见的氮氧化物之一,它对人体呼吸系统有害,会引起呼吸道炎症和气喘等健康问题。
除了一氧化氮和二氧化氮,还有一种氮氧化物叫做三氧化二氮。
三氧化二氮是一种无色气体,它在大气中主要由雷电活动产生。
三氧化二氮是一种强氧化剂,它能与大气中的水蒸气反应生成硝酸,进而形成酸雨。
酸雨对环境和生态系统造成严重破坏,对植物、土壤和水体产生毒性影响。
空气中氮氧化物的存在形态多样,它们与大气中的其他化合物相互作用,形成复杂的化学体系。
这些化合物不仅对环境造成影响,还对人类健康产生潜在的危害。
因此,减少氮氧化物的排放,控制空气污染,保护环境和人类健康是当务之急。
只有通过全社会的共同努力,才能实现清洁空气的目标,创造一个更加美好的未来。

空气中氮氧化物含量的测定方法1 空气中氮氧化物含量测定方法本文主要介绍了空气中氮氧化物的来源与危害。
氮的氧化物有一氧化氮、二氧化氮、三氧化二氮、四氧化三氮和五氧化二氮等多种形式。
大气中的氮氧化物主要以一氧化氮NO和二氧化氮NO2形式存在。
一氧化氮为无色、无臭、微溶于水的气体在大气中易被氧化为NO2。
NO2为棕红色气体具有强刺激性臭味是引起支气管炎等呼吸道疾病的有害物质。
大气中的NO和NO2可以分别测定也可以测定二者的总量。
它们主要来源于石化燃料高温燃烧和硝酸、化肥等生产排放的废气以及汽车排气。
测定方法化学发光法盐酸萘乙二胺分光光度法传感器法库仑原电池法阐述了这几种方法的原理并从优缺点适用的范围等方面进行了分析对比为测定以及防治氮氧化物提供了依据。
氮氧化物是评价空气质量的控制标准之一。
空气中的氮氧化物主要包括一氧化氮NO和二氧化氮NO2 。
据有关部门统计随着工业化生产的迅猛发展特别是煤炭、石油、天然气的大量开采使用我国多数城市已呈现出NOx深度增加的趋势。
因此了解氮氧化物的来源及危害机理建立适合的氮氧化物的分析方法了解其变化规律对环保管理及环境整治保障人类的生存环境具有重大意义。
空气中氮氧化物含量的测定方法2 1.氮氧化物危害NOx 对环境的损害作用极大它既是形成酸雨的主要物质之一也是形成大气中光化学烟雾的主要物质和消耗臭氧的一个重要因子。
氮氧化物对眼睛和上呼吸道粘膜刺激较轻主要侵入呼吸道深部的细支气管及肺泡。
当NOx进入肺泡后因肺泡的表面湿度增加反应加快在肺泡内约可阻留80一部分变为N2O4。
N2O4与NO2均能与呼吸道粘膜的水分作用生成亚硝酸与硝酸对肺组织产生强烈的刺激及腐蚀作用从而增加毛细血管及肺泡壁的通透性引起肺水肿。
亚硝酸盐进入血液后还可引起血管扩张血压下降并可与血红蛋白作用生成高铁血红蛋白引起组织缺氧。
高浓度的NO 亦可使血液中的氧和血红蛋白变为高铁血红蛋白引起组织缺氧。
因此在一般情况下当污染物以NO2为主时对肺的损害比较明显严重时可出现以肺水肿为主的病变。

空气中氮氧化物的日变化曲线XXX(XX大学环境与化学工程学院环境科学专业091班,辽宁大连 116622)1概述1.1研究背景1.1.1氮氧化物的来源大气中氮氧化物(NOx)包括多种化合物,如一氧化氮、二氧化氮、三氧化二氮、四氧化二氮和五氧化二氮,除二氧化氮以外,其他氮氧化物极不稳定,遇光、湿或热变成二氧化氮或一氧化氮,一氧化氮不稳定又变成二氧化氮。
因此大气污染化学中的氮氧化物主要指的是一氧化氮和二氧化氮。
其主要来自天然过程,如生物源、闪电均可产生NOx 。
NOx的人为源绝大部分来自化石燃料的燃烧过程,包括汽车及一切内燃机所排放的尾气,也有一部分来自生产和使用硝酸的化工厂、钢铁厂、金属冶炼厂等排放的废气,其中以工业窑炉、氮肥生产和汽车排放的NOx 量最多。
城市大气中2/3的NOx来自汽车尾气等的排放,交通干线空气中NOx的浓度与汽车流量密切相关,而汽车流量往往随时间而变化,因此,交通干线空气中NOx的浓度也随时间而变化。
1.1.2氮氧化物的危害NO的生物化学活性和毒性都不如NO2,同NO2一样,NO也能与血红蛋白结合,并减弱血液的输氧能力。
如果NO2的体积分数为(50—100)×10-6时,吸入时间为几分钟到一小时,就会引起6—8周肺炎; 如果NO2的体积分数为(150—200)×10-6时,就会造成纤维组织变性性细支气管炎,及时治疗,将于3—5不周后死亡。
在实验室,NO2体积分数达到10-6级,植物叶片上就会产生斑点,显示植物组织遭到破坏。
体积分数为10-5级的NO2会引起植物光合作用的可逆衰减。
此外,NOx还是导致大气光化学污染的重要物质。
1.1.3氮氧化物的环境浓度NOx的环境本底值随地理位置不同具有明显的差别,Robinson等人综合有关资料认为:在北纬650和南纬650之间的陆地上空,NO的本底值为2×10-9,NO2的本底值4×10-9;世界其他各地NO约为0.2×10-9,NO2约为0.5×10-9;全球总平均值NO为1.0×10-9,NO2为2.0×10-9。
大气环境中氮氧化物的迁移与转化过程氮氧化物(NOx)是一类重要的大气污染物,包括一氧化氮(NO)和二氧化氮(NO2)。
它们主要来自于工业排放、机动车尾气以及燃煤等能源的燃烧过程。
氮氧化物的排放不仅对空气质量和人类健康造成直接影响,还与臭氧和细颗粒物的生成密切相关。
因此,了解氮氧化物在大气环境中的迁移与转化过程对于改善空气质量至关重要。
1. 氮氧化物的迁移氮氧化物在大气中的迁移受到多种因素的影响,包括气象条件、大气稳定度和氮氧化物浓度等。
氮氧化物在大气中的迁移主要通过对流扩散、湍流扩散和大气输送等方式进行。
对流扩散是指由于气温的变化导致气体的上升和下沉,从而使氮氧化物向上或向下扩散。
湍流扩散是指由于湍流的存在,使氮氧化物从一个地方向周围环境进行扩散。
大气输送是指氮氧化物在大气中随着气流的移动而迁移。
2. 氮氧化物的转化氮氧化物在大气中的转化是指氮氧化物之间的化学反应过程,主要包括光解、氧化、光化和光解的反应。
在光解反应中,氮氧化物可以通过吸收太阳辐射而分解成氧和氮气,从而减少氮氧化物的浓度。
在氧化反应中,氮氧化物可以与其他气体(如臭氧、挥发性有机物等)发生反应,生成新的化合物,如硝酸和硝酸盐。
在光化反应中,氮氧化物可以与有机物质一起吸收太阳辐射,产生臭氧,从而形成光化学烟雾。
在光解反应中,氮氧化物可以通过光解而分解成氮气和氧气。
3. 影响氮氧化物迁移与转化的因素除了气象条件和大气稳定度等因素外,还有一些其他因素可以影响氮氧化物在大气中的迁移与转化。
例如,大气中的颗粒物可以吸附氮氧化物,使其在大气中的浓度下降。
此外,氮氧化物的迁移与转化还受到地形和植被等因素的影响。
地形的不同会导致氮氧化物在山地和平原地区的迁移模式不同。
植被可以通过吸收氮氧化物和排放挥发性有机物等方式,影响氮氧化物的浓度和分布。
总之,大气环境中氮氧化物的迁移与转化过程是一个复杂的系统。
了解氮氧化物的迁移与转化对于制定有效的大气污染控制措施和改善空气质量至关重要。
NOx的主要危害空气中含氮的氧化物有一氧化二氮(N2O)、一氧化氮(NO)、二氧化氮(NO2)、三氧化二氮(N2O3}等,其中占主要成分的是一氧化氮和二氧化氮,以NOx(氮氧化物)表示。
NO2比NO的毒性高4倍,可引起肺损害,甚至造成肺水肿。
慢性中毒可致气管、肺病变。
吸入NO,可引起变性血红蛋白的形成并对中枢神经系统产生影响。
NOx对动物的影响浓度大致为1.0毫克/立方米,对患者的影响浓度大致为0.2毫克/立方米。
据北京、上海、天津、沈阳、太原等地的调查表明,这些城市的SO2和NO、重污染区内居民的慢性支气管炎、鼻炎、鼻咽炎患病率比轻污染区高0.5—1倍,个别城市甚至高2-3倍。
NOx除直接危害人体健康外,还通过各种间接方式危害人体健康,破坏生态环境。
NOx的最大危害是NOx与CH化合物在强阳光作用下生成一种浅蓝色的有毒烟雾—光化学烟雾,这种以O, P AN(过氧乙酞基硝酸酷)和H2SO4为主要成分的光化学烟雾对人的眼、鼻、心、肺及造血组织等均有强烈的刺激和损害作用,而且PA N还具有致癌作用。
氧化亚氮(N2O)在高空同温层中会破坏臭氧层,使较多得紫外线辐射到地面,增加皮肤癌的发病率,还可能影响人的免疫系统。
此外,N2O吸收红外线的能力是CO2的两倍以上,大气中的N2O加剧了全球的温室效应。
NOx除了与VOC发生光化学反应生成高浓度O3,还会在大气臭氧层与O3反应消耗O3。
众所周知,大气层上空12—25k m范围内的臭氧层担当着吸收紫外线(240 -320nm ),使人类免受紫外线过度辐照伤害的角色。
但是目前局部大气臭氧层己被人类活动所排放的NOx等气体所破坏,形成所谓的“臭氧洞”,并且“臭氧洞”的面积正在逐渐扩大,对人类自身安全产生越来越大的威胁,臭氧层破坏造成的紫外线过度照射将引发人的眼睛疾病和皮肤癌。
SO2, NOx在大气中和氧结合形成硫酸盐和硝酸盐离子,遇到水雾就会形成酸雨和酸雾,破坏植被,酸化土壤,酸化水域,造成水生和陆地生态失衡,加速岩石风化和金属腐蚀。
氮氧化物的形成原因
氮氧化物(NOx)的形成主要有两种方式:
1.空气中的氮气和氧气在高温条件下相互作用形成。
这种过程通常发生在高温燃烧或工业过程中,例如汽车发动机、燃煤发电站和化工厂。
在这些过程中,高温条件会导致氮气和氧气分子分裂成单个原子,然后重新结合成氮氧化物。
2.燃料中含有氮元素,在其燃烧过程中与氧气发生反应,从而生产氮氧化物。
然而,选择和燃烧温度来决定氮氧化物产生的高低。
例如:煤和天然气产生的氮氧化物会有所不同,同样的燃料,在不同温度燃烧,产生的氮氧化物也不同,燃烧温度越高,氮氧化物产生量也就越多。
因此,控制燃料中氮元素的含量以及燃烧过程中的温度都可以有效降低氮氧化物的排放。
空气中氮氧化物标准
空气中氮氧化物是指一类污染物,主要包括一氧化氮(NO)和二氧化氮
(NO2)。
它们是大气污染物中的重要组成部分,对人体健康和环境造成严重影响。
因此,各国都制定了空气中氮氧化物的排放标准,以保护大气环境和人民健康。
首先,空气中氮氧化物的排放标准是根据国家的环境保护法规和大气污染防治
要求制定的。
这些标准通常包括大气中氮氧化物的浓度限值、排放标准和监测要求等内容。
通过严格的监测和控制,可以有效减少氮氧化物对大气环境的污染。
其次,空气中氮氧化物的排放标准对于工业生产和交通运输等领域都有具体的
要求。
工业企业在生产过程中必须严格控制氮氧化物的排放,采取有效的污染治理措施,确保排放浓度不超过国家规定的限值。
对于交通运输领域,汽车尾气中的氮氧化物排放也受到严格的监管,要求车辆使用低排放技术,减少氮氧化物的排放量。
此外,空气中氮氧化物的排放标准还涉及到城市规划和建设。
城市规划部门在
规划新的工业区和居住区时,需要考虑氮氧化物的排放标准,避免污染物对居民生活的影响。
建设工程也需要按照相关标准进行设计和施工,减少氮氧化物的排放。
总的来说,空气中氮氧化物的排放标准是保护大气环境和人民健康的重要举措。
各国都在不断完善相关法规和标准,加强对氮氧化物排放的监管和治理。
只有通过严格的标准和有效的措施,才能实现大气环境的持续改善,为人们创造一个更加清洁、健康的生活环境。
氮氧化物检测标准氮氧化物(NOx)是一类有害气体,主要包括一氧化氮(NO)、二氧化氮(NO2)和三氧化二氮(N2O3)等。
它们主要来源于高温燃烧过程、工业生产及交通运输等。
氮氧化物对人体健康和环境具有较大危害,因此需要对空气中的氮氧化物进行检测。
以下是一些常见的氮氧化物检测标准。
1.《固定污染源废气氮氧化物的测定定电位电解法》HJ693-2014:这是我国关于氮氧化物检测的一个标准,主要规定了使用定电位电解法检测固定污染源废气中氮氧化物的方法。
2.《环境空气氮氧化物(一氧化氮和二氧化氮)的测定盐酸萘乙二胺分光光度法》:这是一个关于环境空气中氮氧化物检测的标准方法,适用于测定空气中一氧化氮和二氧化氮的浓度。
3.《氮氧化物国家标准》:这个标准规定了氮氧化物的排放浓度限值,适用于各类污染源,如工业炉窑、发电厂等。
4.《恶臭污染物排放标准》(GB14554-93):这个标准规定了氮氧化物排放浓度限值,参照表2的方法进行连续监测,氮氧化物月均值不超过标准规定的限值。
5.《室内一氧化碳检测标准》:这个标准规定了室内一氧化碳、二氧化碳和甲烷组分的分项测定方法,可以用于氮氧化物检测的参考。
在进行氮氧化物检测时,需要关注以下几个方面。
1.检测方法的准确性:选择合适的检测方法,确保检测结果的准确性。
2.检测设备的可靠性:使用可靠的检测设备,如氮氧化物检测仪,确保检测系统的稳定运行。
3.检测标准的适用性:根据具体情况,选择适用于当前场景的检测标准。
4.检测数据的处理和分析:对检测数据进行合理处理和分析,以满足相关法规和标准的要求。
5.检测过程中的安全防护:在检测过程中,注意安全防护,避免对人体和环境造成危害。
大气环境中氮氧化物的浓度分布特征分析大气环境中氮氧化物(NOx)是一类重要的空气污染物,其浓度分布特征对于了解大气污染情况和制定相应的环境保护措施具有重要意义。
一、影响大气中氮氧化物浓度分布的因素大气中的氮氧化物主要来自两个方面:一是人类活动的排放,如工业生产、交通运输以及能源消耗等;二是自然源,如火山喷发、生物过程和闪电等。
人类活动的排放是大气中氮氧化物的主要来源。
工业生产过程中,燃煤、燃油等导致燃烧反应的产生,进而释放大量的氮气和氧气,形成氮氧化物。
交通运输过程中,车辆的燃烧排放以及尾气中的氮化物,也是大气中NOx的重要来源。
此外,能源消耗也会导致氮氧化物的产生。
自然源是大气中NOx的另一个重要来源。
火山喷发会释放大量的气体和颗粒物,其中也包括NOx。
生物过程中,例如植物的新陈代谢和土壤中的微生物活动等,也会产生一定量的氮氧化物。
此外,闪电放电也会导致大气中NOx的释放。
总结以上因素,大气中NOx浓度分布受到人类活动和自然因素的综合影响,各区域之间的浓度存在差异,而且在不同的时间尺度上也存在明显的变化。
二、大气中氮氧化物浓度分布的空间特征大气中氮氧化物浓度的空间分布具有明显的区域差异。
城市地区通常是浓度较高的地带,主要是由于工业和交通的排放所致。
尤其是工业园区周围、交通枢纽以及市中心,氮氧化物浓度往往更高。
此外,山区和沿海地区也容易受到大气氮氧化物的污染,尤其是山谷气候条件下的城市容易形成氮氧化物的滞留。
同时,气象条件也对大气中NOx浓度的分布产生一定的影响。
风向和风速是影响附近地区氮氧化物浓度的重要参数。
风向决定了氮氧化物在大气中的传输方向,风速则影响传输的速率。
例如,风速较低和风向不利的情况下,城市周边地区的氮氧化物容易聚集,并导致高浓度区域的形成。
此外,大气中氮氧化物浓度的季节变化也是需要关注的因素。
夏季,氮氧化物的浓度往往较低,主要是由于高温、强光和湿度的作用下,氮氧化物发生一系列的化学反应和光解反应,从而影响了其浓度。
空气中氮氧化物(NOx)的测定
(盐酸萘乙二胺分光光度法)
1、实验目的
(一)熟悉、掌握小流量大气采样器的工作原理和使用方法;
(二)熟悉、掌握分光光度分析方法和分析仪器的使用;
(三)掌握大气监测工作中监测布点、采样、分析等环节的工作内容及方法。
2、实验原理
大气中的氮氧化物(NOx)主要是一氧化氮(NO)和二氧化氮(NO2),测定氮氧化物浓度时,先用三氧化铬(CrO3)氧化管将一氧化氮成二氧化氮。
二氧化氮被吸收在溶液中形成亚硝酸(HNO2),与对氨基苯磺酸起重氧化反应,再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料。
于波长540~545之间测定显色溶液的吸光度,根据吸光度的数值换算出氮氧化物的浓度,测定结果以二氧化氮表示。
本法检出限为0.05μg/5mL,当采样体积为6L时,最低检出浓度为0.01μg /m3。
3、实验仪器和试剂
(一)实验用仪器
除一般通用化学分析仪器外,还应具备:多孔玻板吸收管、空气采样器(KC—6型)、双球玻璃氧化管(内装涂有三氧化铬催化剂的石英砂)、分光光度计(7220型)、KC—6D型大气采样器
(二)实验用试剂
所有试剂均用不含硝酸盐的重蒸蒸馏水配制。
检验方法是要求用该蒸馏水配制的吸收液的吸光度不超过0.005(540~545nm,10mm比色皿,水为参比)。
1. 显色液:称取5.0克对氨基苯磺酸,置于200毫升烧杯中,将50毫升冰醋酸与900毫升水的混合液分数次加入烧杯中,搅拌使其溶解,并迅速转入1000毫升棕色容量瓶中,待对氨基苯磺酸溶解后,加入0.03克盐酸萘乙二胺,用水稀释至标线,摇匀,贮于棕色瓶中。
此为显色液,25℃以下暗处可保存一月。
采样时,按四份显色液与一份水的比例混合成采样用的吸收液。
2. 三氯化铬—砂子氧化管:将河砂洗净,晒干,筛取20~40目的部分,用
(1+2)的盐酸浸泡一夜后用水洗至中性后烘干。
将三氧化铬及砂子按(1+20)的重量混合,加少量水调匀,放在红处灯下或烘箱里于105℃烘干,烘干过程中应搅拌数次。
做好的三氧化铬—砂子应是松散的,若粘在一起,说明三氧化铬比例太少,可适当加一些砂子,重新制备。
将三氧化铬—砂子装入双球玻璃管中,两端用脱脂棉塞好,并用塑料管制的小帽将氧化管的两端盖紧,备用。
3. 亚硝酸钠标准贮备液:将粒状亚硝酸钠(优级纯)在干燥器内放置24小时,称取0.3750克溶于水,然后移入1000毫升容量瓶中,用水稀释至标线。
此溶液每毫升含250微克NO 2-,贮于棕色瓶中,存放在冰箱里,可稳定三个月。
4. 亚硝酸钠标准水溶液:临用前,吸取1.00毫升亚硝酸纳标准贮备液于100毫升容量瓶中,用水稀释至标线。
此溶液每毫升含2.5微克NO 2-。
4、实验步骤
1. 采样:将10毫升采样用的吸收液注入多孔玻板吸收管中,吸收管的进气口接三氧化铬—砂子氧化管,并使氧化管的进气端略向下倾斜,以免潮湿空气将氧化剂弄湿污染后面的吸收管。
吸收管的出气口与大气采样器相连接,以0.4升/分的流量避光采样至吸收液呈浅玫瑰红色为止(采气4~24升)。
如不变色,应加大采样流量或延长采样时间。
在采样同时,应检测采样现场的温度和大气压力,并做好记录。
2. 测定步骤:
①标准曲线的绘制:取6支10毫升比色管,按表1所列数据配制标准色列。
测定二氧化氮时所配制的标准色列
加完试剂后,摇匀,避免阳光直射,放置20分钟,用1厘米比色皿,于波长540纳米处,以水为参比,测定吸光度。
扣除空白试剂的吸光度以后,对应NO 2-的浓度ug/mL,用最小二乘法计算标准曲线的回归方程。
用测得的吸光度对5毫升溶液中亚硝酸根离子含量(微克)绘制标准曲线,并计算各点比值。
②样品的测定:采样后,室温放置二十分钟,20℃以下时放置四十分钟以上。
将吸收液移入比色皿中,与标准曲线绘制时的条件相同测定空白和样品的吸光度。
5、实验结果与数据处理
1. 计算:
氮氧化物(NO2−,mg/m3)
式中: A—试样溶液的吸光度;
A0—空白液的吸光度;
a—标准曲线截距;
b—标准曲线斜率;
Vr—换算为参比状态下的采样体积;
f—实验系数(0.88),当空气中NO2的浓度高于0.720 mg/m3时,为0.77;
D—气样吸收液稀释倍数
2. 注意事项:
①配制吸收液时,应避免在空气中长时间曝露,以免吸收空气中的氮氧化物。
光照射能使吸收液显色,因此在采样、运送及存放过程中,都应采取避光措施。
②采样过程中,如吸收液体积显著缩小,要用水补充到原来的体积(应预先作好标记)。
③氧化管应于相对湿度为30%~70%时使用,当空气相对湿度大于70%时,应勤换氧化管;小于30%时,在使用前,用经过水面的潮湿空气通过氧化管,平衡1小时后再使用。
6、讨论
(一)小流量大气采样器的基本组成部分及其所起作用。
(二)简要说明盐酸萘乙二胺分光光度法测定大气中NOx的原理和测定过程。
(三)分析影响测定准确度的因素,如何消减或杜绝在样品采集、运输和测定过程中引进的误差。