2020届全国高考化学专题复习 电化学
- 格式:pptx
- 大小:2.74 MB
- 文档页数:57

专题04电化学2020年考纲考点2020考纲要求1、理解原电池和电解池的构成、工作原理及应用,能书写电极反应和总反应方程式。
2、了解常见化学电源的种类及其工作原理。
3、了解金属发生电化学腐蚀的原因、金属腐蚀的危害以及防止金属腐蚀的措施。
IIIIII III本节考向题型研究汇总题型考向考点/考向考试要求选择题电化学知识综合应用III填空题电极反应式、计算III 考向题型研究(一)原电池1.(2013·全国I·T10)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。
根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器漫入该溶液中,一段时间后发现黑色会褪去。
下列说法正确的是()A.处理过程中银器一直保持恒重B.银器为正极,Ag2S被还原生成单质银C.该过程中总反应为2Al+3Ag2S=6Ag+A12S3D.黑色褪去的原因是黑色Ag2S转化为白色AgCl【答案】B【解析】根据题意,首先这个过程是电化学过程,而在整个过程中并未有外接电源,所以判断为原电池过程。
原电池过程一定有一个自发的氧化还原反应,我们根据题意可以寻找到氧化剂和还原剂以及应该发生的反应。
首先,还原剂应该是金属Al,氧化剂是Ag2S,产物自然是Ag和A12S3,发生置换反应,但是考虑到该反应是在溶液中进行,而A12S3在水溶液中发生双水解,生成Al(OH)3和H2S,所以最终总方程式为:2Al+3Ag2S+6H2O=6Ag+2Al(OH)3↓+3H2S↑,其中氧化剂Ag2S所在电极为正极,即银器所在极为正极,Al所在极为负极。
综上所述,B正确。
1.(2019·全国I·T12)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。
下列说法错误的是A.相比现有工业合成氨,该方法条件温和,同时还可提供电能B.阴极区,在氢化酶作用下发生反应H 2+2MV2+2H++2MV+C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3D.电池工作时质子通过交换膜由负极区向正极区移动【答案】B【解析】由生物燃料电池的示意图可知,左室MV+失电子发生氧化反应生成MV2+,电极反应式为MV+—e—=MV2+,所以左室电极为燃料电池的负极,左室区因为发生氧化反应也可称为阳极区,放电生成的MV2+在氢化酶的作用下与H2反应生成H+和MV+,反应的方程式为H2+2MV2+=2H++2MV+;右室MV2+得电子发生还原反应生成MV+,电极反应式为MV2++e—=MV+,所以右室电极为燃料电池的正极,右室区因为发生还原反应也可称为阴极区,放电生成的MV+与N2在固氮酶的作用下反应生成NH3和MV2+,反应的方程式为N2+6H++6MV+=6MV2++NH3,电池工作时,氢离子作为阳离子通过交换膜由负极向正极移动。


2020届高考二轮复习电化学专题:第6节金属的电化学腐蚀与防护1、下列有关金属腐蚀的认识中正确的是( )A. 金属被腐蚀时发生的全部是氧化还原反应B. 金属腐蚀可以分为化学腐蚀和电化腐蚀,只有化学腐蚀是氧化还原反应C. 防止钢铁被腐蚀不需要避免它受潮D. 钢铁发生腐蚀时以发生化学腐蚀为主2、下列说法中,不正确的是( )A.电解饱和食盐水或熔融氯化钠时,阳极电极反应式均为2Cl--2e-===Cl2↑B.酸性介质或碱性介质的氢氧燃料电池的正极反应式均为O2+2H2O+4e-===4OH-C.精炼铜和电镀铜时,与电源负极相连的电极反应式均为Cu2++2e-===CuD.钢铁发生吸氧腐蚀和析氢腐蚀的负极反应式均为Fe-2e-===Fe2+3、铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是()A.正极电极反应式为:2H++2e- = H2↑B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3C.此过程中铜并不被腐蚀D.此过程中电子从Fe移向Cu4、铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。
下列说法中,不正确...的是( )A. 腐蚀过程中铜极上始终只发生:2H+ + 2e-= H2↑B. 若水膜中溶有食盐将加快铁铆钉的腐蚀C. 若在金属表面涂一层油脂能防止铁铆钉被腐蚀D. 若将该铜板与直流电源负极相连,则铁铜均难被腐蚀5、研究电化学腐蚀及防护的装置如图所示。
下列有关说法错误的是( )A.d为石墨,铁片腐蚀加快B.d为石墨,石墨上电极反应为O2+2H2O+4e-=4OH-C.d为锌块,铁片易被腐蚀D.d为锌块,外电路中电子流向为锌块→铁片6、下列叙述不正确...的是( )A.在海轮外壳上镶锌块,可减缓船体的腐蚀B.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气最终转化为铁锈C.生铁中含有碳,抗腐蚀能力比纯铁弱D.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈7、据了解,铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。
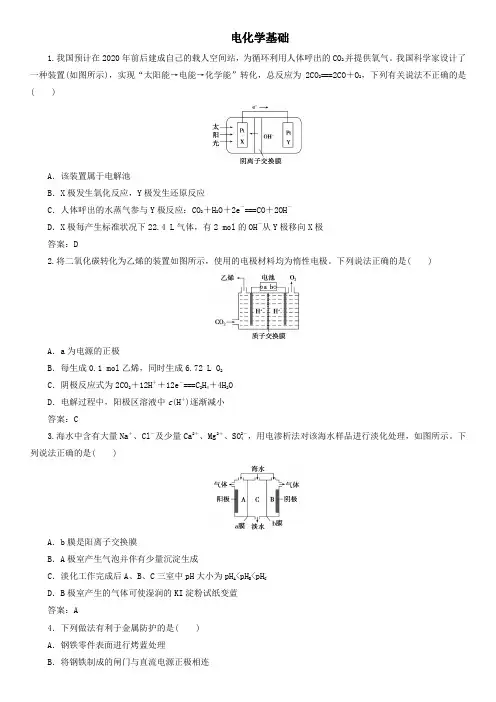
电化学基础1.我国预计在2020年前后建成自己的载人空间站,为循环利用人体呼出的CO2并提供氧气。
我国科学家设计了一种装置(如图所示),实现“太阳能→电能→化学能”转化,总反应为2CO2===2CO+O2,下列有关说法不正确的是( )A.该装置属于电解池B.X极发生氧化反应,Y极发生还原反应C.人体呼出的水蒸气参与Y极反应:CO2+H2O+2e-===CO+2OH-D.X极每产生标准状况下22.4 L气体,有2 mol的OH-从Y极移向X极答案:D2.将二氧化碳转化为乙烯的装置如图所示,使用的电极材料均为惰性电极。
下列说法正确的是( )A.a为电源的正极B.每生成0.1 mol乙烯,同时生成6.72 L O2C.阴极反应式为2CO2+12H++12e-===C2H4+4H2OD.电解过程中,阳极区溶液中c(H+)逐渐减小答案:C3.海水中含有大量Na+、Cl-及少量Ca2+、Mg2+、SO2-4,用电渗析法对该海水样品进行淡化处理,如图所示。
下列说法正确的是( )A.b膜是阳离子交换膜B.A极室产生气泡并伴有少量沉淀生成C.淡化工作完成后A、B、C三室中pH大小为pH A<pH B<pH CD.B极室产生的气体可使湿润的KI淀粉试纸变蓝答案:A4.下列做法有利于金属防护的是( )A.钢铁零件表面进行烤蓝处理B.将钢铁制成的闸门与直流电源正极相连C.菜刀切菜后不洗净就放回刀架D.埋在地下的钢管与铜块相连答案:A5.(·泉州一模)锂空气电池是一种新型的二次电池,其放电时的工作原理如下图所示。
下列说法正确的是( )A.电解液中,Li+由多孔电极迁移向锂电极B.该电池放电时,负极发生了还原反应C.充电时,电池正极的反应式为Li2O2===2Li++O2↑+2e-D.电池中的电解液可以是有机电解液或稀盐酸等答案:C6.一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+。

专题09 电化学基本原理1.【2020新课标1卷】最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。
示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:①EDTA-Fe2+-e-=EDTA-Fe3+②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+该装置工作时,下列叙述错误的是A.阴极的电极反应:CO2+2H++2e-=CO+H2OB.协同转化总反应:CO2+H2S=CO+H2O+SC.石墨烯上的电势比ZnO@石墨烯上的低D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性【答案】C【解析】考点定位:考查电化学原理的应用、电极反应式书写、铁盐与亚铁盐的性质等【试题点评】准确判断出阴阳极是解答的关键,注意从元素化合价变化的角度去分析氧化反应和还原反应,进而得出阴阳极。
电势高低的判断是解答的难点,注意从物理学的角度借助于阳极与电源的正极相连去分析。
2.【2020新课标2卷】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。
将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO 2+4Na2Na2CO3+C。
下列说法错误的是A.放电时,ClO4-向负极移动B.充电时释放CO2,放电时吸收CO2C.放电时,正极反应为:3CO2+4e−=2CO32-+CD.充电时,正极反应为:Na++e−=Na【答案】D【解析】考点定位:考查新型二次电池,涉及电极反应式书写、离子移动方向判断等【试题点评】本题以我国科学家发表在化学顶级刊物上的“一种室温下可呼吸的钠、二氧化碳二次电池”为载体考查了原电池和电解池的工作原理,掌握原电池和电解池的工作原理是解答的关键,注意充电与发电关系的理解。
本题很好的弘扬了社会主义核心价值观个人层面的爱国精神,落实了立德树人的教育根本任务。
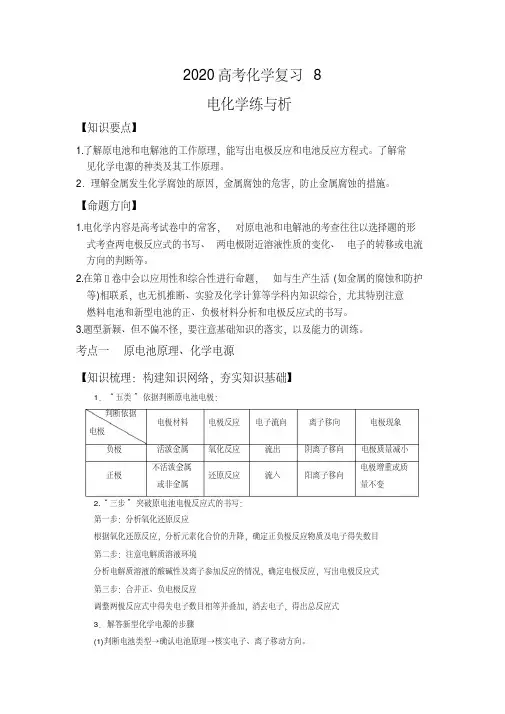

直流电源2020届高考化学专项提分练习 电化学(含答案)1.针对右图装置的说法中,正确是()A .溶液中pH 值明显下降B .铁片为正极,镀锌铁片为负极C .阴极的电极反应式:Fe -2e → Fe 2+D .电子由锌经溶液流向铁 【答案】B2.以石墨为电极分别电解水和饱和食盐水,关于两个电解池反应的说法正确的是 ( ) A .阳极反应式相同 B .电解结束后所得液体的pH 相同C .阴极反应式相同D .通过相同电量时生成的气体总体积相等(同温同压)【答案】C3.某原电池反应的离子方程式为:Zn + 2H +→ Zn 2+ + H 2↑,关于此原电池下列说法正确的是 ()A .HNO 3可作电解质溶液B .在电解质溶液中电子从正极流向负极C .锌极质量不变D .该原电池的正极材料可以为铁【答案】D4.如图用石墨电极电解CuCl 2溶液。
下列分析正确的是()A .a 极发生还原反应B .每生成6.4 g Cu ,转移电子0.2 molC .阳极反应式:2Cu 2e Cu ++→D .在直流电源中电流从b 流向a 【答案】B5.用石墨电极电解CuCl 2溶液(见右图)。
下列分析正确的是()A .通电使CuCl 2发生电离B .a 端是直流电源的负极C .阳极上发生的反应:Cu 2++2e - →CuD .通电一段时间后,在阴极附近观察到黄绿色气体 【答案】B6.将碳棒和铁棒平行插入NaCl 溶液,两棒的液面以上部分用铜丝相联并接入电流计,电流计指针偏转。
以下说法正确的是( ) A .电子自碳棒通过溶液流向铁棒B .电子自铁棒通过铜丝流向碳棒C .溶液中的H +得到电子放出H 2D .铜丝失去电子发生氧化反应【答案】B7.石墨作电极电解氯化铜溶液,(右图),下列分析正确的是()A .a 端是直流电源的负极B .通电使氯化铜发生电离C .阳极上发生的反应:Cu 2++2e→CuD .通电一段时间,在阴极附近观察到有黄绿色气体产生 【答案】A8.右图为阳离子交换膜法电解饱和食盐水原理示意图,其中的阳离子交换膜仅允 许Na +通过。
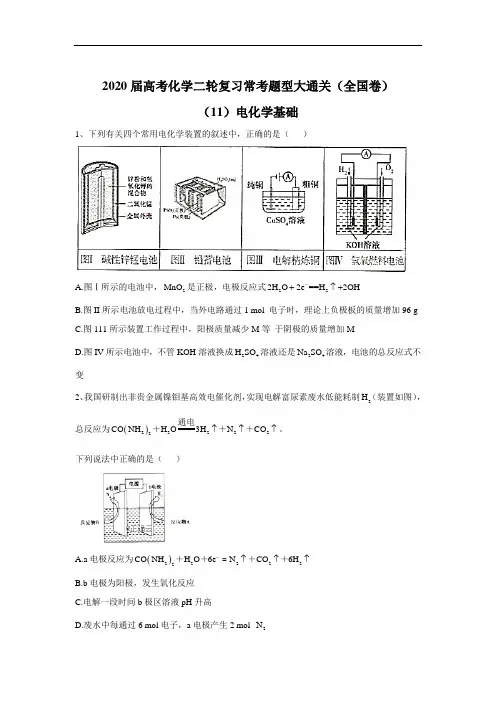
2020届高考化学二轮复习常考题型大通关(全国卷)(11)电化学基础1、下列有关四个常用电化学装置的叙述中,正确的是( )A.图Ⅰ所示的电池中,2MnO 是正极,电极反应式2-2O e ==O 2H 2H 2H -↑++B.图II 所示电池放电过程中,当外电路通过1 mol 电子时,理论上负极板的质量增加96 gC.图111所示装置工作过程中,阳极质量减少M 等 于阴极的质量增加MD.图IV 所示电池中,不管KOH 溶液换成24H SO 溶液还是24Na SO 溶液,电池的总反应式不变2、我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制2H (装置如图),总反应为()222222CO NH H O3H N CO ↑↑↑通电+++。
下列说法中正确的是( )A.a 电极反应为()222222CO NH H O 6e N CO 6H -↑↑↑++++=B.b 电极为阳极,发生氧化反应C.电解一段时间b 极区溶液pH 升高D.废水中每通过6 mol 电子,a 电极产生2 mol 2N3、电解合成 1 , 2-二氯乙烷的实验装置如下图所示。
下列说法中正确的是( )A.该装置工作时,化学能转变为电能B.2CuCl 能将24C H 还原为 l , 2-二氯乙烷C.X 、Y 依次为阳离子交换膜、阴离子交换膜D.该装置总反应为222222CH =CH +2H O+2NaCl===H +2NaOH+ClCH CH Cl 电解4、伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间都夹放着几张盐水泡过的布。
如图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积时成。
下列说法正确的是( )A.该原电池正极的电极反应式为O 2+4e -+4H +2H 2OB.电池长时间工作后,中间的布上会有白色固体颗粒生成,该固体颗粒为Ag 2OC.当电路中转移0.2 mol 电子时,消耗锌板的总质量为52 gD.该伏打电堆工作时,在银板附近会有Cl 2放出5、三元电池成为2018年我国电动汽车的新能源,其电极材料可表示为23+42Li Ni Co Mn O z x y ++,且x +y+z=1。

2020年高考化学试题分类汇编——电化学1.(2020年安徽理综·12)Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O↑。
下列说法正确的是A.石墨电极上产生氢气B.铜电极发生还原反应C.铜电极接直流电源的负极D.当有0.1mol电子转移时,有0.1molCu2O生成。
答案:A2.(2020年北京理综·6)下列叙述不正确的是A.铁表面镀锌,铁作阳极B.船底镶嵌锌块,锌作负极,以防船体被腐蚀C.钢铁吸氧腐蚀的正极反应:O2 +2H2O+4e-=4OH—D.工业上电解饱和食盐水的阳极反应:2Cl一一2e一=C12↑答案:A3.(2020年福建理综·11)控制适合的条件,将反应2Fe3++2I-2Fe2++I 2设计成如右图所示的原电池。
下列判断不正确...的是A.反应开始时,乙中石墨电极上发生氧化反应B.反应开始时,甲中石墨电极上Fe3+被还原C.电流计读数为零时,反应达到化学平衡状态D.电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极答案:D4.(2020年广东化学·14)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH 溶液为点解液,铝合金为负极,空气电极为正极。
下列说法正确的是A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e=Al(OH)3↓C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变D.电池工作时,电子通过外电路从正极流向负极答案:A5.(2020年广东理基·25)钢铁生锈过程发生如下反应:①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O。


2020届高考化学二轮专题复习电化学基础【考点分析】1.了解原电池和电解池的工作原理。
2.了解常见化学电源的种类及其工作原理。
3.理解金属发生电化学腐蚀的原因,金属腐蚀的危害、防止金属腐蚀的措施。
【知识网络图】1)活泼性不同的两个电极2)合适的电解质溶液3)形成闭合回路—氧化反应—=Zn不断溶解还原反应++2e —=H2类型析氢腐蚀吸氧腐蚀1)改变金属内部结构(2)在金属表面覆盖保护层(3)电化学保护定义:使电流通过电解质溶液而在阴、阳两极引发氧化还原反应的过程电解池1)与电源相连的两电极2)电解质溶液3)形成闭合回路反应原理阳极(与电源正极相连的电极)发生氧化反应阴极(与电源负极相连的电极)发生还原反应应用:氯碱工业、电解精炼、电镀电解【知识梳理】一、原电池和电解池电极确定的方法1.根据反应本质速判电极:不论是原电池还是电解池,阳极总是发生氧化反应,阴极总是发生还原反应(原电池负极发生氧化反应,正极发生还原反应),若能找出电极发生的反应是氧化反应,还是还原反应,则可迅速确定电极。
2.根据电子、离子移动方向判断电极:不论是在原电池还是在电解池中,电子总是从阳极(负极)流向外电路;电解液中总是阳离子移向阴极(正极),阴离子移向阳极(负极)。
3.根据溶液pH变化或电极现象判断电极:无论是在原电池还是在电解池中,只要是有H2生成的电极,该电极区溶液的pH就增大,该电极上发生还原反应,该电极为正极;只要是有O2生成的电极,该电极区pH 就减小,该电极发生氧化反应,该电极为负极(阳极)。
二、电极反应式的书写1.原电池电极反应式的书写(1)一般电极反应式的书写判断电极反应产物,找出得失电子总数H+应让其结合—生成水。
电极反应式要依据电荷守恒、质量守恒、电子守恒加以配平两电极反应式相加,与总反应式对照(2)复杂电极反应式的书写复杂电极反应式 = 总反应式 — 较简单一极电极反应式2.电解池电极反应式的书写:首先分析电解质水溶液的组成,找全离子并分为阴、阳两组;然后分别对阴阳离子排出放电顺序,写出两极上的电极反应式;后合并两个电极反应式得出电解总方程式。
绝密★启用前2020年高考化学二轮专题复习测试《电化学基础》本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间90分钟。
第Ⅰ卷一、单选题(共10小题,每小题4.0分,共40分)1.研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl。
下列“水”电池在海水中放电时的有关说法不正确的是()A.负极反应式:Ag+Cl--e-===AgClB.正极反应式:5MnO2+2e-=== Mn5C.每生成1 mol Na2Mn5O10转移2 mol电子D. AgCl是还原产物2.燃料电池能有效提高能源利用率,具有广泛的应用前景。
下列物质均可用作燃料电池的燃料,其中最环保的是()A.甲醇B.天然气C.液化石油气D.氢气3.关于下列各装置图的叙述中不正确的是()A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液B.装置②的总反应是Cu+2Fe3+===Cu2++2Fe2+C.装置③中钢闸门应与外接电源的负极相连D.装置④中的铁钉几乎没被腐蚀4.下图是电解CuCl2溶液的装置,其中c、d为石墨电极。
则下列有关的判断正确的是()A. a为负极、b为正极B. a为阳极、b为阴极C.电解过程中,d电极质量增加D.电解过程中,氯离子浓度不变5.关于下图所示①、②两个装置的叙述,正确的是()A.装置名称:①是原电池,②是电解池B.硫酸浓度变化:①增大,②减小C.电极反应式:①中阳极:4OH--4e-===2H2O+O2↑,②中正极:Zn-2e-===Zn2+D.离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动6.用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH (不考虑二氧化碳的溶解)。
则电解过程中转移的电子的物质的量为()A. 0.4 molB. 0.5 molC. 0.6 molD. 0.8 mol7.某小组为研究电化学原理,设计如图装置。