第3讲 盐类的水解
- 格式:doc
- 大小:1.62 MB
- 文档页数:64
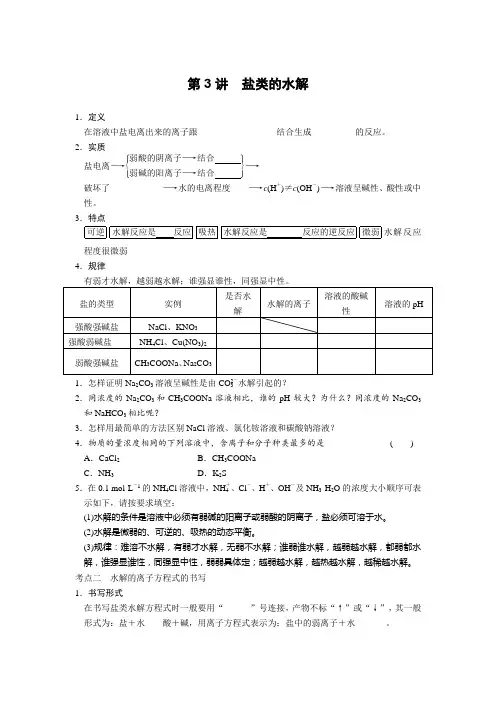
第3讲 盐类的水解1.定义在溶液中盐电离出来的离子跟__________________结合生成__________的反应。
2.实质盐电离―→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子―→结合 弱碱的阳离子―→结合 ―→ 破坏了____________―→水的电离程度____―→c (H +)≠c (OH -)―→溶液呈碱性、酸性或中性。
3.特点可逆水解反应是 反应吸热水解反应是 反应的逆反应微弱水解反应程度很微弱 4.规律盐的类型 实例 是否水解 水解的离子溶液的酸碱性 溶液的pH强酸强碱盐 NaCl 、KNO 3 强酸弱碱盐 NH 4Cl 、Cu(NO 3)2 弱酸强碱盐CH 3COONa 、Na 2CO 31.怎样证明Na 2CO 3溶液呈碱性是由CO 2-3水解引起的?2.同浓度的Na 2CO 3和CH 3COONa 溶液相比,谁的pH 较大?为什么?同浓度的Na 2CO 3和NaHCO 3相比呢?3.怎样用最简单的方法区别NaCl 溶液、氯化铵溶液和碳酸钠溶液? 4.物质的量浓度相同的下列溶液中,含离子和分子种类最多的是 ( )A .CaCl 2B .CH 3COONaC .NH 3D .K 2S5.在0.1 mol·L -1的NH 4Cl 溶液中,NH +4、Cl -、H +、OH -及NH 3·H 2O 的浓度大小顺序可表示如下,请按要求填空:(1)水解的条件是溶液中必须有弱碱的阳离子或弱酸的阴离子,盐必须可溶于水。
(2)水解是微弱的、可逆的、吸热的动态平衡。
(3)规律:难溶不水解,有弱才水解,无弱不水解;谁弱谁水解,越弱越水解,都弱都水解,谁强显谁性,同强显中性,弱弱具体定;越弱越水解,越热越水解,越稀越水解。
考点二 水解的离子方程式的书写 1.书写形式在书写盐类水解方程式时一般要用“______”号连接,产物不标“↑”或“↓”,其一般形式为:盐+水酸+碱,用离子方程式表示为:盐中的弱离子+水_____。

《盐类的水解》讲义一、盐类水解的概念在溶液中,盐电离出来的离子跟水所电离出来的 H⁺或 OH⁻结合生成弱电解质的反应,叫做盐类的水解。
我们要知道,盐类水解的实质是破坏了水的电离平衡,促进了水的电离。
比如说,氯化铵(NH₄Cl)在水溶液中,NH₄⁺会和水电离出的OH⁻结合形成弱电解质一水合氨(NH₃·H₂O),使得溶液中 c(H⁺)> c(OH⁻),溶液呈酸性。
而碳酸钠(Na₂CO₃)在水溶液中,CO₃²⁻会和水电离出的 H⁺结合形成碳酸氢根离子(HCO₃⁻),使得溶液中 c(OH⁻)> c(H⁺),溶液呈碱性。
二、盐类水解的特点1、可逆性盐类的水解反应是可逆的,存在水解平衡。
以醋酸钠(CH₃COONa)为例,CH₃COO⁻与 H₂O 电离出的 H⁺结合生成 CH₃COOH,同时 CH₃COOH 也会电离出 CH₃COO⁻和H⁺,水解和电离是一个动态的平衡过程。
2、吸热性盐类的水解反应是吸热反应,升高温度会促进水解。
这是因为温度升高,水解平衡向正反应方向移动,水解程度增大。
3、微弱性盐类的水解程度一般都比较小。
例如,即使是碳酸钠这样的强碱弱酸盐,其水解产生的氢氧根离子浓度也相对较小,溶液的碱性并不是特别强。
三、盐类水解的规律1、有弱才水解只有含有弱酸阴离子或弱碱阳离子的盐才会发生水解。
比如氯化钠(NaCl),钠离子和氯离子对应的酸和碱都是强酸强碱,所以不会水解。
而醋酸铵(CH₃COONH₄),其中的醋酸根离子和铵根离子分别对应的醋酸和一水合氨是弱酸和弱碱,所以会发生水解。
2、谁弱谁水解盐中的阴离子对应的酸越弱,水解程度越大;阳离子对应的碱越弱,水解程度越大。
例如,相同浓度的碳酸钠(Na₂CO₃)和碳酸氢钠(NaHCO₃)溶液,由于碳酸的酸性弱于碳酸氢根的酸性,所以碳酸钠的水解程度大于碳酸氢钠。
3、谁强显谁性当盐中的阳离子对应的碱是强碱,阴离子对应的酸是弱酸时,溶液显碱性;反之,溶液显酸性。

第3讲 盐类的水解一、盐类的水解及其规律1.盐类的水解2.盐类水解规律有弱才水解,越弱越水解;谁强显谁性,同强显中性。
盐的类型实例是否水解水解的离子溶液的酸碱性强酸强碱盐NaCl 、KNO 3⑩强酸弱碱盐 NH 4Cl 、Cu(NO 3)2弱酸强碱盐CH 3COONa 、Na 2CO 33.表示方法——水解离子方程式水解离子方程式的书写规律:谁弱写谁,都弱都写;阳离子水解生成弱碱,阴离子水解生成弱酸。
(1)一般来说,盐类水解的程度不大,应该用“”表示。
盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
如Cu2++2H2O; N H4++H2O。
(2)若水解程度较大,书写时要用“”“↑”或“↓”,主要有:Al3+和HC O3-、C O32-、HS O3-、S O32-、HS-、S2-、Al O2-等的双水解,Fe3+和HC O3-、C O32-、Si O32-、Al O2-等的双水解。
如NaHCO3与AlCl3反应的离子方程式为。
(3)多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。
如Na2CO3水解反应的离子方程式为(主要)、(次要);不能写成C O32-+2H2O H2CO3+2OH-。
(4)多元弱碱阳离子的水解简化成一步完成,如FeCl3溶液中:。
要将盐的电离方程式与盐类水解的离子方程式区别开来。
如:HS-+H2O S2-+H3O+是HS-电离的离子方程式,而HS-+H2O H2S+OH-是HS-水解的离子方程式。
二、影响盐类水解的因素1.内因——盐本身的性质2.外因(1)升高温度,水解平衡向方向移动,水解程度增大。
(2)增大浓度,水解平衡向水解方向移动,水解程度 。
加水稀释,水解平衡向方向移动,水解程度增大。
(3)增大c(H +)可促进 离子水解,抑制 水解;增大c(OH -)可促进 水解,抑制 离子水解。
(4)加入与水解有关的其他物质,符合化学平衡移动原理。

第3讲盐类的水解盐类水解的规律有弱才水解,越弱越水解;谁强显谁性,同强显中性。
盐的类型实例是否水解水解的离子溶液的酸碱性溶液的pH强酸强碱盐NaCl、KNO3否中性pH=7 强酸弱碱盐NH4Cl、Cu(NO3)2是NH+4、Cu2+酸性pH<7弱酸强碱盐CH3COONa、Na2CO3是CH3COO-、CO2-3碱性pH>7一、选择题(每小题只有一个选项符合题意)1.下列事实与盐类水解无关的是()A.MgCO3可以除去MgCl2酸性溶液中的Fe3+B.氯化铁溶液常用作铜印刷电路板的腐蚀剂C.常用热的纯碱溶液除去油污D.长期施用硫酸铵易使土壤酸化2.对滴有酚酞溶液的下列溶液,操作后颜色变深的是()A.明矾溶液加热B.Na2CO3溶液加热C.氨水中加入少量NH4Cl固体D.小苏打溶液中加入少量NaCl固体3.向三份0.1 mol·L-1CH3COONa溶液中分别加入少量NH4NO3、Na2CO3、CH3COONa固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为() A.减小、增大、减小B.增大、减小、减小C.减小、增大、增大D.增大、减小、增大4.下列有关盐类水解的事实或应用、解释的说法不正确的是()选项事实或应用解释A 用热的纯碱溶液去除油污纯碱与油污直接发生反应,生成易溶于水的物质B 泡沫灭火器灭火Al2(SO4)3与NaHCO3溶液反应产生CO2气体C 施肥时,草木灰(主要成分K2CO3)与NH4Cl不能混合使用K2CO3与NH4Cl反应生成NH3,降低肥效D 明矾[KAl(SO4)2·12H2O]作净水剂明矾溶于水生成Al(OH)3胶体5.25 ℃时,实验测得0.10 mol·L-1的NaHB溶液的pH=9.1。
下列说法中正确的是()A.NaHB的电离方程式为:NaHB===Na++H++B2-B.HB-在水溶液中只存在HB-的水解平衡C.HB-的水解程度大于电离程度D.溶液中水电离出的c(H+)为10-9.1 mol·L-16.常温下,0.2 mol·L-1的一元酸HA与等浓度NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是()A.HA为强酸B.该混合溶液pH=7.0C.该混合溶液中:c(A-)+c(Y)=c(Na+)D.图中X表示HA,Y表示OH-,Z表示H+7.25 ℃时浓度都是1 mol·L-1的四种正盐溶液:AX、BX、AY、BY;AX的溶液pH=7且溶液中c(X-)=1 mol·L-1,BX的溶液pH=4,BY的溶液pH=6。



盐类的水解课件完整版一、教学内容本节课我们将探讨《化学》教材中第三章第三节“盐类的水解”。
具体内容包括盐类水解的基本概念、原理及其应用。
通过学习,学生将理解并掌握盐类水解的实质、影响因素和实际应用。
二、教学目标1. 理解盐类水解的概念,掌握盐类水解的基本原理。
2. 学会分析盐类水解的影响因素,并能运用这些知识解决实际问题。
3. 培养学生的实验操作能力和科学思维。
三、教学难点与重点教学难点:盐类水解原理的理解和应用。
教学重点:盐类水解的概念、影响因素和实验操作。
四、教具与学具准备1. 教具:多媒体课件、实验器材(烧杯、试管、滴定管等)。
2. 学具:笔记本、笔、实验报告册。
五、教学过程1. 导入:通过展示一个实际情景——日常生活中盐的溶解现象,引发学生对盐类水解的思考。
2. 知识讲解:(1)介绍盐类水解的概念和实质。
(2)讲解盐类水解的影响因素,如温度、浓度等。
(3)举例说明盐类水解在生产和生活中的应用。
3. 例题讲解:通过讲解典型例题,让学生学会分析盐类水解问题。
4. 实践操作:学生分组进行实验,观察盐类水解现象,并记录实验结果。
5. 随堂练习:学生完成与盐类水解相关的习题,巩固所学知识。
六、板书设计1. 盐类水解的概念、实质。
2. 盐类水解的影响因素。
3. 盐类水解的应用。
七、作业设计1. 作业题目:(1)解释盐类水解的概念。
(2)列举并解释影响盐类水解的因素。
(3)举例说明盐类水解在生活中的应用。
2. 答案:(1)盐类水解:盐类在水中溶解时,发生水分子与盐离子之间的相互作用,使盐离子发生水解反应。
(2)影响因素:温度、浓度、溶剂性质等。
(3)应用:如洗涤剂、造纸、纺织等。
八、课后反思及拓展延伸1. 反思:通过本节课的学习,学生应掌握盐类水解的基本概念和原理,能够分析影响盐类水解的因素,并了解其实际应用。
2. 拓展延伸:鼓励学生查阅相关资料,了解盐类水解在环保、医药等领域的应用,提高学生的科学素养。


第三节 盐类的水解一、盐类的水解(一)盐的分类1、按组成分:正盐:电离时生成的阳离子是金属离子(或铵根),阴离子为酸根离子的盐酸式盐:电离时生成的阳离子除金属离子(或铵根)外还有氢离子,阴离子为酸根离子的盐。
碱式盐:电离时生成的阴离子除酸根离子外还有氢氧根离子,阳离子为金属离子(或NH 4+)的盐。
2、按溶解性:易溶盐(NaCl );微溶盐(CaSO 4);难溶盐(BaCO 3)3、按形成盐的酸碱的强弱不同:强酸强碱盐(KNO 3)、强酸弱碱盐(NH 4Cl )、强碱弱酸盐(NaF )、弱酸弱碱盐(CH 3COONH 4)(二)盐溶液呈现不同酸碱性的原因——盐类的水解1、定义:在溶液中,盐电离出来的离子与水电离出来的H +或OH -结合生成弱电解质的反应,叫做盐类的水解2、实质:22()()H O H O OH c H c OH H -+-+⎧⎫−−−→⇒→→≠⎨⎬⎭⎩弱碱阳离子弱碱盐电离出来的离子破坏水的电离平衡促进水的电离弱酸阴离子弱酸→溶液呈酸性或碱性表示为:盐+H 2O酸+碱3、特点:(1)极其微弱,为可逆反应,存在水解平衡(2)是中和反应的逆反应,水解反应是吸热反应4、规律:有弱就水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性,同强显中性 注:(1)组成盐的酸越弱,水解程度越大。
例如:水解程度:Na 2CO 3 >CH 3COONa ,因为酸性:H 2CO 3 <CH 3COOH(2)同浓度的正盐比其酸式盐水解程度大。
例如:0.1mol/L 的Na 2CO 3 >0.1mol/L 的NaHCO 3(3)弱酸酸式盐的酸碱性,看电离与水解程度大大小。
HCO 3-、HPO 42-、HS - 以水解为主→显碱性HSO 3-、H 2PO 4- 以电离为主→显酸性5、盐类水解方程式的书写 (1)一般原则:①必须写“”②不写“↑”“↓” ③H 2CO 3、H 2SO 3等不拆开④多元弱酸阴离子分步水解,分步书写,以第一步为主;多元弱碱阳离子水解方程式一步写完⑤遵守质量守恒、电荷守恒、客观事实(2)书写模式:盐的离子+ H2O弱酸(或弱碱)+OH-(或H+)举例:CH3COONa溶液:CH3COO-+ H2O CH3COOH+OH-NH4Cl溶液:NH4++ H2O NH3·H2O +H+Na2CO3溶液:CO32-+H2O HCO3-+ OH-(第一步水解)HCO3-+ H2O H2CO3+ OH-(第二步水解)FeCl3溶液:Fe3++3H2O Fe(OH)3+3H+(3)双水解——阴阳离子都水解①非彻底型:用“”连接例:CH3COONH4:CH3COO-+ NH4++H2O CH3COOH+NH3·H2O(CH3COONH4显中性)②彻底型:用“=”连接。

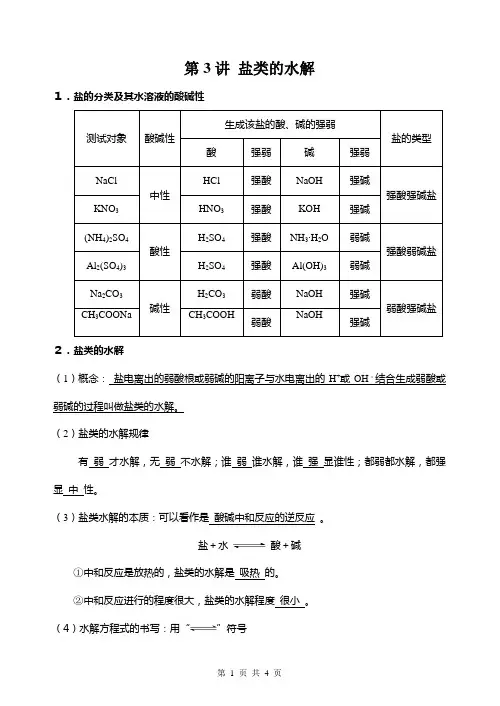
第3讲盐类的水解1.盐的分类及其水溶液的酸碱性测试对象酸碱性生成该盐的酸、碱的强弱盐的类型酸强弱碱强弱NaCl中性HCl 强酸NaOH 强碱强酸强碱盐KNO3HNO3强酸KOH 强碱(NH4)2SO4酸性H2SO4 强酸NH3〃H2O 弱碱强酸弱碱盐Al2(SO4)3 H2SO4强酸Al(OH)3 弱碱Na2CO3碱性H2CO3弱酸NaOH 强碱弱酸强碱盐CH3COONa CH3COOH 弱酸NaOH 强碱2.盐类的水解(1)概念:盐电离出的弱酸根或弱碱的阳离子与水电离出的H+或OH-结合生成弱酸或弱碱的过程叫做盐类的水解。
(2)盐类的水解规律有弱才水解,无弱不水解;谁弱谁水解,谁强显谁性;都弱都水解,都强显中性。
(3)盐类水解的本质:可以看作是酸碱中和反应的逆反应。
盐+水酸+碱①中和反应是放热的,盐类的水解是吸热的。
②中和反应进行的程度很大,盐类的水解程度很小。
(4)水解方程式的书写:用“”符号①化学方程式:盐+水酸+碱②离子方程式:弱酸根或弱碱阳离子+H2O弱酸或弱碱分子+OH-(或H+)③多元弱酸根的水解是分步的,第一步水解的程度远大于第二步水解。
如Na 2CO3溶液: CO32-+H2O HCO3-+OH-(主要)HCO 3-+H2O H2CO3+OH-(次要)④多元弱碱的阳离子水解复杂,看作一步水解。
如Fe3++3H2O Fe(OH)3+3H+例1.请预测下列盐溶液的酸碱性,若能发生水解反应,请写出水解反应的离子方程式。
硝酸铵溶液性,氯化铁溶液性,硫酸铝溶液性,碳酸钾溶液性,醋酸钠溶液性,【答案】酸性NH4++H2O NH3·H2O+H+酸性Fe3++3H2O Fe(OH)3+3H+酸性Al3++3H2O Al(OH)3+3H+碱性CO 32-+H2O HCO3-+OH-,HCO3-+H2O H2CO3+OH-碱性CH3COO-+H2O CH3COOH+OH-例2.实验测得NaHCO3溶液的pH>7,请从电离和水解两方面分析导致NaHCO3溶液显碱性的原因。
第3讲盐类的水解
【2021·备考】
2017版课程标准素养落地
1.了解盐类水解原理及其规律,能结合
电离、离子反应及化学平衡等分析溶液
的性质。
2.了解影响盐类水解的主要因素,能正
确书写水解反应方程式。
3.了解盐类水解的应用。
认识盐类水解有一定的限度,是可以调
控的,能多角度、动态地分析盐类水解
平衡,并运用盐类水解平衡原理解决实
际问题;知道可以通过分析、推理等方
法认识盐类水解的本质特征、建立模型。
能运用模型解释盐类水解平衡的移动,
揭示现象的本质和规律。
考点一盐类的水解及其规律
『知识梳理』
1.盐类的水解概念理解
2.水解类型及规律总结
有弱才水解,越弱越水解,谁强显谁性,同强显中性。
盐的类
型
实例是否水解水解的离子
溶液的酸碱
性
溶液的pH
强酸强碱盐NaCl、
KNO 3
否中性pH=7
强酸弱碱盐NH4Cl、
Cu(NO3)2
是NH+4、Cu2+酸性pH<7
弱酸强碱盐CH3COO
Na、
Na2CO3
是
CH3COO-、
CO2-3
碱性pH>7
名师提示你
越弱越水解的理解:如相同浓度的CH3COONa、Na2CO3、NaHCO3溶液碱性强弱,是由盐增加一个氢离子形成的离子或物质的电离程度确定的,由于酸性CH3COOH>H2CO3>HCO-3,故对应盐溶液的碱性:Na2CO3溶液>NaHCO3溶液>CH3COONa溶液。
3.盐类水解离子方程式的书写
(1)一般要求
一般盐类水解程度很小⇨
水解产
物很少
⇨气体、沉淀不标“↑”或“↓”,易分解产物(如NH3·H2O
等)不写其分解产物的形式
如NH4Cl的水解离子方程式为
NH+4+H2O NH3·H2O+H+。
(2)三种类型的盐水解方程式的书写。
①多元弱酸盐水解:分步进行,以第一步为主,一般只写第一步水解方程式。
如Na2CO3的水解离子方程式为
CO2-3+H2O HCO-3+OH-。
②多元弱碱盐水解:水解离子方程式一步写完。
如FeCl3的水解离子方程式为
Fe3++3H2O Fe(OH)3+3H+。
③阴、阳离子相互促进的水解:水解程度较大,书写时要用“===”、“↑”、“↓”等。
如Na2S溶液与AlCl3溶液混合反应的水解离子方程式为2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑。
名师提示你
NH+4与CH3COO-、HCO-3、CO2-3等在水解时相互促进,水解程度比单一离子的水解程度大,但仍然水解程度比较弱,不能进行完全,在书写水解方程式时应用“”。
『考向突破』
考向一水解原理
基础知识判断
[题目设计]
1.判断正误(正确的打“√”,错误的打“×”)
(1)(全国卷)25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1N A(×)
(2)(全国卷)100 mL 1 mol·L-1 FeCl3溶液中所含Fe3+的数目为0.1N A(×)
(3)(天津卷)某温度下,一元弱酸HA的K a越小,则NaA的K h(水解常数)越小(×)
(4)(全国卷)1 L 0.1 mol·L-1 NH4Cl溶液中,NH+4的数量为0.1N A(×)
(5)(海南卷)向硫酸铝溶液中滴加碳酸钠溶液的离子方程式为2Al3++3CO2-3 ===Al2(CO3)3↓(×)
(6)(上海卷)0.1 mol·L-1 CH3COONa溶液的pH>7,证明乙酸是弱酸(√)
(7)(北京卷)饱和NaClO溶液的pH约为11:ClO-+H2O HClO+OH-(√)
(8)(重庆卷)25 ℃时,等体积等浓度的硝酸与氨水混合后,溶液的pH=7(×)
通过实验探究水解原理
[题目设计]
2.现有0.1 mol·L-1的纯碱溶液,用pH试纸测定溶液的pH,其正确的操作是____________________________________________________
____________________________________________________。