碳原子结构
- 格式:ppt
- 大小:379.51 KB
- 文档页数:2

4个碳原子相互结合的几种方式
四个碳原子可以相互结合形成不同的化学物质,以下是几种常见的结构:
1. 直链烷烃(甲烷):四个碳原子通过单键相连,形成直线状结构,化学式为CH3-CH2-CH2-CH3。
2. 环状烷烃(环丁烷):四个碳原子形成一个环状结构,每个碳原子与相邻两个碳原子通过单键相连,化学式为CH2-CH2-CH2-CH2。
3. 双键烯烃(丁二烯):四个碳原子中,两个碳原子之间形成双键,其他碳原子通过单键相连,化学式为CH2=CH-CH=CH2。
4. 环状芳香烃(环已烷):四个碳原子形成一个环状结构,每个碳原子与相邻两个碳原子通过单键相连,同时还有一个氢原子连接在每个碳原子上,化学式为CH2-CH=CH-CH=CH2。

c原子的轨道表示式C原子的轨道表示式C原子是指碳原子,其原子序数为6。
碳原子的电子结构为1s²2s²2p²,其中1s²表示1s轨道上有2个电子,2s²表示2s轨道上有2个电子,2p²表示2p轨道上有2个电子。
C原子的1s轨道是最内层的能级,能量最低。
它是球对称的,具有最小的角动量量子数l=0。
1s轨道只能容纳2个电子,且自旋量子数ms相反。
C原子的2s轨道是第二层的能级,能量次低。
它也是球对称的,但比1s轨道的大小更大。
2s轨道只能容纳2个电子,且自旋量子数ms相反。
C原子的2p轨道是第二层的能级,能量较高。
2p轨道有三个不同的方向,分别是2px、2py和2pz轨道。
这三个轨道的形状类似于一个沿着坐标轴的椭球形,分别沿着x、y和z轴方向延伸。
2p轨道一共能容纳6个电子,每个轨道最多容纳2个电子,且自旋量子数ms 相反。
C原子的电子结构可以用轨道填充图表示。
轨道填充图是一种表示电子分布的图形,可以清晰地展示出各个轨道上的电子数目。
在C 原子的轨道填充图中,1s轨道上有2个电子,2s轨道上有2个电子,2px、2py和2pz轨道上各有1个电子。
C原子的轨道表示式还可以用波函数表示。
波函数是描述粒子在空间中出现的概率分布的数学函数。
C原子的波函数可以用数学公式表示,但根据要求,本文不输出公式。
通过波函数,可以计算出C 原子的电子在不同轨道上的概率分布。
C原子的轨道表示式对于理解和研究碳原子的性质具有重要意义。
通过轨道表示式,可以了解到C原子的电子结构和各个轨道上的电子分布情况。
这有助于解释碳原子的化学性质和参与化学反应的机理。
总结起来,C原子的轨道表示式包括1s、2s和2p轨道,其中1s轨道能级最低,2s轨道次之,2p轨道能级最高。
这些轨道上的电子按照一定规则填充,使得C原子的电子结构稳定。
通过轨道表示式,可以更好地理解和研究碳原子的性质和行为。


有机化学基础知识点整理碳原子的杂化与轨道理论有机化学基础知识点整理碳原子的杂化与轨道理论在有机化学中,碳原子是最基本的元素之一。
了解碳原子的杂化与轨道理论对于理解有机化合物的性质和反应机理至关重要。
本文将对碳原子的杂化与轨道理论进行整理和总结。
1. 碳的电子结构碳原子的电子结构为1s²2s²2p²。
其中,1s²表示1s轨道上有2个电子,2s²表示2s轨道上有2个电子,2p²表示2p轨道上有2个电子。
2. 杂化理论为了解释碳原子形成四个等价化学键的能力,瓦尔登最早提出了杂化理论。
该理论认为,碳原子的3个2p轨道和1个2s轨道混合形成4个等价的sp³杂化轨道。
3. sp³杂化轨道sp³杂化轨道是由1个2s轨道和3个2p轨道线性组合而成。
这使得碳原子能够与其他原子形成四个等价键,构建出大量的有机化合物。
4. 共价键的形成碳原子通过共价键与其他原子结合。
共价键是由两个轨道上的电子的重叠形成的,其中一个电子来自于碳原子的sp³杂化轨道,另一个电子来自与碳原子连接的原子。
5. σ-键与π-键共价键可以分为σ-键和π-键。
σ-键由两个轴向重叠的杂化轨道形成,是最强的化学键。
π-键由两个平行的杂化轨道上的电子的侧向重叠形成,通常比σ-键弱一些。
6. 碳的杂化和化学性质碳原子通过杂化形成的sp³杂化轨道赋予碳原子良好的空间取向性,使其能够形成多种化学键和多样化的化合物。
碳原子的杂化方式直接决定了有机化合物的结构和性质。
7. 举例说明a. 甲烷(CH₄)是一种最简单的有机化合物,由一个碳原子和四个氢原子组成。
碳原子的sp³杂化轨道形成四个σ-键,使得甲烷分子呈现出三维立体结构。
b. 乙烯(C₂H₄)是一种含有π-键的有机化合物。
碳原子的sp²杂化使得碳原子形成了三个σ-键和一个π-键,乙烯分子具有平面结构。

碳原子激发态电子排布式
碳原子激发态电子排布式:
1、碳原子的结构:
碳原子是包含稳定的6个电子的原子。
碳原子的核外电子结构被形容为2s2 2p2,这表示它有两个2s框架电子和两个2p轨道电子。
2s框架电子排布在它的第一层,而2p轨道电子排布在它的第二层。
2、激发态电子排布:
在碳原子激发态下,其电子排布将发生变化。
一旦激发,两个2s框架电子被激发到更高能量的2p轨道上。
这样,激发后的碳原子会变成
4s0 4p,也就是说,激发后会有4个2p轨道电子。
其中,有两个电子是原电子,另外两个电子则是新出现的激发态电子。
3、电子分布:
在此激发态下,电子由远到近排列,由2s轨道开始,再到2p轨道,后来2p轨道再次被激发,激发的电子由3d轨道占位,它们与2p轨道电子无任何分离,交替环绕着核心。
因此,在激发态电子排布中,每个轨道中的电子数为4个。
4、各电子的分布:
排布在2s轨道中的电子有两个,它们是原始结构中的电子,被称为核
心电子。
排布在2p轨道中的电子也有两个,但这两个电子来自于激发状态,称为激发电子。
排布在3d轨道中的电子也有两个,它们也是来自于激发态,称为非核心激发电子。
总之,碳原子的激发态电子排布式为4s0 4p2 3d2,即,每个轨道中的电子数共计4个。


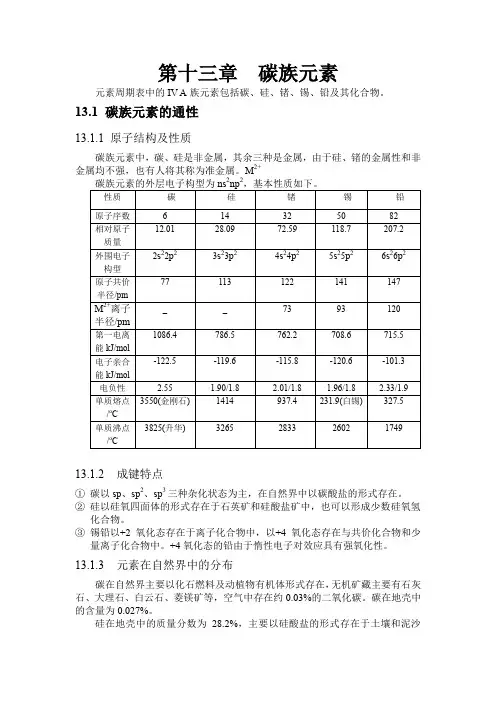
第十三章碳族元素元素周期表中的IV A族元素包括碳、硅、锗、锡、铅及其化合物。
13.1 碳族元素的通性13.1.1 原子结构及性质碳族元素中,碳、硅是非金属,其余三种是金属,由于硅、锗的金属性和非金属均不强,也有人将其称为准金属。
M2+2213.1.2成键特点①碳以sp、sp2、sp3三种杂化状态为主,在自然界中以碳酸盐的形式存在。
②硅以硅氧四面体的形式存在于石英矿和硅酸盐矿中,也可以形成少数硅氧氢化合物。
③锡铅以+2氧化态存在于离子化合物中,以+4氧化态存在与共价化合物和少量离子化合物中。
+4氧化态的铅由于惰性电子对效应具有强氧化性。
13.1.3元素在自然界中的分布碳在自然界主要以化石燃料及动植物有机体形式存在,无机矿藏主要有石灰石、大理石、白云石、菱镁矿等,空气中存在约0.03%的二氧化碳。
碳在地壳中的含量为0.027%。
硅在地壳中的质量分数为28.2%,主要以硅酸盐的形式存在于土壤和泥沙中,自然界也存在石英矿。
锗、锡、铅在地壳中的含量都不高,主要以硫化物和氧化物的形式存在。
如硫银锗矿4Ag2S·GeS2、锡石矿SnO2、方铅矿PbS等。
13.2 碳及其化合物13.2.1 单质碳有三种同素异形体,金刚石、石墨、球型碳。
无定形碳中也有石墨的结构。
石墨结构金刚石结构①金刚石的性质金刚石就是我们常说的钻石(钻石是它的俗称),它是一种由纯碳组成的矿物。
金刚石是自然界中最坚硬的物质,因此也就具有了许多重要的工业用途,如精细研磨材料、高硬切割工具、各类钻头、拉丝模。
还被作为很多精密仪器的部件。
金刚石有各种颜色,从无色到黑色都有,以无色的为特佳。
它们可以是透明的,也可以是半透明或不透明。
多数金刚石大多带些黄色。
金刚石的折射率非常高,色散性能也很强,这就是金刚石为什么会反射出五彩缤纷闪光的原因。
金刚石在X射线照射下会发出蓝绿色荧光。
金刚石仅产出于金伯利岩筒中。
金伯利岩是它们的原生地岩石,其他地方的金刚石都是被河流、冰川等搬运过去的。

碳的排列方式
碳的排列方式主要有以下几种:
正交结构:这种排列方式是最基本的碳原子排列方式,每个碳原子与周围的碳原子形成正方形的结构。
蜂窝状结构:这种排列方式与蜂窝状类似,碳原子排列成六边形的结构。
立方体结构:这种排列方式是由一些六边形的碳原子构成的立方体结构,其中每个六边形都与周围的六边形相连。
树枝状结构:这种排列方式是由一些六边形的碳原子构成的树枝状结构,每个树枝都与周围的树枝相连。
无定形结构:这种排列方式是指碳原子的排列方式没有明显的规律和规则,形状也比较随意。
以上是碳的一些排列方式,不同的排列方式会影响碳的性质和用途。
例如,树枝状结构的碳材料具有优良的导电性和导热性,适用于制造电子元器件和热管理材料;无定形结构的碳材料则可以用于制造超级电容器和电池等能量存储设备。
碳元素和碳原子-概述说明以及解释1.引言1.1 概述碳素是周期表中第六位元素,也是地球上最为丰富的元素之一。
它具有丰富的化学性质和结构多样性,使其在生物学、化学、物理学等多个领域具有重要的地位。
碳原子是构成碳元素的基本单位,其稳定的四价态和能够形成长链状、环状甚至球状的结构,赋予了碳元素多样性和复杂性。
本文将重点探讨碳元素的性质、碳原子的结构以及碳在生活中的应用,旨在全面了解碳元素的重要性,并展望其未来的发展前景。
1.2 文章结构文章结构部分包括了引言、正文和结论三个部分。
在引言部分,将对碳元素和碳原子进行概述,介绍文章的结构和阐明文章的目的。
接着在正文部分,将分别探讨碳元素的性质、碳原子的结构以及碳在生活中的应用情况。
最后在结论部分,将总结碳元素的重要性,展望碳元素的未来发展潜力,并进行文章的结束语,形成完整的逻辑框架。
整篇文章将通过引言引出主题,通过正文展开讨论,最后通过结论部分总结全文内容,确保文章结构清晰明了,逻辑性强。
1.3 目的本文旨在深入探讨碳元素和碳原子的相关知识,介绍碳元素的性质、碳原子的结构以及碳在生活中的应用。
通过对碳元素的性质和结构进行科学解析,我们可以更好地认识碳元素在自然界和人类社会中的重要作用。
同时,本文旨在强调碳元素在各个领域的应用价值,希望能引起人们对碳元素的关注和重视。
最终目的是增强人们对碳元素的认识,促进碳元素的可持续利用和发展,为推动人类社会的可持续发展做出贡献。
2.正文2.1 碳元素的性质碳是周期表中的第六个元素,原子序数为6,元素符号为C。
碳元素是自然界中最丰富的元素之一,其性质独特且多样化。
以下是碳元素的一些主要性质:1. 化学稳定性:碳元素具有很高的化学稳定性,不易与其他元素发生化学反应,因此被誉为“化学之王”。
这种稳定性使得碳具有广泛的应用价值。
2. 电负性:碳元素的电负性适中,可与多种元素形成共价键或离子键,从而构成各种有机化合物。
由于碳原子具有四个价电子,在共价键中能够形成多样化的化学键型,包括单键、双键和三键。
碳原子结构
碳原子是一种化学元素,其原子结构是由六个质子和六个中子组
成的核心和六个电子组成的外壳组成的。
碳原子的电子排布,其最外
层电子排布为2-4,也就是说,处在第二层的价电子只有两个,可以结
合四个氢原子,形成甲烷分子。
当一个碳原子和另外三个碳原子相连
而形成的分子称为甲基。
大约100亿个碳原子可以组合成一个直径为1毫米的石墨球。
碳原子可以形成多种化学键,比如单键、双键和三键,因此在生物、化学、地学和工业领域都有着广泛的应用。
碳原子不共面的情况
一种常见的碳原子不共面的情况是在石墨烯中。
石墨烯是由单
层碳原子组成的二维晶格结构,碳原子呈蜂窝状排列。
在石墨烯中,碳原子的结构使得它们不处于同一平面上,而是形成了一个类似于
蜂窝的结构。
这种不共面的排列赋予石墨烯许多独特的性质,如高
导电性、高热传导性和机械强度。
除了石墨烯,碳原子不共面的情况也存在于碳纳米管和富勒烯
等碳基材料中。
这些材料由碳原子以不同的方式排列而成,因此具
有各种不同的性质和应用。
碳原子不共面的情况还在有机化学中发挥着重要作用。
在某些
有机分子中,碳原子的空间排列不是平面的,而是呈现出三维的空
间结构。
这种不共面的排列可以影响分子的立体构型和化学性质,
对于有机合成和药物设计具有重要意义。
总的来说,碳原子不共面的情况在化学和材料科学中具有重要
的意义,它们为我们提供了许多新颖材料和化学反应的可能性,也
为我们深入理解碳基材料和有机分子的性质提供了新的视角。
我们
对这些不共面的结构有了更深入的认识,将有助于我们开发出更多具有特殊性能和应用的新型材料。
三个碳原子的化合物结构式1. 引言化合物是由不同元素以特定的比例和方式结合而成的物质。
其中,碳原子是构成有机化合物的基本组成部分之一。
有机化合物是指含有碳原子的化合物,它们在自然界中广泛存在,并在生物、化学和工业领域中发挥重要作用。
本文将介绍三个碳原子的化合物结构式,包括甲烷、乙烷和丙烷。
2. 甲烷(CH4)甲烷是最简单的有机化合物,由一个碳原子和四个氢原子组成。
它的结构式如下所示:H|H – C – H|H甲烷是一种无色、无味的气体,在自然界中广泛存在,如沼气和天然气中。
它是一种温室气体,对地球的气候变化有着重要的影响。
甲烷也是一种重要的燃料,在工业生产和能源领域中被广泛应用。
3. 乙烷(C2H6)乙烷是由两个碳原子和六个氢原子组成的有机化合物。
它的结构式如下所示:H H| |H – C – C – H| |H H乙烷是一种无色、无味的气体,在自然界中也存在于天然气中。
它是一种重要的燃料,常用于烹饪、供暖和工业生产中。
乙烷的燃烧产生的能量被广泛利用,同时也会释放出二氧化碳和水蒸气等排放物。
4. 丙烷(C3H8)丙烷是由三个碳原子和八个氢原子组成的有机化合物。
它的结构式如下所示:H H H| | |H – C – C – C – H| | |H H H丙烷是一种无色、无味的气体,也存在于天然气中。
它是一种常用的燃料,广泛应用于家庭、商业和工业领域。
丙烷的燃烧产生的能量较高,被用于供暖、烹饪和发电等用途。
5. 结论三个碳原子的化合物结构式包括甲烷、乙烷和丙烷。
甲烷是由一个碳原子和四个氢原子组成,乙烷是由两个碳原子和六个氢原子组成,丙烷是由三个碳原子和八个氢原子组成。
它们在自然界和人类生活中都起着重要的作用,是常用的燃料和化学原料。
了解这些化合物的结构式有助于我们深入理解有机化合物的基本特性和应用领域。
以上是关于三个碳原子的化合物结构式的介绍,希望能对读者有所帮助。
参考文献: - “Methane” - PubChem - “Ethane” - PubChem - “Propane” - PubChem。
碳离子符号碳离子符号可表示为:一、分子式及原子结构(表示方法) Carbon ion symbol碳离子符号可表示为C。
化合价,是4个价电子参加共价键的运动。
C的正四面体共价键有三种结合方式,其中一种是两个H的孤对电子,和两个C的孤对电子成键。
C原子的最外层电子数为4,是4个价电子参加共价键的运动。
所以最外层上有4个价电子参加共价键的运动。
C原子中4个价电子的结合能为: 1.86eV。
碳原子的相对原子质量为: 12。
二、性质和用途( 1)碳原子无色,不燃烧,不支持燃烧,也不溶于水,但可与许多物质发生化学反应,它属于非金属单质,在自然界的存在仅次于氧。
( 2)碳能使酸性KMnO4溶液变成中性。
( 3)碳的密度比铁的小,所以常把碳和金刚石等金属混在一起,把金刚石用做工具钢,因此说碳具有金属光泽,而且还有导电、导热等性能。
( 4)一般碳元素只有一种稳定的同位素,即碳13,它的原子核内只含有一个质子,所以在化学反应中不容易失去,其半衰期有the 2C2++→+2O22C2++→2O2。
2C2++→2O2。
4个价电子参加共价键的运动。
C的正四面体共价键有三种结合方式,其中一种是两个H的孤对电子,和两个C的孤对电子成键。
C原子的最外层电子数为4,是4个价电子参加共价键的运动。
所以最外层上有4个价电子参加共价键的运动。
C原子中4个价电子的结合能为: 1.86eV。
碳原子的相对原子质量为: 12。
3。
密度: 1。
理论化学计算;能力要求: 1。
理解原子结构和原子性质的基本概念。
2。
了解原子结构与性质之间的关系。
3。
熟悉原子结构模型的分类。
3。
培养分析问题,解决问题的能力。
4。
理解质量守恒定律的含义。
5。
了解碳酸根和碳酸氢根离子的形成条件。
7。
初步认识碳酸根离子的检验方法。
8。
简单认识碳酸根的来源。
4。
熟悉各族原子及原子团的名称和元素符号的意义。
5。
了解原子结构与元素性质的关系。
6。