原子的结构2
- 格式:ppt
- 大小:1.10 MB
- 文档页数:43

课题二原子的结构(2)【知识要点】1.元素(组成物质的基本成分)的化学性质与原子结构的关系(1)稀有气体的原子最外层电子数为8个(氦为2个),它们的化学性质比较稳定。
一般认为最外层电子数为个的结构为稳定结构(只有一个电子层的则为2个)。
(2)金属的原子最外层电子数一般少于个,在化学反应中易最外层电子,使次外层变成最外层,通常达到8个电子的稳定结构。
(3)非金属的原子最外层电子数一般个,在化学反应中易电子,使最外层达到8个电子的稳定结构。
(4)一般情况下,原子的最外层电子数相同,其化学性质相似。
2.离子(1)带电的原子或原子团叫离子。
带电的离子叫阳离子,如Na+ 、NH+ ,带电的离子叫阴离子,如Cl-、CO32-。
(2)原子与离子的比较异:①原子一般(填“稳定”或“不稳定”),而离子比较。
②原子不显电性,而离子。
③表示方法不同,如钠原子表示为,钠离子表示为。
同:都是构成物质的粒子;质量、体积都很;在不停;有间隙。
(3)构成物质的粒子有、和。
3.相对原子质量。
(1)定义:以一种碳原子原子质量的为标准,其他原子的质量跟它相比较所得到的比值。
(2)计算公式:某原子的相对原子质量(Ar)=。
(3)原子的质量主要集中在原子核上。
相对原子质量≈+。
(4)相对原子质量是一个比值,其单位为“1”,而质量单位是“千克”。
【要点分析】例1 某粒子的结构示意图如下.下列对该粒子的判断中,错误的是()A. 原子核内有17个质子B. 该粒子是原子C. 在化学反应中易失去电子D. 该粒子属于非金属原子解析圆圈中数字17代表质子数,A选项正确;示意图中质子数与核外电子数相等,表示是原子结构,B选项正确;由于最外层有7个电子,所以容易得到电子,属于非金属原子,故C选项错误,D选项正确。
答案 C例2下列粒子结构示意图能表示原子的是_________;表示阳离子的是_________;表示阴离子的是_________。
解析 原子结构示意图中,弧线表示电子层,弧线上面的数字表示该层的电子数;当质子数=核外电子数时,为原子的结构示意图;质子数>核外电子数时,是阳离子的结构示意图;质子数<核外电子数时,是阴离子结构示意图。




3.2.2 原子的结构(2)1.知道原子核外电子是分层排布的;2.了解原子结构示意图的含义,理解原子最外层电子数与原子种类的关系;3.了解离子的形成过程,知道离子与原子的区别与联系。
一、原子核外电子的分层排布1.电子层(1)核外电子的运动有自己的特点,它没有固定的轨道,但有经常出现的区域,我们称之为________。
(2)在多电子原子中,电子能量不同,能量越低,离核越_____,能量越高,离核越_____。
离核________的电子层为第一层,次之为第二层,依次类推为三、四、五、六、七层,离核最远的也叫________。
(3)原子核外电子排布,从里往外,第一层最多排_____个电子,第二层最多排_____个电子,最外层电子数不超过_____个(只有一层的,电子不超过_____个)。
2.原子结构示意图:(1)示意图各部分含义①圆圈表示原子核;“+”表示原子核带_____电;圈内数字表示________;②弧线表示________,弧线上的数字表示________________。
(2)部分原子的原子结构示意图3. 原子的化学性质与电子排布的关系原子种类实例最外层电子数得失电子结构稳定性化学性质稀有气体He、Ne、Ar___((He为___)___得,___失_________稳定质子数金属Na、Mg、Al___易_________不稳定非金属N、O、S___易_________不稳定最外层电子数为8(若第一层为最外层时,电子数为2)的结构叫相对稳定结构4.原子的化学性质主要由原子的_________决定二、离子1.离子概念:带电的原子2.离子分类及形成:(1)阳离子:原子______电子而形成阳离子,质子数___电子数,所以阳离子带正电,如Na+(2)阴离子:原子______电子而形成阴离子,质子数___电子数,所以阴离子带负电,如O2-(3)注意:①原子变为离子时,______数没有改变;______数、____________数发生了改变。
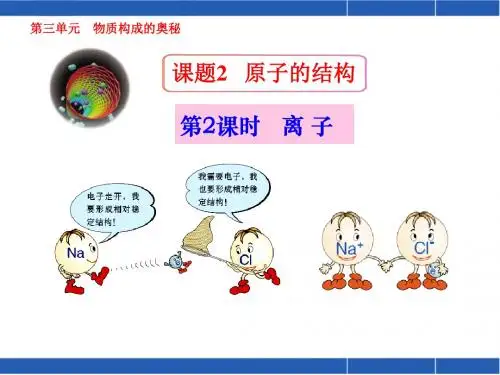



《原子的结构》教案第二课时大法寺中学李结一、教学目标1、知识与技能:①了解原子核外的电子是分层排布的;了解典型元素原子核外电子的排布特点;②以氯化钠为例,了解离子的形成过程,知道离子是构成物质的一种粒子;③了解化学在宏观物质与微观粒子之间建立联系的途径和特点。
2、过程与方法:充分利用教材提供的图、表等资料,借助模型等手段,初步学会运用类比、想象、归纳、概括等方法获取信息并进行加工。
3、情感态度与价值观:对学生进行世界的物质性、物质的可分性的辩证唯物主义观点的教育;激发学生对微观世界的探究欲和学习化学的兴趣。
二、教学重难点重点:核外电子的分层排布,离子的形成难点:离子的形成三、教学过程(一)问题导入【提问】物质铜、水、氯化钠分别由什么粒子构成的?【过渡】探索离子,让我们从原子说起…【回顾】原子的结构【过渡】前面学到原子的体积很小,与原子相比,原子核的体积更小。
如果把原子比作一个体育场,原子核只相当于体育场中的一只蚂蚁。
因此,原子核外有很大的空间,电子就在这个空间里作高速运动。
(二)探究新知一、核外电子的排布【展示】《电子的自白》并播放《核外电子排布》视频【讲授】核外电子的排布1.分层排布(高速运动)电子层:一二三四五六七离核远近:近远能量高低:低高【小结】排布特点1:电子在核外是分层排布的【展示】氧原子结构示意图和钠原子结构示意图【小结】排布特点2:原子的第一层最多排2个电子,第二层最多排8个电子,最外层电子数最多不超过8个(只有1层的不超过2个电子)。
排布特点3:电子总是先排在能量较低的电子层里【思考】能否用一个更简明的图形直观、形象地表示电子的分层排布呢?【讲授】原子结构示意图【活动】我会描述:画出属于你的原子结构示意图【分析】原子结构示意图【问题】1、上面的原子中,哪些是稀有气体的原子?哪些是金属的原子?哪些是非金属的原子?2、它们的原子的最外层电子数分别有什么特点?【过渡】小知识:物质都有趋向于稳定状态的特点。