《原子的结构》人教版化学2
- 格式:ppt
- 大小:4.39 MB
- 文档页数:20

《原子的结构》作业设计方案(第一课时)一、作业目标本次作业旨在通过巩固课堂所学知识,让学生深刻理解原子的基本结构、原子的构成以及核外电子的排布规律等概念,掌握原子的基本性质,并能够运用这些知识解决简单的化学问题。
二、作业内容1. 基础知识巩固学生需完成关于原子结构的基础知识填空题,包括原子核、质子、中子、电子及其相互关系,以及核外电子排布的基本规律。
2. 实践操作题学生需利用提供的元素周期表,查找指定元素(如钠、氯等)的原子结构信息,并绘制出该原子的结构示意图,标明核内质子数、中子数及核外电子排布情况。
3. 理解应用题结合课堂所学的原子结构知识,分析日常生活中常见的物质(如水、盐等)的组成元素及其原子结构特点,并尝试解释其化学性质。
4. 思考探究题提供一些有关原子结构的趣味化学实验(如气体导电实验),鼓励学生探索实验背后的原理,并思考如何利用所学原子结构知识解释实验现象。
三、作业要求1. 所有题目必须独立完成,不得抄袭他人答案。
2. 基础知识的填空题需要准确无误地填写每个空白处。
3. 实践操作题需用规范的方式绘制原子结构示意图,并准确标注相关信息。
4. 理解应用题需要结合所学知识进行合理分析,并用化学语言进行表述。
5. 思考探究题需要记录实验过程和观察到的现象,并尝试用所学的原子结构知识进行解释。
6. 作业需在规定时间内提交,并保持字迹清晰、格式规范。
四、作业评价教师将根据以下标准对学生的作业进行评价:1. 基础知识的掌握程度。
2. 实践操作题的准确性和规范性。
3. 理解应用题的逻辑性和表述能力。
4. 思考探究题的探索精神和解释的合理性。
5. 作业的按时提交情况和整体规范性。
五、作业反馈教师将对每位学生的作业进行详细批改,指出错误并给出正确答案或解释。
对于共性问题,将在课堂上进行集中讲解。
同时,鼓励学生之间互相交流学习,共同进步。
通过本次作业,学生可以更好地掌握原子的结构知识,为后续学习打下坚实的基础。

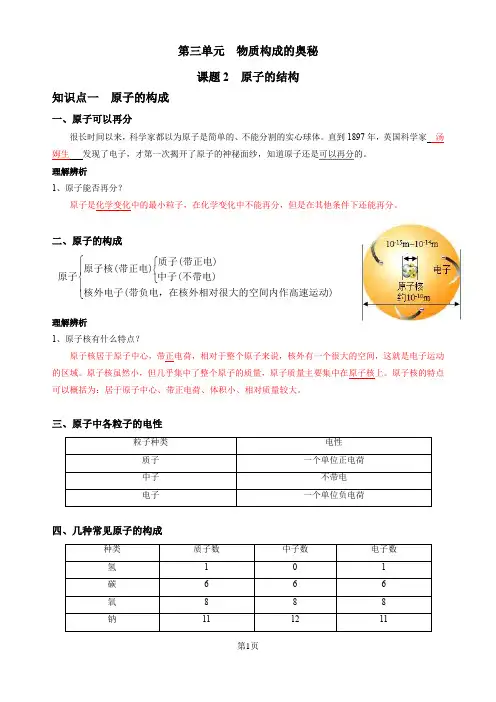
第三单元 物质构成的奥秘课题2 原子的结构知识点一 原子的构成一、原子可以再分很长时间以来,科学家都以为原子是简单的、不能分割的实心球体。
直到1897年,英国科学家 汤姆生 发现了电子,才第一次揭开了原子的神秘面纱,知道原子还是可以再分的。
理解辨析1、原子能否再分?原子是化学变化中的最小粒子,在化学变化中不能再分,但是在其他条件下还能再分。
二、原子的构成⎧⎧⎨⎪⎨⎩⎪⎩质子(带正电)原子核(带正电)原子中子(不带电)核外电子(带负电,在核外相对很大的空间内作高速运动)理解辨析1、原子核有什么特点?原子核居于原子中心,带正电荷,相对于整个原子来说,核外有一个很大的空间,这就是电子运动的区域。
原子核虽然小,但几乎集中了整个原子的质量,原子质量主要集中在原子核上。
原子核的特点可以概括为:居于原子中心、带正电荷、体积小、相对质量较大。
三、原子中各粒子的电性四、几种常见原子的构成理解辨析1、原子一定是由质子、中子、核外电子构成的吗?原子一般由质子、中子、电子这三种粒子构成,但某种氢原子中只有一个质子和一个核外电子,无中子。
五、原子中各种粒子之间的关系1、原子中,质子所带正电荷总数与核外电子所带负电荷总数相等,中子不带电,整个原子不显电性。
2、在原子中,核电荷数=质子数=核外电子数。
3、不同种类的原子,核内质子数不相等。
例题1、下列关于原子的叙述,正确的是( C)A.原子是不能再分的粒子B.一切原子的原子核都是由质子和中子构成的C.原子核内质子数等于核外电子数D.原子核内质子数必等于中子数例题2、有关原子带电情况的解释正确的是(B)A.原子中质子带浮负电,电子带正电B.原子核带正电C.电子不带电D.电子和中子电荷中和使得原子不带电例题3、在分子、原子、质子、中子、电子、原子核这些粒子中选择填空:(1)能保持物质化学性质的粒子是分子;(2)化学变化中的最小微粒是原子;(3)能直接构成物质的粒子是分子、原子;(4)构成原子核的粒子是质子、中子;(5)带正电的粒子是质子、原子核;(6)带负电的粒子是电子;(7)不带电的粒子是中子;(8)质量与氢-1原子质量近似相等的粒子是质子、中子;(9)质量最小的的是电子;(10)在同一原子中数目相等的是质子、电子。

人教版(2024新版)九年级上册化学:第三单元课题2《原子结构》教案教学设计一、教材分析九年级学生在之前的学习中已经初步了解了分子和原子的概念,对物质的微观构成有了一定的认识。
然而,原子结构的内容相对抽象,远离学生的生活经验,学生难以形成直观的表象认识。
此外,学生在物理课上虽然接触过电荷等概念,但对于原子内部粒子的带电性和电性关系等知识仍需进一步学习。
因此,在教学过程中,教师需要采用多种教学手段,如多媒体展示、实验演示、类比推理等,将抽象的原子结构直观化,帮助学生理解和掌握相关知识。
同时,教师还应关注学生的学习差异,采用分层次教学和个别指导相结合的方式,确保每个学生都能在课堂上取得成长和进步。
二、设计思路原子的结构是初中化学教学中的一个重要内容,它位于义务教育教科书九年级上册化学(人教版)第三单元中,是学生学习化学的基础。
本单元共分“分子和原子”“原子的结构”“元素”三个课题,其中“原子的结构”包含原子的构成、原子核外电子排布、离子的形成、相对原子质量等内容。
通过本单元的学习,学生将从微观角度理解物质的构成,为后续学习化学反应、酸碱盐等知识打下坚实基础。
原子的结构教学不仅涉及原子构成粒子的种类和数量,还包含构成原子的原子核、核外电子、质子和中子在层次、电性、数量和质量等方面的相互联系。
这些知识点对于学生理解物质世界的本质具有重要意义,也是培养学生抽象思维和逻辑推理能力的关键。
三、教学目标【化学观念】了解原子是由原子核和核外电子构成的,原子核带正电,电子带负电。
了解原子核是由质子、中子构成的,质子带正电,中子不带电。
理解原子的质量主要集中在原子核上。
【科学思维】了解原子核外电子的排布规律及离子的形成过程。
初步掌握相对原子质量的概念及其计算方法。
【科学探究】通过观察、想象、类比、模型化的方法,初步理解化学现象的本质。
学会运用科学探究的方法,如观察、归纳、推理等,解决化学问题。
能够在宏观与微观之间建立联系,理解物质的微观构成与宏观性质之间的关系。

《原子结构》教学设计的可能状态,复杂的原子光谱得以诠释。
1936年马德隆发表了以原子光谱事实为依据的完整的构造原理。
【过渡】什么是能层?什么是能级?构造原理又是什么?我们通过今天的学习内容进行了解。
现史,认识到科学是在不断发展的,培养求真务实、不断进步的科学精神与社会责任感。
讲授新课第三节有机化合物的分类方法【知识回顾】1.原子的结构①数量关系:核电荷数(Z) = 核内质子数= 核外电子数②质量关系:质量数(A)= 质子数(Z)+ 中子数(N)质量数:对质子和中子的相对质量取整数相加的数值,即近似原子量。
2.原子核外电子层的表达方式原子质量主要集中在原子核上。
原子核体积很小,只占原子体积的几亿分之一。
3.核外电子排布的一般规律(1)先排能量低的电子层,再排能量高的电子层,由内向外。
基础知识回顾回顾前面学习过的知识,为能层能级构造原理的做的学习铺垫。
(2)每一层最多容纳电子数:2n2个。
(3)最外层电子数不超过8个(K层为最外层时不超过2个)。
(4)次外层电子数不超过18个,倒数第三层不超过32个。
(5)倒数第三层不超过32个电子。
一、能层与能级1. 能层(1)含义:核外电子按能量不同分成能层,即电子层。
(2)符号及能量关系:小结:能层越高,电子的能量越高,离原子核越远。
2. 能级(1)含义:同一能层的电子,还被分成不同能级。
(2)能级符号与所能容纳电子数如下表:【思考与讨论】(1)一个能层的能级数与能层序数(n)间存在什么关系?一个能层最多可容纳的电子数与能层序数(n)间存在什么关系?答案:2n2 ;相等(2)以s、p、d、f为符号的能级分别最多可容纳多少个电子?3d、4d、5d能级容纳的最多电子数是否相同?答案:;相同(3)第五能层最多可容纳多少个电子?它们分别容纳在几思考交流通过思考与交流,学会归纳总结能级数与序数、最多容纳电子数的关系,更深入的理解核外电子排4.下列能级符号表示正确且最多容纳的电子数按照从少到多的顺序排列的是( A )A.1s、2p、3dB.1s、2s、3sC.2s、2p、2dD.3p、3d、3f5.原子核外P 能层和p 能级可容纳的最多电子数分别为( C )A.32 和2B.50 和6C.72 和6D.86 和10二、基态与激发态原子光谱1.基态与激发态(1)基态原子:处于最低能量状态的原子。


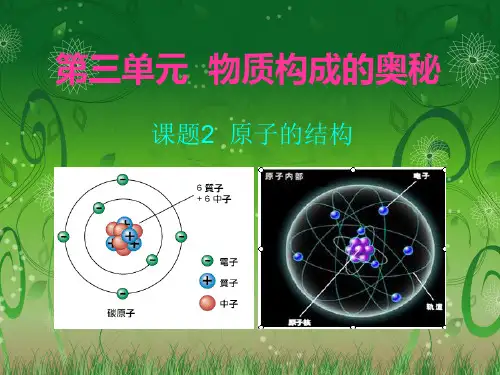

2022-2022学年人教版化学九年级上册32原子的结构教案(2)课题2 原子的结构一.教学目标【与技能】1.了解原子是由原子核和核外电子构成的。
2.了解核电荷数、质子数和核外电子数的关系。
3.知道原子核外电子的分层排布规律,并能用结构示意图表示。
【过程与方法】1.通过交流提问的方式来提高学生的归纳和表达能力。
2.运用形象恰当的比喻来学习微观的概念。
【情感·态度·价值观】通过对原子结构的学习,激发学生对微观世界的好奇心和探究欲,增强学生学习化学的兴趣。
二.教学重难点【教学重点】原子的构成及核外电子分层排布规律。
【教学难点】原子结构示意图的书写。
三.教学过程(一)导入新课1964年10月16日,我国第一颗原子弹爆炸了,我们看到了这朵美丽的蘑菇云腾空而起,放出了巨大的能量,这与原子结构密切相关。
前面我们学习了化学变化中分子能再分子而原子不能再分,如果抛开化学变化,原子能否再分呢今天我们一起来揭开原子神秘的面纱。
(二)推进新课1.原子的构成师:原子到底能不能分?如果能分,它又是由哪些部分构成的呢?带着这些问题,我们来学习本课题的第一个问题:原子的构成。
2.构成原子的粒子及性质:构成原子的粒子电子原子核质子中子(1)电性和电量1个电子带1个单位的负电荷1个质子带1个单位的正电荷中子不带电(2)相对质量忽略不计113.阅读课本第54页第一段的内容,原子内部大部分空间被电子占据,原子核体积很小,原子是一个空心球体。
【讨论交流】1.构成原子的三种粒子的电性、质量如何?整个原子的质量集中在哪里?2.原子中有带电粒子,那么整个原子是否带电?为什么?3.是否所有原子中都含有中子?4.原子中质子数、电子数、中子数有何关系?5.不同种类的原子内部结构有何不同?【温馨点拨】1.质子带正电,电子带负电,中子不带电。
质子和中子质量近似相等,电子质量较质子和中子小得多。
原子的质量主要集中在原子核上。
2.原子不带电。
《原子结构》第二课时教学设计原子结构理论成功的阐述了原子的稳定性,氢原子光谱的产生和不连续性。
1926年,量子力学推翻了玻尔的氢原子模型,指出一定空间运动状态的电子并不在玻尔假定的线性轨道上运行,而在核外空间各处都可能出现,但出现的概率不同,可以算出它们的概率密度分布。
概率密度:P表示电子在某处出现的概率;V表示该处的体积;求真务实、不断进步的科学精神与社会责任感。
讲授新课第一节原子结构第二课时电子云与原子轨道、泡利原理、洪特规则、能力最低原理一、电子云【问题】图1-7 中的小点是什么呢?是电子吗?小点是1s电子在原子核外出现的概率密度的形象描述。
小点越密,表明概率密度越大。
由于核外电子的概率密度分布看起来像一片云雾,因而被形象的称作“电子云”。
1.电子云概念电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。
电子在原子核外一定空间范围内出现的概率统计起来,好似在原子核外笼罩着一团带负电的云雾,形象称为“电子云”。
2.电子云轮廓图电子云图很难绘制,使用不便,我们常使用电子云轮廓图。
为了表示电子云轮廓的形状,对核外电子的空间运动状态有一个形象化的简便描述。
把电子在原子核外空间出现概率P=90%的空间圈出来,即电子云轮廓图。
【过渡】所有原子的任意能层的s电子的电子云轮廓图都思考认识核外电子的运动特点。
知道电子的运动状态(空间分布及能量)。
是一个球形,只是球的半径不同。
同一原子的能层越高,s 电子云半径越大,是由于电子的能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展。
就像宇宙飞船必须提供能量推动才能克服地球引力上天,2s电子比1s电子能量高,克服原子核的吸引在离核更远的空间出现的概率就比1s大,因而2s电子云必然比1s电子云更弥散。
二、原子轨道1.定义:电子在原子核外的一个空间运动状态称为一个原子轨道。
2.形状:(1)s电子的原子轨道呈球形,能层序数越大,原子轨道的半径越大。
《原子的结构》说课稿说课教师节:陈耀楷我今天说课的内容是人教版九年级化学上册第三单元课题2《原子的结构》,下面我分别从说教材、说学情、说教法和学法、说教学过程,说预期效果等几个方面说说本节课的教学设想一、说教材本单元在教材中的地位、作用:本单元教材是双基的重要组成部分,本单元基本概念较集中,这些概念是中学化学中最核心的一些概念。
所以本单元是全书(甚至是整个中学段)的一个重心,是基础。
所以本单元教材对于学生十分重要,它既是今后学习的理论基础,又是必不可少的工具。
而本课题包括原子的构成、相对原子质量两部分内容。
此前学生已经学习了分子、原子的概念,初步探索了物质构成的奥秘,但他们并不满足,还想知道原子是否可以再分,原子的质量有多大等等。
本课题学习的原子的构成,就是回答这些问题。
关于原子质量,书上给出了氢原子和氧原子的绝对质量,并指出它们数值太小,不便于记忆、书写和计算,只能使用相对质量。
考虑到此时学生尚无同位素的知识,不便提元素相对原子质量是按各种天然同位素原子所占的一定百分比计算出来的平均值,所以此处只能要求学生对相对原子质量做含糊的、初步的了解。
将原子的相对原子质量作为元素的相对原子质量使用。
本课的教学目标:知识与技能1.阐述原子、原子核的构成,并解释整个原子呈电中性的原因。
2.能说出核电荷数、质子数和核外电子数的关系,并能进行简单的计算。
3.简述相对原子质量的概念,学会查找相对原子质量。
过程和方法1.通过对“原子进一步可分”的讨论,进一步提高抽象思维能力和微观想象能力。
2.在学习原子的结构、相对原子质量等问题时,设计出一个个问题情境(见教学过程),带着问题看录像,阅读课文、思考讨论,自然的得出结论。
3.在分析原子结构时,鼓励主动与他人进行交流和讨论,清楚地表达自己的观点,逐步形成良好的学习习惯和学习方法。
情感、态度与价值观:通过对“原子可分,原子核也可分”的讨论,渗透物质的无限可分的辩证唯物主义的观点。