青蒿素分析方法的确定
- 格式:ppt
- 大小:2.30 MB
- 文档页数:48

北京化工大学北方学院NORTH COLLEGE OF BEIJING UNIVERSITY OFCHEMICAL TECHNOLOGY(2013)届本科生天然产物有效成分提取大作业题目:青蒿素的提取学院:理工院专业:化学工程与工艺学号: 090101153 姓名:马鸿飞指导教师:刘雪凌教研室主任(负责人):2012 年 6 月 5 日天然色素的提取——青蒿素提取马鸿飞化学工程与工艺化工0906班学号090101153指导老师:刘雪玲摘要提取青蒿素的工艺 ,考察了粒度、压力、温度、时研究了超临界CO2流量等影响因素.以萃取率为目标 ,综合考虑产品收率 ,优化了超临间、CO2界萃取工艺条件 ,得到较佳的操作条件:萃取压力 20 MPa ,萃取温度50 ℃,每千克原料CO质量流量1 kg/ h ,分离器Ⅰ的温度为60 ℃,压力为14 MPa.2在优化条件下萃取 4 h ,萃取率达到 95 %以上 ,萃取物纯度在 15 %以上. 关键词:青蒿素超临界二氧化碳萃取黄花蒿前言超临界流体萃取是利用处于临界温度,临界压力之上的超临界流体具有溶解许多物质的能力的性质,将SCF作为萃取剂,从液体或固体中萃取分离出特定的成分的新型分离技术由于它具有低能耗、无污染和适合于处理易热分解和易氧化物质的特性,因而在化学工业、能源工业和医药工业中引起广泛的兴趣和应用。
流体与普通的有机溶剂相比,具有明显的优SCF 萃取剂特别是超临界CO2势。
它是环境友好型溶剂,对人畜无害,不污染环境,也不会残留在产品中,而且临界温度(31。
1度)和临界压力(7.387MPa)较低,故操作条件相对较温和。
流体密度接近于液体,因而具有很大的溶解能力,而粘度却接近由于超临界CO2于气体,其扩散能力又比液体大100倍以上。
并且,其溶解能力和选择性很方便的通过改变压力和温度进行调节,萃取速率快,操作时间短,所以一直受到大家的重视。
SFE技术在食品、医药、香料和天然色素等领域的天然物提取分离上的应用研究,一直是SFE技术研究最活跃的领域,受历史和传统习惯的影响,国外这方面的研究主要集中在天然香味物、调味品和天然色素的提取上,而国内则多集中在传统中药的有效成分的提取上,以适应中药现代化的发展要求。



UPLC—MS MS法检测青蒿中青蒿素的含量摘要:采用UPLC-MS/MS法检测青蒿中青蒿素的含量,色谱柱Waters ACQUITY BEH C18(50 mm×2.5 mm,1.9 μm),以甲醇和水梯度洗脱,甲醇-水体积比为40%(0 min)-70%(4.5 min)-40%(5.0 min)-40%(5.5 min),流速0.30 mL/min,柱温30 ℃,进样量3.0 μL,离子模式(ESI+)分析,青蒿素母离子为m/z=283.3。
子离子m/z=151.2,m/z=209.4。
结果表明,在上述条件下,青蒿素与杂质分离完全,无明显干扰,检出限达到0.174 ng,平均回收率为99.38%,精密度良好,青蒿中青蒿素含量为(1 045.19±27.55)mg/kg,该法适用于青蒿素分析。
关键词:UPLC-MS/MS;青蒿;青蒿素Detection of Artemisinin in Artemisia annua L. by UPLC-MS/MSAbstract:The detection of artemisinin in Artemisia annua L. was analysed by UPLC-MS/MS. The chromatographic column waters ACQUITY BEH C18(50 mm×2.5 mm,1.9 μm)was used in the analysis. The elution program was 40% (methanol/water,V/V,0 min)-70%(4.5 min)-40%(5 min)-40%(5.5 min). The isolation was preformed with 0.3 mL/min at 30 ℃,and the injection volume was 3.0 μL in ESI(+)scan. The precursor ion of artemisinin was m/z=283.3,daughter ion were m/z=151.2,m/z=209.4. The results showed that artemisinin could be detected in these conditions. The detection limit was 0.174 ng with recovery of 99.38% and good precision. The content of artemisinin in Artemisia annua L. reached (1 045.19±27.55)mg/kg. It was suitable for detecting artemisinin in Artemisia annua L..Key words:UPLC-MS/MS;Artemisia annua L.;artemisinin青蒿(Artemisia annua L.),又名黄花蒿,菊科,一年生草本,高1.5 m,全株黄绿色,有浓烈挥发性香气。


柱层析提取法提取青蒿素的工艺研究罗嘉玲;李青嵘;张雅文;陈亚飞;倪贺;李海航【摘要】研究开发了一种柱层析提取法提取青蒿素的新工艺.将干燥粉碎的黄花蒿植物材料用提取溶剂V石油醚∶V95%乙醇=2∶8按m料∶V液=1.0∶3.5湿法装入层析柱中,静置lh后洗脱.少量和放大提取实验都显示:收集3.50、4.75、7.00和10.50倍体积洗脱液时,青蒿素的提取率分别超过90%、95%、97%和99%.结果表明:该提取方法工艺简单、提取率高、溶剂用量少、节能环保、设备和生产成本低,适合工业上提取制备青蒿素.%A new column chromatographic extraction (CCE) method was developed for the extraction of artemisinin from Artemisia annua.Dried material was loaded into a column using 3.5-fold (V/m) extraction solvent of petroleum ether:95%ethanol (2∶ 8).After 1 h when artemisinin is fully dissolved,the column was eluted with the extraction solvent.The extraction efficiency in both small-scale and enlarged-scale experiments reached more than 90%,95%,97% or 99%when collecting 3.50-,4.75-,7.00-or 10.50-fold eluent,respectively.The results indicated that the CCE method is simple and highly efficient;and the extraction process can be completed in a column at room temperature at low equipment and production costs.It can be used for industrial extraction of artemisinin.【期刊名称】《华南师范大学学报(自然科学版)》【年(卷),期】2018(050)002【总页数】5页(P65-69)【关键词】黄花蒿;青蒿素;柱层析提取;混合溶剂【作者】罗嘉玲;李青嵘;张雅文;陈亚飞;倪贺;李海航【作者单位】华南师范大学生命科学学院∥广东省植物发育生物工程重点实验室,广州510631;华南师范大学生命科学学院∥广东省植物发育生物工程重点实验室,广州510631;华南师范大学生命科学学院∥广东省植物发育生物工程重点实验室,广州510631;华南师范大学生命科学学院∥广东省植物发育生物工程重点实验室,广州510631;华南师范大学生命科学学院∥广东省植物发育生物工程重点实验室,广州510631;华南师范大学生命科学学院∥广东省植物发育生物工程重点实验室,广州510631【正文语种】中文【中图分类】Q819青蒿素(Artemisinin)是20世纪70年代从菊科艾属的草本植物黄花蒿( Artemisia annua L.)中分离得到的一种具有过氧桥结构的倍半萜内酯类化合物[1]. 青蒿素是最有效的抗疟疾药物之一,具有高效、速效和低毒等特点[2-5]. 也有研究[6-7]通过青蒿素的结构修饰,合成出了系列活性更高的青蒿素衍生物,如双氢青蒿素、蒿甲/乙醚和青蒿琥酯等. 青蒿素及其衍生物除抗疟疾外,还有抗肿瘤、抗孕、抗纤维化、抗血吸虫和弓形虫等寄生虫、抗心律失常和治疗各种皮肤病等作用[8-9].青蒿素主要是从青蒿植物材料中提取. 青蒿素在青蒿中的含量很低,不同产地青蒿中青蒿素含量差异显著,最高可达干质量的1%~2%[5]. 目前提取青蒿素通常采用有机溶剂浸泡法,超声或微波辅助的浸泡提取法,也有用超临界CO2 萃取法. 王轶[10]以青蒿叶干粉为原料, 用95%乙醇搅拌提取青蒿素,通过正交实验得到的最佳提取条件为: 原料粒度0.25 mm,溶剂量60 mL/g, 提取温度50 ℃,提取时间120 min,青蒿素提取率可达78.2%. 黄荣岗等[11]用 70%甲醇在5 ℃下低温提取青蒿素3 h,青蒿素的提取率最高达到82.5%. 钱国平等[12]用超临界CO2提取法提取青蒿素,提取率达到95%以上,提取物纯度可达10%以上. 赵兵等[13]在50 ℃下用超声波辅助的石油醚提取青蒿素,提取率可达83%. 郝金玉等[14]用乙醇、三氯甲烷、环己烷、正己烷、石油醚、120#溶剂油和6#溶剂油等不同溶剂提取青蒿素,比较了微波辅助提取与索氏提取、超临界CO2提取和加热搅拌提取法的效果,表明微波辅助萃取可大大提高提取速率,6#油的提取率最高,达到92.1%.目前工业上提取青蒿素主要以汽油等为溶剂加热提取,存在溶剂用量大、能耗高、提取率低和安全性差等问题. 本实验室开发了一种提取天然药物的柱层析提取新方法[15-16],本研究利用该柱层析提取法开发和优化从黄花蒿中提取青蒿素工艺,旨在为青蒿素的工业化生产提供更安全、低成本的方法.1 材料与方法1.1 实验材料与试剂干燥粉碎的黄花蒿植物材料和青蒿素标准品由广州斯威森科技有限公司提供. HPLC所用甲醇为色谱纯,其它试剂均为分析纯试剂,购自本地试剂公司.1.2 青蒿素HPLC定性定量分析方法的建立用95%乙醇将青蒿素标准品配成质量浓度为312.5 mg/L的溶液, UV759分光光度计(上海精科实业有限公司)测定青蒿素的紫外吸收光谱和吸收峰. 以实验确定的紫外吸收峰为检测波长,用LC-20AT高效液相色谱(日本岛津公司)系统对青蒿素进行定性与定量分析. 所用色谱柱为C18 柱(250 mm ×4.6 mm,5 μm),流动相为V甲醇∶V水=75∶25,流速为1 mL/min,进样量10 μL. HPLC分析样品经过0.45 μm的膜过滤. 样品中青蒿素的保留时间为青蒿素标准品保留时间. 用10mg/mL的青蒿素标准品溶液,配制成不同质量浓度的溶液[16],制作青蒿素质量浓度与峰面积之间的定量曲线,计算样品中青蒿素含量.1.3 柱层析法提取青蒿素方法的优化柱层析提取法是将植物材料用最少体积的提取溶剂装入层析柱中,待成分充分溶解后,用同样的溶剂、按柱层析洗脱的原理和方法,将材料中的青蒿素从层析柱中洗脱出来,整个过程在室温下进行. 因此,需要筛选出溶解青蒿素的最佳溶剂,然后测定青蒿材料吸收该溶剂达到饱和时所需要的最小体积的溶剂(Minimum Volume,MV)[15],材料中青蒿素充分溶解(达到溶解平衡)所需要的时间已事先测定为0.5h.1.3.1 提取溶剂最佳配比的确定干燥的黄花蒿茎叶粉末过42.5 μm筛,作为提取材料. 提取溶剂为不同比例的V石油醚∶V95%乙醇混合溶剂(10∶0、8∶2、6∶4、4∶6、2∶8、0∶10). 在5 mL提取溶剂中加入1 g材料,浸泡0.5 h后,离心取上清液,HPLC测定提取液中青蒿素的含量,选择青蒿素含量高的溶剂作为提取溶剂.1.3.2 材料饱和吸液最小体积(MV)的确定在10 mL提取溶剂中加入1 g提取材料,在25 ℃下、200 r/min分别震荡浸泡0.5、1.0、2.0、3.0、4.0、5.0 h,过滤,测定剩余提取液的体积(V余),1 MV=10-V余.1.3.3 柱层析法少量提取青蒿素方法的建立称取青蒿材料9 g,按比m料∶V液=1.0∶3.5加入提取溶剂,按柱层析湿法装柱的方法,装入层析柱. 静置0.5 h,待青蒿素充分溶解后,以1.0 MV/h的流速洗脱. 依次按1.0、0.5、0.5、1.0 MV的体积收集洗脱液,共收集4份、总体积3 MV 的洗脱液. 残渣用10倍体积的提取溶剂超声辅助的浸泡提取1次,超声功率为240 W、频率为40 kHz,时间为1 h. HPLC测定每份提取液中青蒿素的含量,计算提取率(以收集的3 MV和残渣中的青蒿素总量作为100%,计算各部分的提取率). 每个实验重复3次,结果为3次重复的平均值,计算重复之间的标准差(Standard Error,SE).1.3.4 柱层析法大量提取青蒿素方法的建立用直径为8 cm,柱高为80 cm的层析柱放大80倍进行实验,填料质量为750 g. 青蒿素的提取及检测方法与柱层析少量提取法相同.2 结果与分析2.1 青蒿素定性定量分析青蒿素在190~400 nm的紫外光范围内只有一个显著的吸收峰(图1A),吸收峰波长为208 nm,选择该波长为HPLC的检测波长. 图1B为青蒿素标品HPLC图谱,根据青蒿素标准品的保留时间,确定提取液中青蒿素保留时间为8 min. 在质量浓度为1~6 g/L范围内,青蒿素与其峰面积之间有良好的线性关系(图1C). 在采用的实验分析条件下,提取液中的青蒿素能与杂质达到基线分离(图1D),可准确测定溶液中的青蒿素含量.图1 青蒿素HPLC定性定量分析方法的建立Figure 1 Qualitative and quantitative analysis of artemisinin by HPLC2.2 柱层析法提取青蒿素的最佳条件确定2.2.1 提取溶剂的筛选通过浸泡实验测定了不同比例的石油醚与95%乙醇组成的混合溶剂对青蒿素提取的影响. 结果表明(图2),在V石油醚∶V95%乙醇在10∶0到0∶10范围内,青蒿素的提取率随 95%乙醇比例的增加而提高;在V石油醚∶V95%乙醇为2∶8时,青蒿素提取率最高;此后再增加提取液中95%乙醇的比例,青蒿素提取率逐渐下降. 因此,确定青蒿素在该溶剂系统中的最佳提取溶剂为V石油醚∶V95%乙醇=2∶8.图2 提取液不同配比对青蒿素提取效率的影响Figure 2 Effect of ether and ethanol proportions in the extraction solvent on the extraction efficiency of artemisinin2.2.2 植物材料饱和最小吸液体积的测定植物材料1 g在浸泡0.5~5.0 h后,吸收的提取液体积基本一样,介于3.0~3.5 mL/g之间(图3),表明材料吸收提取溶剂的速度很快,浸泡0.5 h已达到吸收饱和. 因此,确定青蒿材料对最佳提取溶剂的饱和吸液时间为0.5 h,材料的饱和最小吸液体积为3.5 mL/g,即1 MV=3.5. 根据以上结果,确定从植物材料中提取青蒿素的条件为:提取液V石油醚∶V95%乙醇=2∶8. 按m植物材料∶V提取液=1.0∶3.5将植物材料装入层析柱中,放置0.5 h后,再用该溶剂将层析柱中的青蒿素洗脱出来.图3 植物材料饱和吸液最小体积(MV)的确定Figure 3 Determination of minimum volume (MV) of solvent for the plant material fully absorbed2.3 柱层析法提取青蒿素条件的优化及其放大提取实验收集的4份(1.0、0.5、0.5、1.0 MV)提取洗脱液和残渣浸泡提取液其青蒿素质量分数分别为92.3%、4.3%、1.4%、1.8%、0.2%(图4A). 结果表明:收集前1.0、1.5 MV的提取液(分别为材料干质量的3.50倍和4.75倍体积的溶剂),青蒿素的提取率可分别达到92.3%和96.6%. 收集3 MV体积的提取液时(即材料干质量的10.5倍体积提取液),青蒿素的提取率可达到99.8%,残渣中的青蒿素质量分数只有0.2%.实验室条件下,将以上提取实验放大80倍,步骤和试剂不变,收集前4份、总体积3 MV的提取液和残渣的浸泡提取液,分析结果如图4B所示. 前1.0 MV和1.5 MV 的提取液中青蒿素提取率分别达到90.2%和95.1%,收集3 MV体积的洗脱液,青蒿素的提取率可达到99.4%,植物材料中残留的青蒿素为0.6%. 为了减少提取液的体积和节省提取时间,生产中可以只收集前1.5 MV提取液,青蒿素的提取率均可达到95%以上.图4 柱层析法提取青蒿素的提取效果Figure 4 Extraction efficiency of artemisinin by the columnchromatographic extraction柱层析法提取的青蒿素,经过减压浓缩回收溶剂,蒸干后得到提取物. 实验所用的植物材料中青蒿素的质量分数为1.85%,经柱层析浓缩后,提取物少量提取实验和放大提取实验中青蒿素的质量分数达22.5%.3 讨论与结论传统的青蒿素提取方法主要是用有机溶剂浸泡或加热回流提取,或同时加超声波、微波辅助提取,通常需要经过多次提取才能达到比较高的提取率. 这些方法存在溶剂用量大、操作复杂、能耗高等问题[17]. 而超临界CO2萃取法的设备成本和提取物生产成本高,在工业上的应用受到限制.本研究用最新开发的柱层析法提取青蒿素,具体工艺流程为:干燥粉碎的黄花蒿植物材料用提取溶剂(V石油醚∶V95%乙醇=2∶8)按m料∶V液=1.0∶3.5的量,湿法装入层析柱中,静置1 h后,用提取溶剂洗脱. 收集前1.5 MV提取液,青蒿素的提取率可达到95%以上. 文中选用的青蒿素提取的溶剂为石油醚与 95% 乙醇组成混合溶剂系统. 该系统可通过 2 种不同极性有机溶剂之间的不同比例,配制从低极性的石油醚到高极性的95%乙醇呈不同极性的混合溶剂. 该提取液可直接或加入少量水后即可使石油醚相与醇水相自动分离,达到不同目标成分的分离;同时,2 种有机溶剂都可以分离回收和重复使用[18]. 此外,柱层析提取法的所有操作都在室温下完成,避免了青蒿素的受热分解,降低了能耗.综上所述:用柱层析提取法提取青蒿素,工艺简单、提取率高、溶剂用量少、节能环保、设备和生产成本低,适合工业上大量制备青蒿素.参考文献:[1] HSU E. The history of Qinghao,in the Chinese materia medica[J]. Transactions of the Royal Society of Tropical Medicine &Hygiene,2006,100(6):505-508.[2] 张海惠. 黄花蒿中青蒿素的提取工艺优化、含量测定及细胞培养研究[D]. 雅安:四川农业大学,2012.ZHANG H H. Artemisinin of extraction process optimization,content determination and cell culture from Artemisia annua L.[D]. Ya’an:Sichuan Agricultural University,2012.[3] 张馨莹. 黄花蒿中青蒿素的提取工艺及测定方法研究[D]. 重庆:西南大学,2013. Zhang X X. Study on the extraction technology and determination methods of artemisinin from Artemisia annua L. [D]. Chongqing:Southwest University,2013.[4] 徐溢,范琪,盛静,等. 青蒿素的提取分离和检测方法研究进展[J]. 药物分析杂志,2013(9):1465-1470.XU Y,FAN Q,SHENG J,et al. Research and development of separation and detection methods for artemisinin [J]. Chinese Journal of Pharmaceutical Analysis,2013(9):1465-1470.[5] 何玉娟. 黄花蒿植物中青蒿素的提取分离过程研究[D]. 天津:天津大学,2004. HE Y J. Extraction and separation of artemisinin from Artemisia annua L.[D]. Tianjin:Tianjin University,2004.[6] HAYNES R K. From artemisinin to new artemisininantimalarials:biosynthesis,extraction,old and newderivatives,stereochemistry and medicinal chemistry requirements [J]. Current Topics in Medicinal Chemistry,2006,6(5):509-537.[7] 路娟,陈莉,房碧晗,等. 青蒿素类衍生物结构修饰研究进展[J]. 中医药信息,2014(4):181-187.LU J,CHEN L,FANG B H,et al. Advances in structure modification ofartemisinin derivatives [J]. Information on Traditional Chinese Medicine,2014,31(4):181-187.[8] 周洁芸,朱焰. 青蒿素及其衍生物抗肿瘤作用研究进展[J]. 天然产物研究与开发,2014,26(6):975-981.ZHOU J Y,ZHU Y. Progress in antitumor effects of artemisinin and its derivatives [J]. Natural Production Research Development,2014,26(6):975-981.[9] 张楠. 青蒿素类药物的主要研究进展[J]. 中国药物评价,2013,30(1):13-16. ZHANG N. Research progress of the artemisinin drugs [J]. Chinese Journal of Drug Evaluation,2013,30(1):13-16.[10] 王轶. 青蒿素最佳提取工艺研究[J]. 河南农业科学,2007,36(7):84-86. WANG Y. Studies on the optimum technology of artemisinin extraction[J]. Henan Agricultural Science,2007,36(7):84-86.[11] 黄荣岗,杨家庆,詹利之,等. 不同工艺提取青蒿中青蒿素的对比研究[J]. 按摩与康复医学旬刊,2012(3):4-5.[12] 钱国平,杨亦文,吴彩娟,等. 超临界CO2从黄花蒿中提取青蒿素的研究[J]. 化工进展,2005,24(3):286-290.QIAN G P,YANG Y W,WU C J,et al. Supercritical CO2 extraction of artemisinin from Artemisia annua L.[J]. Chemical and Industrial Progress,2005,24(3):286-290.[13] 赵兵,王玉春,吴江,等. 超声波用于强化石油醚提取青蒿素[J]. 化工冶金,2000,21(3):310-313.ZHAO B,WANG Y C,WU J,et al. Extraction of artemisinin enhanced with ultrasonic wave[J]. Engineering Chemistry & Metallurgy,2000,21(3):310-313.[14] 郝金玉,韩伟,施超欧,等. 黄花蒿中青蒿素的微波辅助提取[J]. 中国医药工业杂志,2002,33(8):385-387.HAO J Y,HAN W,SHI C O,et al. Microwave-assisted extraction of artemisinin from Artemisia annua L.[J]. Chinese Journal ofPharmaceuticals,2002,33(8):385-387.[15] NI H,ZHOU X H,LI H H,et al. Column chromatographic extraction and preparation of cordycepin from Cordyceps militaris waster medium [J]. Journal of Chromatography B,2009,877(22):2135-2141.[16] WANG L,GONG L H,CHEN C J,et al. Column-chromatographic extraction and separation of polyphenols,caffeine and theanine from green tea [J]. Food Chemistry,2012,131(4):1539-1545.[17] 廖巧,龙世平,杨春贤. 青蒿素提取与检测工艺的研究进展[J]. 安徽农业科学,2012,40(28):1631-1636.LIAO Q,LONG S P,YANG C X. Research progresses on extraction and detection techniques of artemisinin [J]. Journal of AnhuiAgriculture,2012,40(28):1631-1636.[18] HAN H B,LI H,HAO R L,et al. One-step column chromatographic extraction with gradient elution followed by automatic separation of volatiles,flavonoids and polysaccharides from Citrus grandis [J]. Food Chemistry,2014,145(4):542-548.。

青蒿素化学结构鉴定的经过屠呦呦的小组先后在北京医学院林启寿教授(已故)和中国医学科学院药物研究所梁晓天教授(已故)的指导下,用分离到的青蒿素进行过元素分析、红外光谱、质谱、核磁和部分化学反应的研究,分子中没有氮原子,推测此化合物是一种具有倍半萜结构的新型的抗疟药。
由于研究力量和仪器设备薄弱,难以单独完成全部结构鉴定研究,因此和上海有机化学所协商。
经“上海地区523办公室”协调,由周维善教授主持,吴照华和吴毓林负责,并同意中药所派一人参加。
自1974年2月起,中药所先后派出倪慕云、刘静明和樊菊芬到上海,短时期和有机所的研究小组共同工作。
屠呦呦本人没有参加有机所的研究。
尽管这些工作是在上海有机所进行,但是梁晓天教授也为青蒿素的结构研究做了很多贡献,并通过屠呦呦和她组员的通话,为上海的研究提出参考意见。
1974-1975年在有机所的主持下,研究了青蒿素一系列的化学反应,其中最有价值的四组反应,一是与碘化钠作用生成碘的颜色反应和三苯磷的还原反应证实青蒿素中过氧基团的存在;二是用盐酸羟胺反应和氢氧化钠滴定证明青蒿素有一个内酯基团;三是用NaBH4可将其内酯基还原成半缩醛,而保留过氧基团不变,这个产物开始称其为“还原青蒿素”,在青蒿素的化学结构确定后,才称之为“双氢青蒿素”;四是青蒿素的氢化反应,用钯-碳酸钙催化,生成脱氧青蒿素。
这些化合物为以后的构效关系研究和青蒿素衍生物的制备奠定了基础[刘静明、倪慕云、樊菊芬、屠呦呦(北京中医研究院中药研究所)、吴照华、吴毓林、周维善(中国科学院上海有机化学研究所),青蒿素(Arteann uin)的结构和反应,化学学报1979,37(2):129-143]。
在红外光谱、核磁共振氢谱,质谱、圆二色谱数据和化学反应的基础上,有机所的专家推定出青蒿素的部分结构。

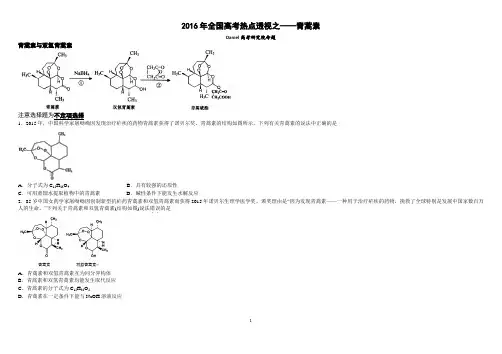
2016年全国高考热点透视之——青蒿素Daniel高考研究院命题青蒿素与双氢青蒿素注意选择题为不定项选择1.2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖。
青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是A.分子式为C15H22O4B.具有较强的还原性C.可用蒸馏水提取植物中的青蒿素D.碱性条件下能发生水解反应2.85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学医学奖。
颁奖理由是“因为发现青蒿素——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家数百万人的生命。
”下列关于青蒿素和双氢青蒿素(结构如图)说法错误..的是A.青蒿素和双氢青蒿素互为同分异构体B.青蒿素和双氢青蒿素均能发生取代反应C.青蒿素的分子式为C15H22O5D.青蒿素在一定条件下能与NaOH溶液反应3.青蒿琥酯是治疗疟疾的首选药,可由青蒿素两步合成得到。
下列有关说法正确的是A.青蒿素分子式为C15H22O5B.青蒿素不能与NaOH溶液反应C.反应②原子利用率为100%D.青蒿琥酯能与氢氧化钠溶液反应可生成青蒿琥酯钠4.中国女药学家屠呦呦因发现青蒿素对疟疾的治疗作用而成为2015年诺贝尔生理医学奖获得者之一。
下列说法不正确...的是A.从青蒿中提取青蒿素的方法是以萃取原理为基础,萃取是一种化学变化B.青蒿素的分子式为C15H22O5,它属于有机物C.人工合成青蒿素经过了长期的实验研究,实验是化学研究的重要手段D.现代化学分析测试中,可用元素分析仪确定青蒿素中的C、H、O元素5.某种药物青蒿素结构如右图所示,则下列说法正确的是A.青蒿素易溶于水B.青蒿素的晶体为原子晶体C.青蒿素能与NaOH溶液反应D.青蒿素不能与NaOH溶液反应6.2011年我国女科学家屠呦呦因“发现青蒿素——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”而获得有诺贝尔奖“风向标”之誉的拉斯克临床医学奖。

中考化学化学科普阅读题20篇(附带答案解析)(word)一、中考化学科普阅读题1.阅读下面科普短文(改编自屠呦呦2015年12月7日瑞典演讲稿)。
很多中药古方都提到了青蒿入药抗疟疾,但当1971年开始从青蒿中提取有效成分时,结果却总是不理想。
屠呦呦研究组反复研究中医古籍,其中“青蒿一握,以水两升渍,绞取汁,尽服之”激发了她的灵感。
是不是高温下破坏了青蒿中抗疟的有效成分?屠呦呦立即改用乙醚在较低温度下进行提取,成功获得了抗疟有效单体的提纯物质,命名为青蒿素。
完成样品纯化后,通过元素分析、光谱测定、质谱及旋光分析等技术手段,测定相对分子质量为282,得出了青蒿素的化学式。
但青蒿素的具体结构是什么样的呢?有机所得专家做了一个定性实验,加入碘化钾后,青蒿素溶液变黄了,说明青蒿素中含有过氧基团;而后专家又通过X射线衍射法等方法,最终确定了青蒿素是含有过氧基的新型倍半萜内酯。
由于自然界中天然青蒿素的资源是有限的,接下来就要把自然界的分子通过人工合成制成药物。
在这一过程中,研究组又有一项重大研究成果,获得了青蒿素的衍生物。
衍生物之一是双氢青蒿素,它也具有抗疟的疗效,并且更加稳定,水溶性好,比青蒿素的疗效好10倍,进一步体现了青蒿素类药物“高效、速效、低毒”的特点。
依据文章内容,回答下列问题:(1)从中国古代青蒿入药,到2004年青蒿素类药物被世界卫生组织列为对抗疟疾的首选药物,经历了漫长的历程。
将下列三项针对青蒿素的研究按时间先后排序______(填数字序号)。
① 确定结构② 分离提纯③ 人工合成(2)屠呦呦用乙醚提取青蒿素,获得成功的关键在于改变了哪种条件:______。
(3)青蒿素分子中碳、氢、氧原子个数比为______。
(4)向无色的双氢青蒿素溶液中加入碘化钾,实验现象为______。
(5)根据上述文字介绍,下列说法正确的是______(填字母序号)。
A.确定了青蒿素的组成元素,由此就可以确定青蒿素的化学式B.青蒿素是含有过氧基的新型倍半萜内酯C.由于自然界中有青蒿,因此我们应用青蒿素时只需从青蒿中提取即可【答案】(1)②①③ (2)温度(多答溶剂不扣分)(3)15:22:5(4)溶液变为黄色(5)B【解析】试题分析:根据短文中的叙述可知,(1)从中国古代青蒿入药,到2004年青蒿素类药物被世界卫生组织列为对抗疟疾的首选药物,经历了漫长的历程。

青蒿素的发现及其获奖启示摘要:青蒿素的发现被国际社会认为是中国继麻黄素之后的第二大医学贡献,屠呦呦研究员由于在青蒿素的发现中作出重大贡献而获得2011年度美国拉斯克临床医学研究奖。
通过对青蒿素的发现过程和化学结构确定的简单介绍谈几点教学思考。
关键词:青蒿素化学结构发现过程化学教学天然产物世界上影响人数最多的疾病并非现在深受关注的艾滋病,而是一种堪称“历史悠久”的疾病——疟疾,也就是俗称的“打摆子”,同时,它也是当今除艾滋病外,上升趋势最为显著的一种传染病,每年2~3亿人感染此病,200多万人死亡。
19世纪从南美洲金鸡纳树皮中得到的奎宁曾成为最有效的药物,治愈了众多的疟疾患者。
20世纪第二次世界大战后模仿奎宁基本结构而合成的一批新药如氯喹、伯喹也曾救治过无数的病人。
但是20世纪60年代出现抗药性疟原虫后,以往常用的抗疟药(如氯喹、磺胺、奎宁等)的效果便不复存在,以至于造成了无药可医的局面,特别在东南亚、非洲地区情况更为严重。
青蒿素类药物的出现以其副作用低且不易产生抗药性而被誉为“治疗疟疾的最大希望”。
2011年的9月23日,我国81岁高龄的女药学家屠呦呦被授予2011年度美国拉斯克临床医学研究奖,获奖理由是“因为发现青蒿素——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命。
”站在奖台上的屠呦呦说:“青蒿素的发现是中国传统医学给人类的一份礼物。
”1.青蒿素发现与获奖意义1.1青蒿素的发现青蒿是传统中药,在长沙马王堆汉墓中就有青蒿作为药物的文字记载。
青蒿为常用中药,是一年生菊科植物黄花蒿的干燥地上部分。
中药青蒿具有清虚热、除骨蒸、解暑热、截疟、退黄之功效,在中国有两千多年的沿用历史。
青蒿素又名黄蒿素,是我国药学工作者1971年从菊科植物黄花蒿叶中提取分离到的一种具有过氧桥的倍半萜内酯类化合物。
20世纪60年代疟原虫对原有的药物产生抗体而使这些药物失效,我国政府临时组织“523”工作组,专门寻找新的抗疟药,但没有找到有效药物。
2020年第24期广东化工第47卷总第434期 · 149 · 高效液相色谱法在“青蒿素提取”实验教学中的应用孙忠文,李玉鹏,谢惠定,邱开雄,陈丽君*(昆明医科大学药学院暨云南省天然药物药理重点实验室,云南昆明650500)[摘要]为解决“青蒿素提取”系列实验在《有机化学》实验课程中对目标单体化学成分纯度判断不精准、环境污染及安全隐患等问题,加强与培养本科生对现代化仪器的实际操作能力和科研素养,将高效液相色谱法应用到“青蒿素提取”系列实验的实验教学中,解决了传统实验教学中薄层色谱法和熔点测定法在青蒿素纯度鉴定过程中存在的不足。
本文阐述了实验教学中青蒿素纯度鉴定存在的问题,高效液相色谱在青蒿素纯度鉴定中引入的必要性,该部分内容在实验课程中的开展模式,以及实验开展前后的相关工作。
[关键词]青蒿素;实验教学;高效液相色谱[中图分类号]G4 [文献标识码]A [文章编号]1007-1865(2020)24-0149-03Application of High Performance Liquid Chromatography in the ExperimentalTeaching of Artemisinin ExtractionSun Zhongwen, Li Yupeng, Xie Huiding, Qiu Kaixiong, Chen Lijun*(School of Pharmaceutical Science and Yunnan Key Laboratory of Pharmacology for Natural Products, Kunming Medical University, Kunming650500, China)Abstract:In order to solve the problems of inaccurate judgment of the purity of the target monomer chemical composition, environmental pollution and potential safety hazards in the experimental course of “Organic Chemistry” in the series of experiments of artemisinin extraction, strengthen and cultivate undergraduates' practice of modern instruments operating ability and scientific research literacy, applying high performance liquid chromatography (HPLC) method to the experimental teaching of the artemisinin extraction series of experiments, solving the problems of thin layer chromatography (TLC) and melting point determination in the artemisinin purity identification process in traditional experimental teaching of inadequacy. This article describes the problems in the purity identification of artemisinin in experimental teaching, the necessity of introducing HPLC in the purity identification of artemisinin, the development mode of this part in the experimental course, and the related work before and after the experiment.Keywords: artemisinin;experimental teaching;high performance liquid chromatography青蒿素的传奇发现及作为抗疟药物的卓越效力和影响力,使其一登上世界舞台就收到了极大关注,其有效性、安全性及廉价性使其成为抗疟疾的一线药物,挽救了数以万计的生命[1]。
“从青蒿素的提取历程中探寻实验方法”项目教学作者:王换荣林肃浩来源:《化学教学》2022年第02期摘要:呈現高中化学必修1模块“实验方法选择”的项目教学案例。
以“从青蒿素的提取历程中探寻实验方法”为项目学习主题,以“调研青蒿素的提取方法发展史”为主项目,以“从茶叶中提取茶多酚”为进阶项目。
通过小组合作和外部资源协同探究实践和解决问题。
教师对学生项目任务的完成、展示和答辩进行持续的评价,有利于发展学生高水平的化学实验素养。
关键词:项目教学; 实验方法选择; 教学案例; 实验素养; 青蒿素文章编号: 10056629(2022)02005905中图分类号: G633.8文献标识码: B1 项目主题及教学目标高阶化学实验素养,是指当学生面对一个真实完整的复杂且陌生的学术实验情境时,在正确的实验思想指导下,以较强的信息获取能力、实验探究能力、分析推理能力,高质量地认识、分析、讨论和解决实验问题的过程中所表现出来的综合品质[1]。
通常,高阶化学实验素养的养成以调研和实验型项目为载体。
2017年版普通高中化学课程标准根据化学学科核心素养对高中学生发展的要求提出,实验课程的目标是能发现和提出有研究价值的化学问题;能依据研究目的设计并优化实验方案,完成实验操作;能对观察记录的实验信息进行加工并获得结论;能和同学交流实验研究的成果;能尊重事实和证据;养成独立思考、敢于质疑和勇于创新的精神[2]。
项目教学将学生置于模拟科学家进行科学研究的探索中,全过程由学生设计、讨论、准备与实施,在项目实施中发现和解决问题,提高和发展高水平的实验素养。
1.1 青蒿素的性质及其应用价值青蒿素是一种无色针状晶体,熔点为156~157℃。
青蒿,又名黄花蒿,菊科草本植物,主要分布在广西、云南、四川等地。
青蒿素是从青蒿中提取的一种有效抗疟药物。
围绕“青蒿素的提取与提纯方式优化”的分析,帮助学生建立基于物质性质选择其提取和提纯方法的视角,以及真实情况下提高目标物质产量的实验思路,体验化学知识在生活中的应用,提升学生对实验方法选择与实验方案设计的价值的认识。